Los parámetros clínicos y analíticos de la apendicitis aguda (AA) son la base diagnóstica. Se analiza la diferencia de sus valores según la histología para distinguir las AA simples de las complicadas.
MétodosAnálisis observacional retrospectivo que incluye pacientes (>14 años) que ingresan con diagnóstico de AA desde el 1 abril 2014 al 31 julio 2016. Histopatológicamente se dividen en AA complicada (perforada y/o gangrenada) y AA no complicada (flemonosa). Entre los 2 grupos se compara sexo, edad, temperatura al ingreso, duración de sintomatología, recuento leucocitario preoperatorio (WBC), porcentaje de neutrófilos, volumen plaquetario medio (VPM), índice de distribución de plaquetas (PDW), proteína C-reactiva (PCR) y estancia hospitalaria.
ResultadosSe analizan 335 pacientes y se incluyen 284, de los cuales 194 (68,3%) tienen AA no complicada (AAnc) y 90 (31,7%) AA complicada (AAc). La edad, la duración de sintomatología, el porcentaje de neutrófilos, la PCR y la estancia hospitalaria son mayores en la AAc (p<0,05). Las diferencias de las medias entre AAnc y AAc son: edad 13,2 años (IC 95%: 8,2-18,2), duración de sintomatología 14,1h (IC 95%: 6,3-21,9), porcentaje de neutrófilos 5,0% (IC 95%: 3,2-6,8), PCR 73,6mg/l (IC 95%: 50,0-97,2) y estancia hospitalaria 2,2 días (IC 95%: 1,4-3,0), con p<0,05. Un modelo basado en parámetros preoperatorios (edad, duración de sintomatología, porcentaje de neutrófilos y PCR) se calcula para predecir la posibilidad de AAc. El área bajo la curva del modelo es 0,80 (IC 95%: 0,75-0,85).
ConclusionesEl modelo predice la posibilidad de desarrollar AAc, pero debe validarse de manera prospectiva.
To analyze whether clinical and analytical parameters differ according to histopathology in cases of acute appendicitis (AA).
MethodsThis is a retrospective, observational study including patients (>14 years of age) admitted for suspicion of AA from 1 April 2014 to 31 July 2016. Histopathology was divided into complicated (including perforated and gangrenous AA) and uncomplicated appendicitis (phlegmonous). Sex, age, temperature of patients on admission to the Emergency Department, symptom duration, preoperative white blood cell (WBC) count, neutrophil percentage, mean platelet volume (MPV), platelet distribution width (PDW), C-reactive protein (CRP) and hospital stay were compared in the two groups.
ResultsThree hundred and thirty-five patients were analyzed, and 284 were included. Appendicitis was uncomplicated in 194 (68.3%) and complicated in 90 (31.7%). Age, symptom duration, neutrophil percentage, CRP and hospital stay were higher in the complicated AA group (P < .05). The mean differences between uncomplicated and complicated AA were: age 13.2 years (95% CI: 8.2-18.2), symptom duration 14.1hours (95% CI: 6.3-21.9), neutrophil percentage 5.0% (95% CI: 3.2-6.8), CRP 73.6mg/l (95% CI: 50.0-97.2) and hospital stay 2.2 days (95% CI: 1.4-3.0), with p<0.05 for all these variables. A model based on the preoperative parameters (age, symptom duration, neutrophil percentage and CRP) was calculated to predict the likelihood of complicated AA. The receiver operating characteristic (ROC) of the model had an area under the curve of 0.80 (95% CI 0.75-0.85).
ConclusionThis model is able to diagnose complicated AA without the need for imaging techniques, although it must be validated with prospective analysis.
La apendicitis aguda (AA) es la urgencia quirúrgica abdominal más frecuente1. En numerosos casos, la anamnesis, la exploración y los parámetros analíticos son suficientes para un diagnóstico precoz2,3. Es un tema de conocida relevancia, como muestra la reciente publicación del análisis RIFT en el que se analizan las distintas escalas de puntuación empleadas en pacientes con sospecha de AA4. Su interés es mayor dado a que el retraso de la cirugía aumenta la morbimortalidad5, y está asociado a un aumento de la tasa de perforación y complicación1,6. Las técnicas de imagen han mejorado el diagnóstico7, pero la ecografía muestra una baja sensibilidad4 y el uso de la tomografía computarizada (TC) aumenta el riesgo de radiación8 y no diferencia entre AA no complicada (AAnc) y AA complicada (AAc)9. De esta manera, son precisos métodos rápidos y de fácil aplicación que predigan la probabilidad de complicaciones en las AA. Algunos datos clínicos y analíticos como la edad10, la duración de la sintomatología10 y el aumento de los marcadores inflamatorios11,12 han sido utilizados para predecir la AA perforada. Otros parámetros analíticos han sido analizados en relación al diagnóstico de la AA como el índice de distribución plaquetaria (platelet distribution width [PDW]) y el volumen plaquetario medio (VPM)13,14. El VPM es un marcador de la función y activación plaquetaria y sus niveles se han evidenciado disminuidos en la AA15.
Aunque individualmente estos elementos son pobres predictores de complicaciones de AA, en conjunto es posible que tengan un alto poder discriminatorio. El objetivo de este análisis es desarrollar un modelo predictivo basado en parámetros clínicos y analíticos para diferenciar la AAnc y la AAc (gangrenada y/o perforada) en adultos, sin utilizar pruebas de imagen para dirigir la toma de decisiones tales como el abordaje quirúrgico, la duración de la antibioterapia, predecir la estancia hospitalaria y valorar su aplicación, en caso de que se muestre evidencia, en cuanto al tratamiento conservador de AA.
MétodosPacientesSe lleva a cabo un análisis observacional retrospectivo a partir de los apéndices cecales cuya histología muestran inflamación (flemonosa, gangrenada, perforada) en pacientes (>14 años) ingresados por el servicio de urgencias de un hospital de segundo nivel de España. Los participantes o sus tutores legales, firman el consentimiento informado de la intervención quirúrgica. Se excluyen los pacientes menores de 14 años, dado que los parámetros analíticos tienen rangos de normalidad distintos en el hospital.
El análisis es aprobado por el Comité Ético de Investigación Clínica de la institución.
Se analizan de forma retrospectiva 335 pacientes cuyo apéndice cecal se recibe en el servicio de anatomía patológica entre el 1 abril 2014 y el 31 julio 2016.
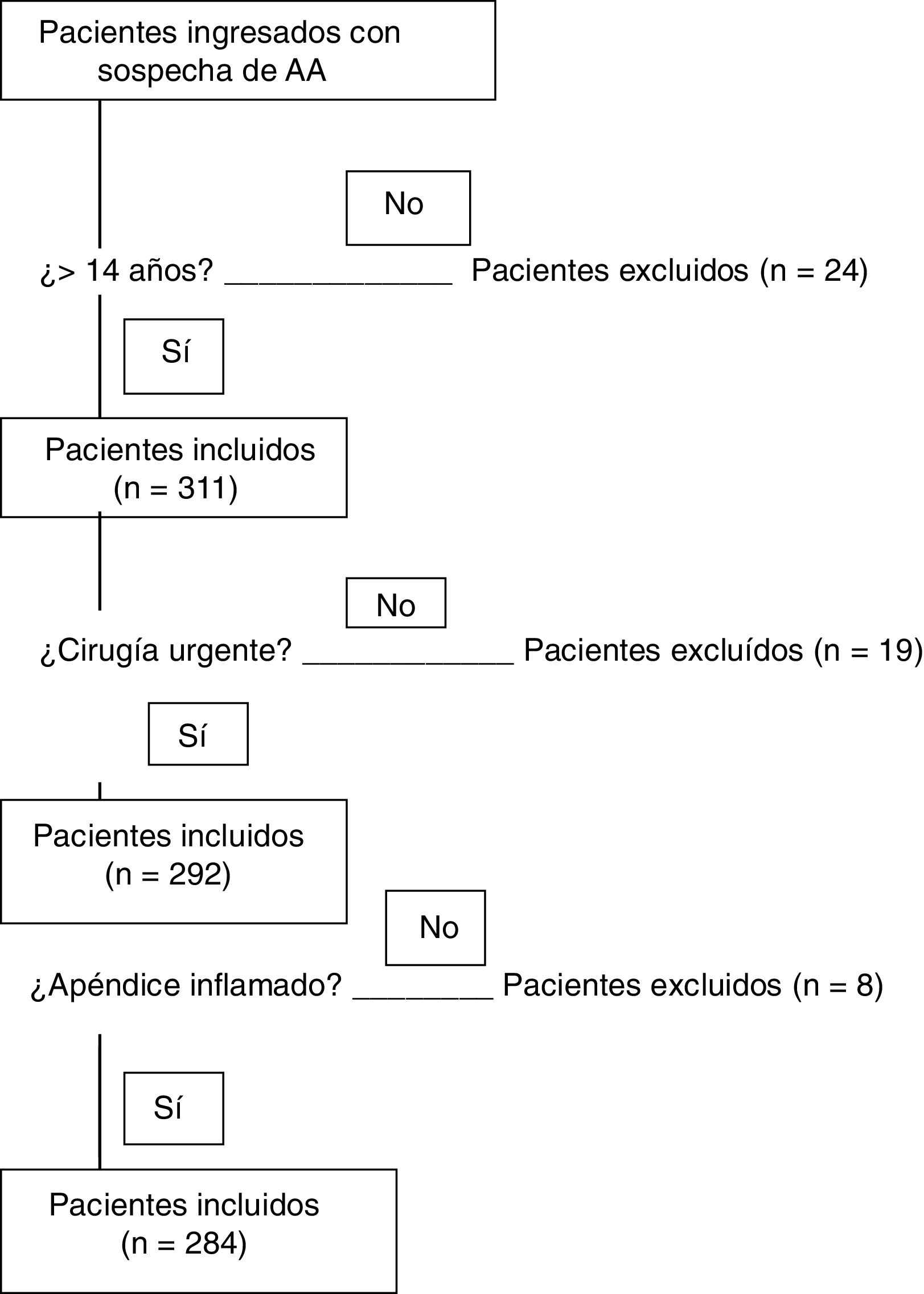
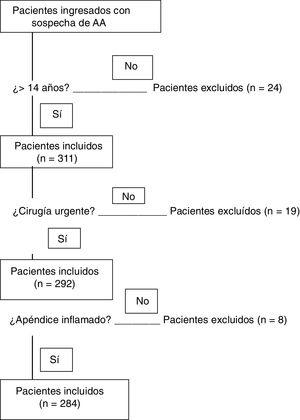
Veinticuatro pacientes menores de 14 años son excluidos. Diecinueve apéndices cecales extraídos en cirugía programada no se incluyen, igual que 8 apéndices cecales cuya histología no muestra inflamación (fig. 1). Los 284 pacientes incluidos se dividen en 2 grupos según los hallazgos histopatológicos en relación a la infiltración de células inflamatorias en las capas de la pared apendicular y las soluciones de continuidad asociadas. Los grupos son AAnc (flemonosa) y AAc (perforada y/o gangrenada).
Se recogen edad, sexo, temperatura al ingreso en el servicio de urgencias, duración de sintomatología (desde que se inicia el dolor hasta que se interviene), recuento leucocitario preoperatorio (white blood cell [WBC]), porcentaje de neutrófilos (N.° %), VPM, PDW, proteína C-reactiva (PCR) y estancia hospitalaria.
Test de laboratorioLas muestras analíticas se obtienen del sistema venoso y se procesan en tubos con EDTA. Se analizan automáticamente según los dispositivos certificados internacionalmente aprobados por un facultativo especialista en análisis clínico. Los intervalos de referencia en el hospital son: 3,7-9,5×103/μl para WBC, 40-74% para el porcentaje de neutrófilos, 7,2-11,1fl para MPV, 10-18% para PDW y 0,0-8,0mg/l para PCR.
Análisis estadísticoEl análisis estadístico es llevado a cabo mediante el software SPSS® de Windows 21.0 (IBM Corp., Armonk, NY, EE. UU.). Los porcentajes y las medianas con rango intercuartílico (IQR) son utilizados para describir los principales resultados. El test de la t de Student y la prueba de χ2 se utilizan para comparar variables cuantitativas y categóricas.
La regresión logística se utiliza para hallar la odds ratio (OR) de cada variable en análisis univariante y multivariante para predecir la AAc (variable dependiente).
Además, la sensibilidad, la especificidad, el valor predictivo positivo y negativo y el cociente de probabilidad positiva y negativa se calculan con 2 puntos de corte de 0,1 y 0,2. La curva receiver operating characteristic (ROC) se obtiene para cada variable y para el modelo predictivo hallado según el análisis multivariante. Los resultados se muestran con un intervalo de confianza del 95% (IC 95%) y la p<0,05 se considera estadísticamente significativa.
ResultadosLos 284 pacientes se dividen en 2 grupos según los hallazgos histopatológicos: 194 (68,3%) son AAnc (AA flemonosas) y 90 (31,7%) son AAc (AA gangrenosas y/o perforadas).
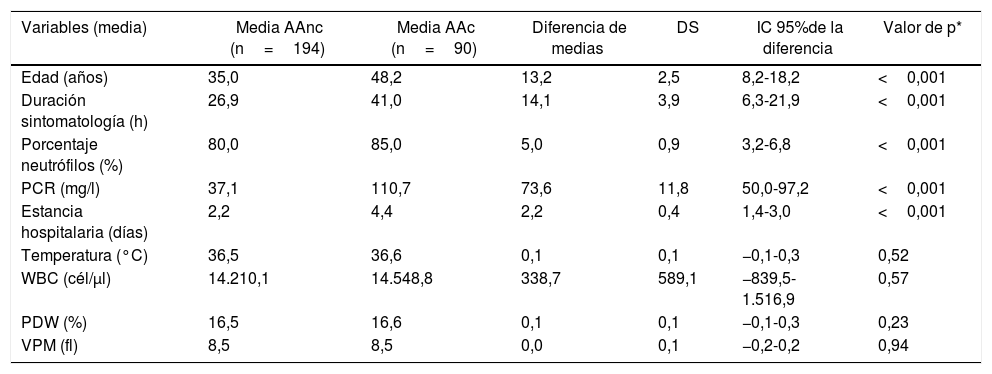
En cuanto al sexo, no hay diferencias estadísticamente significativas entre los grupos (p=0,92): hay 81 mujeres (41,8%) en el grupo de AAnc y 37 (41,1%) en el grupo de AAc. Las características de los pacientes se muestran en la tabla 1. La edad media, la duración de sintomatología, el porcentaje de neutrófilos, la PCR y la estancia hospitalaria son mayores en el grupo de AAc, mientras que no hay diferencias estadísticamente significativas entre los grupos con respecto a temperatura corporal al ingreso, el WBC o los parámetros analizados en la actualidad como MPV y PDW (tabla 1).
Comparación de grupos de AAnc y AAc
| Variables (media) | Media AAnc (n=194) | Media AAc (n=90) | Diferencia de medias | DS | IC 95%de la diferencia | Valor de p* |
|---|---|---|---|---|---|---|
| Edad (años) | 35,0 | 48,2 | 13,2 | 2,5 | 8,2-18,2 | <0,001 |
| Duración sintomatología (h) | 26,9 | 41,0 | 14,1 | 3,9 | 6,3-21,9 | <0,001 |
| Porcentaje neutrófilos (%) | 80,0 | 85,0 | 5,0 | 0,9 | 3,2-6,8 | <0,001 |
| PCR (mg/l) | 37,1 | 110,7 | 73,6 | 11,8 | 50,0-97,2 | <0,001 |
| Estancia hospitalaria (días) | 2,2 | 4,4 | 2,2 | 0,4 | 1,4-3,0 | <0,001 |
| Temperatura (°C) | 36,5 | 36,6 | 0,1 | 0,1 | −0,1-0,3 | 0,52 |
| WBC (cél/μl) | 14.210,1 | 14.548,8 | 338,7 | 589,1 | −839,5-1.516,9 | 0,57 |
| PDW (%) | 16,5 | 16,6 | 0,1 | 0,1 | −0,1-0,3 | 0,23 |
| VPM (fl) | 8,5 | 8,5 | 0,0 | 0,1 | −0,2-0,2 | 0,94 |
AAc: apendicitis aguda complicada; AAnc: apendicitis aguda no complicada; DS: desviación estándar; IC 95%: intervalo de confianza del 95%; PCR: proteína C-reactiva; PDW: índice de distribución de plaquetas (platelet distribution width); VPM: volumen plaquetario medio; WBC: recuento leucocitario preoperatorio (white blood cell).
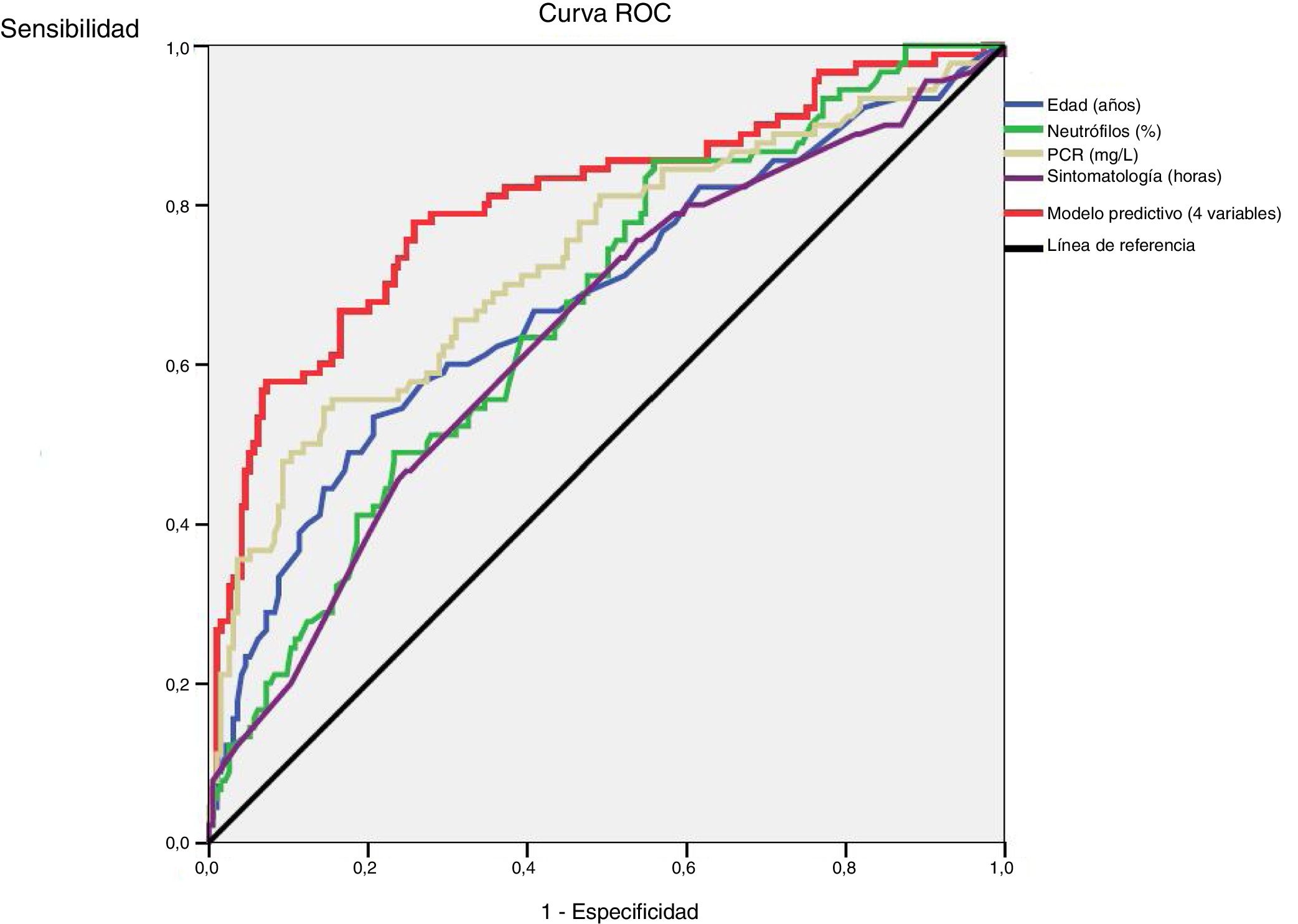
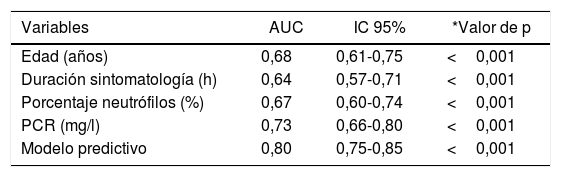
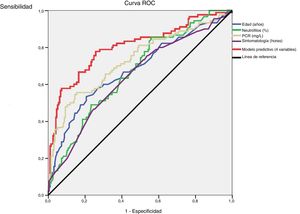
Se desarrolla una curva ROC para definir los valores predictivos de los parámetros y biomarcadores preoperatorios para el diagnóstico de AAc (fig. 2). Las áreas bajo la curva son 0,68 (IC 95%: 0,61-0,75) para la edad, 0,64 (IC 95%: 0,57-0,71) para la duración de la sintomatología, 0,67 (IC 95%: 0,60-0,74) para el porcentaje de neutrófilos y 0,73 (IC 95%: 0,66-0,80) para la PCR.
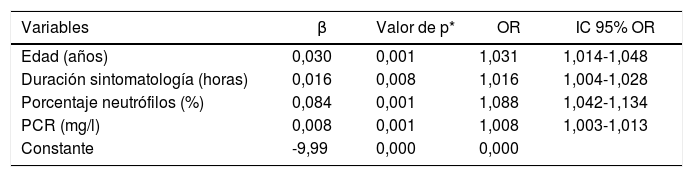
Después del modelo multivariante de regresión logística basado en los valores preoperatorios estadísticamente significativos mostrados en la tabla 2 (edad, duración de sintomatología, WBC y porcentaje de neutrófilos), la R2 de Nagelkerke tiene un valor de 0,36. La curva de ROC con IC 95% mostrada en la figura 2 para el modelo ajustado de regresión basado en estos parámetros tiene un área bajo la curva de 0,80 (IC 95%: 0,75-0,85) (tabla 3). La probabilidad predictiva (P) de la AAc se calcula mediante la siguiente fórmula:
Variables incluidas en la fórmula para el modelo clínico predictivo
| Variables | β | Valor de p* | OR | IC 95% OR |
|---|---|---|---|---|
| Edad (años) | 0,030 | 0,001 | 1,031 | 1,014-1,048 |
| Duración sintomatología (horas) | 0,016 | 0,008 | 1,016 | 1,004-1,028 |
| Porcentaje neutrófilos (%) | 0,084 | 0,001 | 1,088 | 1,042-1,134 |
| PCR (mg/l) | 0,008 | 0,001 | 1,008 | 1,003-1,013 |
| Constante | -9,99 | 0,000 | 0,000 |
IC 95% OR: intervalo de confianza del 95% OR; OR: odds ratio; PCR: proteína C-reactiva.
Estos son los parámetros incluidos en el modelo calculado para AAc. Por cada año, aumenta la posibilidad de AAc un 3,1%. Por cada hora de sintomatología, la posibilidad aumenta un 1,6%. Por cada 1% de porcentaje de neutrófilos aumenta un 8,8% y por cada 1mg/l de PCR aumenta un 0,8%.
Valores de curva ROC de variables estadísticamente significativas y del modelo predictivo
| Variables | AUC | IC 95% | *Valor de p |
|---|---|---|---|
| Edad (años) | 0,68 | 0,61-0,75 | <0,001 |
| Duración sintomatología (h) | 0,64 | 0,57-0,71 | <0,001 |
| Porcentaje neutrófilos (%) | 0,67 | 0,60-0,74 | <0,001 |
| PCR (mg/l) | 0,73 | 0,66-0,80 | <0,001 |
| Modelo predictivo | 0,80 | 0,75-0,85 | <0,001 |
AUC: área bajo la curva (area under the curve); IC 95%: intervalo de confianza del 95%; PCR: proteína C-reactiva; ROC: receiver operating characteristic.
P=1/ [1+e –(−9,99+0,030 × edad (años)+0,016 × duración sintomatología (h)+0,084 × porcentaje de neutrófilos (%)+0,008 × PCR (mg/l))].
Con el uso de esta fórmula, se proponen 2 modelos según 2 valores de corte diferentes.
En el primer modelo, con un valor de corte de 0,1, la sensibilidad y la especificidad son del 96,7 y 22,8%, respectivamente, y el valor predictivo positivo y negativo son del 36,9 y 93,6%, respectivamente. El cociente de probabilidad (likelihood ratio) positivo es 1,26 y el negativo es 0,146.
En el segundo modelo, con un valor de corte de 0,2, la sensibilidad, la especificidad, el valor predictivo positivo y negativo son 80,3, 52,8, 45,2 y 87,2%, respectivamente, y los cocientes de probabilidad positivo y negativo son 1,70 y 0,374, respectivamente.
DiscusiónLa AA es la cirugía abdominal urgente más frecuente, el retraso en su diagnóstico puede asociar la perforación y la peritonitis. En la literatura, la mayoría de los análisis se centran en predecir la apendicitis4,6,7,12, y solo unos pocos artículos han analizado las diferencias entre AA simple y complicada11,16,17.
En el análisis publicado por el RIFT Study Group4, se comparan las distintas escalas de puntuación empleadas en el diagnóstico de las AA. En el algoritmo propuesto se aconseja el empleo de la escala de respuesta inflamatoria a apendicitis (AIRS) en varones y el empleo de la puntuación de apendicitis en adultos (AAS) en mujeres, basados en parámetros clínicos y analíticos, de manera que se reserva la utilización de técnicas radiológicas para los casos en los que se va a obtener rentabilidad diagnóstica, es decir los pacientes que han obtenido una puntuación con menor riesgo para AA, pero no permiten observación. No obstante, en el Reino Unido, el empleo de la TC es menor comparado con el resto de países europeos analizados (España, Italia, Portugal, Irlanda), pero presentan una tasa de apendicectomías en blanco (20%) mayor en comparación con el conjunto de los demás países (6,2%). De manera que estas escalas permiten valorar los pacientes con mayor riesgo para AA, pero a su vez se registra un alto porcentaje de apendicectomías negativas en el Reino Unido, probablemente relacionado con la menor tasa de realización de TC4.
En este análisis que se ha expuesto, se debe tener en cuenta que la duración de la sintomatología, definida desde que se inicia el dolor hasta que se realiza la intervención quirúrgica urgente, es un parámetro que aumenta el riesgo de las AAc, de manera que la posibilidad de desarrollar AAc aumenta un 1,6% por cada hora de sintomatología. En el metaanálisis publicado por Li et al.18 una duración de sintomatología menor (<24h) no se asocia al desarrollo de AAc, pero el riesgo sí es mayor si la duración es >24h. Cabe destacar, que si comparan un subgrupo de duración <6h y uno con duración de 6-12h, hay diferencias estadísticamente significativas con mayor estancia hospitalaria y mayor infección de herida quirúrgica en el subgrupo de 6-12h. En este aspecto los datos son contradictorios, en el metaanálisis publicado por Van Dijkl et al.19, no hay relación entre duración de la sintomatología y AAc, si bien la duración de la sintomatología se define desde la llegada a urgencias o desde el diagnóstico, según los análisis incluidos. Esta falta de consenso en la definición de duración de sintomatología genera un sesgo en los resultados. Sería preciso realizar un análisis prospectivo que incluya la duración desde el inicio de la sintomatología hasta la intervención quirúrgica y la duración desde la admisión a urgencias hasta la intervención quirúrgica20.
Con relación a las técnicas radiológicas, la ecografía en el análisis RIFT muestra una sensibilidad diagnóstica para apendicitis aguda del 38 y 37% en mujeres y varones, respectivamente, con alta sospecha diagnóstica4.
La TC tiene alta sensibilidad para diagnosticar apendicitis aguda (92% en mujeres y 94% en varones)4, pero presenta una baja sensibilidad (62%) para diagnosticar apendicitis perforada16,17. Además, se asocia con la exposición a la radiación, en una enfermedad que suele afectar a pacientes jóvenes, con el correspondiente riesgo de desarrollar cáncer (riesgo de 1:1.250 para una dosis equivalente de radiación a la empleada en la TC)8. A su vez, se añade el riesgo a desarrollar nefropatía asociada a contraste (11%) y reacciones alérgicas8, y cabe resaltar que es una técnica que no está disponible en la totalidad de los hospitales.
En este análisis se desarrolla un sistema de puntuación para distinguir entre apendicitis simple y complicada, basado en las características de los pacientes y en parámetros analíticos que son recopilados rutinariamente en la práctica clínica.
Cabe constatar que se incluyen los pacientes con AA, pero quedaron excluidos pacientes con absceso periapendicular, a los que no se les intervino, dado que se trata de una entidad distinta, el plastrón apendicular.
Los puntos de corte seleccionados se eligen para mostrar diferentes opciones diagnósticas del mismo modelo propuesto. En un test diagnóstico se requiere alta sensibilidad para diagnosticar los verdaderos positivos y es por ello que se considera de mayor aplicabilidad el modelo con el punto de corte 0,1, a pesar de la menor especificidad.
Este sistema identifica un grupo sustancial de pacientes con alta probabilidad de AAc, en los que se debe considerar el uso de antibioterapia de mayor duración21,22 y el abordaje quirúrgico; y en los que se debe presuponer una estancia hospitalaria mayor23–26. Además, aunque la apendicectomía urgente es el tratamiento actual de la AAnc, distintos análisis, incluidos ensayos aleatorizados27–31, han valorado el tratamiento conservador con antibioterapia, aunque en la actualidad no es aceptado de forma sistemática, dado que el 39% de los pacientes con AAnc tratados de forma conservadora ha requerido apendicectomía durante el ingreso o posteriormente por recidiva30,31. De esta manera, aunque se precisa mayor evidencia para aplicar el tratamiento antibiótico en las AAnc, debe iniciarse la búsqueda de parámetros clínico-analíticos que permitan la selección de pacientes susceptibles de este tratamiento cuando la evidencia científica lo permita.
Varios parámetros han sido analizados en la literatura como posibles predictores de complicación de las AA. El riesgo de perforación es mayor en gente de edad avanzada10 y la presencia de mayor duración de dolor abdominal11. Queda constatado que la edad media y la duración de sintomatología es mayor de manera estadísticamente significativa en las AAc.
Con relación a los resultados analíticos, muchos estudios han demostrado que los niveles de PCR aumentan de manera proporcional con la severidad de la respuesta inflamatoria de las AA6,11,32–36. Contajes mayores de neutrófilos han sido a su vez evidenciados en esta patología13. En este análisis, PCR y porcentaje de neutrófilos tienen diferencias estadísticamente significativas entre AA simple y AAc.
Algunos marcadores trombocitarios, incluidos MPV y PDW, han sido asociados con la activación trombocitaria, trombosis y la fisiopatología de enfermedades relacionadas con la inflamación como la AA37. En nuestro análisis, ni MPV ni PDW son predictores estadísticamente significativos para el diagnóstico de las AAc.
Con ello es conocido que elementos individuales de los hallazgos clínicos y los resultados analíticos son pobres predictores de AAc, pero, en combinación, tienen un poder discriminatorio alto. Los test de laboratorio de respuesta inflamatoria y los descriptores clínicos de dolor abdominal son potentes parámetros diagnósticos y deberían ser incluidos en la evaluación diagnóstica.
La mayor edad, la mayor duración de sintomatología y el mayor porcentaje de neutrófilos y PCR son factores predictivos de AA gangrenada y/o perforada. En este análisis se muestra un modelo predictivo capaz de indicar un riesgo aumentado de AAc (AA gangrenada y/o perforada).
De esta manera con el uso de este modelo, las técnicas de imagen no son requeridas para el diagnóstico de AAc y, aunque existe cierta limitación dado que deben ser realizadas ante sospecha de ciertas enfermedades incluidas en el diagnóstico diferencial de AA, tales como plastrón apendicular o neoplasia, es cierto que no tienen alta sensibilidad para diferenciar entre AAc y AAnc y los parámetros clínicos y analíticos presentados en este análisis permiten la orientación diagnóstica.
Con lo expuesto, la edad del paciente, la duración de la sintomatología y dos parámetros analíticos (recuento de neutrófilos y PCR) son utilizados para calcular la probabilidad de desarrollar AAc.
Con relación a la aplicabilidad clínica, el modelo permite mayor enfoque terapéutico, véase la elección del abordaje quirúrgico laparotómico o laparoscópico y el uso de antibioterapia más prolongado21,22. A su vez es capaz de predecir una mayor estancia hospitalaria.
Las limitaciones de este análisis se basan en la metodología retrospectiva, que hace que exista un sesgo destacable en la duración de la sintomatología. De esta manera, se precisa de una valoración prospectiva para su validación interna y posteriormente realizar la validación externa.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al Departamento de Estadística del Hospital de Guadalajara su contribución al análisis.