Introducción
El colangiocarcinoma (CCA) fue descrito por primera vez por Durand-Fardel en 1840; se trata de un tumor maligno que proviene de las células epiteliales de los conductos intra y extrahepáticos. Es un tumor raro, ya que solo representa el 2% de todos los cánceres; puede aparecer en cualquier parte del sistema biliar y se clasifica, según su sitio anatómico de presentación, en CCA extrahepático (CCE) y CCA intrahepático (CCI). La forma extrahepática se subdivide en 2, proximal, hiliar o perihiliar (del 40 al 70% de los casos) y distal (del 20 al 30% de los casos). El CCI es la segunda causa más común de cáncer hepático primario; sin embargo, dentro de los CCA solo representa del 5 al 10% de todos los casos. Además de esto, se reconocen 3 tipos macroscópicos diferentes de CCA: el tipo formador de tumor, el cual representa un nódulo bien delimitado del parénquima hepático; el tipo periductal infiltrante, el cual muestra infiltración extensa a lo largo de las estructuras portales intrahepáticas, y el tipo intraductal, en el cual el tumor está confinado dentro de los conductos biliares mayores. De los ya mencionados, el más frecuente es el formador de tumor, que representa el 86% de los casos. Las diferencias anatómicas entre estos subtipos resulta en una presentación clínica dispar y, por lo tanto, cada caso requiere de una estrategia de tratamiento única1-10.
Epidemiología
Los tumores hepatobiliares representan el 13% de las muertes por neoplasias malignas en el mundo y el 3% en los Estados Unidos. El CCA representa del 10 al 20% de las muertes por tumores hepatobiliares. La prevalencia del CCA tiene una gran variación geográfica, con sus índices más altos en Asia y los más bajos en Australia. Su incidencia anual es de aproximadamente 1 por 100.000 habitantes en Estados Unidos; 7,3 por 100.000 en Japón, y 2 por 100.000 en Inglaterra y Gales. Además, su prevalencia difiere según el grupo racial y étnico; en los Estados Unidos, los de mayor prevalencia son los hispanos, nativos americanos y japoneses (2,8-3,3/100.000), en tanto los de menor presentación son los blancos no hispanos y africanos (2,1/100.000). En las últimas 4 décadas, en este país la incidencia del CCI ha aumentado en un 165%, pasando de 0,32 por 100.000 habitantes de 1975-1979 a 0,85 por 100.000 de 1995 a 1999, en tanto el CCE ha permanecido sin cambios. Se han reportado cambios similares en el incremento de la incidencia en Europa y Japón. La causa de esto aún no está clara y se continúa estudiando, aunque se cree que puede deberse a una mejor detección de la patología. En los países occidentales, la edad media de presentación es de 65 años, con un pico de incidencia en la octava década de la vida, y solo en raras ocasiones es diagnosticado en pacientes menores de 40 años, excepto en paciente con colangitis esclerosante primaria (CEP). En cuanto a la distribución por sexo, el hombre parece ser afectado discretamente más que la mujer (1,9 y 1,5/100.000, respectivamente)11-21.
Factores de riesgo
En la mayoría de los casos se consideran esporádicos, aunque la etiología del CCA es oscura; solo en una pequeña porción de pacientes se puede establecer un factor de riesgo que, comúnmente, es una inflamación de larga evolución que ha generado un daño crónico al epitelio biliar. El factor de riesgo más común es la CEP, ya que entre un 5 y un 30% de los pacientes con esta enfermedad desarrollaran CCA; su índice de incidencia anual es del 0,6 al 1,5%, con una odds ratio (OR) de 10,7 a 47,1. La mayoría de los pacientes que desarrollan CCA lo harán dentro de los primeros 2,5 años posteriores al diagnóstico de la CEP. Además de esta, existen otros factores de riesgo, como son la enfermedad fibropoliquística congénita del sistema biliar, particularmente los quistes de colédoco y la enfermedad de Caroli. Los quistes de colédoco se asocian al 10-15% de los casos de CCA y existe un riesgo acumulado del 1% por año con esta enfermedad hasta llegar a los 15 a 20 años del diagnóstico, cuando permanece estable, con una edad promedio al momento del diagnóstico de 32 años, lo cual es considerablemente menor a la edad promedio de presentación en la población general. Se ha documentado que en Asia, como en los países occidentales, la litiasis hepática, particularmente la que presenta piedras de bilirrubinato de calcio, puede ser responsable de un 5-10% de los CCA. Además de estos factores de riesgo establecidos, algunas otras condiciones se han asociado con el CCA (tabla 1), como la derivación bilioentérica con colangitis recurrente, cirrosis biliar, colelitiasis, cirrosis hepática alcohólico nutricional, cirrosis no específica, diabetes, tirotoxicosis y pancreatitis crónica. También se ha considerado el thorotrast, que es un medio de contraste radiactivo utilizado entre 1930 y 1940; se ha asociado como un factor que aumenta 300 veces las posibilidades de CCA en relación con la población general. En tanto la obesidad, la cirrosis hepática no alcohólica, la infección por virus de la hepatitis B y C y el tabaquismo se han considerado exclusivamente factores de riesgo para el CCI13,22-33.
Cuadro clínico
Los CCA son usualmente asintomáticos en estadios tempranos. Algunos de los síntomas de presentación son similares a los de los pacientes con colelitiasis. En los pacientes con CCI, regularmente se presentan de mayor a menor frecuencia con dolor abdominal, pérdida de peso e ictericia, en tanto los pacientes con CCE se presentan regularmente con ictericia silente. La exploración física puede revelar hepatomegalia, vesícula biliar palpable (signo de Courvoisier) o datos de hipertensión portal secundario a trombosis de la vena porta o compresión. Estos síntomas inespecíficos usualmente aparecen cuando la enfermedad está avanzada. En pacientes con CEP, debe sospecharse CCA cuando dentro del primer año del diagnóstico el paciente presenta ictericia, prurito, pérdida de peso o dolor abdominal, o cuando se observa un aumento del nivel de bilirrubinas34-40.
Diagnóstico
En análisis de laboratorio, la bilirrubina sérica esta elevada (más de 10 mg/dl) junto con la fosfatasa alcalina (ALP) y la gamma glutamil transferasa (GGT). Aunque en casos de obstrucción parcial de la vía biliar la bilirrubina puede ser normal y solo tener elevaciones de la ALP o la GGT. En cuanto a los marcadores tumorales, el antígeno carbohidrato 19-9 (CA 19-9) y el antígeno carcinoembrionario son los más utilizados. En pacientes con colangitis esclerosante se ha reportado que el CA 19-9 tiene una sensibilidad del 50 al 100% y una especificidad del 50 al 98%. Se han propuesto varios valores corte para el CA 19-9, generalmente entre 100 U/ml y 200 U/ml, en donde se ha encontrado que un valor mayor de 100 U/ml tiene una sensibilidad del 53% y una especificidad del 75 al 90% para el diagnóstico de CCA en pacientes sin CEP. En un estudio se combinó el CA 19-9 con valor mayor de 180 U/ml con el ACE mayor de 5,2 ng/ml, logrando una sensibilidad del 100% y una especificidad del 78% para el CCA. Se han asociado niveles de CA 19-9 de 1.000 U/ml o más a la presencia de tumores irresecables. A pesar de estos resultados, estos marcadores también se pueden elevar en otros tumores malignos, en colestasis sin cáncer y posterior a una lesión hepática. También el CA 19-9 no es útil en el 7% de la población que es negativa al antígeno de Lewis, ya que tienen niveles indetectables de este marcador. Por lo tanto, los valores elevados de estos marcadores no se deben de utilizar como única forma diagnostica de CCA. Existen otros marcadores en el periodo de estudio, como los subtipos A y C de la mucina humana, que son los más promisores para un uso clínico futuro, con una sensibilidad y una especificidad del 71 y el 90%, respectivamente, aunque su utilidad amerita una mayor evaluación41-45.
En cuanto a la imagenología el ultrasonido es usualmente el primer medio de imagen que se utiliza cuando se sospecha de obstrucción biliar; el CCI puede ser identificado como una tumoración hepática; en contraste, el CCE regularmente son lesiones infiltrativas que son difíciles de detectar. En este estudio se puede apreciar dilatación de la vía biliar intrahepática sin una tumoración identificable, aunque se puede observar un engrosamiento, nódulo o irregularidad intraluminal. A pesar de todo esto, el ultrasonido tiene una sensibilidad de 89% y una especificidad del 80 al 95% en el CCE46-49.
La tomografía computarizada de 3 fases es la que ofrece mayor información en cuanto a diseminación local, invasión vascular, afectación ganglionar y presencia de metástasis. En esta, el CCA se observa como una lesión hipodensa de márgenes irregulares, además de presentar dilatación y engrosamiento de la vía biliar intrahepática. Para el CCE, la precisión diagnóstica va del 79 al 92%, aunque subestima la extensión del tumor, particularmente en el tipo hiliar con un rango del 90 al 100%, en tanto detecta prácticamente todos los tumores mayores de 1 cm intrahepáticos. En cuanto a la precisión para la resecabilidad, este estudio nos brinda un 60-85% en pacientes con CCA50-53.
La resonancia magnética, particularmente la colangiorresonancia, es considerada el estudio diagnóstico de elección para el CCA; se ha demostrado en varios estudios, incluyendo metaanálisis, una sensibilidad y una especificidad del 90%. Tiene la ventaja de no ser invasiva y que no requiere instrumentación biliar. Nos permite una valoración completa de la anatomía biliar y la extensión del CCA, invasión vascular, infiltración ganglionar y metástasis. El CCI aparece como una lesión hipodensa en T1 e hiperintensa en T2 y con concentración del medio de contraste en el tumor en las imágenes tardías54-56.
También se pueden utilizar la colangiopancreatografía retrógrada endoscópica (CPRE) y la colangiografía transhepática percutánea, aunque en épocas recientes han sido reemplazadas por la colangiorresonancia debido a que son particularmente invasivas. Estas tienen la ventaja de dar imágenes dinámicas del sistema biliar y pueden determinar la localización y extensión del CCE dentro del sistema biliar. Tienen una sensibilidad y una especificidad del 75 al 85%, y del 70 al 75%, respectivamente, y tienen la ventaja de brindar una citología por cepillado y/o biopsia que confirma el diagnóstico de CCA, aunque esto último como medida de rutina ha reportado una sensibilidad del 9 al 24% y una especificidad del 61 al 100%57-60.
Estadificación
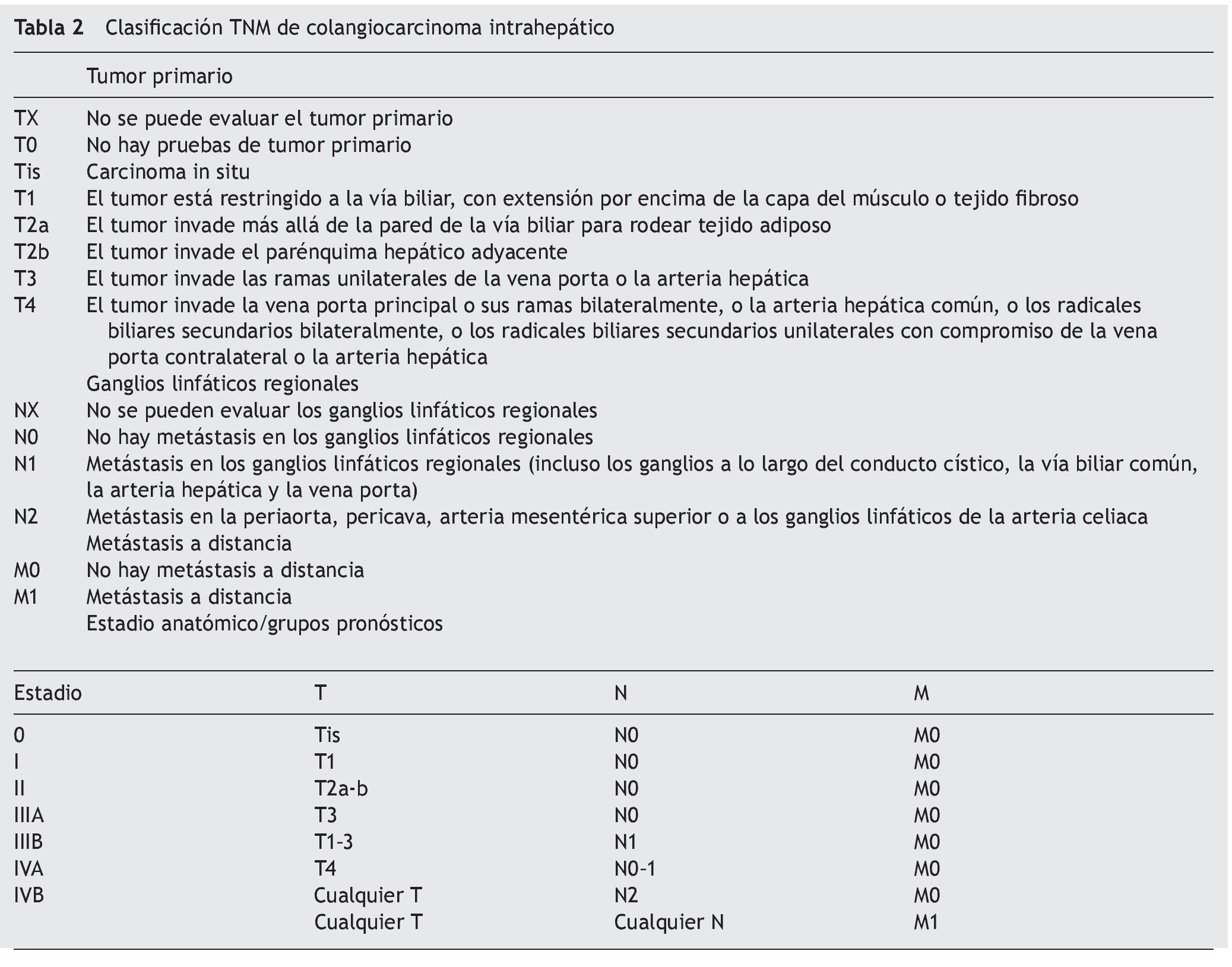
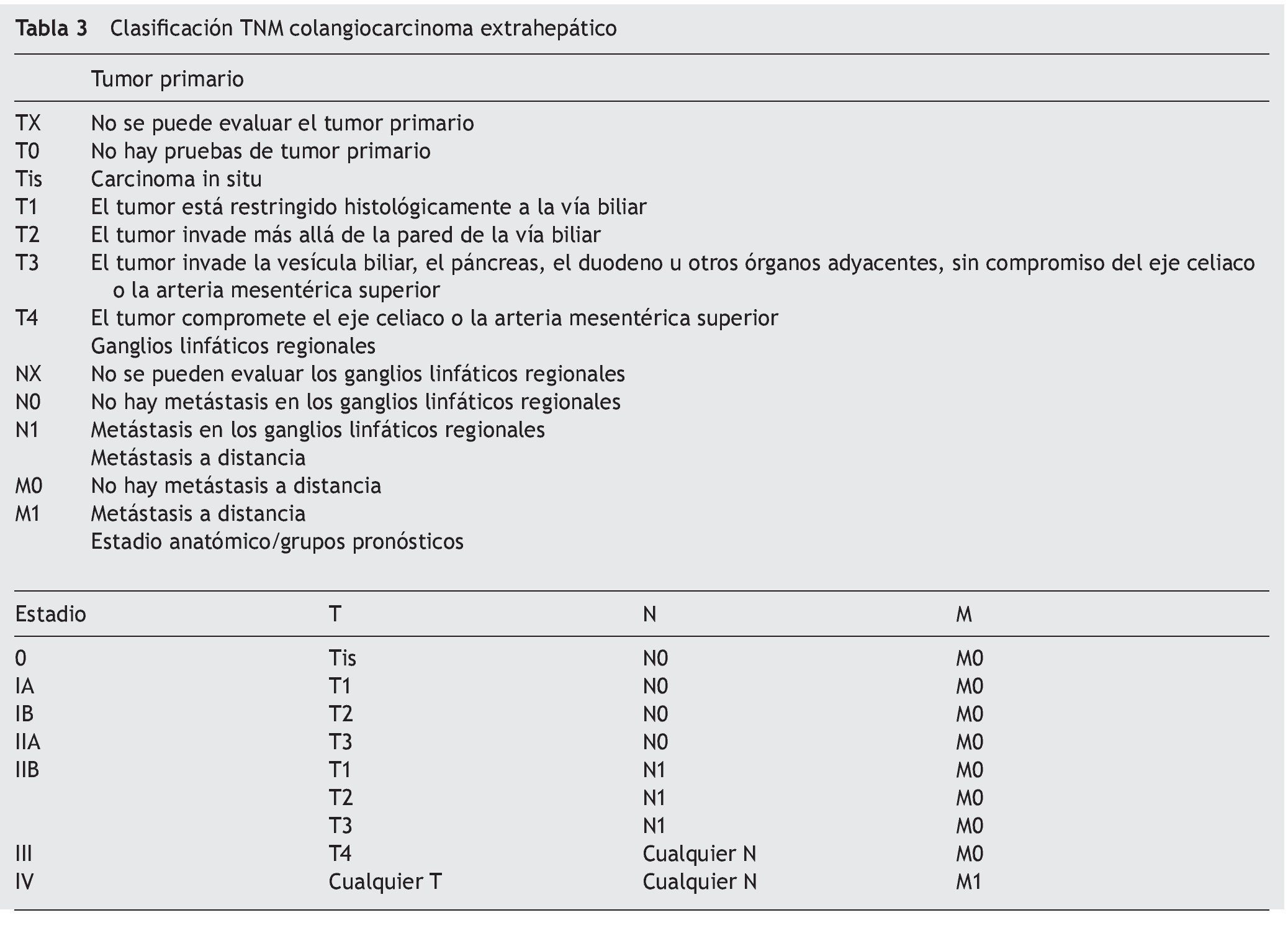
Los 3 sistemas más comúnmente utilizados para estadificar el CCA son el Bismuth-Corlette modificado, el del Comité Americano de Cáncer/Unión Internacional para el Control del Cáncer clasificación TNM y la Clasificación del Centro de Cancerología Sloan-Kettering.
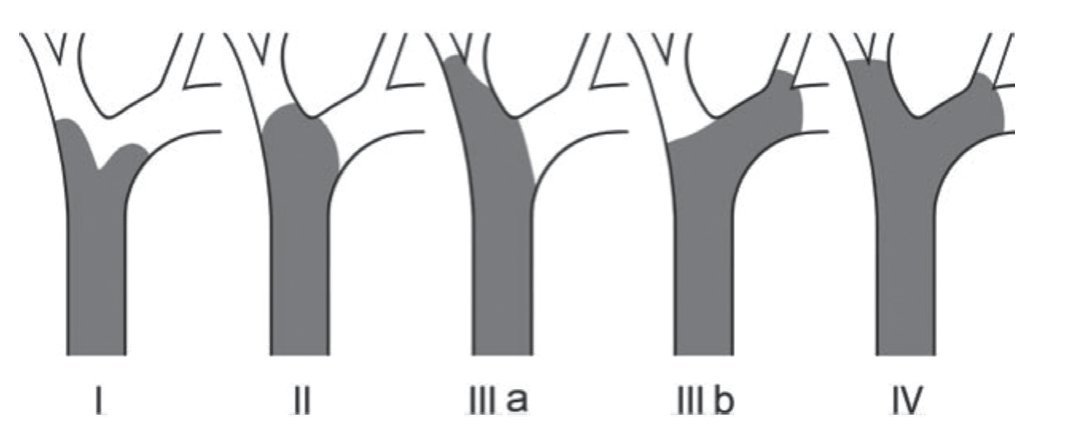
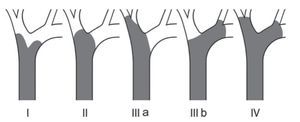
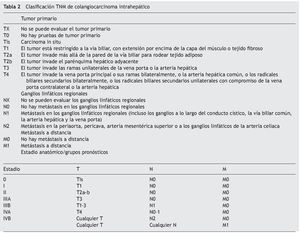
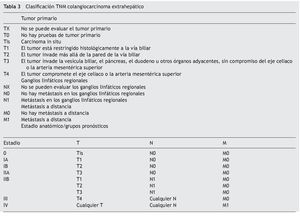
La clasificación de Bismuth-Corlette modificado fue propuesta en los años 70 y se enfoca exclusivamente en el nivel y la extensión de la invasión del tumor a lo largo del árbol biliar (fig. 1). Este es, probablemente, el sistema más utilizado en el mundo para CCA, aunque no provee información clave, como afectación vascular, afectación a ganglios, metástasis o atrofia hepática, ya que inicialmente se concibió como guía para el manejo quirúrgico, aunque por sus limitaciones en muchos centros especializados ya no se utiliza para este principio6,61. La clasificación TNM (tablas 2 y 3) está basada en los hallazgos histopatológicos; esta se asocia usualmente a la clasificación histológica de la Organización Mundial de la Salud y es la más utilizada para clasificar el estadio del tumor posterior a la resección quirúrgica. Aunque esta clasificación entra dentro del sistema estandarizado del TNM para cáncer y, debido a su uso posquirúrgico, no es útil para una valoración preoperatoria y ayudar a distinguir entre las opciones quirúrgicas62.
Figura 1. Estadificación del colangiocarcinoma Bismuth-Corlette. Modificado de Bismuth H & Corlette MB. Intrahepatic cholangioenteric anastomosis in carcinoma of the hilus of the liver. Surg Gynecol Obstet 1975;140:170-1786.
Por último, mencionaremos el sistema del Centro de Cancerología Sloan-Kettering (tabla 4), el cual fue diseñado para predecir la resecabilidad del tumor y pronóstico. Este clasifica el CCA según 3 factores, la extensión local del tumor, la localización del tumor en la vía biliar y la presencia de invasión a la vena porta y/o atrofia hepática lobar, aunque el tamaño del hígado no se especifica. Sus limitantes han sido la complejidad del mismo, ya que ha sido difícil su utilización en otros centros, y no evalúa los ganglios linfáticos, metástasis o afectación de la arteria63.
Por lo tanto, podemos considerar en este aspecto que no existe un sistema de estadificación óptimo para esta patología que nos brinde información detallada acerca de la extensión de la enfermedad, afectación vascular y metástasis sin tener que someter a cirugía al paciente y, en consecuencia, nos dé información fidedigna de la resecabilidad del tumor y sobrevida. Por lo anterior, es decisión de cada médico utilizar el sistema que considere adecuado para cada paciente según la evidencia disponible.
Tratamiento quirúrgico
Las opciones de tratamiento para el CCA son limitadas y se asocian a altos índices de recurrencia y una sobrevida corta. El tratamiento quirúrgico es la única opción de cura para el CCA, ya que cuando se puede resecar el tiempo medio de sobrevida es de 36 meses con un índice de recurrencia del 62,2% después de 26 meses de seguimiento, en tanto, si el tumor es irresecable, el paciente fallecerá dentro de los 6 a 12 meses posteriores al diagnóstico. A los 5 años, el índice de sobrevida es mejor para los pacientes con CCI (63%) que para los pacientes con CCE hiliar (30%) y distal (27%). El CCA solitario intrahepático se puede manejar con segmentectomía o lobectomía, con índices de sobrevida del 22 al 63% a los 5 años, que se han correlacionado con resecciones con márgenes libres de tumor (R0), ausencia de metástasis a ganglios linfático o invasión vascular. También se debe de considerar que los factores asociados a una reducción de la sobrevida después de la resección incluyen la cirrosis, ya que pacientes con clase Child-Pugh B y C e hipertensión portal se deben de considerar como que presentan una contraindicación relativa a la cirugía. La resección quirúrgica del CCE también es el tratamiento de elección en ausencia de CEP. Para el CCE hiliar, el tratamiento es la resección del conducto hepático afectado con lobectomía o lobectomía extendida con linfadenectomía regional y hepaticoyeyunoanastomosis, los ganglios linfáticos se encuentran positivos en un 28% de los casos: en este grupo, se tiene una sobrevida del 20 al 30% a los 5 años posteriores a la cirugía en pacientes con resección R0. En tanto para los pacientes con CCE distal, regularmente ameritan un procedimiento de Whipple; en un 68% de ellos, tendrán ganglios linfáticos positivos; la sobrevida en este grupo a los 5 años es del 27%, con un promedio de 25 meses con resección R0. Es importante tener siempre en consideración que la cirugía debe de intentarse únicamente con objetivos curativos, ya que no existe ninguna mejora en la sobrevida si no se reseca todo el tumor64-67. Cerca del 16 al 25% de los pacientes que se someten a laparotomía tendrán un tumor irresecable al momento de la cirugía. Las mayores determinantes de resecabilidad son: extensión del tumor dentro del árbol biliar, afectación hepática, invasión vascular, atrofia lobar y metástasis. Según la clasificación de TNM, se consideran irresecables todo estadio III y IV por CCA64-67.
En casos seleccionados, con una etapa temprana y tumores hiliares pequeños en que no es posible la resección total del tumor, se puede realizar hepatectomía con linfadenectomía regional para la resección completa de la enfermedad seguida de trasplante hepático. Se ha encontrado que este manejo quirúrgico, acompañado de un régimen estricto preoperatorio de quimioterapia y radioterapia neoadyuvante puede, llegar a tener índices de sobrevida del 91 y el 76% a 1 y 5 años, respectivamente64-67.
Consideraciones anestésicas en el manejo de colangiocarcinoma y fallo hepático
La anestesia óptima se extiende más allá de la farmacología y de los procedimientos técnicos. Los pacientes con CCA requieren anestesia, dependiendo del procedimiento quirúrgico que se les realizara68. Esto va desde la cirugía mínimamente invasiva, laparoscopia diagnóstica, cirugía abierta, hasta el trasplante de hígado. El manejo anestésico en estos pacientes es dependiente no solo de la magnitud de la cirugía, sino de su enfermedad hepática y vías biliares de base68,69. El hígado es el sitio principal de la biotransformación de los fármacos. Sin embargo, en pacientes con enfermedad parenquimatosa avanzada, la función de los sistemas orgánicos se encuentra alterada; esto unido al uso de agentes anestésicos eleva los riesgos anestésicos70,71. La insuficiencia renal, el sangrado postoperatorio y la sepsis son las complicaciones más frecuentes responsables de la mortalidad en dichos pacientes68,70.
La anestesia y la cirugía pueden agravar las alteraciones de los pacientes con hepatopatías previas y, en algunos casos, pueden precipitar a una insuficiencia hepática con consecuencias fatales; todo esto en relación con la etiología y la extensión del fallo hepático en cada paciente71. Es indispensable comprender la fisiopatología de las enfermedades hepáticas y de las vías biliares, tales como síntesis de albúmina, factores de coagulación, metabolismo de los fármacos, homeostasis de la glucosa y producción de bilirrubina; con el objetivo de brindar una atención perioperatoria óptima en la cirugía de CCA69.
Anatomía, fisiopatología hepática y anestesia
El hígado pesa aproximadamente 1.500 mg, su flujo sanguíneo normal es de 1.500 ml/min en adultos, correspondiente a un 25-30% del gasto cardiaco. La arteria hepática suministra el 25-30% del flujo sanguíneo y el 70-75% restante proviene de la vena porta. La arteria hepática suministra el 45-50% de los requerimientos de oxígeno del hígado, mientras que la vena porta aporta el 50-55%. La unidad funcional del hígado es el hepatocito, ahí se lleva a cabo el metabolismo de carbohidratos, la síntesis de albúmina, el metabolismo de aminoácidos, la síntesis de urea, el metabolismo de ácidos grasos y colesterol, la formación de bilirrubina y el metabolismo de substancias exógenas, entre ellas la mayoría de los medicamentos. La mayoría de los factores de coagulación y la vitamina K también se sintetizan en el hígado70. Por su parte, la enfermedad hepática altera la función de varios órganos y sistemas que pueden afectar a la evolución del proceso anestésico-quirúrgico; las condiciones más frecuentemente asociadas se resumen en el (tabla 5). Cada una de estas afecciones debe evaluarse para establecer la repercusión que se pudiera tener en el transoperatorio y emitir las recomendaciones pertinentes para la optimización en el preoperatorio72,73.
Manejo anestésico preoperatorio
La valoración preanestésica de los pacientes con hepatopatías debe centrarse en los patrones de lesión hepática y en la gravedad de la alteración funcional, así como en el fallo funcional de otros órganos y sistemas71. Los pacientes con hepatopatía presentan una mayor incidencia de complicaciones postoperatorias y de muerte perioperatoria, por lo que el manejo debe de ser óptimo70. De esa manera, el enfoque clínico de un paciente con CCA debe ser minucioso y son indispensables los siguientes puntos clave:
— Interrogatorio: debe de realizarse detalladamente con el fin de identificar las características de la enfermedad hepática, el tiempo de aparición (aguda o crónica), origen (hepatocelular o colestásico), y grado de reversibilidad (presencia de cirrosis) en caso de que ya se cuente con el diagnóstico enfermedad hepática conocida, como es en el caso de la cirugía por CCA. Búsqueda intencionada de factores de riesgo (transfusiones sanguíneas, medicamentos, alcoholismo, toxicomanías, infecciones virales) y de sintomatología ligada a falla hepática (ictericia, coluria, acolia, astenia, adinamia, anorexia). Además, se debe preguntar acerca de anestesias previas, antecedentes quirúrgicos, así como enfermedades en otros sistemas70,72.
— Exploración física: valorar estado nutricional, ictericia, sangrado, ginecomastia, ascitis, hepatoesplenomegalia, cardiomiopatía, encefalopatía, presencia de circulación colateral, edemas maleolares, atrofia testicular, acropatía (indicador de compromiso hepatopulmonar) y estado hiperdinámico (visualización de telangiectasias y disnea)70,72.
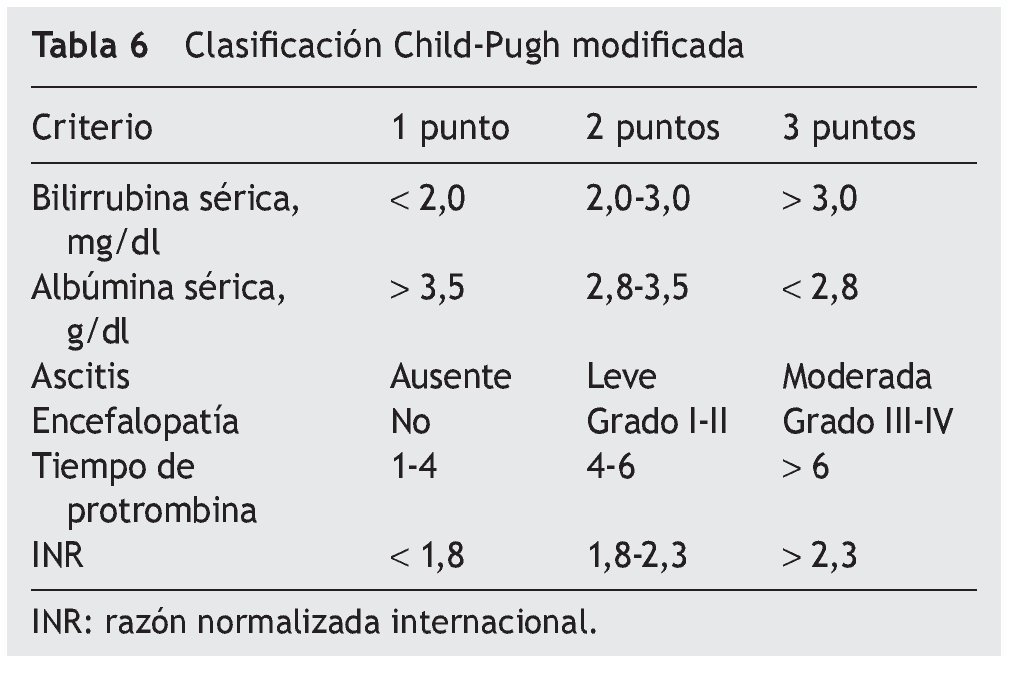
— Exámenes de laboratorio: los básicos para el estudio en el caso de hepatopatía por cáncer son: biometría hemática, recuento plaquetario, urea, creatinina, electrolitos séricos, glucemia, gasometría arterial, electrocardiograma, radiografía de tórax y muy importantes las pruebas funcionales hepáticas ,las cuales se pueden dividir en 3 grupos (tabla 6):
1. Función de la síntesis. El tiempo de protrombina refleja los niveles plasmáticos de factores de la coagulación sintetizados por el hígado: II, V, VII y IX, así como la determinación de albúmina sérica, que nos ayuda en hepatopatías crónicas72.
2. Patrón colestásico (excretor). Los niveles plasmáticos de bilirrubina total, principalmente la directa, refleja la función excretora del hígado, tanto en enfermedad intrahepática como extrahepática. La intrahepática puede estar acompañada de elevación de ALP72.
3. Patrón hepatocelular. Determinado por los niveles de las aminotransferasas (aspartato aminotransferasa-alanina aminotransferasa). Se traducen en presencia de inflamación a nivel hepatocelular y ayudan a la diferenciación entre hepatitis aguda (niveles de enzimas hepáticas > 10 veces el valor normal) y hepatitis crónica (niveles hasta 5 veces el valor normal)73. La gamma glutamil transpeptidasa es indicativa de daño hepatobiliar por alcohol72.
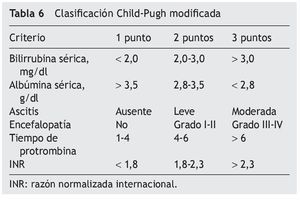
— Valoración del riesgo quirúrgico: el mejor índice para estimar el riesgo quirúrgico y valorar la reserva funcional hepática es la Clasificación de Child-Pugh modificada (tabla 7). Esta escala fue un modelo iniciado en el año 1964 por Child y Turcotte, con el objetivo de estratificar el riesgo quirúrgico en pacientes con descompensación portal. Posteriormente, fue modificada por Pugh en el año 1972, al cambiar el parámetro de estatus nutricional por el tiempo de protrombina. Se realiza de acuerdo con el grado de ascitis, las concentraciones plasmáticas de bilirrubina y albúmina, el tiempo de protrombina y el grado de encefalopatía. Una puntuación total de 5-6 es considerada grado A (enfermedad bien compensada), 7-9 es grado B (compromiso funcional significativo) y 10-15 es grado C (enfermedad descompensada). Estos grados se correlacionan con una sobrevida del paciente al año y a los 2 años72,74.
Instauración de la terapéutica adecuada
El objetivo es conducir al paciente a quirófano, en el mejor estado general posible, en caso de cirugía electiva, como en el caso de cáncer de vías biliares, corrigiendo los parámetros clínicos y bioquímicos que incrementen el riesgo perioperatorio. Se deben de corregir los trastornos de la coagulación; si las plaquetas son menores de 50.000/mm3 (cada unidad de plaquetas aumenta el recuento de 5.000 a 10.000/mm3), si el tiempo de protrombina es mayor a 3 s, administrar vitamina K a 10 mg/día. La ascitis se puede corregir con restricción de sodio y diuréticos desde el preoperatorio. De la misma manera, se debe considerar al paciente con estómago lleno, para lo que es necesario una inducción de secuencia rápida en el transoperatorio. Por su parte, la profilaxis para la broncoaspiración, en estos casos, se maneja con antagonistas H2 de histamina, metoclopramida y citrato de sodio70. La monitorización hemodinámica, hemostática, renal, ventilatoria y neuromuscular son de suma importancia durante el transoperatorio; algunos autores recomiendan el uso de dopamina a dosis bajas para la protección renal y efecto antialdosterona70. Los bloqueadores beta no se contraindican y son de suma importancia cuando hay hipertensión portal.
La presencia de ascitis, hipoalbuminemia < 3 mg/dl, coagulopatía (tiempo de protrombina > 1,5 veces el control), creatinina sérica > 1,2 mg/dl en hombres y de 0,9 mg/dl en mujeres, junto a un procedimiento quirúrgico, se asocia a una alta mortalidad72. La ictericia obstructiva es un riesgo elevado para la presentación de complicaciones posquirúrgicas y la mortalidad perioperatoria (del 8 al 28%). De esta manera, se pueden identificar 3 criterios, los cuales incrementan la mortalidad: hematocrito inferior al 30%, bilirrubina total mayor a 11 mg/dl e ictericia secundaria a un proceso neoplásico (carcinoma de páncreas o CCA); en presencia de estos 3 factores, la mortalidad alcanza el 60%72,75.
Inducción de anestesia en enfermedad hepatobiliar
Se decidirá el tipo de anestesia de acuerdo con el grado de reserva hepática de la Clasificación Child-Pugh modificada (tabla 7). La anestesia regional se podrá utilizar solamente en caso de que la clasificación resulte clase A, asumiendo que el estado de coagulación es aceptable y en casos seleccionados de enfermedad hepática avanzada siempre y cuando el estado de coagulación sea aceptable y la cirugía se pronostique a tiempo corto perioperatorio, como en la escleroterapia68,69. La anestesia general es la más utilizada en pacientes hepatópatas; se utilizará cuando la clase resulte B, C o sean grandes procedimientos quirúrgicos; en procedimientos laparoscópicos y en el CCA también es de elección71. La inducción de secuencia rápida es indicativa en pacientes con neumonía por aspiración y pacientes con ascitis; de no requerirse, debe de realizarse de manera cuidadosa la inducción del anestésico, ya que así disminuiremos el efecto del anestésico. La succinilcolina es una elección adecuada para facilitar la intubación endotraqueal71.
Cuando se utiliza anestesia general, se recomiendan dosis modestas de analgésicos volátiles, ya que los anestésicos inhalados disminuyen el flujo sanguíneo hepático, a causa de un efecto vasodilatador sistémico y un discreto efecto inotrópico negativo72. Dentro de los anestésicos volátiles, el mejor estudiado en cuanto a toxicidad hepática es el halotano69,71. La hepatitis por halotano es poco frecuente (1:25.000) y es posible que se deba a un mecanismo inmunitario estimulado por exposiciones repetidas69. El halotano, el enflurano, el isoflurano y el desflurano producen hialuro trifluoroacetilo oxidativo reactivo, que puede tener reacciones cruzadas, pero la capacidad del metabolismo hepático de los anestésicos volátiles es un factor probable para la génesis de la hepatitis69,71. El isoflurano, el desflurano y el sevoflurano presentan un menor metabolismo hepático que el halotano y el enflurano, y con ello se han asociado a una tasa menor de falla hepática71,73. En caso de contar con el antecedente de reacción de hipersensibilidad hacia alguno de estos agentes, no se recomienda su utilización, ya que una segunda reacción podría ser catastrófica71.
El uso de relajantes musculares no despolarizantes debe de considerar el mecanismo de eliminación de estos agentes, considerando que la dosis inicial para conseguir la relajación total puede ser mayor en los pacientes con hepatopatías68,71. El atracurio y el cisatracurio se recomiendan, ya que su metabolismo no depende de la función hepática o renal68,69,71. La obstrucción biliar completa puede interferir con la eliminación de relajantes, como vecuronio y pancuronio, ya que dependen del metabolismo hepático69. En pacientes con colestasis extrahepática y filtración glomerular normal, la galamina es más fiable71. Se recomienda el uso de sedantes y analgésicos de corta duración, ya que estos medicamentos pueden desencadenar episodios de encefalopatía hepática y delirio. El uso de benzodiacepinas o barbitúricos puede producir reacciones hepatotóxicas de carácter colestásico73. Los narcóticos pueden provocar un espasmo del esfínter de Oddi, produciendo cólicos biliares en pacientes con colestasis, y dificultar la interpretación de las colangiografías intraoperatorias; se puede utilizar glucagón para aliviar el espasmo no mecánico del esfínter de Oddi71. La utilización de remifentanilo o dosis baja de fentanilo como opioide, en combinación con midazolam, es relativamente segura, ya que se elimina rápidamente, produciendo adecuada sedación, analgesia y anestesia68. La liberación plasmática de fentanilo es significantemente más baja en pacientes cirróticos; la eliminación de la vida media se incrementa debido al decremento de liberación plasmática. El uso de midazolam, en pacientes con enfermedad hepática avanzada, es perjudicial debido a que se tiene una disminución en las tasas de filtración glomerular y esta complicación no se presenta con el uso de sufentanilo y propofol, porque estos se eliminan más lentamente68.
Es de suma importancia la monitorización de la frecuencia cardiaca, la presión arterial, la presión venosa central, electrocardiográfica, la saturación de O2 y los niveles de CO2 durante el evento quirúrgico, para evitar la reducción del flujo sanguíneo hepático secundario a hiperventilación y la acumulación de CO2 propia de la hipoventilación, con la consiguiente respuesta catecolaminérgica y la disminución del flujo hepático secundaria76.
Conclusiones
Aunque se han tenido un avance significativo en el entendimiento del CCA, este aún permanece como uno de los problemas de más difícil manejo que enfrenta el cirujano. Para considerar una resección curativa, se requiere de márgenes histológico negativos, lo que significa una resección quirúrgica amplia, que solo se puede lograr en un 30% aproximadamente de todos los casos. Aunque se ha presentado progreso en el diagnóstico, la estadificación y el manejo del CCA, se necesita más trabajo para poder mejorar los índices de curación y, sobre todo, prevenir esta agresiva enfermedad.
* Autor para correspondencia:
Blvd. Puerta de Hierro 5150, Fracc. Corporativo Zapopan, 45110 Zapopan, Jalisco.
tel. y fax: (33) 3848 5410.
Correo electrónico: robana@prodigy.net.mx (R. Anaya Prado).