El cáncer de laringe representa un reto para el clínico desde el diagnóstico hasta la toma de decisiones para el manejo. La estadificación se basa en la clínica, con ayuda de métodos endoscópicos y radiológicos. Una vez hecho el diagnóstico, tomamos en cuenta que: debemos procurar la preservación del órgano cuando es posible, pensar en la calidad de vida, en la calidad de la voz, la experiencia del equipo y el costo-utilidad del tratamiento. Estas decisiones se basan en estudios con un pobre nivel de evidencia, sin embargo con buenos resultados. Para las etapas tempranas tenemos tres opciones; la cirugía abierta, la cirugía láser transoral y la radioterapia. En la enfermedad avanzada y el salvamento, podemos seguir conservando el órgano con la combinación de estas herramientas, sin afectar a la supervivencia, y con una vida digna. Actualmente están en desarrollo nuevas tecnologías como el uso de robot en el tratamiento de estos tumores, pero debemos esperar a que haya más experiencia e instrumental adecuado.
Cancer of the larynx represents a challenge for the clinician from the time of diagnosis until the time of decision-making regarding disease management. Staging is based clinically, with endoscopic and radiological assistance. Once a diagnosis is made, the following are taken into consideration: organ preservation, when possible, quality of life, voice quality, surgical team experience, and treatment cost-benefit. These decisions are based on studies with a poor level of evidence; however, with good results. For early disease stages, there are three options: open surgery, transoral laser surgery, and radiotherapy. For advanced disease and salvage, organ preservation can be considered using a combination of these tools, without affecting survival, and offering a good quality of life. New technologies are currently being developed, such as the use of robotics in the treatment of these tumors, but wider experience and adequate instrumentation are being awaited.
Introducción
El cáncer de laringe representa el 0.5% del total de las neoplasias malignas, y del 3-4% de las localizadas en el área de cabeza y cuello. En el mundo se reportan aproximadamente 120,000 casos al año1,2. En Europa se estima un total de 52,000 casos nuevos, con una incidencia en el sexo masculino del 3%, con una mortalidad del 2%; en el sexo femenino la incidencia y la mortalidad no rebasan el 1%. En Estados Unidos se estima un total de 9,500 a 11,000 casos y la incidencia en el sexo masculino es de 9,680, con una mortalidad de 2,910; en el caso de las mujeres, la incidencia es de 2,570 y la mortalidad, 760 pacientes al año.
En cuanto a la supervivencia global (SG) reportada en Europa en dos periodos distintos, se observó una elevación discreta del 60.6% al 63.1%. Por otro lado, en Estados Unidos, a partir del NCDB (National Cancer Database) y el SEER (Surveillance, Epidemiology and End Results) se hizo una evaluación a 5 años de la supervivencia, que muestra disminución en diferentes periodos sobre un total de 158,426 casos, y sobre todo en pacientes con tumores T3N0M0; así, también depende el tratamiento que se le brinde; para la cirugía es del 63.3%; para la cirugía más radioterapia, del 65.2%; para la quimiorradioterapia concomitante, del 59.2%, y para radioterapia exclusiva, del 42.7%3,4. Lo anterior contrastado con el reporte hecho por Cosetti et al5, en el que la supervivencia se ve afectada principalmente por la enfermedad regional al momento del diagnóstico, y de manera más importante cuando hay enfermedad metastásica y factores relacionados con el huésped y criterio para proponer un tratamiento con base en estudios preoperatorios. Sin embargo, consideramos que la diferencia en supervivencia, en lo reportado por Europa y Estados Unidos, está en relación con que existe un mayor número de grupos quirúrgicos que en Norteamérica, donde la tendencia durante los años del estudio fue más hacia un tratamiento con radioterapia o quimiorradioterapia.
Los factores de riesgo, principalmente relacionados con el cáncer de laringe, son el alcohol (RR = 4 para 100 g/día) y el tabaco, y cuando ambos se encuentran presentes se sinergizan. En el humo del tabaco se han demostrado más de 4,000 sustancias químicas, de las cuales más de 60 son carcinógenos, esto aunado a la constante inflamación e irritación producida por el humo, que interfiere con las barreras protectoras naturales en el cuerpo humano, lo cual lleva a la iniciación de los tumores, promoción de lesiones desarrolladas previamente, y actuación como cocarcinógenos. Esto también sucede con los fumadores pasivos, ya que el humo que despide el cigarro y que es inhalado contiene incluso una mayor concentración de carcinógenos. Se han reportado además otros agentes causales, como el virus del papiloma humano (VPH), infección de la cual se tiene como consecuencia la papilomatosis laríngea, relacionada de forma más importante con los subtipos 6 y 11, pero el mecanismo de transmisión y el curso de la misma es impredecible; sabemos que hay alteraciones en la vía del p53 a través de la expresión del oncogén E6, con la consecuente inducción de la proliferación de células tumorales, pero la sinergia entre el virus y otros agentes carcinógenos son hipotéticas, ya que solo la existencia del VPH parece ser insuficiente para el desarrollo de un tumor. Sin embargo, existen estudios que señalan que el riesgo de muerte por cáncer relacionado con tumores asociados al VPH es menor que en una población negativa a la infección6.
Diagnóstico del carcinoma glótico
Se requiere una adecuada estadificación del cáncer de laringe previa al tratamiento, para así tener una mejor planificación y, en consecuencia, poder evaluar de forma comparativa los resultados de las diferentes modalidades de tratamiento. Para el carcinoma de la laringe de cualquier subsitio, la extensión de diseminación e infiltración deberá ser estudiada en cada caso según los hallazgos clínicos, foniátricos, endoscópicos y de imagen. El protocolo para la estadificacion incluye: laringoscopia indirecta, microlaringoscopia directa, tomografía computarizada (TC) con medio de contraste y resonancia magnética (RM). La combinación de una evaluación clínica y endoscópica y la indicación de TC o RM resultan en mejora de la exactitud diagnóstica (el 80 frente al 97% respectivamente)7. La pregunta es si se debería llevar todos los estadios al mismo protocolo de estudio o si el protocolo sería diferente para tumores tempranos y para los avanzados.
La laringoscopia indirecta, descrita por primera vez por Manuel Garcia en 1854 tras inspeccionar su propia laringe con un espejo dental iluminado con luz solar, permitió iniciar un manejo más adecuado de los tumores de laringe en su época8. Es importante destacar que la utilización del espejo ha continuado hasta nuestros días, pero para una evaluación óptima altamente especializada, la laringoscopia mediante nasofibrolaringoscopio o laringoscopios rígidos de 90°, con o sin monitores, ha permitido obtener una mejor evaluación inicial, incluso con la posibilidad de obtener una biopsia en el mismo momento. Esta evaluación inicial nos permite ubicar la lesión si se encuentra en el tercio anterior y si involucra o no la comisura, el tercio medio de la cuerda vocal y el involucro del tercio posterior, con posible infiltración al proceso vocal del aritenoide. La extensión y el tamaño nos permiten establecer el estadio clínico, sobre todo en etapas tempranas. El problema del involucro de la comisura anterior nos permitirá conocer con exactitud el estadio y requerirá estudios de extensión para determinar su extensión y clasificarlo en estadio I o III. Es importante señalar que las lesiones T1 y T2 seleccionadas seguramente no pasaran al siguiente nivel diagnóstico de estas neoplasias, y no hay estudios que permitan establer el porcentaje de este grupo de pacientes.
La microlaringoscopia de suspensión (MLS): la laringoscopia directa rígida se realiza transoralmente, así la laringe queda expuesta facialmente en la mayoría de los casos. Varias condiciones propias del paciente se han identificado como parámetros para no exponer adecuadamente la laringe, como cuello corto, macroglosia, problemas musculares del cuello, obesidad y limitación a la extensión del cuello debido a varias condiciones como cirugías o lesiones propias de la columna cervical9. La MLS tiene tres funciones principalmente; la primera, establecer el diagnóstico histológico cuando este no se logra durante la laringoscopia indirecta o no se considera para algunos grupos, como en el posible manejo ambulatorio. La segunda es delimitar y estadificar la extensión del tumor con visión endoscópica directa; así también, gracias a las lentes de 30°, 70° y 90°, podemos evaluar adecuadamente la extensión hacia el ventrículo, la comisura anterior o las lesiones que desciendan hacia la subglotis, comúnmente referidas como zonas oscuras de la laringe10,11. Eryilmaz et al12 demostraron que la laringoscopia directa sola tiene un papel limitado en las zonas oscuras de la laringe, con una sensibilidad del 50-70%. La evaluación clinicoendoscópica no es suficiente para descartar la afección de los cartílagos laríngeos y los tejidos extralaríngeos, lo que resulta en poca exactitud para la estadificación (57.5%)7. Esta limitación ya está bien reconocida en los tumores glóticos, sobre todo en la comisura anterior, donde pueden convertirse precozmente en tumores más avanzados. No se puede evaluar la extensión profunda, como la afección de los espacios paraglótico y preepiglótico, el esqueleto cartilaginoso y las estructuras extralaríngeas7. La tercera es poder realizar el tratamiento de la lesión mediante resección transoral con láser CO2 o, recientemente, cirugía robótica transoral (TORS por sus siglas en inglés) que aún no se considera un estándar en los grupos que lo tienen en su arsenal. Sin embargo, como se ha mencionado anteriormente, en caso de no lograrse una exposición adecuada, se tendrá que optar por otro tipo de manejo como radioterapia, cirugía abierta o cirugía con MLS mediante fibra de CO2 láser.
Diagnóstico radiológico
Tomografía computarizada
Desde 1976, la TC es un método diagnóstico utilizado habitualmente para evaluar la mayor parte de los tumores en el área de cabeza y cuello y la herramienta radiológica más importante en la estadificación preterapéutica de los tumores laringofaríngeos. Por otra parte, la TC de la laringe tiene sus limitaciones, especialmente para determinar la invasión cartilaginosa, por la mezcla de cartílago calcificado, osificado o no calcificado, por lo que la TC en general subestima la infiltración cartilaginosa.
Cuando se conjunta la TC y la lente de 70°, es claramente superior, con una sensibilidad del 70-100%. Así, para la comisura anterior y el ventrículo, también ambos son considerados como perfectos con una sensibilidad del 100%; sin embargo, para la subglotis, el telescopio rígido es superior a la TC, con una sensibilidad del 70-90%12.
Imagen por resonancia magnética
Recientemente, la RM se ha probado como método diagnóstico útil para la evaluación del carcinoma laríngeo. Según lo reportado en la literatura, la RM parecer ser de mayor utilidad que la TC en predecir la invasión del cartílago. Becker et al13 demostraron en su estudio que la hipótesis de la visualización de una mayor intensidad de la señal en la secuencia T2, sobre todo a nivel del cartílago, comparado con las estructuras adyacentes, indica inflamación peritumoral dentro del cartílago laríngeo, y en contraparte una señal de la misma intensidad en la secuencia T1 y T2 indicaría tumor intracartilaginoso. Así, los criterios diagnósticos por imagen de RM que ellos proponen tienen el potencial de hacer una mejor distinción entre tejido tumoral e inflamación peritumoral. Lo anterior permitiría reducir el sobrediagnóstico en la interpretación de la RM.
Para Zbären et al7, en un estudio que comparó RM, TC y correlación histopatológica, así como para Daflo et al14 con RM y correlación histopatológica, la RM parece ser el estudio de elección para detectar invasión de cartílago, subglotis y comisura anterior. Sin embargo, estamos de acuerdo con Zbären et al7, se debe tomar en cuenta las potenciales fallas de ambas técnicas de imagen, llamadas subestimación en el caso de la invasión del cartílago observadas en la TC y la sobrestimación con la RM, que son esenciales para la decisión de un tratamiento apropiado. Una interpretación interdisciplinaria cuidadosa tanto de la TC como de la RM se debe llevar a cabo por el cirujano de cabeza y cuello, el radiólogo y el radiooncólogo, tomando en consideración los hallazgos clínicos y endoscópicos, imprescindibles para evitar un tratamiento inadecuado7.
Manejo de T1a, T1b y T2
Actualmente, el tratamiento del cáncer de laringe en etapas tempranas se basa en estudios con un bajo nivel de evidencia. Las opciones con que se cuenta son la cirugía preservadora de órgano, ya sea transoral o abierta, y la radioterapia. Recientemente la medicina personalizada ha tenido un importante auge, por lo que hay que considerar varios aspectos cuando decidimos en conjunto con el paciente la mejor opción para su tratamiento.
T1a/T1b, T2 y T3 seleccionados
Se tiene que tener en mente que en estos estadios siempre se debe conservar la laringe y tratar al paciente con intento curativo independientemente del tratamiento, ya que en la mayoría de los casos estos mueren de un segundo tumor primario u otras enfermedades coexistentes. Recordemos también que la enfermedad regional ganglionar es un evento poco frecuente en estas etapas, por las características anatómicas a nivel de la glotis. Las opciones para estas etapas son: la cirugía abierta, la cirugía láser transoral y la radioterapia.
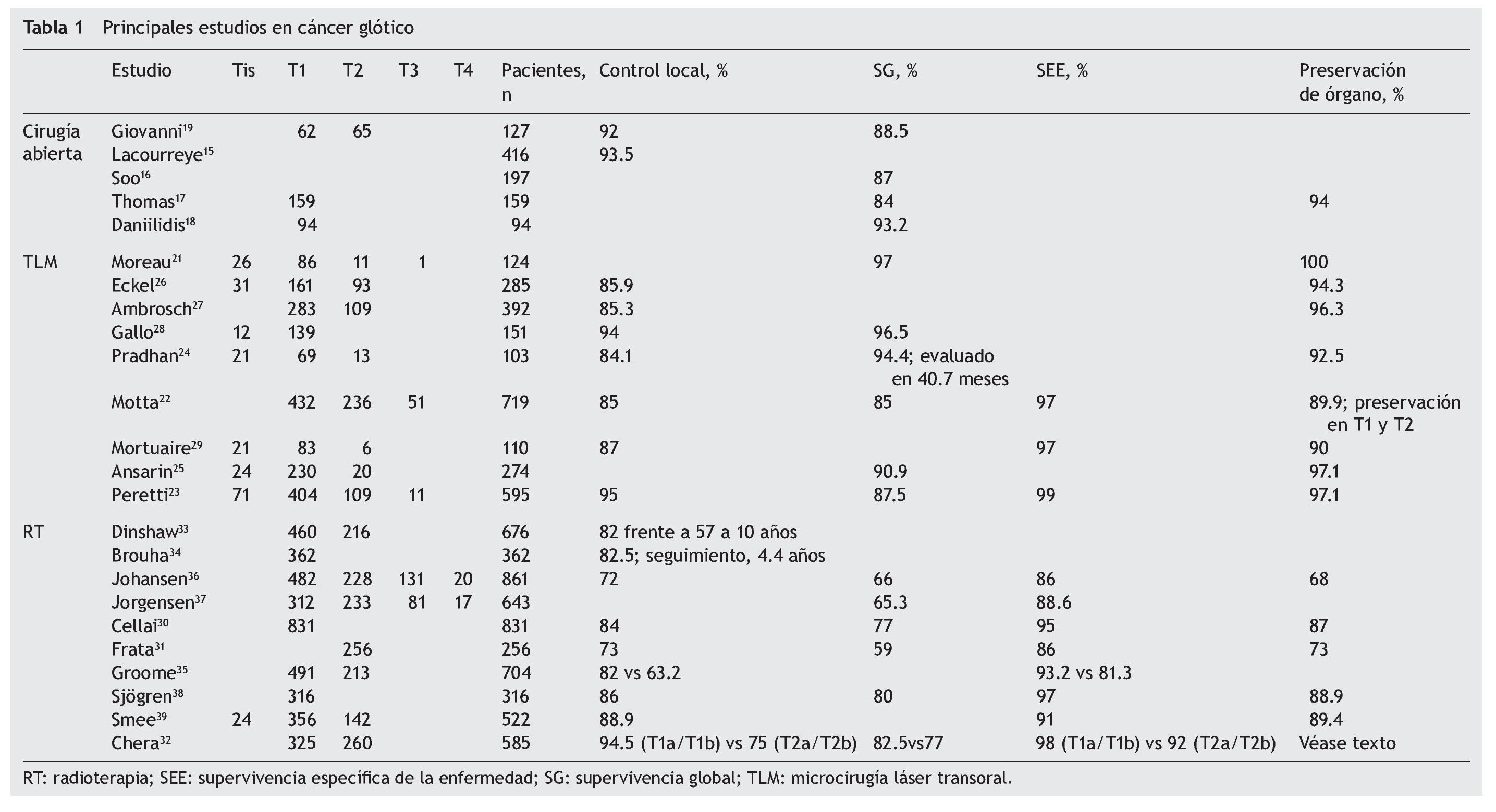
Los primeros estudios en el manejo quirúrgico del cáncer de laringe incluyen procedimientos tales como: laringofisura con cordectomía, laringectomía parcial frontolateral, procedimientos de la comisura anterior y hemilaringectomía y la laringectomía supracricoidea con cricohioidoepiglotopexia y/o cricohioidopexia en Europa. Lacourreye et al15 compararon dos técnicas en pacientes con tumores T2 y se reportó un control local de hasta el 93.5%, por lo que es una excelente opción para el tratamiento de estos pacientes; en otra serie del mismo autor, se reporta un control local de hasta el 100% de las lesiones de la porción media de la cuerda, en comparación con las que la ocupan toda, lo que da pauta para una mejor estadificación de los pacientes entendiendo el comportamiento biológico de los tumores localizados en la laringe. Por otra parte, al mismo tiempo en Norteamérica hay estudios como el de Soo et al16 en el Memorial Sloan-Kettering, con 197 pacientes llevados a laringectomía vertical parcial, e incluso con pacientes en etapas localmente avanzadas, con baja morbimortalidad y sobrevida reportada del 87% a 5 años, lo que coincide con otros (tabla 1)17-19.
El control a 5 años en cirugía abierta conservadora es de un 90-98%, y anteriormente se consideraba siempre realizar traqueostomía. Actualmente sabemos que no es necesario realizarla en todos los casos, con lo cual la morbilidad de estos procedimientos se ve disminuida17,19. Por lo anterior concluimos que actualmente las indicaciones para llevar a cabo una cirugía abierta es cuando hay tumor invasor que no se puede resecar endoscópicamente de manera segura, si la exposición de la laringe es difícil, si no se cuenta con el recurso del láser de CO2 y cuando el paciente prefiere este tipo de cirugía.
Históricamente, después de los estudios de Wolfgang Steiner et al en Götingen (Alemania), el uso de la microcirugía láser para el tratamiento del cáncer de laringe se ha expandido al resto del mundo, y actualmente hay numerosos estudios al respecto. El control local a 5 años en pacientes tratados con cirugía láser se reporta desde un 85-98%, y las principales ventajas son la menor duración del tratamiento y reducción de los costos, y que deja abiertas todas las opciones en caso de que se presente una recurrencia o un segundo tumor primario en el área de cabeza y cuello20.
Se han publicado gran cantidad de artículos sobre el tratamiento del cáncer de laringe glótico temprano con microcirugía transoral con láser CO2, algunos de los cuales incluyen tumores localizados en la supraglotis, que excluimos por no ser motivo del presente análisis21. Como se observa en la tabla 1, el uso de la microcirugía láser transoral no solo se reserva para pacientes con tumores tempranos, también se ha utilizado para el tratamiento de pacientes con tumores T3 bien seleccionados por un adecuado control oncológico (control local y locorregional del 66 y el 83% respectivamente) y, como mencionaremos más adelante, también es útil en el manejo de pacientes a la recurrencia o con enfermedad voluminosa aunque se ha observado que en estos pacientes el porcentaje de preservación de laringe se puede ver disminuido hasta en un 80.5%, como lo reportado por Motta et al22, o incluso menor, como lo reportado por Peretti et al23, que es del 72.7% a 5 años. Por otra parte, el porcentaje de preservación de órgano reportado en la mayoría de las series para tumores T1 y T2 está por encima del 95%.
En el análisis del control local, existe una diferencia importante entre las distintas series, y va desde el 84.1% reportado por Pradhan et al24, donde se demuestra un alto porcentaje de pacientes con tumores T2 que recurrieron (23.1%) y el control local fue del 72.9%, lo que no se observó para los Tis, T1a y T1b, en los que el control local es del 84.5%. Por lo anterior, podemos concluir que el control local está en relación directa con la extensión del tumor y su localización, y que para los pacientes que tienen una lesión hacia la comisura anterior el control local se ve afectado por la dificultad para la exposición y el margen, que en la mayoría de los casos será limitado (≤ 1 mm), lo cual se traduce en un mayor riesgo de recurrencia25.
A pesar de que la supervivencia global en algunos estudios se reporta a los 36 meses o incluso a los 40, el comportamiento es parecido en todos los reportes y se encuentra por arriba del 90%. La supervivencia específica a la enfermedad (SEE), aunque no reportada en todas las series, es de alrededor del 97%. Un aspecto importante, como ya se ha mencionado, es la preservación del órgano, lo cual tiene impacto en la calidad de vida del paciente, y en la mayor parte de las series con TLM (microcirugía láser transoral) se reporta de alrededor del 90-100%; en las series de manejo con radioterapia, no se obtiene este alto porcentaje26-29.
Antes del advenimiento de la cirugía láser, se consideraba que el tratamiento estándar para los tumores T1 era la radioterapia (tabla 1), y el control local a 5 años se reportaba en un 82-89%. Cellai et al30, con 831 pacientes tratados con radioterapia para T1, reportaron un control local del 84%, con SEE del 95% y alta tasa de preservación laríngea (87%). En pacientes con tumores T2 tratados con radioterapia, el porcentaje de control local a 5 años disminuye hasta un 73%, como lo reportado por Frata et al31; similares resultados se reportan para el tratamiento con cirugía láser en la misma etapa clínica. En este estudio también se observó que los factores que afectan al control local son la extensión tumoral y la movilidad cordal alterada, que fueron estadísticamente significativos en los análisis univariable y multivariable.
Chera et al32 actualizaron recientemente el estudio clásico de Mendenhall, en el que se hace evidente la diferencia en cuanto al control local y la supervivencia global comparando a pacientes con tumores T1 y T2, así como una discreta diferencia en la SEE. El control local de los tumores T1a fue del 94%; T1b, el 93%; T2a, el 80%, y T2b, el 70%. La SEE y la supervivencia global fueron: T1a, el 97 y el 82%; T1b, el 99 y el 83%; T2a, el 94 y el 76%, y T2b, el 90 y el 78% respectivamente, y la preservación laríngea a 5 años: T1a, el 95%; T1b, el 94%; T2a, el 81%, y T2b, el 74%.
Dinshaw et al33 estudiaron tres regímenes de tratamiento basados en el tiempo y la dosis de radiación, y reportaron control local a 10 años del 82% para T1 y del 57% para T2. En este estudio se concluye que una mayor dosis por fracción con corta duración del tratamiento se puede reflejar en menor costo con toxicidad similar.
Un aspecto importante a valorar en el manejo con radioterapia es el tiempo de espera (desde el estudio histopatológico al inicio de la radioterapia) y la disponibilidad de los equipos, por lo cual Brouha et al34 evaluaron el tiempo de espera a la radioterapia con la evolución del paciente, y observaron que, tras una media de seguimiento de 4.4 años y con una media de tiempo de espera de 43 días, no hubo relación significativa con la evolución en el análisis de regresión de Cox (p = 0.88), ya que el control local fue del 82.5%. Otros autores han mostrado resultados similares, pero sabemos que la radioterapia tiene resultados oncológicos comparables a la TLM, como se ha demostrado en otros estudios35-39.
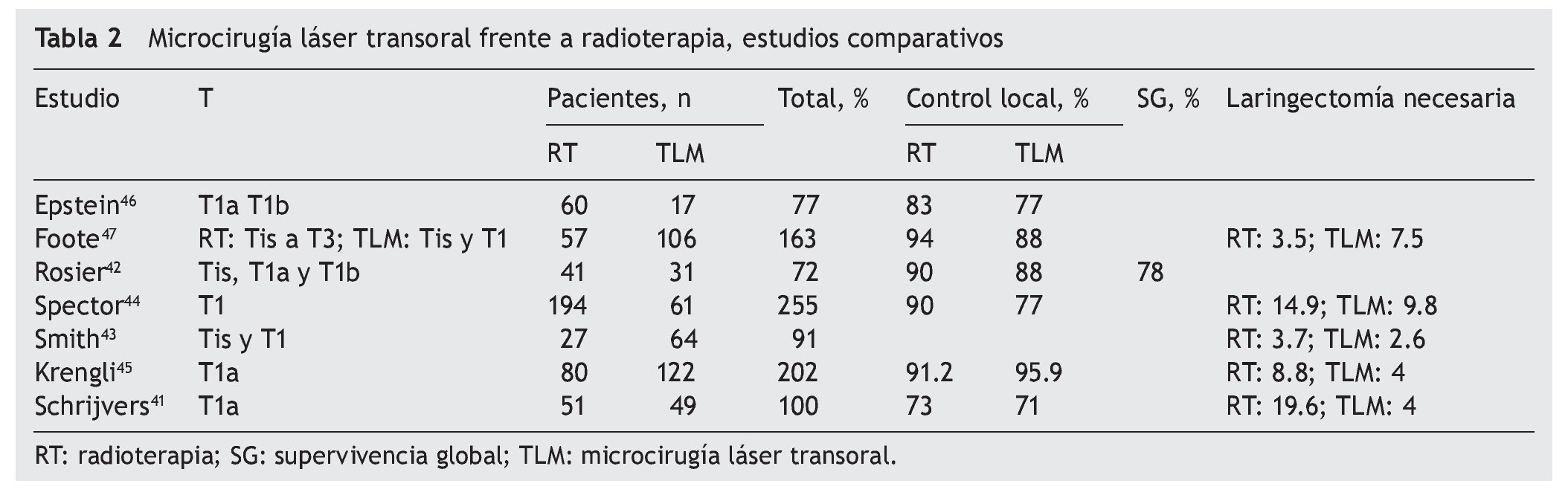
Con todos estos antecedentes en el tratamiento del cáncer de laringe temprano, era de esperar que viniera la controversia sobre el manejo establecido, ya sea con radioterapia o TLM, y aunque en su mayoría los estudios son retrospectivos con un bajo nivel de evidencia, existen ya varios artículos al respecto. Como hemos observado, las tres opciones (cirugía abierta, TLM y radioterapia) son oncológicamente seguras; por esto la diferencia radica ahora en la calidad de la voz, el costo final del tratamiento y algo que recientemente ha cobrado suma importancia: la preservación del órgano en la evaluación a largo plazo. De los estudios analizados para el presente artículo, solo 7 realmente comparan retrospectivamente head-to-head ambos tratamientos (tabla 2).
Cuando se evalúa el control local comparando radioterapia y TLM, no hay diferencia estadísticamente significativa para ambos grupos, como en el metanálisis realizado por Higgins40, el cual incluye seis series; sin embargo, no incluye la serie de Schrijvers et al41, quien tiene un menor control local en ambos grupos (tabla 2).
En cada una de las series hay un sesgo importante que influye en los resultados, y es el hecho de tener más de una modalidad de tratamiento, como la serie de Rosier et al42, donde 10 pacientes de 31 llevados a TLM recibieron radioterapia adyuvante por margen positivo, o en la de Smith et al43, de la que 9 pacientes del grupo de TLM pasaron a otros tratamientos como hemilaringectomía vertical, laringectomía total o radioterapia o, por el contrario, pacientes llevados de forma inicial a radioterapia y que fueron llevados a cirugía endoscópica de rescate.
Cuando revisamos específicamente el porcentaje de pacientes que requirieron laringectomía en el estudio de Higgins40, existe una diferencia discreta cuando el tratamiento inicial es con TLM, por lo observado en los estudios de Spector et al44 (el 14% del grupo de radioterapia requirió laringectomía, frente al 9.8% del de TLM), Krengli et al45 (el 8.8 frente al 4%) y el estudio más reciente de Schrijvers41, en el que la diferencia en preservación fue mejor para el grupo de TLM (el 95 frente al 77%; p = 0.043). Consideramos que la diferencia sí es importante y se debe tomar en consideración junto con el paciente para llevar a cabo un tratamiento46,47.
Se debe tener en cuenta varios factores para otorgar un tratamiento del cáncer de laringe temprano, y a pesar de que el manejo se basa en estudios con pobre nivel de evidencia, en la mayoría se concluye que no hay diferencia estadísticamente significativa en el control a 5 años y en la sobrevida global. Pero sí hay mayor preservación laríngea a largo plazo en los pacientes llevados a TLM inicialmente, con la ventaja de dejar abiertas las opciones en caso de recurrencia; en el caso de la radioterapia, la ventaja radica discretamente en una mejor calidad de la voz. Por otra parte, debemos considerar que el paciente que es llevado inicialmente a tratamiento con radioterapia no tiene la oportunidad volver a tratamiento con radioterapia; lo más frecuente es llevarlo a laringectomía total y, en casos bien seleccionados, se puede rescatar con cirugía láser o cirugía abierta preservadora de órgano. No menos importante es la infraestuctura del sitio en que se lleve a cabo el tratamiento, y la experiencia del equipo es un punto álgido en el que se debe trabajar, ya que es un hecho que el costo-utilidad es mejor para el tratamiento con TLM.
Cáncer de laringe avanzado
El cáncer de laringe es hasta el día de hoy el modelo de tratamiento en que se preserva el órgano con intento curativo. A pesar de ello, no existen estudios prospectivos que comparen un tratamiento quirúrgico conservador y otro no quirúrgico en pacientes con enfermedad localmente avanzada. Dada la evidencia que existe en el manejo de pacientes T3 con una adecuada evaluación y selección en relación con el control local con cirugía conservadora, esta puede ser una opción viable, pero dependerá de la experiencia del equipo y las preferencias del paciente.
En cuanto a los pacientes con tumores que requieren laringectomía total, sabemos que no hay mejora en la superviviencia o el control local respecto al tratamiento no quirúrgico. Sin embargo, se han estudiado varias opciones de tratamiento que en forma inicial fue con intento paliativo y posteriormente para la conservación del órgano, con el afán de mejorar la calidad de vida con una laringe funcional, y con el potencial efecto de la quimioterapia de actuar como un citorreductor sistémico, y un radiosensibilizador locorregional. Los primeros indicios de este pensamiento fueron con el trabajo de Tarpley et al en 197548, que usaron metotrexato y leucovorina preoperatorios en tumores de cabeza y cuello.
Más tarde, el primer estudio aleatorizado fue el clásico del Department of Veterans Affairs (VA) Laryngeal Cancer Study Group49, donde se estudió a un total de 332 pacientes con cáncer de laringe en estadios III y IV aleatorizados a dos grupos de tratamiento: laringectomía total seguida de radioterapia o quimioterapia seguida de radioterapia para quienes respondían o cirugía para los que no. La supervivencia a los 5 años fue igual para ambos grupos (68%). Una característica importante es que la mayoría de los pacientes estaban en etapa III y afección en la supraglotis. Esto representó un cambio en la perspectiva, por lo que más tarde vinieron estudios como el realizado por la GETEC (Groupe d’Étude des Tumeurs de la Tête et du Cou), que analizó a 68 pacientes; sin embargo, a diferencia del de VA, todos lo pacientes tenían fijación del aritenoides, y solo el 31% eran tumores supraglóticos. En este estudio, la supervivencia a 2 años fue mayor para el grupo de cirugía (84%), pero el 42% de los llevados a quimioterapia no necesitaron de laringectomía50.
El tratamiento concomitante basa su uso en el concepto de radiosensibilización, que sigue siendo teórico, ya que se cree que la quimioterapia sincroniza las células tumorales en una fase del ciclo celular (G2) en donde tiene su mayor acción la radioterapia. Además podría alterar mecanismos de reparación del ADN y tener efectos antiangiogénicos51.
Después del estudio del VA, otro estudio clave fue el que publicó en 2003 la RTOG 91-11 (Radiation Therapy Oncology Group)52, que aleatorizó a 547 pacientes con cáncer de laringe en estadios III y IV, pero solo analizó a 497; el grupo en que se observó la mayor proporción de pacientes con laringe intacta fue el de quienes recibieron quimioterapia (cisplatino) y radioterapia concomitantes (88%), a diferencia de los del grupo de quimioterapia de inducción seguida de radioterapia (75%) o radioterapia sola (70%). También el control locorregional fue mejor con la concomitancia (el 78 frente al 61% con la quimioterapia de inducción y el 56% con radioterapia sola). Si analizamos los datos de este estudio, veremos que un alto porcentaje de pacientes presentaba tumores en la supraglotis, y además una menor proporción era de pacientes con etapa clínica IV, y que también se incluyó a pacientes con tumores T2; sin embargo, la preservación laríngea se logró en un alto porcentaje de los casos.
En lo que respecta al tipo de radioterapia, existe un metanálisis realizado por Bourhis et al53, donde se analiza si el tipo de radioterapia podría tener impacto en la supervivencia, por lo que se revisaron estudios que compararan radioterapia convencional con hiperfraccionamiento o acelerada en pacientes con tumores de cabeza y cuello no metastásicos. En un total de 15 estudios con 5,615 pacientes, se observó beneficio absoluto en supervivencia del 3-4% en los pacientes llevados a un fraccionamiento no convencional y el beneficio fue significativamente mayor en el hiperfraccionamiento (el 8% a 5 años) que con la radioterapia acelerada (el 2% con fraccionamiento acelerado sin dosis de reducción).
Un estudio reciente que exploró el papel de la quimioterapia es de Pointreau et al54, donde se analiza el uso del docetaxel (T) aunado al platino y al 5-fluorouracilo (PF), en pacientes con cáncer de laringe e hipofaringe avanzado. La preservación laríngea fue mayor para el grupo de TPF que en el de PF (el 70.3 frente al 57.5%), lo que nos hace pensar que se podría preservar el órgano en más pacientes.
Finalmente el metanálisis de Pignon et al55 evaluó el papel de la quimiorradioterapia en el tratamiento del cáncer de laringe, y se observa una mejora en la superviviencia en comparación con el uso de tratamiento secuencial o radioterapia sola. Se analizaron 24 nuevos estudios con un total de 16,485 pacientes; se observó un beneficio absoluto del 6.5% a 5 años con la concomitancia, y también una disminución del efecto de la quimioterapia con la edad.
Con todo esto concluimos que debe evaluar al paciente un equipo multidisciplinario, y en el caso de pacientes con enfermedad localmente avanzada, ser acucioso con la factibilidad de conservar el órgano, según el grado de afección laríngea, la funcionalidad de esta al momento de la evaluación, la experiencia del equipo multidisciplinario y, por supuesto, la elección del paciente.
Quimioterapia exclusiva para la glotis
El concepto de quimioterapia exclusiva, o como tratamiento único, para el manejo del cáncer de la glotis no ha sido muy estudiado en el mundo; de hecho, el concepto ha sido ampliamente estudiado en Francia56,57 y recientemente por un grupo en el MD Anderson Cancer Center en Estados Unidos58 como alternativa para conservación de órgano. El grupo francés ha basado sus resultados en quimioterapia a base de platino + 5-fluorouracilo, con respuestas completas hasta en 21/58 (36.2%) y 35/79 (33%) pacientes. El grupo americano ha basado sus resultados en quimioterapia a base de TIP (paclitaxel+ifosfamida+cisplatino) con respuestas completas de 11/31 (37%) pacientes. Estos grupo de respuestas completas es donde se ha logrado conservar el órgano en un 100%, incluidos los rescates. La conservación de órgano en general para el grupo francés fue del 100%, y 2 (5.7%) pacientes requirieron radioterapia58; para el grupo americano fue del 83%, y 5 (16%) pacientes requirieron radioterapia59.
Sin embargo, la observación a estos estudios es que un gran porcentaje (85%) de pacientes se encontraban en estadio tempranos, I (n = 9) y II (n = 21) en el estudio francés57; en el estudio americano58, estaban en estadio II el 71% de los pacientes, sin contar que este solo incluyó a 14 pacientes con cáncer de la glotis. Esto podría ser diferente para los estadios avanzados, en los que el porcentaje de respuestas completas en tumores avanzados no es tan significativa, como se demustra en el estudio de Laccourreye et al59; de sus pacientes con quimioterapia de inducción seguidos de cirugía conservadora en T3-T4, tuvieron respuesta completa 6/60 (10%) pacientes. Una reciente revisión realizada por Holsinger et al60 de la base de datos del grupo del Hospital Georges Pompidou, en París (Francia) muestra una cohorte de 142 pacientes, de los que en 71 (50%) se localizaba el tumor en la glotis; en su mayoría, cisplatino + 5-flourouracilo fue el fármaco base, aunque se utilizaron otros esquemas. En este estudio, el 65,5% podría desde un inicio ser candidatos a cirugía conservadora, dando una mediana de 5 (1-17) ciclos de quimioterapia, tras una mediana de seguimiento de 5 años, incluidos de T2 a T4. Se observó mejor supervivencia global para los tumores de la glotis; tuvo recurrencias el 83%; sin embargo, después del rescate se obtuvo un control del 97% para los tumores glóticos y el 88.7% para los no glóticos (no signifocativo, p = 0.09), y proponen que el mejor candidato para quimioterapia exclusiva es el paciente con carcinoma de la glotis, N0 y con bajo estatus de comorbilidades. El problema de este estudio es que no muestra el número de pacientes por T, lo cual no hace pensar que, por ser del mismo grupo, en su gran mayoría se trata de pacientes en T2. La validación del uso de la quimioterapia está en nuestros días lejos de ser un estándar de manejo para la conservación del órgano en laringe y determinar el subsitio donde demuestre su mayor utilidad, sobre todo ahora que el manejo de los tumores en etapas tempranas con láser y cirugía conservadora ha mostrado supervivencias del 89 al 100% para T1, del 83 al 100% para T2 y del 73 al 91% para estadio III, con toxicidad nula en comparación con la quimioterapia exclusiva. Este abordaje deberá basarse en protocolos institucionales con un grupo multidisciplinario, con seguimiento estrecho para rescate de recurrencias tempranas.
Salvamento posterior a recaída en la glotis
La recaída del carcinoma glótico frecuentemente ha sido asociado a la radioterapia exclusiva; recientemente, a los tratamientos concomitantes con quimiorradioterapia, y es aquí donde hay varios reportes sobre el manejo de estas recurrencias. Sin embargo, en la era de la conservación de órgano, también dichas recaídas pueden ocurrir en los tratamientos a base de láser transoral o cirugías conservadoras abiertas, de los cuales existen pocos reportes con series grandes de las que se pueda obtener una conclusión, y por último la laringectomía total.
Recurrencia tras radioterapia
El manejo de la racaída posterior a la radioterapia puede abarcar una amplia gama de opciones en el momento actual, como los manejos conservadores con cirugía láser transoral, y en un futuro próximo seguramente veremos reportes con abordajes con robot, una amplia gama de cirugías conservadoras, como cirugía frontolateral, laringectomía vertical, laringectomía vertical parcial, laringectomía parcial supracricoidea con cricohioidoepiglotopexia o cricohioidopexia.
Ganly et al61 han demostrado que los pacientes que requieren laringectomía total de salvamento tienen menores supervivencia global y SEE que los pacientes que requirieron laringectomía parcial de salvamento (supervivencia global, el 50 frente al 89%; p = 0.003; SEE, el 51 frente al 93%; p = 0.002). Esto mismo observaron Holsinger et al62; obtuvieron mayor mortalidad global entre los pacientes con laringectomía total: el 73.74% (54/73) frente al 59.4% (19/32) de los pacientes en tratamiento conservador (p = 0.011).
Piazza et al63 observaron en su estudio de cirugía de salvamento consistente en resección endoscópica con láser de CO2 en 22 pacientes, laringectomía parcial abierta en 15 y laringectomía total en 34, que la pT posterior a la cirugia fue pT1 en 12 pacientes, pT2 en 20, pT3 en 20 y pT4a en 19. La SEE, la supervivencia libre de enfermedad y la preservación laríngea fueron del 72, el 61 y el 40% respectivamente. Sin embargo, es de los pocos estudios que incluyen todas las T; en general los rescates con cirugía conservadora están destinados a los tumores T1, T2 y casos seleccionados T3.
Roedel et al64 manejaron a 53 pacientes —incluidos rT1 a rT4 con recurrencia tras radioterapia— con TLM; en 24 (42%) pacientes fue necesaria solo una cirugía y en 31 (58%), 2; sin embargo, de este último grupo, 20 (38%) pacientes terminaron en laringectomía total o paliación. Las tasas de control locorregional a 3 y 5 años para todos los pacientes fueron del 46.1 y el 38.8% respectivamente. La supervivencia global a 3 y 5 años fue del 67.5 y el 53.3%. La SEE a 3 y 5 años fue del 68.6% en cada una. No hubo diferencia estadísticamente significativa en el control locorregional ni en la supervivencia de los pacientes que se presentaron con una recurrencia temprana o avanzada. Las laringectomías parciales (laringectomía vertical, laringectomía frontolateral, laringectomía vertical parcial, supracricoideas con cricohioidopexia o cricohioidoepiglotopexia)65-67 son una excelente opción para el menejo de la recurrencia, pero pueden realizarse en un tercio de las recurrencias en la laringe y generalmente se reservan para tumores T1 y T2 y casos extremadamente seleccionados de T3; la conservación del órgano se logra en la mayoría de los casos (70-85%), y la supervivencia a 3 años va del 80 al 89%; sin embargo, a 5 años puede bajar hasta el 50%, debido principalmente a la recurrencia local o enfermedad metastásica66. La selección del procedimiento está exclusivamente relacionada con la experiencia del grupo con alguna de las técnicas o las preferencias del cirujano. Sin embago, parece que el grupo de mejor pronóstico en supervivencia es el de glotis, pues se ha demostrado que los tumores de la supraglotis tienen una disminución clara tras cirugía conservadora comparados con los de glotis67.
Es claro que por muchos años la laringectomía total había sido considerada el tratamiento de elección para pacientes con recurrencia posterior a radioterapia, incluso hoy para los grupos que no incluyen en su arsenal la cirugía conservadora o láser, continúa siendo de primera elección. Así también es claro que no todos los pacientes son candidatos a cirugía cosnservadora, y hasta nuestros días alrededor del 70% de los rescates continúan siendo con laringectomía total61,62.
Recurrencia posterior a resección con láser
La resección posterior a láser generalmente ocurre en pacientes con etapas clínicas tempranas, ya que pocos grupos se atreven a realizar tratamientos con láser en etapas avanzadas, así que generalmente en este grupo de pacientes guardan todas los opciones de tratamiento como si nunca hubieran sido tratados con anterioridad, lo anterior es cierto si se detectan también en etapas tempranas. Mortuaire et al29 mostraron en Francia una serie de 110 pacientes en etapas Tis a T2; las opciones de manejo de 22 pacientes con recurrencia local (17 T1a, 1 T1b y 4 T2) fueron: 9 con laringectomía total, 5 con laringectomía parcial, 4 con cordectomía láser, 2 con radioterapia y 2 sin tratamiento curativo. Roedel et al68, del grupo alemán de Goettingen, observaron que 44 pacientes (78.6%) se presentaron con recurrencia temprana local en estadios I/II y 12 (21.4%) tuvieron una recurrencia local o locorregional avanzada en estadios III/IV. El control locorregional a 3 y 5 años fue significativamente mayor en los pacientes tratados de una recurrencia temprana (el 67.6 frente al 27.5% y el 63.6 frente al 27.5% respectivamente; p = 0.02). Las tasas de laringectomía de salvamento para pacientes con recurrencias tempranas o avanzadas fueron del 9.1 y el 25% respectivamente. Las tasas de supervivencia global de los pacientes con recurrencia temprana y avanzada a 3 y 5 años fueron del 75.1 frente al 51.6% y el 61.6 frente al 25.8% respectivamente.
Recurrencia posterior a cirugía conservadora abierta
Las posibilidades de conservación de órgano en una recurrencia posterior a cirugía conservadora son muy bajas. Laccourreye et al69 han reportado una conservación de órgano tan solo del 6.6% de los pacientes con laringectomía supracricoidea previa, con un control local posterior a tratamiento con laringectomía total o radioterapia del 80%. Hoy otra posibilidad podría ser la quimiorradioterapia concomitante, pero esta posibilidad también se vislumbra poco probable, ya que el principal síntoma con que estos pacientes se presentan es la disnea, y casi siempre son candidatos a cirugía radical; recurrencias pequeñas podrían ser candidatas a tratamiento con láser, pero actualmente es casi anecdótico. Otra serie de China70 reporta salvamento con laringectomía parcial en 26/77 (34%) pacientes después de cirugía de salvamento; las tasas de supervivencia global a 3 y 5 años fueron del 59.1 y el 52.7% respectivamente, y ambas tasas de recurrencia a 3 y 5 años fueron del 30.7%. La mayoría de los pacientes fallecieron por falla en el sitio primario (48.4%). Luna-Ortiz et al71, en una serie de pacientes con laringectomía parcial vertical y reconstrucción con imbricación de la cuerda falsa, solo hallaron un paciente que se pudo llevar a laringectomía supracricoidea con CHEP.
Nuevas tecnologías en el tratamiento de carcinoma glótico
El uso de TORS en la cirugía de cabeza y cuello ha traído importantes ventajas en la magnificación tridimensional, incrementando los grados de libertad de sus brazos y, por supuesto, una articulación distal que semeja la mano humana en cuanto a sus movimientos. Lo anterior con el fin de optimizar el manejo oncológico con una reducción de la morbilidad relacionada al tratamiento. Su principal indicación en el momento actual para el menejo de los tumores de laringe se limita a la supraglotis, y el primer reporte fue el de McLeod et al72 en 2005, para una lesión quística de la epiglotis. En la glotis, Park et al73 reportaron 3 casos de resección de lesiones cordales, pero realizaron traqueostomía, lo cual es una desventaja cuando se compara con la cirugía conservadora abierta o la microlaringoscopia de suspensión y láser. La cirugía robótica permite llevar a cabo resecciones en bloque, a diferencia de los cortes por partes del tumor con el láser; sin embargo, hasta el momento no se ha demostrado que esto tenga ventajas o desventajas en ningun estudio, y quizá menos aún en la laringe, donde la resección microscópica de tumores tempranos permite la resección justa y se evita la ablación de tejido innecesaria74. Para los tumores avanzados es factible realizar resecciones en bloque mediante MLS y láser. En conclusión, actualmente TORS tiene una aplicación limitada en la glotis, debido principalmente a una deficiente exposición y no tener en el momento actual los instrumentos para llevar a cabo esta cirugía en la glotis.
La resección endoscópica con electrodos de microdisección (MEs)75, que consisten en una aguja de tungsteno ultrafino de 21 cm de largo angulado a 90° (derecho e izquierdo), 135° y 180°. El extremo proximal del mango es curvo y se inserta en un electrocauterio convencional. El generador electroquirúrgico se establece a una potencia de 5-20 W para resección del tejido blando o cartílago. El sangrado se trata con pinzamiento de los vasos con minifórceps y electrocoagulación. La exposición con la laringoscopia de suspensión convencional es parecida a la observada en las resecciones con láser de CO2. MEs tiene varias ventajas sobre el láser de CO2: un tiempo quirúrgico menor, mejor hemostasia, fácil utilización y menor costo y mantenimiento del equipo75.
Conclusiones
Actualmente el diagnóstico debe incluir el manejo de telescopios de 30°, 70° y 90°, así como MLS, con el fin de realizar un manejo conservador de la laringe. Los estudios de imagen siguen siendo una herramienta importante, sobre todo cuando se conjunta con el diagnóstico endoscópico/ clínico.
Los tratamientos para los tumores glóticos tempranos basados en cirugía, radioterapia o TLM obtienen una supervivencia similar y una ligera ventaja en la preservación de órgano a largo plazo cuando el tratamiento inicial es con TLM. La cirugía abierta tiene la desventaja de obtener una calidad de voz menor que con radioterapia o TLM, además de una mayor morbilidad. Se podría considerar para tumores T3N0M0 estas modalidades de tratamiento, en casos estrictamente seleccionados y con un seguimiento estrecho para detectar la recurrencia temprana.
Para los tumores avanzados, en la era de la conservación de órganos, tenemos como opción la quimiorradioterapia con una adecuada selección del paciente y siempre considerando la morbilidad durante y después del tratamiento, ya que si esto no es aplicable a un paciente, sabemos que no habrá diferencia en supervivencia si el tratamiento es con cirugía radical y radioterapia adyuvante. Cuando nos enfrentamos a la recurrencia, el manejo depende del tratamiento primario; así, los pacientes tratados con radioterapia pueden ser rescatados con cirugía abierta o TLM si esta es temprana; para los pacientes llevados a cirugía abierta, la radioterapia o la TLM deberá ser una opción, y en casos seleccionados, sería posible una nueva cirugía conservadora. Para los pacientes con TLM inicial se reservan todas las opciones de manejo al rescate como si fuera un tratamiento de novo.
La quimioterapia exclusiva es un tratamiento hasta el momento poco explorado. Se ha observado un alto porcentaje de respuesta, pero que se mantenga es el punto álgido de su uso, por lo que se requiere mayor número de casos.
Las nuevas tecnologías aparecen prometedoras. Sin embargo, en la glotis aún no está claro su papel como en el caso de TORS.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido el 1 de mayo de 2014;
aceptado el 1 de julio de 2014
* Autor para correspondencia:
Departmento de Cabeza y Cuello, Instituto Nacional de Cancerología, Ave.
San Fernando #22, Col. Sección XVI, México D.F. 14080,
teléfono y fax 55 56280400, ext. 424, celular 5517989455.
Correo electrónico:kuauhyama@yahoo.com.mx; kuauhyama@starmedia.com (K. Luna-Ortiz).