Las concentraciones plasmáticas elevadas de colesterol LDL (cLDL) son un factor de riesgo para la enfermedad cardiovascular. A pesar de las diversas recomendaciones internacionales sobre el manejo de la hipercolesterolemia, el porcentaje de pacientes con cLDL superior a sus objetivos terapéuticos según su riesgo cardiovascular global es alto, por lo que es necesario utilizar todas las estrategias terapéuticas disponibles. El consumo de alimentos enriquecidos con fitoesteroles (FER) y fitoestanoles (FEN) reduce los niveles de cLDL en torno a un 10%. El uso de FER/FEN se recomienda como parte integral de los cambios dietéticos dirigidos al control y reducción de los lípidos plasmáticos, sin embargo debe recordarse que estos alimentos mantienen su efecto de descenso adicional de los niveles de cLDL cuando se administran junto a tratamientos farmacológicos hipolipidemiantes. En esta revisión, se resumen las últimas evidencias clínicas del consumo de alimentos enriquecidos con FER/FEN con relación a la modificación de las concentraciones de cLDL cuando se administran solos o asociados a fármacos hipolipidemiantes, así como las últimas recomendaciones internacionales sobre su papel en el manejo clínico de la hipercolesterolemia.
Raised low-density lipoprotein cholesterol (LDLc) plasma concentration is a major risk factor for atherosclerotic cardiovascular disease. Despite international recommendations on hypercholesterolemia management the percentage of individuals with LDLc plasma concentration above goals according to their global cardiovascular risk remains high, and additional therapeutic strategies should be evaluated. Consumption of functional foods enriched with phytosterols (PSRs) and phytostanols (PSNs) reduces LDLc concentrations by 10% as average. Although recommended as part of any lipid-lowering diet in the first intervention step, PSRs/PSNs maintain their LDL reduction capacity when administered with lipid-lowering drugs; therefore, they can be also considered in some cases as an adjuvant to drug therapy. In this document we summarise the latest evidence regarding the LDL reducing effects of PSR/PSN supplementation, alone or as an add-on to hipolipemic drugs and the international recommendations of its clinical use.
Las enfermedades cardiovasculares (ECV) son responsables de la mayoría de muertes en los países desarrollados, así como en aquellos en vías de desarrollo. La Organización Mundial de la Salud estima que en el año 2030, hasta 23,6 millones de personas, un 36% más con respecto al 2008, morirán como consecuencia de ECV1. Estos datos están estrechamente ligados al aumento de la prevalencia de los factores de riesgo cardiovascular como la obesidad, el síndrome metabólico (SM) y la diabetes, agentes causales de la arteriosclerosis prematura y la ECV2. Estudios recientes sobre el riesgo cardiovascular a lo largo de toda la vida muestran que los individuos con un óptimo perfil de riesgo, con buen control de la presión arterial y del colesterol, no fumadores y no diabéticos tienen menos eventos cardiovasculares en comparación con aquellos con 2 o más de los factores mencionados3. Además, de los 9 factores de riesgo cardiovascular definidos en el estudio INTERHEART, a la dislipidemia le correspondió la principal contribución al riesgo poblacional para el desarrollo de infarto agudo de miocardio4. De hecho, está ampliamente estudiado que la reducción en las concentraciones plasmáticas de colesterol LDL (cLDL), mediante cambios sobre el estilo de vida o agentes farmacológicos, repercute de forma significativa en la disminución de la morbimortalidad cardiovascular5,6.
El hígado y el intestino son los principales reguladores del metabolismo del colesterol. La vía de la absorción del colesterol presenta oportunidades clínicas para la suplementación dietética con agentes que atenúen dicha absorción, entre los que destacan los fitoesteroles/fitoestanoles (FER/FEN) como importantes7.
El objetivo de esta revisión es ofrecer un punto de vista global sobre el potencial terapéutico de los FER en el manejo de la dislipidemia, y definir unas recomendaciones basadas en la evidencia científica que puedan ser utilizadas como guías clínicas para aquellos profesionales que trabajan en la prevención de la ECV.
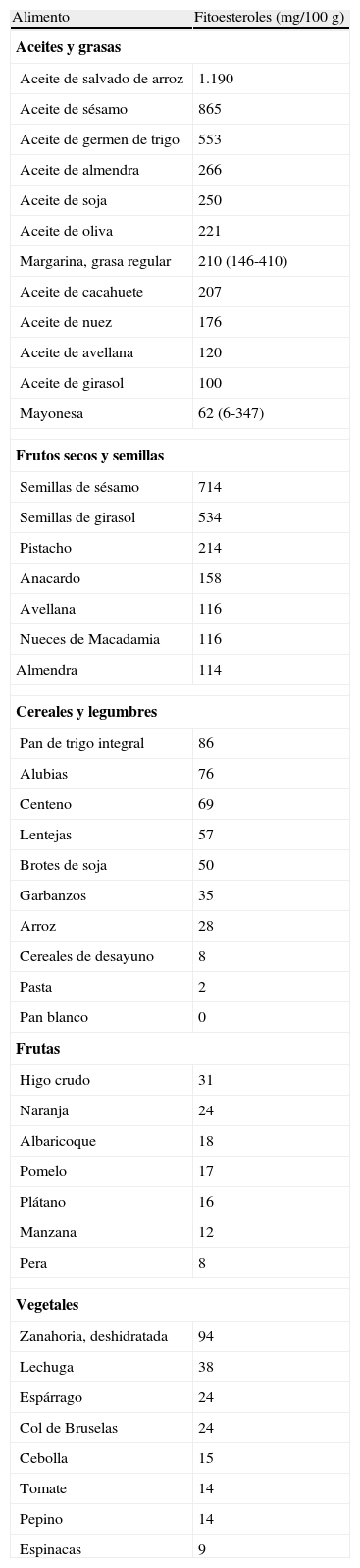
FitoesterolesProcedenciaLos FER son compuestos no nutritivos con una estructura análoga a la del colesterol y con la misma función en los vegetales que tiene el colesterol en los animales. Hay más de 250 FER diferentes, incluyendo los FEN, que son la forma saturada de los esteroles. Las fuentes alimenticias más comunes de los FER son los alimentos vegetales, ricos en estigmasterol, b-sitosterol y campesterol8. Los FEN se encuentran en concentraciones más bajas que los esteroles y se producen mediante la hidrogenación de estos. Existen grandes diferencias en la cantidad y tipo de consumo de alimentos vegetales en todo el mundo. La ingesta de FER varía entre 160mg/día en Gran Bretaña y 375mg/día en Japón, alcanzando hasta 600mg/día en poblaciones que siguen dietas vegetarianas9. La ingesta de FEN es de aproximadamente 50mg/día10. La tabla 1 resume las principales fuentes de FER. Destacan con un porcentaje mayor en FER los alimentos de origen vegetal como los aceites, los frutos secos, las semillas, las legumbres y los cereales enteros. Los moluscos (ostra, 264mg/100g), los crustáceos (langosta, 137mg/100g) y la yema de huevo (95mg/100g) son las fuentes no vegetales más importantes de FER11.
Contenido medio de esteroles y estanoles en algunos alimentos vegetales (mg/100g)
| Alimento | Fitoesteroles (mg/100 g) |
| Aceites y grasas | |
| Aceite de salvado de arroz | 1.190 |
| Aceite de sésamo | 865 |
| Aceite de germen de trigo | 553 |
| Aceite de almendra | 266 |
| Aceite de soja | 250 |
| Aceite de oliva | 221 |
| Margarina, grasa regular | 210 (146-410) |
| Aceite de cacahuete | 207 |
| Aceite de nuez | 176 |
| Aceite de avellana | 120 |
| Aceite de girasol | 100 |
| Mayonesa | 62 (6-347) |
| Frutos secos y semillas | |
| Semillas de sésamo | 714 |
| Semillas de girasol | 534 |
| Pistacho | 214 |
| Anacardo | 158 |
| Avellana | 116 |
| Nueces de Macadamia | 116 |
| Almendra | 114 |
| Cereales y legumbres | |
| Pan de trigo integral | 86 |
| Alubias | 76 |
| Centeno | 69 |
| Lentejas | 57 |
| Brotes de soja | 50 |
| Garbanzos | 35 |
| Arroz | 28 |
| Cereales de desayuno | 8 |
| Pasta | 2 |
| Pan blanco | 0 |
| Frutas | |
| Higo crudo | 31 |
| Naranja | 24 |
| Albaricoque | 18 |
| Pomelo | 17 |
| Plátano | 16 |
| Manzana | 12 |
| Pera | 8 |
| Vegetales | |
| Zanahoria, deshidratada | 94 |
| Lechuga | 38 |
| Espárrago | 24 |
| Col de Bruselas | 24 |
| Cebolla | 15 |
| Tomate | 14 |
| Pepino | 14 |
| Espinacas | 9 |
Contenido total en fitoesteroles en 100g de alimento. Disponible en: www.usda.gov.
La producción de alimentos enriquecidos en FER se ha incrementado de forma destacable en los últimos años debido al interés que suscita la capacidad que tienen estos compuestos para reducir las concentraciones de cLDL. La primera descripción de la utilización de alimentos enriquecidos con FER es del año 1977. Lees et al., mediante una preparación comercial derivada del aceite de soja enriquecido con FER (3g/día), observaron una disminución significativa del cLDL12. En 1986, Heinemann et al. comunicaron la primera evidencia de la utilización de estanoles vegetales para reducir el colesterol en plasma13. Estos investigadores demostraron que un aceite de girasol suplementado con ésteres de sitoestanol a una dosis de 1,5g/día reducía el cLDL en un 15% en adultos hipercolesterolémicos. Actualmente los productos enriquecidos con esteroles o estanoles utilizan las formas esterificadas debido al aumento de su solubilidad, hecho que permite su incorporación a alimentos tales como yogures, margarinas, mayonesa, cremas de untar, leche y aderezos para ensaladas.
Mecanismo de acciónEl mecanismo de acción mediante el cual los FER/FEN disminuyen las concentraciones de cLDL se conoce de forma parcial. Se ha demostrado que los FER reducen la absorción del colesterol, tanto el que proviene de la dieta como el biliar. El mecanismo implicado parece ser el desplazamiento del colesterol de las micelas a nivel intestinal, hecho que altera la solubilidad intestinal de colesterol y disminuye la hidrólisis de los ésteres de colesterol en el intestino delgado. Por otra parte, un menor número de moléculas de colesterol serán ofrecidas al enterocito para su absorción14. Se ha descrito que la absorción de colesterol se regula mediante el balance entre el flujo de entrada y el flujo de salida de colesterol a nivel del enterocito. La absorción de colesterol por las células de la mucosa intestinal está mediada por la proteína Niemann-Pick C1 like 1 (NPC1L1), que puede ser parcialmente inhibida por los FER/FEN15. El flujo de salida de colesterol del enterocito está mediado por las proteínas ABCG5 y ABCG8, estimuladas por la presencia de esteroles y estanoles en el enterocito16. Además, los estudios in vitro muestran que la esterificación mediada por la proteína de ACAT, necesaria para incorporar el colesterol a los quilomicrones y completar su absorción, es menos eficiente para los FER, lo que provoca que sean excretados de nuevo a la luz intestinal17.
Cambios en el perfil lipídico inducidos por los fitoesterolesDisminución de colesterol LDLEstudios epidemiológicos realizados en el Reino Unido (n=22.256), Suecia (n=77.652) y China (n=3.940) mostraron que la ingesta con FER está inversamente relacionada con las concentraciones de colesterol total y cLDL18–20. Diferentes ensayos controlados y aleatorizados han establecido de forma sólida que las concentraciones plasmáticas de cLDL se reducen en aproximadamente un 10% después del consumo de alimentos enriquecidos con FER/FEN de forma dependiente de la dosis, alcanzando una meseta en aproximadamente 1,5-2 g por día7. Un metaanálisis reciente confirmó que el consumo de alimentos enriquecidos con esteroles o estanoles vegetales (2g/día) reduce las concentraciones de cLDL en unas cantidades similares (8,2 a 9,3%)21.
Efectos adicionales sobre el perfil lipídico plasmáticoLos pacientes con dislipidemias mixtas (aumento del cLDL, triglicéridos altos y niveles de cHDL bajos) podrían beneficiarse de una combinación de fármacos y suplementos con acción en el perfil lipídico global. Los datos disponibles indican que después de la suplementación con FER a dosis de 1,5 a 2g/día se reducen los niveles de triglicéridos entre un 6 y un 20% sin un efecto significativo sobre el cHDL22–24. En un metaanálisis reciente se observó una reducción moderada de los triglicéridos plasmáticos del 6 y del 4% en aquellos individuos con un consumo de 1,6 a 2,5g/día de esteroles o de 2g/día de estanoles, respectivamente24,25. En sujetos con SM e hipertrigliceridemia moderada, el consumo de estanoles vegetales redujo la producción hepática de partículas VLDL de gran y mediano tamaño22. Otros estudios documentan una reducción en las partículas de LDL pequeñas y densas en pacientes con diabetes tipo 2 (DM2) o SM después del consumo de FER/FEN23,26. Con relación a los niveles de lpa, un unico estudio enfocado en valorar los cambios en las concentraciones lpa antes y despues de la suplementación con fitoesteroles, sugiere que los fitoesteroles no influyen en las concentraciones de esta partícula27.
Efecto de los fitoesteroles asociados al tratamiento farmacológico hipolipidemianteEstatinasLas estatinas, inhibidores de la enzima 3-hidroxi-3-metil-glutaril CoA reductasa (HMG-CoA reductasa), son los medicamentos hipolipidemiantes más eficaces para la prevención de la ECV. El bloqueo de la enzima limitante de la síntesis del colesterol, HMG CoA reductasa, conduce a un incremento secundario en el número de receptores de LDL y a un aumento del aclaramiento plasmático de las partículas de LDL. Para equilibrar esta inhibición en la síntesis de colesterol, hay una elevación concomitante en su absorción intestinal, por lo que se ha sugerido que los FER/FEN pueden jugar un papel sinérgico con las estatinas. La sólida evidencia del efecto adicional de los FER sobre las concentraciones de cLDL en pacientes tratados con estatinas se deriva de los diferentes estudios clínicos aleatorizados que se muestran en la tabla 2. Las reducciones en las concentraciones de cLDL variaron entre el 4 y el 17% después de entre 4 y 26 semanas con unas dosis de 1,5 a 3g/día28–43. Los esteroles vegetales produjeron una reducción adicional del cLDL entre el 8 y el 17%. Mientras que los estanoles indujeron una disminución significativa del cLDL entre el 6 y el 16%. De acuerdo con esto, los datos de un metaanálisis de 8 ensayos controlados y aleatorizados que incluyeron a más de 300 pacientes hipercolesterolémicos tratados con estatinas concluyeron que la adición de FER/FEN en dosis de 1,7 a 6g/día redujo de forma significativa el colesterol total (14mg/dl) y el cLDL (13mg/dl) en comparación con el uso de estatinas sin suplemento44. La reducción en el cLDL observada en estos estudios es superior a la del 6% obtenido al doblar la dosis de estatina34,40,41,45. Por tanto, la adición de FER a estatinas en aquellos individuos que no llegan a objetivos terapéuticos sería una estrategia eficaz para mejorar sus concentraciones de colesterol.
EzetimibaEl mecanismo de acción mediante el cual la ezetimiba reduce el colesterol plasmático es la inhibición de su absorción intestinal. La diana molecular de la ezetimiba es la proteína NPC1L146, que actúa como un receptor y transportador transmembrana del colesterol, por lo que su bloqueo impediría su transporte desde la membrana plasmática al retículo endoplasmático46. Los FER podrían considerarse competidores de la ezetimiba en tanto que ambos actúan disminuyendo la absorción de colesterol, aunque los mecanismos son distintos. Dos importantes estudios han abordado esta cuestión47,48. Jakulj et al. realizaron un estudio aleatorizado a doble ciego incluyendo 40 sujetos con hipercolesterolemia leve asignados a tratamiento con 10mg/día de ezetimiba y 25g/día de margarina con FER (2g/día) o con ezetimiba y 25g/día de una margarina sin FER. Los resultados mostraron que la reducción de cLDL de la combinación de FER y ezetimiba (25%) no difería significativamente de la obtenida con monoterapia con ezetimiba (22%)47. Sin embargo, Lin et al. realizaron un estudio controlado con placebo, doble ciego y triple cruzado en el que 21 sujetos con hipercolesterolemia leve recibieron una dieta controlada con FER más (A) un placebo de ezetimiba y un placebo en FER (B) 10mg/día de ezetimiba y un placebo de FER o (C) 10mg /día ezetimiba y 2,5g/día de FER durante 3 semanas cada uno. Los autores observaron que la adición de FER a ezetimiba mejoraba de forma significativa los efectos de la ezetimiba sola, incluyendo una disminución significativa en la absorción intestinal, una mayor excreción fecal de colesterol y una disminución significativa en el cLDL. Los autores argumentaron que el distinto mecanismo de acción de los FER, sustituyendo el colesterol de las micelas intestinales en lugar de bloquear directamente el transportador NPC1L1, explicaría la acción complementaria de ambos compuestos48.
FibratosEl mecanismo farmacológico de los fibratos está mediado por la activación de PPARa, que activa genes lipolíticos provocando un descenso de triglicéridos y un aumento de cHDL. Varios estudios en animales y humanos han demostrado un efecto beneficioso de la terapia conjunta con fibratos y FER sobre el metabolismo del cLDL49–51. Este hecho es de suma relevancia en aquellos pacientes con dislipidemias mixtas moderadas, debido a que el efecto de los FER complementa el perfil terapéutico de los fibratos.
Otros fármacos hipolipidemiantesLas resinas secuestradoras de ácidos biliares promueven la precipitación de los ácidos biliares, hecho que impide su reabsorción en el íleon distal, aboliendo su recirculación enterohepática. No hay suficientes datos para establecer si los FER tienen un efecto adicional sobre la inhibición de la absorción de colesterol cuando se añaden a resinas.
Los ácidos grasos n-3 a dosis altas reducen las concentraciones de los triglicéridos circulantes. La combinación de estos con FER da como resultado un efecto beneficioso sobre el perfil lipídico global. Hay estudios que muestran una disminución significativa entre el 10 y el 15% del cLDL en terapia combinada con FER y omega 352,53. Micallef et al. observaron que sujetos hiperlipidémicos que consumían la combinación de 2g/día de esteroles vegetales y 1,4g/día de ácidos grasos polinsaturados omega 3 tenían una reducción del 22,6% en el riesgo cardiovascular global calculado, en comparación con la disminución del riesgo de aquellos individuos que habían consumido los esteroles vegetales (15,1%) o los omega 3 (15,3%) en monoterapia54.
SeguridadLa ingesta de FER necesaria para disminuir las concentraciones de cLDL oscila entre 1 y 3g/día, muy por encima de la ingesta habitual de 200-400mg/día. Esto ha suscitado incógnitas sobre los posibles efectos nocivos del alto consumo de FER de forma prolongada.
Los principales focos de preocupación respecto al incremento del consumo de FER incluyen los posibles efectos negativos sobre la absorción de vitaminas liposolubles, el riesgo de cáncer y el posible aumento de la ECV debido al incremento en las concentraciones de esteroles circulantes. Aunque la metodología de los estudios poslanzamiento no permite responder a la pregunta de si los alimentos con esteroles o estanoles vegetales añadidos causan efectos negativos para la salud a largo plazo, no se han observado efectos nocivos55,56. Una observación repetida en algunos estudios de alimentos enriquecidos con esteroles vegetales es la modesta supresión de las concentraciones de carotenoides en plasma (10%), especialmente beta-caroteno, alfa-caroteno y licopeno57,58, debido a la inhibición parcial de su absorción intestinal. El aumento en el consumo de frutas y verduras puede compensar esta disminución en la absorción de carotenoides58. Así mismo, los estudios realizados hasta la fecha no han mostrado ningún efecto clínico desfavorable, en particular en trastornos oncológicos o cardiovasculares59,60.
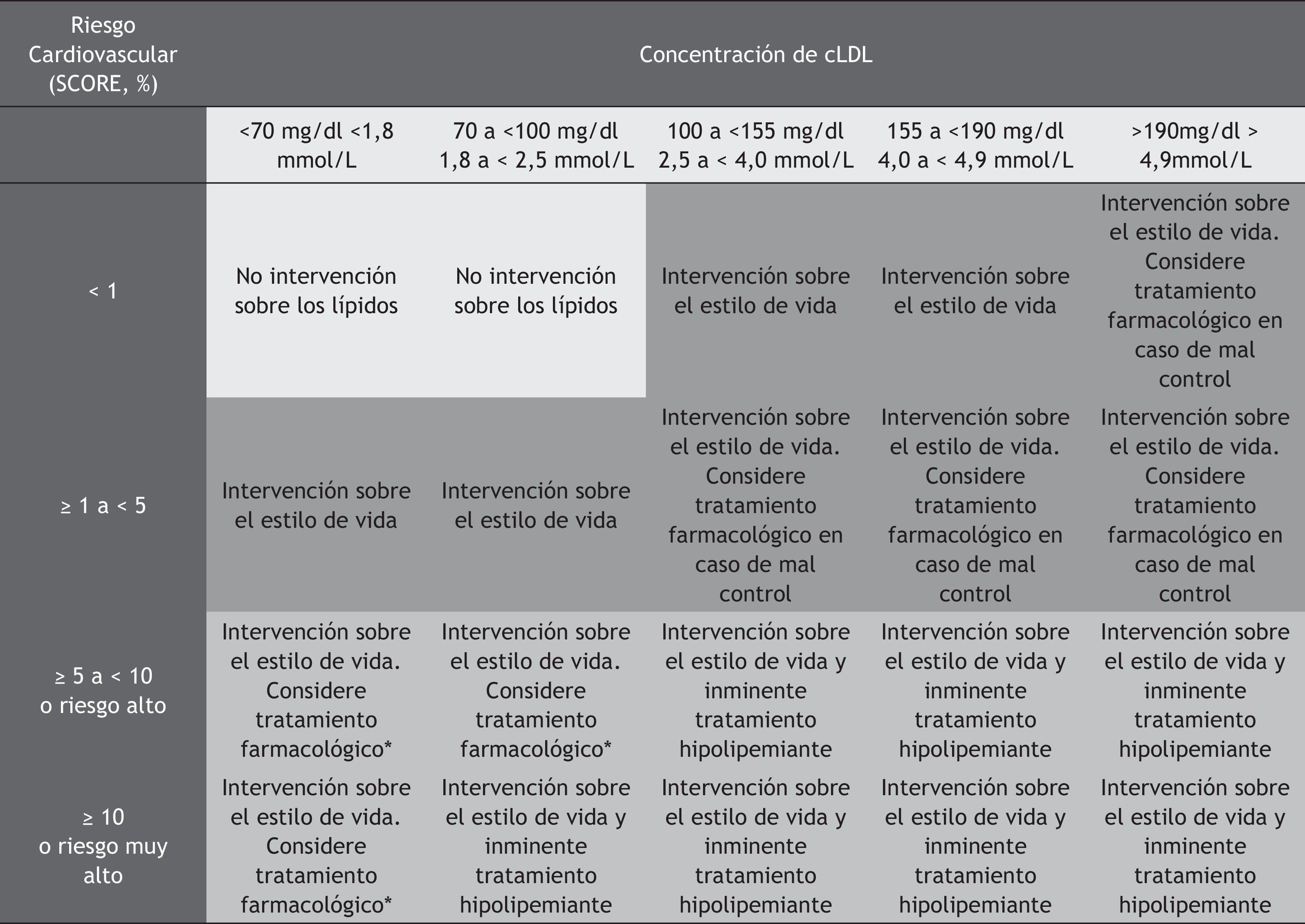
Recomendaciones clínicasLa reducción de las concentraciones de cLDL es un objetivo principal de las políticas de salud pública para disminuir la ECV. La modificación de la dieta y la adopción de un estilo de vida saludable es el primer paso hacia la mejora de los niveles de lípidos séricos. Distintas sociedades científicas como la Sociedad Europea de Arteriosclerosis (EAS) y la Sociedad Europea de Cardiología (ESC) recomiendan la inclusión de 1,5 a 2g/día de FER como parte de las dietas dirigidas a reducir el colesterol, junto con otras modificaciones tales como la disminución de grasas saturadas (< 7% de las calorías diarias), la disminución del consumo de grasas trans (< 2%) y la disminución del colesterol de la dieta (< 200mg/día)61. Los alimentos con esteroles o estanoles vegetales añadidos son útiles en las personas con niveles altos de colesterol y están especialmente indicados en aquellas con riesgo cardiovascular global intermedio o bajo y cifras de colesterol elevadas pero que no precisen acciones farmacológicas (tabla 3). Además, aquellos pacientes que reciben tratamiento farmacológico y que no alcanzan los objetivos terapéuticos de cLDL, o con intolerancia a estatinas, también se pueden beneficiar del efecto aditivo hipocolesterolemiante de los FER. En la tabla 4, obtenida de las guías clínicas sobre el manejo de la dislipidemia de la EAS/ESC, se muestran las recomendaciones de intervención sobre los niveles de cLDL acordes al riesgo cardiovascular global del paciente. La adición de esteroles/estanoles vegetales, como medida de intervención sobre el estilo de vida, es útil en todos los escenarios de riesgo cardiovascular como estrategia única o conjunta para disminuir las concentraciones de cLDL.
Evidencias y recomendaciones clínicas sobre el uso de fitoesteroles
| • El consumo diario de alimentos enriquecidos con esteroles o estanoles vegetales en cantidades de 1,5 a 2 g/día es eficaz en la reducción de las concentraciones plasmáticas de cLDL en torno al 10%, y por lo tanto puede ser considerado como un complemento de los cambios del estilo de vida en los sujetos con riesgo cardiovascular• Los esteroles y estanoles vegetales se pueden combinar eficazmente con las estatinas debido a que complementan el efecto hipolipidemiante de estas. Datos limitados sugieren que los esteroles/estanoles pueden también disminuir los niveles de cLDL en combinación con un fibrato o ezetimiba. La combinación terapéutica con fármacos y FER debe considerarse como una estrategia para el logro de los objetivos de cLDL y disminución del riesgo cardiovascular global• Fomentar el consumo de esteroles y estanoles vegetales puede considerarse como un complemento del cambio en el estilo de vida y podría ser un enfoque dietético importante para reducir, además de las concentraciones de cLDL, los triglicéridos en plasma, especialmente cuando los niveles de triglicéridos son altos. Esta observación inicial requiere más estudios en poblaciones apropiadas con triglicéridos elevados |
Recomendaciones sobre el uso clínico de esteroles/estanoles vegetales según la situación de riesgo cardiovascular global y nivel de LDL acorde con las guías clínicas para el manejo de la dislipemia de la EAS/ESC
La adición de alimentos funcionales enriquecidos con esteroles/estanoles vegetales, tienen un papel como componente de la intervención sobre el estilo de vida, en los individuos con un riesgo cardiovascular global bajo o intermedio que no son candidatos a recibir tratamiento farmacológico (color azul). De la misma forma, los alimentos enriquecidos con esteroles/estanoles vegetales se pueden considerar en el contexto de la intervención terapéutica en pacientes con riesgo cardiovascular alto o muy alto (color gris). Adaptado de Gylling et al. (2014)7.
* En pacientes con enfermedad cardiovascular previa (enfermedad arterial coronaria, accidente cerebrovascular o enfermedad arterial perférica) la terapia con fármacos hipolipemiantes debe considerarse independientemente de los niveles de cLDL.
Teniendo en cuenta la creciente importancia de las estrategias de prevención temprana de la hipercolesterolemia y sus efectos sobre la salud cardiovascular, existe la posibilidad de fomentar el consumo de alimentos enriquecidos con esteroles o estanoles vegetales en adultos y niños (> 6 años) con hipercolesterolemia familiar, como complemento del estilo de vida saludable y tratamiento farmacológico7. De hecho, en estudios clínicos llevados a cabo en niños y adolescentes de 4 a 15 años de edad, el consumo de alimentos suplementados con FER se relacionó con una reducción del 5 al 15% en niños normolipémicos y del 9 al 19% en niños con hipercolesterolemia familiar62–64. Como muestra la tabla 5 se necesitan más estudios para abordar cuestiones no resueltas. Un aspecto clave es la evaluación de los efectos de los alimentos enriquecidos con FER sobre la dislipidemia de los pacientes con SM. Se requieren más estudios para evaluar la variabilidad interindividual y sus bases genéticas, para poder identificar a aquellos sujetos que son grandes respondedores y los poco respondedores, así como a los hiperabsorbedores de los normo- o hipoabsorbedores de esteroles vegetales. Otro aspecto importante es el efecto que pueda tener el consumo de FER sobre los marcadores de arteriosclerosis prematura, como sería el caso de la acción sobre la función endotelial, la inflamación y el estrés oxidativo. Así mismo se carece de estudios a largo plazo con variables cardiovasculares finales aunque, dada la relevancia de los niveles de cLDL en el desarrollo de la aterosclerosis, al igual que se considera en las recientes guias de consenso de las Joint British Societies65, su reducción mediante el enriquecimiento de la dieta en esteroles vegetales debe ser un instrumento útil en prevención cardiovascular.
Cuestiones no resueltas
| • ¿Existe variabilidad interindividual en la eficacia de descenso del colesterol de los esteroles o estanoles vegetales? ¿Es posible identificar los hiper- de los hiporrespondedores?, y si es así, ¿los poco respondedores se podrían beneficiar de ingestas más elevadas en esteroles y estanoles vegetales?• ¿Los esteroles y estanoles vegetales afectan a otras lipoproteínas además de las partículas LDL, como el caso de los remanentes de las partículas ricas en triglicéridos o las subfracciones de HDL o LDL o la lipoproteína (a)?• ¿Cómo afectan los esteroles y estanoles vegetales al metabolismo de las lipoproteínas en poblaciones específicas de riesgo cardiovascular con un perfil lipoproteico aterógeno como los diabéticos o pacientes con síndrome metabólico?• ¿Cómo afectan los esteroles y estanoles vegetales a la homeostasis lipídica celular?• ¿Cómo afectan los esteroles y estanoles vegetales a las células que participan en el proceso de la arteriosclerosis, como las células endoteliales, los monocitos y macrófagos en condiciones de inactivación o activación?• ¿Tienen los esteroles y estanoles vegetales un efecto significativo sobre los marcadores de arteriosclerosis, como factores de coagulación, estrés oxidativo, agregación plaquetaria o inflamación?• ¿El incremento del consumo de esteroles y estanoles reduce los eventos cardiovasculares esperados por su acción hipocolesterolemiante? |
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesDanone ha financiado las reuniones de trabajo y no ha intervenido en el contenido científico del manuscrito. Todos los autores han revisado y leído la versión final del documento.
Adaptación del documento del grupo de expertos de la Sociedad Europea de Arteriosclerosis.