Las estatinas están contraindicadas en pacientes con miopatías. Hasta hace unos años, la alternativa en pacientes con hipercolesterolemia familiar que tenían distrofias musculares y no conseguían niveles adecuados de colesterol era la lipoaféresis. Cuando surgieron los inhibidores de PCSK9, se consiguió suspender la lipoaféresis en algunos de estos pacientes y mantenerlos con concentraciones plasmáticas de colesterol adecuadas.
Presentamos el caso de un varón, diagnosticado en la infancia de distrofia muscular congénita. A los 27 años se remitió a la unidad de lípidos por hipercolesterolemia, donde tras estudio genético se confirmó una hipercolesterolemia familiar heterocigota. A pesar del tratamiento con dieta y ezetimiba continuó con cifras elevadas de cLDL por lo que se incluyó en programa de lipoaféresis. Con esto se alcanzaron niveles de cLDL de 70mg/dl. Al disponer de los iPCSK9, se suspendió la lipoaféresis y se inició tratamiento con alirocumab 150mg quincenal, con buena respuesta y manteniendo valores de cLDL en torno a 75mg/dl.
Statins are contraindicated in patients with myopathies. Until a few years ago, in those patients with Familial Hypercholesterolemia who also presented muscular dystrophies and didńt reach adequate cholesterol plasmatic levels, the next therapeutic ladder was lipoapheresis. When iPCSK9 first appeared, lipoapheresis could be suspended in some of these patients, sustaining nevertheless proper levels of cholesterol.
We present the case of a 27 year-old male, diagnosed with Congenital Muscular Dystrophy in the early childhood. He was referred to the Unit of Lipidology presenting hypercholesterolemia which, after genetic test, was assessed as Heterozygous Familial Hypercholesterolemia. Despite of treatment with diet and ezetimibe, cLDL blood levels abide high, being consequently included in lipoapheresis programme, therewith obtained levels of cLDL of 70mg/dl. In providing iPCSK9, lipoapheresis was withdrawn and treatment with alirocumab 150mg fortnightly introduced, unveiling a positive response, and sustaining cLDL levels around 75mg/dl.
La hipercolesterolemia familiar (HF) es la enfermedad genética autosómica dominante más frecuente. Es causada por la mutación de algunos de los genes que participan en el catabolismo del colesterol unido a las lipoproteínas de baja densidad (cLDL), siendo el más frecuente el que codifica para el receptor de LDL. La HF se caracteriza por niveles elevados de cLDL y una propensión a la enfermedad cardiovascular arterioesclerótica temprana.
Caso clínicoPresentamos el caso de un varón de 27 años, diagnosticado en la infancia mediante estudio genético de una distrofia muscular tipo miopatía centronuclear (herencia recesiva ligada al cromosoma X) con imposibilidad para la toma de estatinas. Debutó a los 7 meses con hipotonía y debilidad muscular esquelética. Ingresado en varias ocasiones por insuficiencia respiratoria secundaria a la debilidad muscular respiratoria que se produce. En la actualidad es parcialmente dependiente para las actividades básicas de la vida diaria y deambula sin ayuda.
Remitido a la Unidad de Lípidos del Hospital San Pedro, Logroño, La Rioja, España, por presentar en noviembre de 2010 un colesterol total (CT) de 286mg/dl y cLDL de 229mg/dl. Tanto su madre como una de sus hermanas presentaban unos niveles de cLDL mayores de 250mg/dl, a pesar de recibir un tratamiento farmacológico.
El paciente no tenía alergias conocidas, era fumador de 5 cigarrillos/día y bebía alguna cerveza de manera ocasional. Presentaba una distrofia muscular congénita, tipo miopatía centronuclear diagnosticada por biopsia muscular a los 10 años. Exploración física: índice de masa corporal: 23,8kg/m2 y tensión arterial: 138/91mmHg. No había presencia de arco corneal, xantomas ni xantelasmas. Tanto la auscultación cardiaca y pulmonar, así como la exploración abdominal eran normales.
Una nueva analítica confirmó la hipercolesterolemia: CT: 304mg/dl; cLDL: 235mg/dl; triglicéridos: 115mg/dl; cHDL: 46mg/dl; apolipoproteína B (apoB): 153mg/dl; apolipoproteína A1: 146mg/dl y lipoproteína (a): 12mg/dl. El ECG mostró una taquicardia sinusal a 108lpm, sin otras alteraciones. Las radiografías simples de tórax y abdomen no mostraron alteraciones relevantes.
Se comenzó tratamiento con dieta hipolipemiante y ezetimiba 10mg/día. Al no alcanzar los niveles objetivos del cLDL tras este tratamiento, se solicitó tanto al paciente como a sus familiares de primer grado un estudio genético, identificándose tanto en él como en su madre y en una de sus hermanas una mutación patogénica en heterocigosis del gen que codifica el receptor de LDL (M025+M080), por lo que se le diagnosticó de una hipercolesterolemia familiar heterocigota (HFhe).
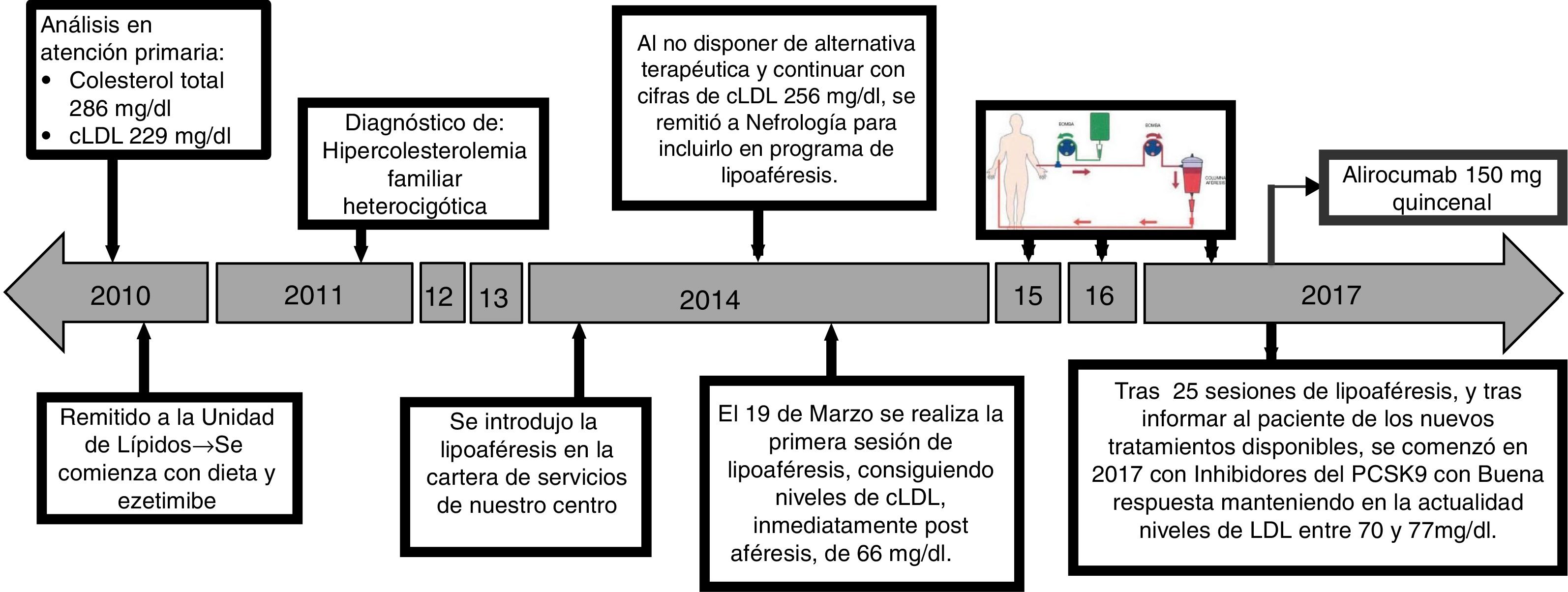
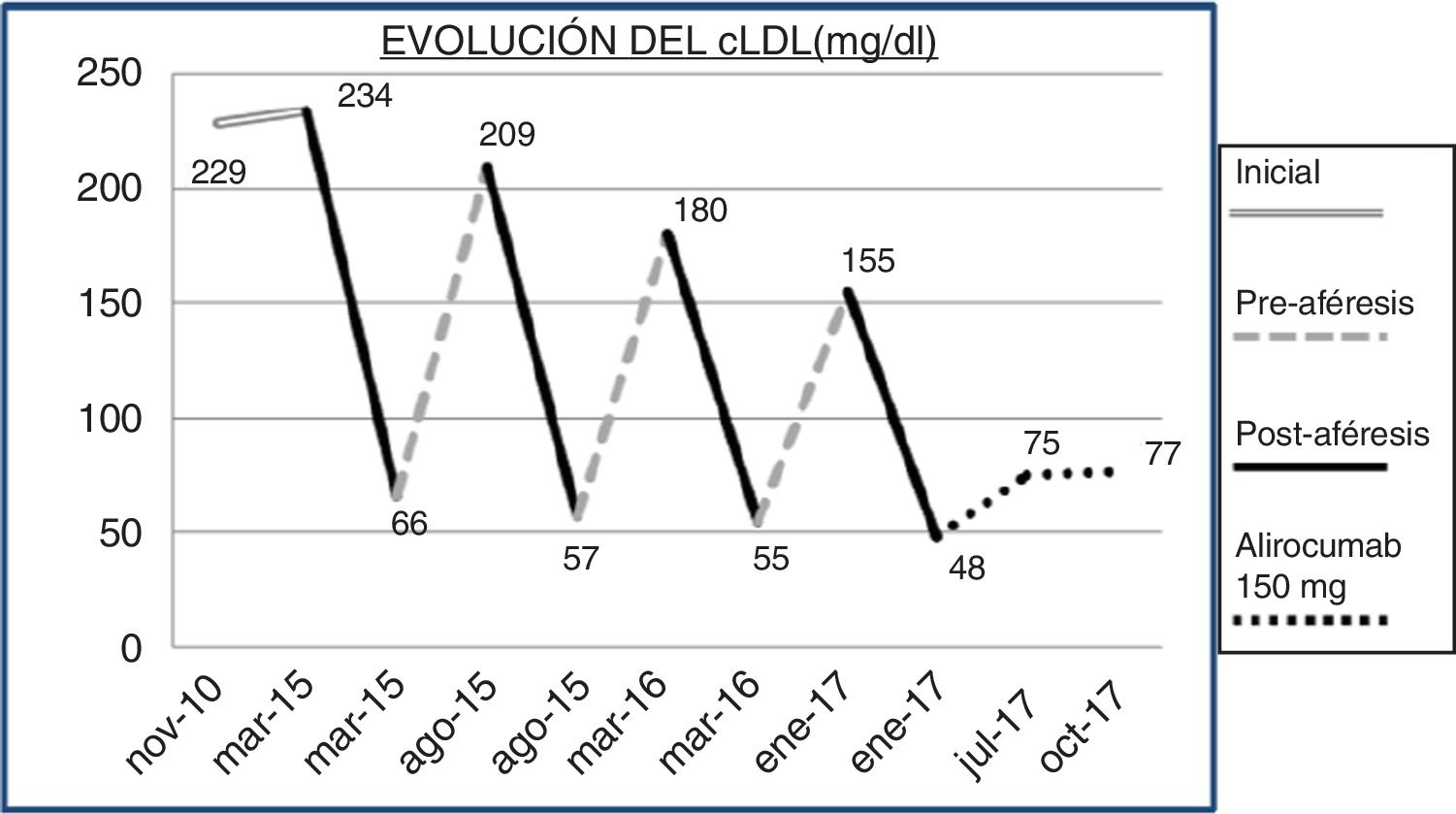
En la figura 1 se puede ver la evolución cronológica de los diferentes tratamientos que llevó el paciente. En 2014 se introdujo la lipoaféresis en la cartera de servicios de nuestro centro, por lo que al continuar con cifras de cLDL 256mg/dl y al no disponer de alternativa terapéutica, se remitió a nefrología. Inmediatamente después de la primera sesión de aféresis, se redujo el cLDL a 66mg/dl. Tras 25 sesiones de lipoaféresis se informó al paciente de la disponibilidad en nuestro centro de los inhibidores de PCSK9 (iPCSK9). En el primer semestre de 2017 se inició tratamiento con 150mg de alirocumab, quincenalmente, por vía subcutánea, con lo que se mantuvo una concentración plasmática de cLDL entre 70 y 77mg/dl. Las variaciones de cLDL con los diferentes tratamientos se recogen en la figura 2. No se detectó ninguna reacción adversa secundaria al tratamiento con iPCSK9. Tampoco hubo un empeoramiento de la distrofia muscular del paciente en cuanto a la aparición de sintomatología muscular, como mialgias o debilidad, ni tampoco variaciones analíticas como el aumento de la creatina quinasa (CK).
DiscusiónLos pacientes con HFhe tienen niveles de cLDL elevados desde el nacimiento, con el consiguiente riesgo prematuro de enfermedad coronaria. El colesterol se deposita en las arterias acelerando la formación de las placas de ateroma. Se estima que la prevalencia de la HFhe es de uno de cada 300 individuos en Europa y de 200 a 250 en EE. UU.1.
El diagnóstico de la HFhe se realiza mediante pruebas genéticas o en base a criterios clínicos. Una mutación en los genes del receptor de LDL, de la apoB o de la PCSK9 confirma este diagnóstico. Cuando las pruebas genéticas no están disponibles se utilizan diversos sistemas de puntuación para el diagnóstico clínico, basados en los niveles de cLDL, presencia de xantomas o arco corneal en la exploración física del paciente, antecedentes personales de enfermedad cardiovascular temprana o antecedentes cLDL elevado en familiares de primer grado con o sin enfermedad cardiovascular prematura1.
El objetivo lipídico en la HFhe, es una disminución del cLDL por debajo de 70mg/dl. La reducción de los niveles de cLDL ha demostrado una estabilización, o incluso la regresión de placa de ateroma que se traduce en un descenso de los eventos cardiovasculares, así como la mortalidad por enfermedad coronaria y la mortalidad global1.
Además de las modificaciones higiénico-dietéticas, la primera línea de tratamiento farmacológico son las estatinas a la máxima dosis tolerada. La mayoría de los pacientes con HF no alcanzan los niveles objetivo de cLDL, lo que obliga a añadir un segundo fármaco: ezetimiba, iPCSK9 o ambos1–4. Si a pesar de estas medidas no se consigue un cLDL adecuado, se puede considerar la lipoaféresis como una terapéutica de tercera línea1,2,5. La distrofia muscular congénita que presenta nuestro caso, contraindica el empleo de estatinas por el riesgo de empeoramiento de la enfermedad con mialgias y rabdomiolisis. Antes de la introducción de los iPCSK9, solo las resinas, la ezetimiba y la aféresis de cLDL eran las medidas hipocolesterolemiantes disponibles.
La lipoaféresis es la eliminación extracorpórea de las lipoproteínas que contienen apoB circulante, incluyendo las LDL, la lipoproteína (a) y las VLDL. Existen varios métodos de aféresis disponibles y se suele realizar cada semana o quincenalmente. Actualmente se reserva para pacientes con HF homocigota o para paciente con HFhe que no consigue niveles objetivos de cLDL a pesar de tratamiento farmacológico óptimo2,6. Los altos costes por sesión y la frecuencia del tratamiento suponen una barrera importante en el tratamiento de la HF6.
Los iPCSK9 son fármacos capaces de reducir el cLDL hasta un 60%, asociados a la terapia con estatinas. Son fármacos bien tolerados y seguros, con una tasa de eventos adversos baja y generalmente de poca gravedad2–5. En la actualidad no se ha encontrado toxicidad muscular ni aumento de la CK en pacientes después de administrar iPCSK97. Con esta nueva medicación se consigue espaciar e incluso evitar el tratamiento con lipoaféresis en los pacientes con HFhe5,6,8.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.