Los informes analíticos del laboratorio clínico son claves para orientar a los médicos clínicos sobre qué valores del perfil lipídico se han de considerar alterados y, por tanto, requieren intervención. Desafortunadamente, existe una gran heterogeneidad en los valores de lípidos que los laboratorios clínicos reportan como «normales, deseables, recomendables o de referencia». Ello puede dificultar la toma de decisiones clínicas y ser una barrera para la consecución de los objetivos terapéuticos en prevención cardiovascular. Una reciente recomendación internacional añade un nuevo factor de heterogeneidad en la interpretación del perfil lipídico, como es la posibilidad de medirlo sin ayuno previo. Todo ello justifica la necesidad de desarrollar un documento que adapte el conocimiento existente a la práctica clínica de nuestro sistema sanitario. En este sentido, profesionales de diferentes sociedades científicas implicadas en la medida y utilización de los datos del perfil lipídico han desarrollado el presente documento para establecer unas recomendaciones que faciliten la homogenización del mismo.
Analytical reports from the clinical laboratory are essential to guide clinicians about what lipid profile values should be considered altered and, therefore, require intervention. Unfortunately, there is a great heterogeneity in the lipid values reported as “normal, desirable, recommended or referenced” by clinical laboratories. This can difficult clinical decisions and be a barrier to achieve the therapeutic goals for cardiovascular prevention. A recent international recommendation has added a new heterogeneity factor for the interpretation of lipid profile, such as the possibility of measuring it without previous fasting. All this justifies the need to develop a document that adapts the existing knowledge to the clinical practice of our health system. In this regard, professionals from different scientific societies involved in the measurement and use of lipid profile data have developed this document to establish recommendations that facilitate their homogenization.
Existe una gran heterogeneidad en la concentración de los constituyentes lipídicos que los diferentes laboratorios clínicos reportan como «normales, deseables, recomendables o de referencia», tanto en la atención especializada como en la atención primaria, en la sanidad pública o en la privada. Esta heterogeneidad puede ser causa de decisiones clínicas erróneas que repercutan directamente en la calidad asistencial. Por este motivo, profesionales de diferentes sociedades científicas implicadas en la producción y utilización de los datos del perfil lipídico han desarrollado el presente documento para establecer unas recomendaciones sobre la homogenización del mismo. Los principales objetivos del documento han sido:
- 1.
Presentar los datos epidemiológicos más recientes de la dislipemia en España.
- 2.
Resaltar la importancia de la consecución de los objetivos terapéuticos lipídicos y describir las principales barreras para la consecución de los mismos.
- 3.
Detallar los factores preanalíticos, analíticos y postanalíticos que influyen en la interpretación del perfil lipídico.
- 4.
Recomendar qué constituyentes del perfil lipídico y qué valores de referencia deben incluirse en los informes analíticos.
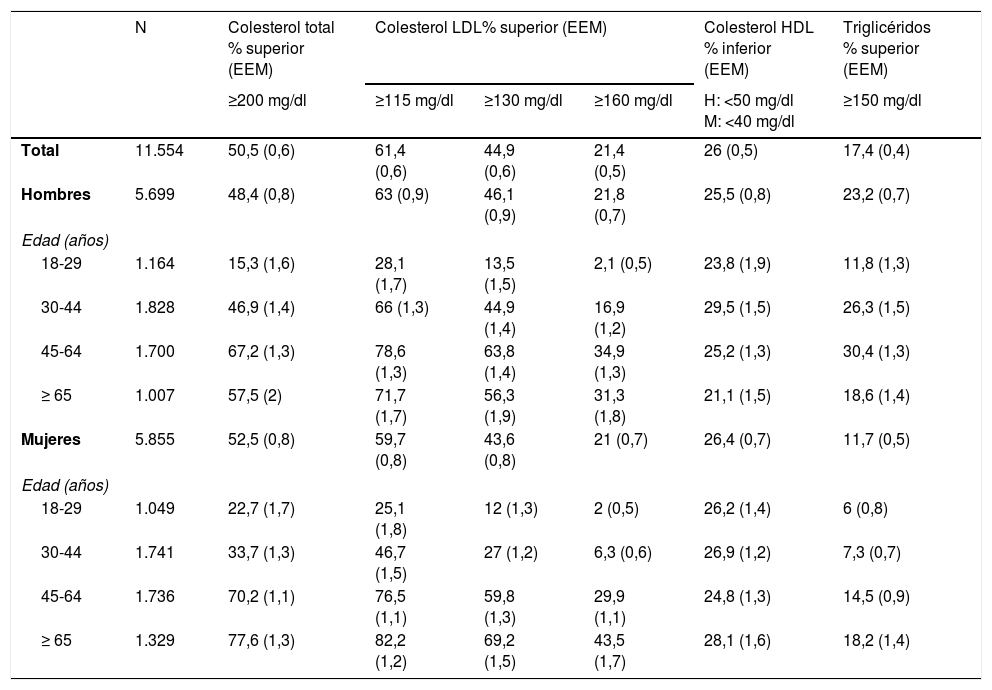
El «Estudio de Nutrición y Riesgo Cardiovascular en España» (ENRICA) es el estudio poblacional más reciente de factores de riesgo cardiovascular realizado en el país, desarrollado entre junio de 2008 y octubre de 2010 con 11.554 individuos, representativos de la población española de edad ≥18 años1. Las muestras de sangre para el perfil lipídico se obtuvieron tras ayunas de 12 h y se analizaron en un laboratorio central. La tabla 1 pone de manifiesto las concentraciones de colesterol total y de baja (cLDL) y alta densidad (cHDL) y triglicéridos por estratos de edad y sexo.
Prevalencia de la dislipemia en la población española de más de 18 años, estratificada por edad y sexo en el estudio ENRICA*. Resultados expresados como % superior al límite recomendado de las diferentes variables lipídicas o en tratamiento farmacológico para control de las mismas
| N | Colesterol total % superior (EEM) | Colesterol LDL% superior (EEM) | Colesterol HDL % inferior (EEM) | Triglicéridos % superior (EEM) | |||
|---|---|---|---|---|---|---|---|
| ≥200 mg/dl | ≥115 mg/dl | ≥130 mg/dl | ≥160 mg/dl | H: <50 mg/dl M: <40 mg/dl | ≥150 mg/dl | ||
| Total | 11.554 | 50,5 (0,6) | 61,4 (0,6) | 44,9 (0,6) | 21,4 (0,5) | 26 (0,5) | 17,4 (0,4) |
| Hombres | 5.699 | 48,4 (0,8) | 63 (0,9) | 46,1 (0,9) | 21,8 (0,7) | 25,5 (0,8) | 23,2 (0,7) |
| Edad (años) | |||||||
| 18-29 | 1.164 | 15,3 (1,6) | 28,1 (1,7) | 13,5 (1,5) | 2,1 (0,5) | 23,8 (1,9) | 11,8 (1,3) |
| 30-44 | 1.828 | 46,9 (1,4) | 66 (1,3) | 44,9 (1,4) | 16,9 (1,2) | 29,5 (1,5) | 26,3 (1,5) |
| 45-64 | 1.700 | 67,2 (1,3) | 78,6 (1,3) | 63,8 (1,4) | 34,9 (1,3) | 25,2 (1,3) | 30,4 (1,3) |
| ≥ 65 | 1.007 | 57,5 (2) | 71,7 (1,7) | 56,3 (1,9) | 31,3 (1,8) | 21,1 (1,5) | 18,6 (1,4) |
| Mujeres | 5.855 | 52,5 (0,8) | 59,7 (0,8) | 43,6 (0,8) | 21 (0,7) | 26,4 (0,7) | 11,7 (0,5) |
| Edad (años) | |||||||
| 18-29 | 1.049 | 22,7 (1,7) | 25,1 (1,8) | 12 (1,3) | 2 (0,5) | 26,2 (1,4) | 6 (0,8) |
| 30-44 | 1.741 | 33,7 (1,3) | 46,7 (1,5) | 27 (1,2) | 6,3 (0,6) | 26,9 (1,2) | 7,3 (0,7) |
| 45-64 | 1.736 | 70,2 (1,1) | 76,5 (1,1) | 59,8 (1,3) | 29,9 (1,1) | 24,8 (1,3) | 14,5 (0,9) |
| ≥ 65 | 1.329 | 77,6 (1,3) | 82,2 (1,2) | 69,2 (1,5) | 43,5 (1,7) | 28,1 (1,6) | 18,2 (1,4) |
EEM: error estándar de la media.
El 53,6% de los individuos con cLDL elevado estaba informado del incremento; el 44,1% de este grupo (23,6% del total de hipercolesterolémicos) estaba tratado con hipolipemiantes y, de estos, el 55,7% (el 13,2% de todos los hipercolesterolémicos) cumplía los objetivos de control. El porcentaje de sujetos con control del cLDL elevado aumentó con la edad y con el número de visitas al especialista, pero disminuyó en los sujetos con diabetes (razón de riesgo [RR] 0,38, intervalo de confianza [IC] del 95%, 0,28-0,53) o con enfermedad cardiovascular (RR 0,55; IC del 95%, 0,33-0,92). También es bajo el grado de control de las concentraciones de triglicéridos y de cHDL en nuestro medio. En un estudio prospectivo de pacientes atendidos en unidades de lípidos especializadas, con trigliceridemia > 2,25 mmol/l (200 mg/dl), se demostró que tras un año de tratamiento solo el 44% de los mismos había disminuido los triglicéridos por debajo de 2,25 mmol/l2. En otro estudio similar, se señaló que solo el 16% de los pacientes con exceso de triglicéridos y cHDL disminuido había alcanzado los objetivos terapéuticos de ambas alteraciones en la última visita de seguimiento3.
Importancia de la consecución de los objetivos de controlLa mortalidad por cardiopatía isquémica está directamente relacionada con la concentración de cLDL. En esta relación no parece existir un umbral inferior de cLDL a partir del cual no disminuya el riesgo cardiovascular y, en cambio, aumente (la denominada «curva en J», que sí existe para la mayoría de las variables biológicas). La ausencia de umbral inferior ha contribuido a que los valores que se fijan como objetivo de control del cLDL sean cada vez menores4. El metaanálisis de los Cholesterol Treatment Trialists’ Collaborators ha demostrado que por cada mmol/l (38,7mg/dl) de reducción en la concentración de cLDL se observa un 20-25% de reducción anual en la enfermedad cardiovascular mortal y no mortal tras el primer año de tratamiento y que, con las terapias actualmente disponibles que permiten reducir el cLDL en 2 mmol/l (77,4mg/dl), se puede disminuir el riesgo de enfermedad cardiovascular grave en prácticamente un 50%5. En términos absolutos, tratar a 10.000 pacientes con riesgo cardiovascular elevado durante 5 años y reducir su cLDL en 2 mmol/l (77,4mg/dl) podría evitar una enfermedad cardiovascular grave en 1.000 pacientes en prevención secundaria y en 500 pacientes en prevención primaria. En el caso del tratamiento con estatinas, cuanto más prolongado fuera el tratamiento mayor sería el beneficio absoluto, ya que estos fármacos reducen de forma continua los episodios cardiovasculares por cada año de tratamiento.
Un reciente estudio de metarregresión ha analizado el impacto de los tratamientos con estatinas y otros tratamientos hipolipemiantes en un total de 312.175 participantes en 49 estudios que presentaron 39.645 episodios cardiovasculares graves. Se observó que tras la reducción de cLDL en 1 mmol/l (38,7mg/dl), la RR de episodios cardiovasculares graves a los 5 años del tratamiento era de 0,77 (IC 95%, 0,71-0,84; p<0,001) para los sujetos tratados con estatinas y de 0,75 (IC 95%, 0,66-0,86; p=0,002) para otras intervenciones que reducían el cLDL (dieta, secuestrantes de ácidos biliares, by-pass ileal y ezetimiba). Por lo tanto, el uso de estatinas y terapias no estatina que actúan a través de la regulación de la expresión del receptor de LDL se asocia a similares reducciones de riesgo cardiovascular por nivel de reducción de cLDL6.
En un registro poblacional danés que incluyó a más de 600.000 habitantes que iniciaron tratamiento con estatinas, se demostró que la discontinuación del tratamiento se relacionaba con un aumento del riesgo de infarto de miocardio (RR 1,26; IC 95% 1,21-1,30) y de muerte por enfermedad cardiovascular 1,18 (IC 95% 1,14-1,23)7. En el Reino Unido, tras la publicación de que las estatinas podían causar efectos secundarios en un 20% de los pacientes, hubo un aumento del abandono del tratamiento en un 11% en los pacientes en prevención secundaria y en un 12% en aquellos en prevención primaria, estimándose que en los 10 años siguientes el número de complicaciones cardiovasculares podría aumentar en al menos 2.100 episodios8.
Estudios que evalúan los objetivos de control en prevención cardiovascularEl estudio EUROASPIRE IV, realizado en 16.426 pacientes con enfermedad coronaria de 24 países europeos, mostró que un 80,5% presentaba un cLDL ≥ 1,81 mmol/l (70mg/dl) a pesar de que el 85,7% estaba tratado con estatinas9.
La comparación de dos registros nacionales (registro TRECE, año 2006 y registro REPAR, año 2014) de pacientes con enfermedad coronaria demostró que la consecución del objetivo de conseguir un cLDL < 1,81 mmol/l (70mg/dl) aumentó del 9,5 en el año 2006 a 27,3% en el 2014, la utilización de estatinas del 69 a 96% y el uso de estatinas a dosis altas de 10,5 a 42,8%10.
Finalmente, el estudio EURIKA, que incluyó 7.641 pacientes en prevención primaria de 12 países europeos11, demostró que solo un 65,3% de los pacientes con alto riesgo (en tratamiento hipolipemiante o con un riesgo ≥ 5% según las tablas SCORE) estaban recibiendo tratamiento hipolipemiante y de estos, un 61,3% tenían un cLDL ≥ 2,58 mmol/l (100mg/dl). En el caso de los pacientes de muy alto riesgo (≥ 10% según tablas SCORE y/o diabetes), solo un 49,5% recibían tratamiento hipolipemiante y de estos, un 82,9% tenían un cLDL ≥1,81 mmol/l (70mg/dl).
Perfil lipídico. Variabilidad preanalíticaLa variación preanalítica es la que experimenta cualquier variable bioquímica de un sujeto por la influencia de diversas condiciones, pudiendo afectar a los resultados de la medida e inducir errores en su interpretación. Para reducir esta variación se recomienda sistematizar las condiciones de los sujetos previamente al análisis de la variable.
Las fuentes de variación preanalítica que afectan al perfil lipídico son múltiples y dependen de factores relacionados con el individuo, con la muestra sanguínea obtenida y con la obtención de la misma. En la tabla 2 se exponen las condiciones relacionadas con el individuo, la obtención de la muestra y la conservación de la misma que pueden influir la medida de las concentraciones lipídicas, así como las recomendaciones para minimizar estas fuentes de variabilidad.
Condiciones preanalíticas que pueden afectar a la medida de los componentes del perfil lipídico
| Del individuo | Recomendación |
|---|---|
| Ayuno | Mantener un ayuno de entre 8 y 10 h; si existen antecedentes de hipertrigliceridemia prolongar ayuno hasta 12 h |
| Dieta | Mantener la dieta y el peso habituales en las 2 semanas previas |
| Peso | |
| Ejercicio físico | Evitar el ejercicio físico intenso en las 24 h previas |
| Café | Evitar la ingesta de café y alcohol en las 12 h previas |
| Alcohol | |
| Fármacos | Suspender los fármacos no imprescindibles durante el mes previo |
| Embarazo | Diferir la extracción hasta los 3 meses posparto o del fin de la lactancia |
| Enfermedad | Retrasar la extracción hasta 3 semanas tras enfermedad leve o 3 meses tras enfermedad grave |
| Obtención de la muestra | |
| Sedestación | Realizar la extracción con el paciente sentado tras 5min. de reposo Si no es posible la sedestación, realizar las extracciones siempre en la misma posición |
| Torniquete | Mantener el torniquete el mínimo tiempo posible (para evitar la hemoconcentración) |
| Tipo de muestra | Obtener muestras de suero o de plasma anticoagulado con EDTA. Si se utiliza EDTA o heparina como anticoagulantes de la muestra, corregir los valores obtenidos multiplicándolos por 1,03 para equivalencia con los valores del suero |
| Conservación de la muestra | Mantener la muestra a 4°C si no se analiza inmediatamente. Los lípidos y lipoproteínas son estables 48 h en refrigeración. Es recomendable evitar la congelación de las muestras ya que puede afectar las medidas de lipoproteínas y sus componentes |
EDTA: ácido etilendiaminotetraacético.
Ayuno. Habitualmente se recomienda medir el perfil lipídico tras un ayuno de entre 8 y 10 h, si no existe hipertrigliceridemia conocida. Si la muestra no se obtiene en ayunas, los resultados de colesterol total y cHDL son válidos, pero la concentración de triglicéridos y de colesterol asociado a las lipoproteínas de muy baja densidad (cVLDL) puede aumentar e incluso, puede existir quilomicronemia. En las poblaciones en que se ha comparado el perfil lipídico de sujetos en ayunas frente al de sujetos no ayunados, se ha observado un aumento de los triglicéridos de 0,3 mmol/l (26,6mg/dl) y unas disminuciones de colesterol total, cLDL y colesterol no-HDL de 0,2 mmol/l (7,74mg/dl) para cada uno de ellos.
En la hipertrigliceridemia disminuyen las concentraciones reales del cLDL si las mismas se calculan mediante la fórmula de Friedewald (los motivos de esta disminución se comentan posteriormente). Esta inexactitud no solo ocurre en la hipertrigliceridemia posprandial, sino en todas aquellas hipertrigliceridemias asociadas a diabetes, síndrome metabólico o enfermedad renal crónica, así como en la hipertrigliceridemia familiar y en las dislipemias mixtas (combinadas) con aumento de triglicéridos y colesterol. La concentración de cLDL solo es exacta si se mide con métodos complejos como el de ultracentrifugación, no disponible en todos los laboratorios clínicos.
Una reciente guía de la Sociedad Europea de Arteriosclerosis y la Sociedad Europea de Bioquímica Clínica y Medicina de Laboratorio ha establecido una recomendación sobre la necesidad o no del ayuno para medir el perfil lipídico12. La obtención de muestras en ayunas solo se recomienda si los triglicéridos son superiores a 5,0 mmol/l (443mg/dl); el problema para seguir esta recomendación es el desconocimiento a priori de las concentraciones del sujeto a analizar. También debe considerarse el ayuno si en la misma muestra se va a medir glucosa y otras magnitudes que lo precisan, situación frecuente en sujetos con diabetes. El cHDL, las apolipoproteínas (apo) A-I y B y la lipoproteína(a) – Lp(a) – no se modifican significativamente por la falta de ayuno. En nuestro medio, lo habitual es obtener las muestras en ayunas; en caso contrario, la circunstancia se debe reflejar en el informe analítico. También se debe registrar el consumo de fármacos, cuyo efecto sobre diferentes variables lipídicas se recoge en la tabla 3.
Efecto de diferentes fármacos no hipolipemiantes en el perfil lipídico
| CT | cLDL | cHDL | TG | |
|---|---|---|---|---|
| Antiepilépticos | ||||
| Ácido valproico | ↑ | |||
| Carbamacepina | ↑ | ↑ | ↑ | ↑ |
| Fenitoína | ↑ | |||
| Fenobarbital | ↑ | ↑ | ||
| Antifúngicos | ||||
| Itraconazol, ketoconazol | ↓ | ↑ | ||
| Antipsicóticos | ||||
| Clozapina | ↑ | |||
| Hormonas | ||||
| Corticoides | ↑ | ↑ | ||
| Danazol | ↑ | ↓ | ||
| Nandrolona | ↑ | ↑ | ↓ | ↑ |
| Estrógenos | ↓ | ↑ | ||
| Progestágenos | ↑ | ↓ | ||
| Tratamiento hormonal sustitutivo | ↓ | ↓ | ||
| Contraceptivos orales | ||||
| Progestágenos 2.a generación | ↑ | ↓ | ↑ | |
| Progestágenos 3.a generación | ↓ | ↑ | ↑ | |
| Raloxifeno | ↓ | ↓ | ||
| Tamoxifeno | ↓ | ↓ | ↑ | |
| Fármacos cardiovasculares | ||||
| Amiodarona | ↑ | ↑ | ↑ | ↔ |
| Bloqueadores alfa adrenérgicos | ↓ | ↓ | ↑ | ↓ |
| Bloqueadores beta adrenérgicos | ↓ | ↑ | ||
| Clopidogrel | ↑ | |||
| Diuréticos tiazídicos | ↑ | ↑ | ↓ | ↑ |
| Inmunosupresores | ||||
| Azatioprina, ciclosporina, sirólimo | ↑ | ↑ | ↑ | ↑ |
| Retinoides | ||||
| Isotretionína | ↑ | ↑ | ↑ | |
| Acitretina | ↑ | |||
| ITINAN | ||||
| Nevirapina | ↑ | ↑ | ↑ | ↓ |
| Efavirenz | ↑ | ↑ | ↑ | ↑ |
| Etravirina | ↑ | ↔ | ↑ | ↑ |
| Rilpivirina | ↔ | ↔ | ↔ | ↔ |
| ITIAN | ||||
| Estavudina | ↑ | ↑ | ↓ | ↑ |
| Zidovudina | ↑ | ↔ | ↑ | ↑ |
| Lamivudina | ↑ | ↔ | ↑ | ↑ |
| Abacavir | ↔ | ↔ | ↓ | ↔ |
| Abacavir/lamivudina | ↑ | ↔ | ↑ | ↑ |
| Abacavir/lamivudina/zidovudina | ↑ | ↔ | ↑ | ↑ |
| Didanosina | ↔ | ↔ | ↓ | ↑ |
| Emtricitabina | ↑ | ↔ | ↑ | ↑ |
| Tenofovir | ↔ | ↔ | ↔ | ↔ |
| Inhibidores de la integrasa | ||||
| Raltegravir | ↔ | ↔ | ↔ | ↔ |
| Inhibidores de la proteasa | ||||
| Indinavir | ↑ | ↑ | ↔ | ↑ |
| Nelfinavir | ↑ | ↑ | ↔ | ↔ |
| Saquinavir | ↑ | ↑ | ↓ | ↑ |
| Lopinavir/ritonavir | ↑ | ↑ | ↔ | ↑ |
| Fosamprenavir | ↑ | ↑ | ↔ | ↑ |
| Atazanavir | ↔ | ↔ | ↔ | ↔ |
| Darunavir/ritonavir | ↑ | ↑ | ↔ | ↑ |
| Ritonavir (dosis completa) | ↑ | ↑ | ↔ | ↔ |
| Inhibidores de la fusión/entrada | ||||
| Enfuvirtida | ↔ | ↔ | ↔ | ↔ |
| Maraviroc | ↔ | ↔ | ↔ | ↔ |
cLDL y cHDL: colesterol de las lipoproteínas de baja y alta densidad, respectivamente; CT: colesterol total; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósidos; ITINAN: inhibidores de la transcriptasa inversa no análogos de nucleósidos; TG: triglicéridos.
¿Qué magnitudes deberían medirse? El perfil lipídico para la evaluación inicial de una dislipemia debe incluir colesterol y triglicéridos totales y cHDL. Con estas medidas se puede calcular el cLDL, si no existe hipertrigliceridemia, y el colesterol no-HDL como colesterol total – cHDL; el colesterol no-HDL incluye al colesterol de las lipoproteínas de densidad intermedia (cIDL) y al colesterol asociado a LDL, VLDL y Lp(a); es decir, todo el colesterol aterogénico.
En sujetos con hipertrigliceridemia en los que la medida de cLDL puede ser inexacta por motivos metodológicos, la medida de colesterol no-HDL y de apoB, que es un equivalente al colesterol no-HDL aunque más costoso, son las alternativas válidas. La European Society of Cardiology (ESC) y la European Atherosclerosis Society (EAS) recomiendan calcular el colesterol no-HDL en estas situaciones clínicas13.
Otras magnitudes como la Lp(a), la apoB o A-I o algunos enzimas o proteínas asociadas al metabolismo lipídico pueden considerase en situaciones clínicas especiales.
¿A quién debe medirse el perfil lipídico? El escrutinio de la dislipemia en sujetos sin enfermedad cardiovascular clínica debería realizarse en todos los varones de más de 40 años y todas las mujeres de más de 50 años de edad, o posmenopáusicas, especialmente si existen otros factores de riesgo cardiovascular. El cribado también debería realizarse en los familiares de pacientes con dislipemia severa o con enfermedad cardiovascular prematura13.
La determinación analítica para el estudio de una posible dislipemia está siempre indicada en pacientes con enfermedad cardiovascular establecida o cuando se considere necesario realizar un cribado de factores de riesgo cardiovascular. También debe considerarse en situaciones clínicas en las que la dislipemia puede contribuir a incrementar el riesgo cardiovascular13 (tabla 4).
¿Con qué frecuencia debe medirse el perfil lipídico? Aunque no está claramente establecido, la repetición de los controles analíticos debería depender del riesgo cardiovascular que presenten los sujetos, de la situación clínica de los mismos y de los valores obtenidos en la primera evaluación. Dado que existe una variabilidad intraindividual de los constituyentes del perfil lipídico se recomienda que en la evaluación inicial de un sujeto se realicen dos medidas del perfil lipídico con un intervalo mínimo de una semana. En pacientes con riesgo cardiovascular bajo, en situación clínica estable, y perfil lipídico normal, parece razonable repetir la analítica cada 3-5 años.
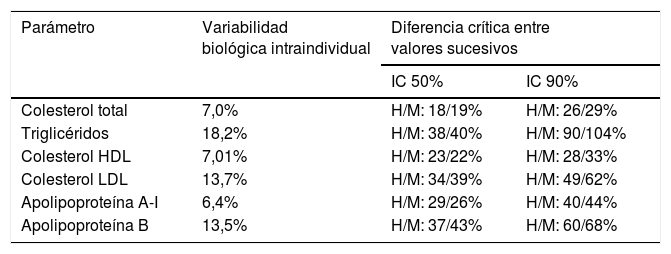
En la tabla 5 se describe la variabilidad intraindividual (biológica) de los principales componentes del perfil lipídico en sujetos sanos y la variabilidad analítica de los métodos para su medida14. En base a estos datos, obtenidos en una población de nuestro país, se muestra qué diferencia mínima crítica ha de existir en hombres y mujeres entre dos medidas sucesivas para que pueda considerarse debida a cambios en el metabolismo lipídico y no a variabilidad biológica.
Variabilidad biológica intraindividual del perfil lipídico y diferencia crítica entre medidas sucesivas para ser considerada como significativa*
| Parámetro | Variabilidad biológica intraindividual | Diferencia crítica entre valores sucesivos | |
|---|---|---|---|
| IC 50% | IC 90% | ||
| Colesterol total | 7,0% | H/M: 18/19% | H/M: 26/29% |
| Triglicéridos | 18,2% | H/M: 38/40% | H/M: 90/104% |
| Colesterol HDL | 7,01% | H/M: 23/22% | H/M: 28/33% |
| Colesterol LDL | 13,7% | H/M: 34/39% | H/M: 49/62% |
| Apolipoproteína A-I | 6,4% | H/M: 29/26% | H/M: 40/44% |
| Apolipoproteína B | 13,5% | H/M: 37/43% | H/M: 60/68% |
H: hombres; HDL: lipoproteínas de alta densidad; IC: intervalo de confianza al 50 y al 90%; LDL: lipoproteínas de baja densidad; M: mujeres.
Cualquier método analítico presenta variabilidad analítica, también denominada error de medida. La variabilidad analítica se debe a los componentes del método de medida: material de calibración, reactivos e instrumentación y es el resultado de dos tipos de error: el error aleatorizado y el error sistemático.
El error aleatorizado o imprecisión analítica evalúa la reproducibilidad de los resultados de un método de medida en cualquier condición en que se utilice. La imprecisión analítica se evalúa y controla mediante medidas repetidas de materiales de control con concentraciones próximas a los puntos de decisión clínica; con ello, se estima la variabilidad de los resultados obtenidos en las muestras clínicas. Se suele expresar como porcentaje de coeficiente de variación (CV) y se obtiene dividiendo la desviación estándar (DE) de los resultados obtenidos en muestras control entre la media (x) de las mismas (%CV= DE/x). La imprecisión analítica es inherente a la variabilidad de los componentes del método analítico (volumen de muestra, tipo de reactivo, variabilidad de los calibradores o del instrumento de medida, etc.).
El error sistemático o inexactitud analítica evalúa cuánto se diferencian los resultados obtenidos del valor verdadero. Se evalúa con materiales de referencia que contiene cantidades exactas del constituyente a medir y se calcula como la diferencia entre el valor verdadero y el obtenido al medir una magnitud analítica.
El objetivo de cualquier método analítico es producir resultados con la mínima imprecisión e inexactitud analíticas para que las mismas no interfieran en la correcta interpretación clínica de los mismos. Este objetivo se consigue mediante la estandarización de los métodos de medida, la cual garantiza que los resultados obtenidos en diferentes laboratorios y con diferentes métodos de medida sean comparables entre sí y a lo largo del tiempo.
Diversas organizaciones internacionales definen los métodos y materiales de estandarización o de referencia para cada magnitud medida. Las compañías de diagnóstico «in vitro» desarrollan sus métodos ajustándolos a estos métodos estándar y los laboratorios clínicos gestionan la calidad analítica de sus resultados utilizando métodos ajustados a los estándares y participando en programas de control de calidad que certifiquen la imprecisión e inexactitud de sus métodos. La estandarización de las magnitudes del perfil lipídico ha mejorado la calidad analítica, la armonización de los resultados entre diferentes laboratorios y la trazabilidad de los resultados obtenidos en cualquier laboratorio clínico con los obtenidos en los estudios internacionales que han analizado el papel de estos marcadores en la enfermedad cardiovascular.
Calidad de los métodos de medidaComo se ha comentado, el perfil lipídico convencional debe incluir las medidas de colesterol y triglicéridos totales, cLDL y cHDL13.
El colesterol y triglicéridos totales y el cHDL se miden directamente en muestras de suero o plasma, sin manipulación previa de las mismas. Incluso existen métodos tipo «point-of-care» que permiten su medida en muestras de sangre total capilar o venosa. Sin embargo, el cLDL o se mide indirectamente tras separar las diferentes lipoproteínas por el método de la ultracentrifugación (técnica compleja) o bien se calcula mediante una fórmula (técnica sencilla, pero inexacta).
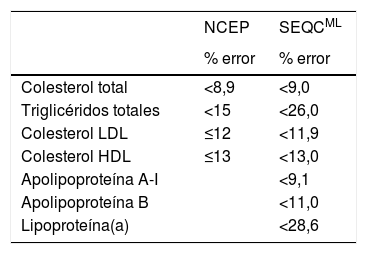
Existen recomendaciones de organismos internacionales como el National Cholesterol Education Program (NCEP)15 y de sociedades científicas nacionales como la Sociedad Española de Medicina de Laboratorio (SEQCML)16, acerca de los requisitos de calidad analítica que deben cumplir los métodos utilizados para medir los constituyentes del perfil lipídico. Las recomendaciones del NCEP están basadas en consenso de expertos, mientras las de la SEQCML se basan en la variabilidad biológica de los constituyentes lipídicos (tabla 6); obviamente, la recomendación basada en la variabilidad biológica de los constituyentes lipídicos es de gran utilidad para la práctica clínica. Según la SEQCML, resulta aceptable que un método analítico tenga una imprecisión igual o menor al 50% de la variabilidad biológica del constituyente a medir14.
Recomendaciones de calidad analítica (% de error total admisible) para los métodos de medida del perfil lipídico según el NCEP (15) o la SEQCML (16)
| NCEP | SEQCML | |
|---|---|---|
| % error | % error | |
| Colesterol total | <8,9 | <9,0 |
| Triglicéridos totales | <15 | <26,0 |
| Colesterol LDL | ≤12 | <11,9 |
| Colesterol HDL | ≤13 | <13,0 |
| Apolipoproteína A-I | <9,1 | |
| Apolipoproteína B | <11,0 | |
| Lipoproteína(a) | <28,6 |
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; NCEP: National Cholesterol Education Panel; SEQCML: Sociedad Española de Medicina de Laboratorio.
Colesterol y triglicéridos totales. Los métodos recomendados para medir ambas magnitudes son métodos enzimático-colorimétricos basados en las mismas reacciones que se producen en el metabolismo lipídico en humanos (colesterol esterasa + colesterol oxidasa; triglicérido lipasa + detección de glicerol). Se trata de métodos estandarizados frente a los de referencia y existen materiales internacionales de control que aseguran la transferibilidad entre diferentes métodos.
La imprecisión analítica, evaluada en el programa de Garantía de Calidad de la SEQCML, es muy baja para los métodos de colesterol (1,7-3,6%) y de los triglicéridos (<5%). Las diferencias entre métodos son aceptables para el colesterol (< 2,1%) en el 98% de los laboratorios participantes y también el 98% de los laboratorios participantes cumplen las especificaciones de calidad recomendadas para la medida de triglicéridos.
Colesterol HDL. Existen métodos homogéneos que permiten medir el cHDL sin necesidad de separar las HDL del resto de lipoproteínas que contienen colesterol. Los métodos utilizan enzimas selectivas, detergentes y/o anticuerpos frente a la apoB para bloquear la reactividad de las lipoproteínas no HDL y están estandarizados frente al método de referencia. En los programas de control de calidad, las imprecisiones de los métodos son aceptables (4-10%) en el 86% de los laboratorios participantes, mientras que las diferencias entre diferentes métodos son mayores que lo deseable (5,6%).
Colesterol LDL. La medida del cLDL es la más problemática de entre los constituyentes del perfil lipídico. El método de referencia requiere la separación de las diferentes lipoproteínas por centrifugación a más de 100.000 gravedades (ultracentrifugación). Este método suele estar disponible solo en laboratorios especializados.
El cLDL se puede calcular mediante la fórmula de Friedewald; por su sencillez y practicabilidad este cálculo se ha empleado en la mayoría de los grandes ensayos clínicos o estudios de población de los que se han derivado recomendaciones sobre objetivos o valores deseables de los componentes del perfil lipídico.
La fórmula de Friedewald fue publicada en el año 1972 y asume que la mayor parte (>99%) de los triglicéridos circulantes está asociada a las lipoproteínas de muy baja densidad (VLDL) y que en las mismas los triglicéridos y el colesterol se hallan en proporción fija17. Aplicando estas asunciones, el cLDL puede calcularse como cLDL = colesterol total - cHDL- cVLDL. El colesterol total y el de HDL no requieren métodos complejos para su medida, pero el cVLDL debería medirse tras separar las lipoproteínas por ultracentrifugación. Sin embargo, el cVLDL puede calcularse a partir de la concentración de triglicéridos/5 (en mg/dl) o triglicéridos/2,21 (en mmol/l). Esta fórmula tiene una inexactitud aceptable cuando la trigliceridemia es inferior a 2,25 mmol/l (200mg/dl), pero no puede utilizarse si la misma excede 4,50 mmol/l (400mg/dl) –situación que provocará una infraestimación de cLDL– o si existe una disbetalipoproteinemia –situación que provocará una sobreestimación de cLDL–. Por ello, no es aconsejable utilizar la fórmula de Friedewald con trigliceridemias superiores a 2,25 mmol/l (200mg/dl). Finalmente, la exactitud del cálculo del cLDL también disminuye cuando la concentración del mismo es muy baja (p.ej. < 1,81 mmol/l [70mg/dl]); sin embargo, a diferencia de en el caso de las hipertrigliceridemias o de la disbetalipoproteinemia la repercusión de esta inexactitud no es tan relevante para tomar decisiones clínico-terapéuticas.
Al igual que para cHDL, también existen métodos homogéneos que no requieren separación de las lipoproteínas para medir cLDL. Los métodos utilizan detergentes selectivos y/o enzimas modificadas. Algunos de estos métodos están certificados por los Centers for Disease Control, aunque se han descrito errores en los mismos sobre todo en pacientes con hipertrigliceridemia y/o lipoproteínas anormales.
Finalmente, aunque los programas de control de calidad evidencian una imprecisión aceptable (4,85-10% en el 80% de los laboratorios), dada la diversidad de métodos para medir/calcular cLDL la comparación entre métodos muestra diferencias de hasta el 35%.
Colesterol no-HDL. Representa una estimación del colesterol de todas las lipoproteínas aterogénicas del plasma: VLDL, LDL, IDL y Lp(a). Se obtiene restando el cHDL del colesterol total. Su ventaja es que no presenta ninguna de las limitaciones de las medidas de cLDL, se correlaciona de forma similar al cLDL con el riesgo cardiovascular y existen objetivos terapéuticos. Se recomienda su utilización cuando la concentración de triglicéridos es mayor a 2,25 mmol/l (200mg/dl).
Apolipoproteína B. Aunque no existen métodos de referencia, la medida de apoB puede estandarizarse con materiales de control de la International Federation of Clinical Chemistry (IFCC). Los métodos más utilizados en los laboratorios clínicos son totalmente automatizables y están basados en la inmunonefelometría o la inmunoturbidimetría. Los Programas de Calidad indican que solo un 70-80% de los laboratorios cumplen las especificaciones de calidad para estas medidas.
Lipoproteína(a). Los métodos para medir Lp(a), basados en inmunonefelometría o inmunoturbidimetría no están estandarizados. En consecuencia, los resultados y los valores recomendados dependen del método utilizado en cada laboratorio que la determine. Existen pocos programas de garantía de calidad para Lp(a), ninguno de ellos en España18.
Perfil lipídico. Variabilidad postanalíticaLa variación postanalítica hace referencia a la interpretación que ante un mismo resultado realizan diferentes profesionales. Esta variabilidad se intenta reducir mediante las recomendaciones o guías de práctica clínica. En este sentido, en el presente documento se comentan las directrices de la «Guía para el control de la dislipemia» de la ESC/EAS 201613, complementando la información de la guía con otras recomendaciones de práctica clínica en caso necesario. Aunque la guía ESC/EAS es el marco de referencia, existen otras guías internacionales como la norteamericana y la canadiense, existiendo algunas discrepancias en las recomendaciones que ofrecen las diferentes guías19.
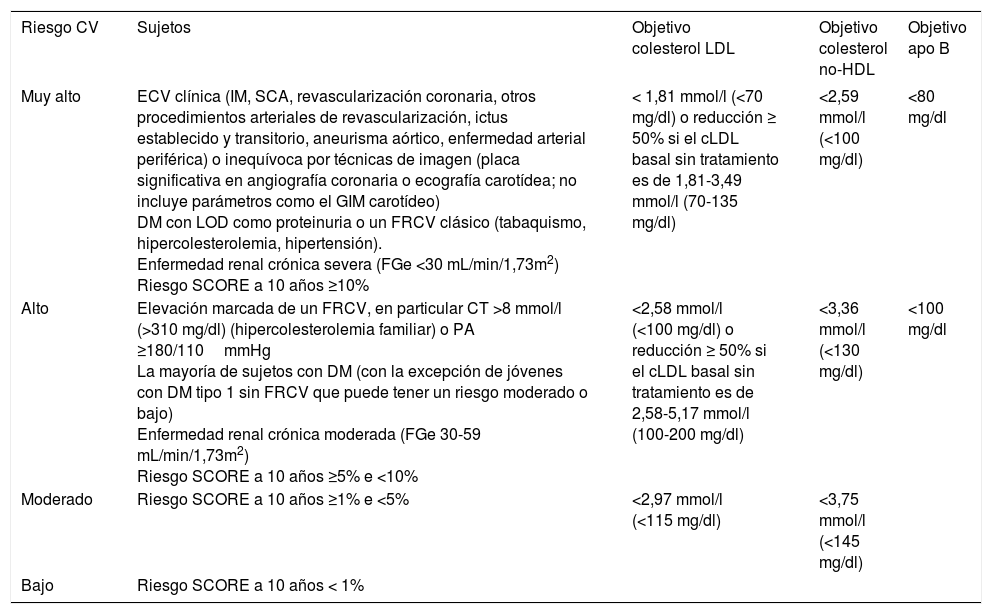
Estratificación del riesgo cardiovascular global y objetivos de control lipídicoEl Programa de Actividades Preventivas y de Promoción de la Salud de la Sociedad Española de Medicina de Familia y Comunitaria (semFYC) en su última actualización recomienda la estratificación del riesgo cardiovascular, y unos objetivos terapéuticos de acuerdo al nivel de riesgo20. En la misma línea, la guía ESC/EAS establece distintas categorías y objetivos terapéuticos para el cLDL según el riesgo cardiovascular de los sujetos (tabla 7).
Categorías de riesgo cardiovascular global y objetivos terapéuticos para colesterol LDL, colesterol no-HDL y apolipoproteína B (apoB)
| Riesgo CV | Sujetos | Objetivo colesterol LDL | Objetivo colesterol no-HDL | Objetivo apo B |
|---|---|---|---|---|
| Muy alto | ECV clínica (IM, SCA, revascularización coronaria, otros procedimientos arteriales de revascularización, ictus establecido y transitorio, aneurisma aórtico, enfermedad arterial periférica) o inequívoca por técnicas de imagen (placa significativa en angiografía coronaria o ecografía carotídea; no incluye parámetros como el GIM carotídeo) DM con LOD como proteinuria o un FRCV clásico (tabaquismo, hipercolesterolemia, hipertensión). Enfermedad renal crónica severa (FGe <30 mL/min/1,73m2) Riesgo SCORE a 10 años ≥10% | < 1,81 mmol/l (<70 mg/dl) o reducción ≥ 50% si el cLDL basal sin tratamiento es de 1,81-3,49 mmol/l (70-135 mg/dl) | <2,59 mmol/l (<100 mg/dl) | <80 mg/dl |
| Alto | Elevación marcada de un FRCV, en particular CT >8 mmol/l (>310 mg/dl) (hipercolesterolemia familiar) o PA ≥180/110mmHg La mayoría de sujetos con DM (con la excepción de jóvenes con DM tipo 1 sin FRCV que puede tener un riesgo moderado o bajo) Enfermedad renal crónica moderada (FGe 30-59 mL/min/1,73m2) Riesgo SCORE a 10 años ≥5% e <10% | <2,58 mmol/l (<100 mg/dl) o reducción ≥ 50% si el cLDL basal sin tratamiento es de 2,58-5,17 mmol/l (100-200 mg/dl) | <3,36 mmol/l (<130 mg/dl) | <100 mg/dl |
| Moderado | Riesgo SCORE a 10 años ≥1% e <5% | <2,97 mmol/l (<115 mg/dl) | <3,75 mmol/l (<145 mg/dl) | |
| Bajo | Riesgo SCORE a 10 años < 1% |
DM: diabetes mellitus; ECV: enfermedad cardiovascular; FGe: filtrado glomerular estimado; FRCV: factor de riesgo cardiovascular; GIM: grosor íntima-media; IM: infarto de miocardio; LOD: lesión de órgano diana; PA: presión arterial; SCA: síndrome coronario agudo.
Por lo que respecta a los triglicéridos y al cHDL, la guía ESC/EAS reconoce su papel como factores de riesgo cardiovascular, pero no los consideran objetivos terapéuticos. A pesar de ello, se definen como deseables las concentraciones de cHDL > 1,03 mmol/l (40mg/dl) en los hombres y > 1,24 mmol/l (48mg/dl) en mujeres y una trigliceridemia < 1,7 mmol/l (150mg/dl). Se recomienda valorar el tratamiento con fibratos o ácidos grasos omega-3, en adición al tratamiento con estatinas, en los pacientes de muy alto riesgo cardiovascular cuando la trigliceridemia es > 2,25 mmol/l (200mg/dl)13.
Una vez alcanzados los objetivos terapéuticos de cLDL en los pacientes de muy alto riesgo pueden considerarse como objetivos secundarios el colesterol no-HDL o la apoB. Los objetivos específicos para el colesterol no-HDL son 0,78 mmol/l (30mg/dl) superiores a los correspondientes al cLDL: < 2,58 mmol/l (100mg/dl) para pacientes de muy alto riesgo y < 3,36 mmol/l (130mg/dl) para pacientes de alto riesgo cardiovascular. Cuando las concentraciones de triglicéridos son > 2,25 mmol/l (200mg/dl), es recomendable utilizar los objetivos de colesterol no-HDL frente al cLDL calculado por la fórmula de Friedewald por su inexactitud. Con respecto a la apoB, los objetivos recomendados son < 80mg/dl para los sujetos de muy alto riesgo y <100mg/dl para los de alto riesgo cardiovascular13.
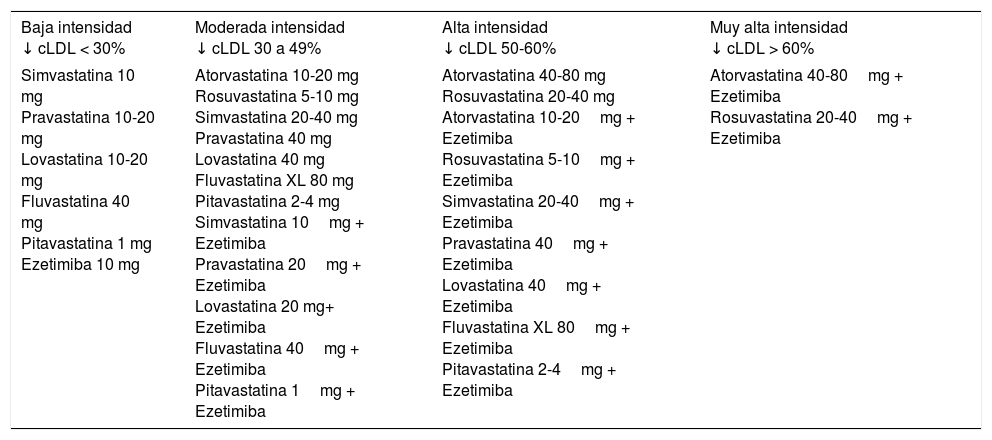
Además de la dieta y de la modificación del estilo de vida, la herramienta clave para alcanzar los objetivos terapéuticos, especialmente en los pacientes de alto/muy alto riesgo cardiovascular, son los fármacos hipolipemiantes. Las estatinas de alta intensidad (atorvastatina, rosuvastatina) utilizadas a la dosis máxima tolerada para alcanzar el objetivo recomendado son la base del tratamiento en este grupo de pacientes. En el caso de intolerancia a las estatinas, debe considerarse la utilización de ezetimiba y/o secuestradores de los ácidos biliares. Si no se alcanzan los objetivos terapéuticos con las estatinas en monoterapia, debe considerarse su asociación con ezetimiba. La tabla 8 indica la clasificación del tratamiento hipocolesterolemiante según la intensidad de reducción del cLDL21. En los casos de muy alto riesgo en los que no se alcance el objetivo con ninguna de estas estrategias puede valorarse la adición de un tercer fármaco como un inhibidor de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9).
Clasificación del tratamiento hipocolesterolemiante según la capacidad de reducción de la concentración de colesterol LDL (cLDL)
| Baja intensidad ↓ cLDL < 30% | Moderada intensidad ↓ cLDL 30 a 49% | Alta intensidad ↓ cLDL 50-60% | Muy alta intensidad ↓ cLDL > 60% |
|---|---|---|---|
| Simvastatina 10 mg Pravastatina 10-20 mg Lovastatina 10-20 mg Fluvastatina 40 mg Pitavastatina 1 mg Ezetimiba 10 mg | Atorvastatina 10-20 mg Rosuvastatina 5-10 mg Simvastatina 20-40 mg Pravastatina 40 mg Lovastatina 40 mg Fluvastatina XL 80 mg Pitavastatina 2-4 mg Simvastatina 10mg + Ezetimiba Pravastatina 20mg + Ezetimiba Lovastatina 20 mg+ Ezetimiba Fluvastatina 40mg + Ezetimiba Pitavastatina 1mg + Ezetimiba | Atorvastatina 40-80 mg Rosuvastatina 20-40 mg Atorvastatina 10-20mg + Ezetimiba Rosuvastatina 5-10mg + Ezetimiba Simvastatina 20-40mg + Ezetimiba Pravastatina 40mg + Ezetimiba Lovastatina 40mg + Ezetimiba Fluvastatina XL 80mg + Ezetimiba Pitavastatina 2-4mg + Ezetimiba | Atorvastatina 40-80mg + Ezetimiba Rosuvastatina 20-40mg + Ezetimiba |
La tabla 9 recoge las recomendaciones para el control analítico de los sujetos que reciban tratamiento hipolipemiante, haciendo especial énfasis en qué determinaciones analíticas deben solicitarse y cuándo se deben efectuar las mismas.
Recomendaciones para el control analítico del tratamiento hipolipemiante
| Antes de iniciar el tratamiento farmacológico | Después de iniciar el tratamiento farmacológico | |
|---|---|---|
| Perfil lipídico | Realizar al menos 2 determinaciones en un intervalo de una semana, excepto en aquellas situaciones que precisen terapia farmacológica como un SCA o pacientes de muy alto RCV | Medir a las 6-8 semanas Medir a las 6-8 semanas de modificar dosis y/o estatina hasta alcanzar el objetivo terapéutico Medir anualmente cuando se ha alcanzado el objetivo, excepto si hay dudas de cumplimentación terapéutica u otras razones específicas |
| Enzimas hepáticas | Medir | A las 8-12 semanas del inicio o de incrementar la dosis |
| Enzimas musculares | Medir y si el nivel de CK supera 4 veces el LSN: - no iniciar terapia farmacológica - repetir la medida tras un mínimo de 3 días sin ejercicio físico | No es necesario medirlas sistemáticamente. Pero, medir CK si existen mialgias |
CK: creatina cinasa; LSN: límite superior de la normalidad; RCV: riesgo cardiovascular; SCA: síndrome coronario agudo.
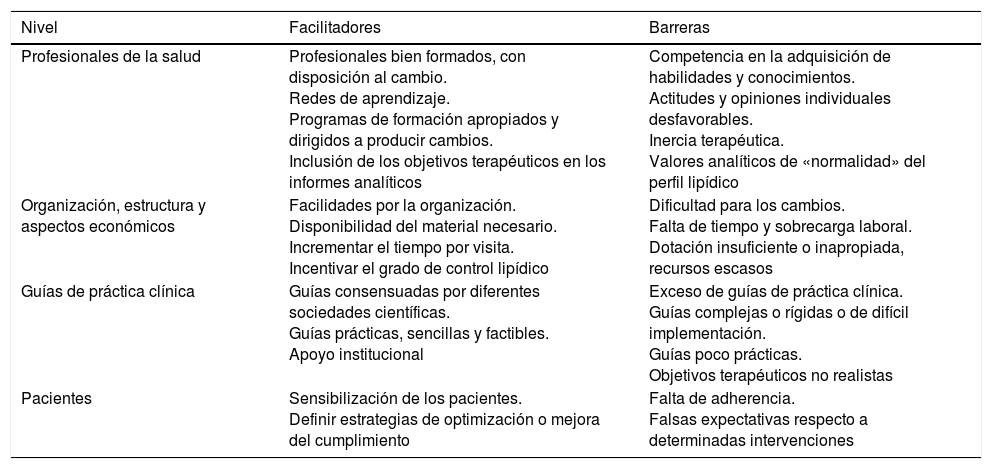
Existen circunstancias que facilitan o dificultan la consecución de los objetivos terapéuticos. La tabla 10 resume los principales facilitadores y las barreras más frecuentes para conseguir los objetivos terapéuticos, agrupados según las áreas de trabajo en que concurren22,23.
Barreras y facilitadores en la consecución de los objetivos terapéuticos
| Nivel | Facilitadores | Barreras |
|---|---|---|
| Profesionales de la salud | Profesionales bien formados, con disposición al cambio. Redes de aprendizaje. Programas de formación apropiados y dirigidos a producir cambios. Inclusión de los objetivos terapéuticos en los informes analíticos | Competencia en la adquisición de habilidades y conocimientos. Actitudes y opiniones individuales desfavorables. Inercia terapéutica. Valores analíticos de «normalidad» del perfil lipídico |
| Organización, estructura y aspectos económicos | Facilidades por la organización. Disponibilidad del material necesario. Incrementar el tiempo por visita. Incentivar el grado de control lipídico | Dificultad para los cambios. Falta de tiempo y sobrecarga laboral. Dotación insuficiente o inapropiada, recursos escasos |
| Guías de práctica clínica | Guías consensuadas por diferentes sociedades científicas. Guías prácticas, sencillas y factibles. Apoyo institucional | Exceso de guías de práctica clínica. Guías complejas o rígidas o de difícil implementación. Guías poco prácticas. Objetivos terapéuticos no realistas |
| Pacientes | Sensibilización de los pacientes. Definir estrategias de optimización o mejora del cumplimiento | Falta de adherencia. Falsas expectativas respecto a determinadas intervenciones |
Una barrera muy importante para la consecución de objetivos terapéuticos es la inercia terapéutica. Por inercia terapéutica se entiende la tendencia a no iniciar o intensificar el tratamiento/la medicación aunque no se alcancen los objetivos terapéuticos. En un estudio realizado en el ámbito de la atención primaria en pacientes diabéticos se observó que el mayor grado de inercia terapéutica correspondió al control del cLDL (86,4%). Esta inercia se produjo especialmente en pacientes en los que, a pesar de no alcanzar el objetivo de control, no se inició tratamiento farmacológico; la inercia terapéutica también fue patente en pacientes a los que no se les intensificó el tratamiento24.
Existen otros factores que constituyen una barrera en la consecución de objetivos terapéuticos. En una encuesta realizada a 1.390 médicos de familia del estado español, un 81% de los mismos indicó que la falta de tiempo en las consultas era la barrera más importante para evaluar el riesgo cardiovascular25. Así mismo, un 71% de los médicos consideró que la barrera más transcendental para la implementación de las recomendaciones de las guías fue, paradójicamente, el exceso de guías de práctica clínica con falta de acuerdo entre diferentes recomendaciones. Finalmente, un 50% de los encuestados opinó que los objetivos terapéuticos no eran realistas.
Conclusiones del documento de consenso(Recomendaciones para el informe de laboratorio)El médico clínico debería fijar sus objetivos terapéuticos basándose en las guías más recientes para el control de la dislipemia13. Pero no siempre es fácil recordar en la consulta todas las recomendaciones que establecen las guías para las diferentes categorías de riesgo cardiovascular y las concentraciones de lípidos que constituyen los objetivos terapéuticos.
Los laboratorios clínicos tienen un papel fundamental para alertar e informar tanto al médico clínico como al propio paciente sobre los resultados anormales o que no alcanzan los objetivos del perfil lipídico. La reciente guía de la EAS y la European Federation of Clinical Chemistry and Laboratory Medicine12 ha sugerido la adopción de cifras comunes, homogéneas en todos los laboratorios para dichas alertas. El laboratorio clínico debería resaltar en su informe analítico los valores que se reflejan en la tabla 11.
Valores a resaltar en el informe analítico por el laboratorio clínico
| Lípido | Valor | Observación |
|---|---|---|
| Colesterol total | ≥5,2 mmol/l (200 mg/dl) | |
| Triglicéridos | ≥1,7 mmol/l (150 mg/dl) | En muestras obtenidas en ayunas |
| ≥2,0 mmol/l (175 mg/dl) | En muestras obtenidas sin ayuno de 8 a 10h | |
| ≥ 5,0 mmol/l (440 mg/dl) | En cualquier condición; indicar la necesidad de repetir la analítica con ayuno de 12h (si procede) | |
| Colesterol LDL | Las alertas dependerán de si se conoce la categoría de riesgo cardiovascular en cuyo caso se reportarán valores superiores a: 1,81 mmol/l (70 mg/dl) si la categoría de riesgo CV es «muy elevado» 2,58 mmol/l (100 mg/dl) si la categoría de riesgo CV es «elevado» 3,36 mmol/l (130 mg/dl) si la categoría de riesgo CV es «moderado» 4,13 mmol/l (160 mg/dl) si la categoría de riesgo CV es «bajo» | |
| Colesterol no-HDL | Ídem que para cLDL; las alertas dependerán de la categoría de riesgo CV en cuyo caso los límites serán los mismos que para cLDL + 0,77 mmol/l (30 mg/dl) | |
| Apolipoproteína B | <0,8 a 1,0 g/l; (80-100 mg/dl) | |
| Colesterol HDL | ≤1,03 mmol/l (40 mg/dl), hombres ≤1,24 mmol/l (50 mg/dl), mujeres | |
| Lipoproteína(a) | ≥500 mg/l (50 mg/dl) | |
Para muestras obtenidas en cualquier condición, el laboratorio debe alertar tan rápidamente como sea posible si se detectan: triglicéridos ≥ 10,0 mmol/L (880 mg/dL) por el riesgo de pancreatitis.
Los autores declaran no tener ningún conflicto de intereses.