La pandemia por el nuevo virus SARS-CoV-2 ha provocado un proceso de adaptación a la nueva situación por parte de toda de la sociedad y, con ello, los centros de reproducción asistida. Tras la fase aguda de la crisis sanitaria, en la que se redujo de forma drástica la actividad, se han reanudado los ciclos, guiados por las recomendaciones de las sociedades científicas.
En este artículo revisamos toda la información publicada respecto al virus y el sistema reproductivo, señalando la presencia de enzima convertidora de angiotensina tipo ii(angiotensin-converting enzyme 2, ACE2) en el sistema reproductivo femenino y masculino, a nivel testicular, ovárico, endometrial y a nivel embrionario. Además, realizamos un análisis comparativo entre las recomendaciones de las sociedades científicas en cuanto al cribado de la infección, las normas de funcionamiento y las medidas generales de laboratorio.
The pandemic caused by the new SARS-CoV-2 virus has led to a process of adaptation to the new situation by society as a whole and, therefore, by assisted reproduction centres. After the acute phase of the health crisis, when activity was drastically reduced, cycles have resumed, guided by the recommendations of scientific societies.
In this article, a review is presented of all the published information regarding the virus and the reproductive system, pointing out the presence of angiotensin-converting enzyme 2 (ACE2) in the female and male reproductive system, at the testicular, ovarian, endometrial and embryonic levels. In addition, a comparative analysis is carried out between the recommendations of the scientific societies regarding the screening of infection, performance standards, and general laboratory measurements.
El 31 de diciembre de 2019, la Comisión Municipal de Salud y Sanidad de Wuhan (provincia de Hubei, China) informó sobre un agrupamiento de casos de neumonía de etiología desconocida en la ciudad de Wuhan. Posteriormente, las autoridades chinas identificaron como agente causante del brote un nuevo tipo de virus de la familia Coronaviridae, que fue llamado «nuevo coronavirus», SARS-CoV-2.
A finales de enero de 2020 el brote en China fue declarado una urgencia de salud pública de importancia internacional por la Organización Mundial de la Salud (OMS). Poco tiempo después, el brote se extendió fuera de las fronteras chinas, afectando otros países, muchos de ellos en Europa. El brote en Italia afectó un porcentaje elevado de población y, a partir de ahí aparecieron un número creciente de casos en todo el mundo. El 11 de marzo de 2020 la OMS declaró la pandemia1.
Los sistemas de salud, durante estos meses, destinaron sus recursos a luchar contra la pandemia, limitando los procedimientos no urgentes o electivos. Estas medidas fueron cruciales no solo para permitir a hospitales e instalaciones médicas tratar el aumento explosivo de pacientes con la infección por SARS-CoV-2 (denominada COVID-19), sino también para reducir la transmisión de la enfermedad mediante estrategias de mitigación, especialmente individuales (el aislamiento). Este cambio radical en la práctica médica tuvo un enorme impacto, lo que llevó a las distintas sociedades científicas y autoridades sanitarias nacionales a interrumpir los servicios de atención a la fertilidad y la realización de técnicas de reproducción asistida (TRA)2.
La Federación Internacional de Sociedades de Fertilidad (International Federation of Fertility Societies, IFFS) recomendó el 12 de marzo de 2020 valorar cuidadosamente la continuación de los tratamientos3. La Sociedad Europea de Reproducción y Embriología Humana (European Society of Human Reproduction and Embriology, ESHRE) emitió una declaración el 14 de marzo de 2020 aconsejando aplazar el embarazo criopreservando los ovocitos o embriones, posponiendo la transferencia4.
El mismo 14 de marzo de 2020 el Gobierno de España declaró el Estado de Alarma, con el cierre de los establecimientos y el confinamiento de la sociedad. Un día más tarde, la Sociedad Española de Fertilidad (SEF) publicó un comunicado en el que se recomendaba, hasta que se eliminara el Estado de Alarma, terminar los ciclos de fecundación in vitro (FIV) iniciados, no iniciar nuevos ciclos, realizar todas las transferencias previstas en fresco de forma diferida, no realizar transferencias de embriones vitrificados, así como cancelar la actividad de programas de inseminación5.
Posteriormente, el 17 de marzo de 2020 la Sociedad Americana de Medicina Reproductiva (American Society for Reproductive Medicine, ASRM) se sumó a las recomendaciones de las otras sociedades científicas, aconsejando finalizar los tratamientos iniciados, evitar realizar transferencias embrionarias y favorecer los servicios de telemedicina durante los primeros días de la pandemia para evitar colocar cargas adicionales en los sistemas de atención médica estresados6.
Actualmente, en España nos encontramos en un momento en el que la curva de la pandemia presenta una disminución progresiva de diagnósticos, ingresos en unidades de cuidados intensivos y muertes diarias. Todo ello permite una progresiva recuperación de la actividad de la sociedad y del sistema sanitario. Pero es en esta etapa donde existe la posibilidad de posibles nuevos rebrotes de la pandemia debido a la convivencia de población inmunológicamente protegida con la que no lo está. Es decir, la sociedad, especialmente la práctica médica, ha de reiniciar la actividad manteniendo unas medidas de seguridad determinadas y además realizando un cribado tanto de pacientes, como de personal sanitario.
El virus SARS-CoV-2 y la enfermedad COVID-19 son entidades de nueva aparición, con una afectación amplia de la población en un tiempo de evolución muy corto. El conocimiento al respecto ha ido incrementándose de una forma exponencial en las últimas semanas, no tan sólo desde el punto de vista del propio virus sino también de los efectos del mismo en el organismo humano. Pronto aparecieron publicaciones respecto al virus y la gestación y, en menor proporción, a la posible afectación en momentos del proceso reproductivo. El objetivo de este artículo se centra en la revisión de las publicaciones realizadas hasta el momento en relación a la posible afectación del SARS-CoV-2 sobre los órganos reproductivos y la fertilidad humana.
MetodologíaSe ha realizado una búsqueda extensa y exhaustiva de la literatura publicada hasta el momento, relacionada con la reproducción humana y la infección por SARS-CoV-2 o la enfermedad COVID-19. Dadas las circunstancias actuales de pandemia, el desconocimiento de la enfermedad y el avance del número de publicaciones diarias se ha recurrido también a la búsqueda en el portal Medrxiv, en los que podemos hallar informes preliminares de trabajos que no han sido certificados por revisión por pares y publicados de forma definitiva. Se adjuntan también diversas publicaciones en formato electrónico, pendientes de publicación definitiva. Esta anotación es importante a la hora de tener en cuenta la calidad y validez de los artículos seleccionados.
Se ha realizado la revisión de un total de 53 artículos científicos y documentos localizados en páginas web de instituciones sanitarias gubernamentales, Pubmed.gov y Medrxiv.org. Se han utilizado las siguientes palabras clave: SARS-CoV-2, COVID-19, human reproductive system, semen, seminal fluid, testis, uterus, folicular fluid, cummulus cells y embryos.
Fisiopatología del SARS-CoV-2La transmisión de este nuevo coronavirus, un virus ARN, ocurre predominantemente a través de gotitas respiratorias, durante el contacto entre personas, y comparte más del 80% de su secuencia de nucleótidos con su pariente más cercano, el virus SARS-CoV, responsable de la epidemia de SARS de 2002-20037-9. El virus SARS-CoV-2 penetra en la célula utilizando como receptor a la enzima convertidora de angiotensina tipo II (ACE2) asociada a la superficie del huesped10,11. Esta enzima, implicada en la regulación negativa del sistema renina-angiotensina-aldosterona (RAS) y en el transporte de aminoácidos, juega un papel determinante en la fisiopatología del SARS-CoV y del SARS-CoV-2. Por consiguiente, aquellas células que expresan ACE2 serían susceptibles de ser infectadas por el SARS-CoV-212,13.
Parte del genoma del virus SARS-CoV-2 codifica proteínas estructurales esenciales. Entre ellas destacan las glicoproteínas de espiga (S), que son esenciales para la entrada en la célula huésped. La proteína S se divide en dos subunidades, S1 y S2. Mientras la subunidad S1 se une a la enzima ACE2, la S2 es activada por la proteasa transmembrana de serina 2 asociada a la superficie del huésped (TMPRSS2, por sus siglas en inglés). Juntas, estas acciones dan como resultado la fusión de la membrana viral a la célula huésped, liberándose el ARN viral en el citoplasma celular. Se sugiere que la presencia de ACE2 puede ser uno de los principales determinantes de la susceptibilidad de las células a la infección por SARS-CoV-2. Es plausible que la coexpresión de ACE2 y de TMPRSS2 sea necesaria para la entrada y replicación del virus en las células14.
La infección viral presenta un período de incubación de la enfermedad de cinco días de media (rango 2-14 días). En el curso de la enfermedad se ha descrito una primera fase de respuesta viral de la infección y, posteriormente, una fase de respuesta hiperinflamatoria. La clínica predominante es la respiratoria, aunque se ha observado la alteración de múltiples órganos y sistemas, e incluso clínica compatible con orquitis (tal y como se ha descrito en la infección por SARS-CoV)15,16. Respecto a la severidad, clasificamos a los pacientes en tres grupos:
- •
Casos que son asintomáticos o leves (80% de pacientes) con tos, fiebre y malestar general que se pueden manejar de forma ambulatoria.
- •
Casos graves (15%), que requerirán oxigenoterapia e ingreso hospitalario.
- •
Casos críticos (5%), que requerirán ingreso en las unidades de cuidados intensivos (UCI) y el uso de ventilación auxiliar mecánica17.
En pacientes con inmunosupresión, patología cardíaca, pulmonar, renal, hepática, sanguínea o metabólica se objetiva un incremento del riesgo de desarrollar insuficiencia respiratoria severa, neumonía, sepsis y muerte. A continuación, procedemos a revisar los datos referentes a la presencia de este virus y sus posibles efectos tanto en el sistema reproductor femenino como en el masculino.
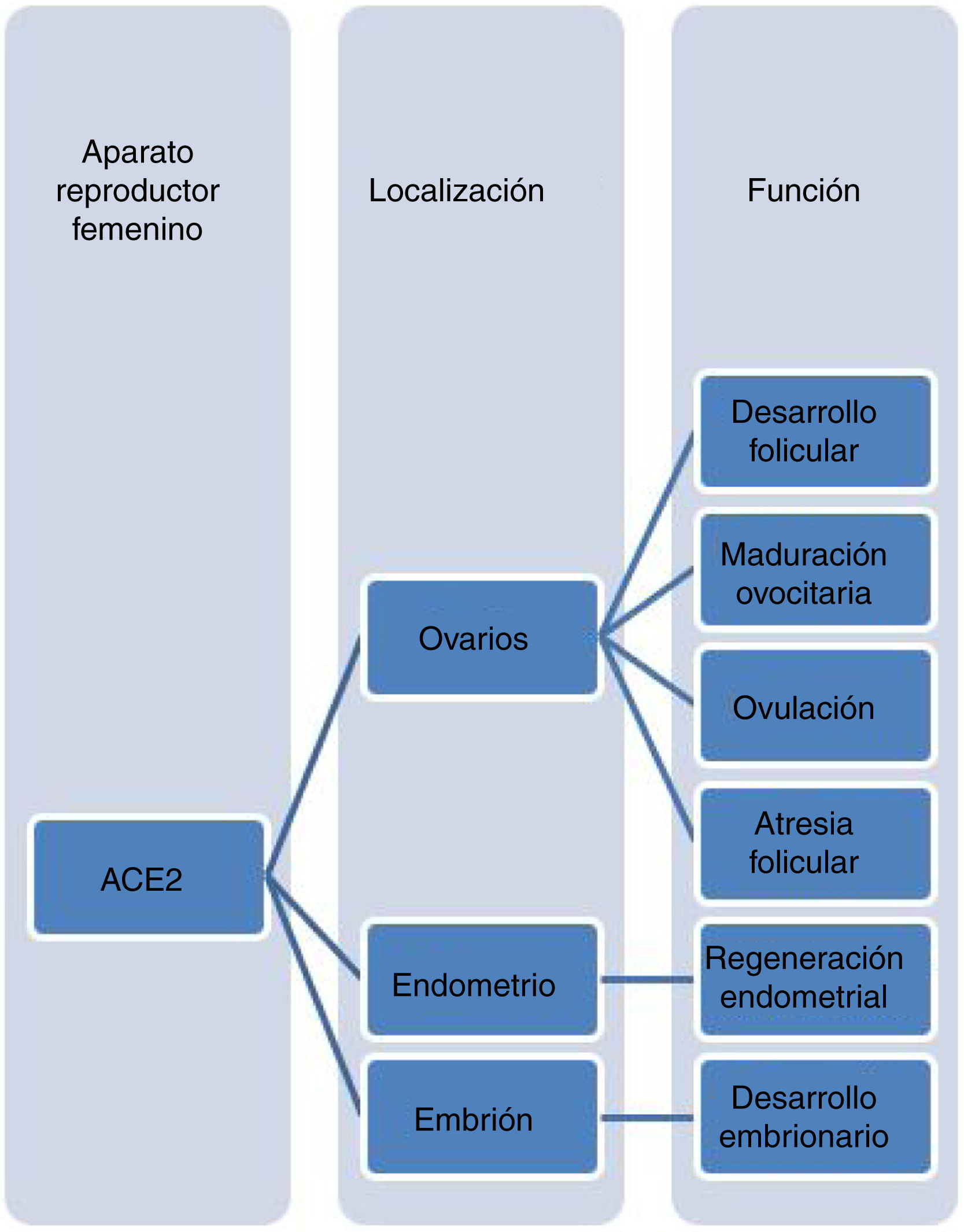
Coronavirus y función reproductiva femeninaExisten diversos artículos que estudian la distribución y función de la enzima ACE2 en el sistema reproductor femenino, en un intento por evaluar el efecto potencial del SARS-COV-2 sobre la fertilidad femenina. Es conocida la relación entre el sistema renina-angiotensina-aldosterona (RAS), mediado por ACE2, y el ovario. La presencia de ACE2 tiene un papel importante en la esteroidogénesis; de hecho, la expresión de ACE2 está regulada negativamente por los niveles de estradiol (E2). Tiene también relación a nivel de la foliculogénesis, la maduración ovocitaria, la ovulación y la atresia folicular. Por tanto, podría estar relacionada con la salud reproductiva18-20.
El estudio de Ding sugiere que los niveles hormonales de estrógenos (regulados por ACE2) podrían tener un efecto protector, basándose en estudios previos en experimentación animal, en los que los estrógenos disminuían la susceptibilidad y la gravedad del fenotipo para la infección por el virus SARS-CoV, mientras que la ovariectomía o el tratamiento con inhibidores del receptor de estrógenos aumentaban la mortalidad de las hembras de ratones. Estos estudios apuntarían a un hipotético papel protector por parte de los estrógenos en la infección por SARS-CoV, MERS-CoV y quizás también del SARS-CoV-2, aunque esta hipótesis está por comprobar21,22.
Por otra parte, la evidencia actual también describe la presencia ACE2 en útero y vagina; aunque, hasta la fecha, no se ha reportado la presencia del virus en el aparato reproductor femenino ni en las secreciones vaginales18,23. Se ha valorado la posibilidad de transmisión sexual del virus en un estudio reciente, que evaluaba una cohorte de pacientes infectadas en Wuhan. Concluyeron que no existe evidencia hasta el momento a este respecto; sin embargo, el riesgo de infección por vía respiratoria o de contacto durante el contacto íntimo en una pareja no debe ser ignorado. En último término, se desconoce si el virus SARS-CoV-2 emplearía los receptores ACE2 presentes y si, en caso de utilizarlos, tendría algún tipo de impacto sobre la calidad ovocitaria, el desarrollo embrionario y la gestación8,24.
ACE2 está también presente en el endometrio y en el embrión. A nivel endometrial, es más abundante en las células epiteliales que en las estromales, y su expresión es mayor en la fase secretora del ciclo menstrual. Parece ser que tendría un papel regulador en la regeneración del endometrio y la actividad miometrial18. Por otra parte, en un estudio reciente se evaluó si el virus SARS-CoV-2 podía afectar a embriones humanos, analizando la expresión de ACE2 y de la proteasa TMPRSS2 en embriones en diversos estadios del desarrollo. Hallaron la expresión de ambas en una proporción de células del epiblasto embrionario y, además, detectaron la presencia de otras proteínas clave en la endocitosis y replicación del virus en todas las fases del desarrollo embrionario25.
Por todo ello, parecería que la gónada femenina podría ser susceptible de ser afectada por el virus. Es especialmente interesante llegar conocer si el virus podría infectar gametos y embriones, y las posibles consecuencias sobre concepciones naturales o sobre embarazos generados mediante TRA26 (fig. 1).
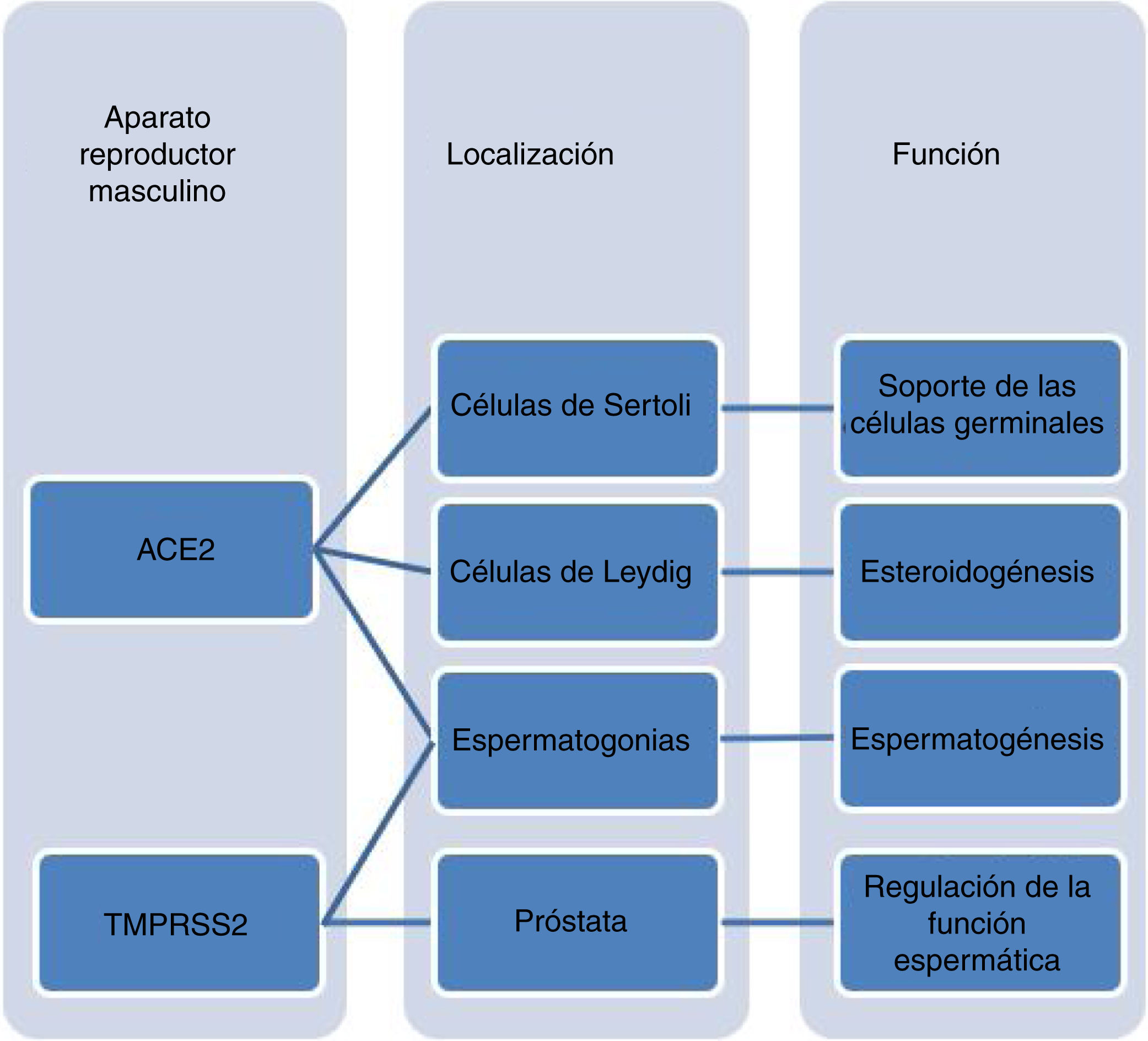
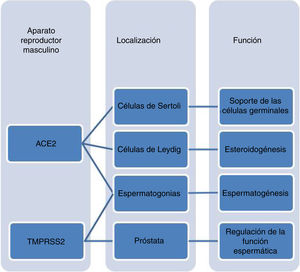
Coronavirus y función reproductiva masculinaLa enzima ACE2 parece desempeñar un papel clave en la espermatogénesis, ya que los niveles testiculares de esta enzima son significativamente inferiores en varones con defectos severos en la producción de espermatozoides, respecto a aquellos con espermatogénesis normal. Por otra parte, la presencia de ACE2 en las células somáticas del parénquima testicular sugiere que desempeñaría un papel importante en la regulación de la esteroidogénesis para la síntesis de andrógenos en las células de Leydig, modulando el desarrollo de las células germinales y condicionando la función reproductiva del varón27. De hecho, en un estudio de Schroeder et al. se realizó una valoración de las hormonas sexuales masculinas en una cohorte de pacientes en el momento del ingreso en la UCI, y destacó la presencia de niveles bajos de testosterona y dihidrotestosterona. Estos valores se relacionaban con niveles plasmáticos elevados de citocinas y con una mayor gravedad de la infección28. Ma et al., por su parte, confirmó estos hallazgos, observando una alteración en la proporción entre la testosterona y la hormona luteinizante (LH) o la hormona folículo-estimulante (FSH). Además, alertó de la necesidad de evaluar la función gonadal entre los pacientes recuperados de la infección por SARS-CoV-2, especialmente los hombres en edad reproductiva29.
Estudios recientes indican que el testículo constituye uno de los órganos del cuerpo humano que expresan ACE2 con mayor intensidad13,30. En este sentido, se ha confirmado que la expresión de ACE2 se muestra incrementada en determinados tipos celulares que residen en el compartimento testicular, predominantemente en espermatogonias, células de Leydig y células de Sertoli31. Resulta interesante resaltar que el porcentaje de espermatogonias que presentan expresión de ACE2 es similar al de células epiteliales alveolares de tipo ii (implicadas directamente en la patogénesis del SARS-CoV-2). Estos resultados coinciden con el estudio realizado por Liu et al. según el cual la distribución de ACE2 en el testículo se encuentra de forma generalizada tanto en células somáticas como en germinales, siendo las células de Sertoli la población celular que presenta un mayor nivel de expresión. Por tanto, sugieren que las células de Sertoli serían las más susceptibles a los efectos de la infección por el SARS-CoV-232.
Curiosamente, algunos autores han constatado que la expresión de ACE2 en el testículo disminuye en relación con el aumento de edad del varón. El máximo nivel de expresión de ACE2 se registra en individuos de 30 años, situación que se muestra revertida en los testículos de hombres de 60 años, dado que se observa el nivel más bajo de expresión de ACE232,33.
Respecto a la TMPRSS2, se encuentra altamente expresada en células epiteliales de la próstata. Su expresión está modulada por genes reguladores de andrógenos, siendo secretada en el líquido seminal en forma de vesículas extracelulares implicadas en la regulación de la función espermática34. En relación a su localización en el tejido testicular, se concentra principalmente en espermatogonias y espermátides, considerando la expresión de esta proteasa relativamente escasa en el resto de las poblaciones celulares estudiadas31.
Por otra parte, sabemos que algunas infecciones víricas, como el VIH, VHB o la parotiditis, pueden cursar con una afectación testicular ocasionando orquitis en algunos casos, así como posibles trastornos reproductivos a largo plazo35. Hasta la fecha no se ha podido establecer con seguridad si el SARS-CoV-2 puede dañar al testículo ni tampoco si los pacientes infectados presentan secuelas a nivel reproductivo. Sin embargo, existe evidencia sobre la relación entre miembros de la familia de coronavirus y la orquitis. Un estudio realizado tras la epidemia de 2002 por SARS-CoV, puso de manifiesto que la orquitis es una complicación del SARS y que la producción espermática puede verse afectada tras la infección. Xu et al. analizaron los testículos de seis pacientes fallecidos por SARS, encontrando destrucción de células germinales de forma difusa, disminución o ausencia de espermatozoides en los túbulos seminíferos, adelgazamiento de la membrana basal e infiltración leucocitaria. Aunque no hallaron material genético del virus en el tejido testicular, observaron abundante deposición de IgG en el epitelio de los túbulos seminíferos, sugiriendo una posible respuesta inflamatoria local a la infección como responsable de la lesión36. Además, resulta interesante destacar que, en un estudio reciente, se ha descrito molestia en la zona gonadal sugestivo de inflamación testicular hasta en un 19% de pacientes con COVID-19. Sin embargo, no se llevaron a cabo exploraciones andrológicas complementarias y el diagnostico de orquitis no pudo ser confirmado16.
Puesto que está demostrado que la orquitis es una complicación del SARS, y dado que el SARS-CoV y el SARS-CoV-2 comparten gran parte de su secuencia genética y utilizan el mismo receptor para su internalización y replicación celular, Cardona Maya et al. plantean en su revisión que sería razonable pensar que el SARS-CoV-2 podría ser transmitido a través del semen, postulando una nueva ruta de transmisión de dicho patógeno37.
En ese sentido, es bien conocida la capacidad de una gran variedad de virus de atravesar la barrera hemato-testicular y tener la capacidad de transmisión por vía sexual a través de las secreciones seminales38. La magnitud de la epidemia causada por el SARS-CoV-2 ha suscitado gran interés científico para determinar si el virus podría permanecer en el semen y tratar de elucidar si existe un riesgo de transmisión sexual. En un primer momento, se estudió si el virus podía encontrarse en el eyaculado de pacientes recuperados tras la infección. Pan et al. evaluaron la presencia de ARN vírico mediante qRT-PCR en una muestra seminal de 34 pacientes con sintomatología moderada obtenida tras una media de 31 días (intervalo comprendido entre 9 y 75 días) desde el momento del diagnóstico, descartando la presencia de SARS-CoV-2 en todas las muestras estudiadas16. En la misma línea, Song et al. tampoco lograron detectar el virus ni en el semen de 11 pacientes sintomáticos y asintomáticos recuperados ni en el tejido testicular de un paciente fallecido durante la fase aguda de la infección39. Un estudio adicional, tampoco halló la presencia del virus en el semen de un paciente transcurridos ocho días desde la confirmación del diagnóstico40. Por el contrario, una contribución muy reciente de Li et al. ha detectado la presencia de material genético del virus en el semen de cuatro de 15 pacientes (26%) en fase aguda de la infección y de dos de 23 pacientes (8,7%) que se encontraban en estado convaleciente tras la infección por SARS-CoV-2. Sin embargo, dada la baja casuística y la disparidad de datos entre los trabajos publicados hasta fecha, conviene ser cauteloso en la interpretación de los resultados41. Serán necesarios nuevos estudios para confirmar estos últimos datos y, sobre todo, la capacidad infectiva del SARS-CoV-2 en el fluido seminal42,43.
Con base en todo lo expresado con anterioridad, el testículo se postula como una posible diana del SARS-CoV-2. En este sentido, el hipotético daño testicular estaría causado bien por infección directa en las células que presentan receptores ACE2, o como consecuencia de una respuesta inflamatoria local secundario a la infección. En ambos casos, la afectación gonadal podría producir alteraciones en la espermatogénesis y en la función endocrina testicular, y estar asociada a un mayor riesgo de infertilidad, especialmente en los pacientes en edad reproductiva que padecen la enfermedad. Desafortunadamente, todavía no existen estudios en la literatura que hayan valorado si la calidad seminal puede verse comprometida en pacientes que hayan superado la enfermedad44 (fig. 2).
Recomendaciones de las sociedades científicas: manejo clínico y de laboratorioLa interrupción de los tratamientos de fertilidad no emergentes fue absolutamente necesaria y justificada durante el período más crítico de la pandemia. Posteriormente, considerando que la infertilidad es una enfermedad y el cuidado de la misma debe considerarse como un elemento del servicio médico esencial, las distintas sociedades fueron emitiendo recomendaciones de cara a reanudar progresivamente la actividad de los centros de reproducción humana asistida45.
A mediados de abril de 2020 la SEF emitió un documento de opinión solicitando la valoración del reinicio de la actividad en los centros de reproducción asistida con adaptación a las medidas de seguridad vigentes y con el escalonamiento asistencial que se considere adecuado por parte de las autoridades sanitarias. Posteriormente, dicha sociedad, junto con la Asociación para el Estudio de la Biología de la Reproducción (ASEBIR), publicaron la primera guía de recomendaciones para la seguridad y reducción de riesgos ante la infección por SARS-CoV-2 en las unidades de reproducción asistida46. Se publicó, más adelante, una segunda versión del documento, en el que se ampliaban y especificaban las recomendaciones respecto a la seguridad en el manejo y evaluación de pacientes, la bioseguridad y la protección del personal sanitario47; y una tercera versión muy recientemente, que incluyó criterios de exclusión temporales (obesidad y comorbilidades)48. Tanto la ESHRE49 como la ASRM han ido actualizando las recomendaciones a medida que avanzaba la pandemia (Actualización #1 a #4)50.
El 29 de mayo de 2020, tres sociedades científicas de medicina reproductiva emitieron un documento: Declaración conjunta de COVID-19 y reproducción humana: ASRM/ESHRE/IFFS, en la que señalaban que «la reproducción es un derecho humano esencial que existe independientemente de la raza, el género, la orientación sexual o el país de origen». Las tres sociedades afirman conjuntamente que los esfuerzos de mitigación han sido un éxito, destacando la importancia de continuar con la atención reproductiva durante la pandemia, y reanudando de forma progresiva y selectiva esta atención médica51.
A continuación, exponemos las principales recomendaciones a seguir respecto al manejo clínico y de laboratorio en los centros de reproducción asistida:
Recomendaciones clínicasCribado de los pacientes. Realizado mediante checklist clínico, test serológicos o por PCR. No existe un criterio único. Esto se explica debido a que ningún test alcanza el 100% de fiabilidad, además de la necesidad de poner estas pruebas a punto ante el diagnóstico de un virus nuevo. Sin embargo, sí hay acuerdo en la necesidad de realizar un cribado a las pacientes antes de realizar técnicas de reproducción asistida para conseguir una gestación.
En la siguiente tabla especificamos las recomendaciones de las sociedades científicas en cuanto al cribado para SARS-CoV-2 (tabla 1).
Recomendaciones de cribado sistemático para SARS-CoV-2 según las principales sociedades científicas
| SEF/ASEBIR | ESHRE | ASRM | |
|---|---|---|---|
| Cribado SARS-CoV-2 | - Cribado telefónico de síntomas previa visita.- PCR/cribado serológico previa PF y TE. Si es +, valorar suspender tratamiento.- Valorar cribado sistemático en varones (no estrictamente necesario). | - Cribado de síntomas dos semanas antes del inicio TRA y durante tratamiento a ambos miembros de la pareja.-Si sospecha: PCR y/o cribado serológico. | - Cribado de síntomas y verificación de la temperatura corporal antes de acceder a las instalaciones. |
PF: punción folicular; TE: transferencia embrionaria.
Es importante tener en cuenta una buena valoración de los resultados de los test de cribado (tabla 2).
Criterios de priorización. Tanto la ASRM como la SEF, en la misma línea que algunos artículos de opinión, contemplan un empeoramiento de los resultados reproductivos más marcado en determinas circunstancias como serían las pacientes de edad avanzada, o aquellas con disminución de la reserva ovárica o las pacientes con endometriosis52,53. Por otra parte, las tres sociedades médicas aconsejan excluir temporalmente a pacientes con comorbilidades como la obesidad mórbida, diabetes tipo i o ii mal controlada, hipertensión, transplante anterior, terapia inmunosupresora, enfermedad pulmonar, hepática o renal.
Otros aspectos relevantes en la realización de TRA a considerar serían: evitar especialmente la posibilidad de desarrollar síndrome de hiperestimulación ovárica, uso amplio de programa de criopreservación y segmentación de los ciclos, así como el tener presente el estado de hipercoagulabilidad relativa que puede ir asociado a una estimulación ovárica y posteriormente la gestación.
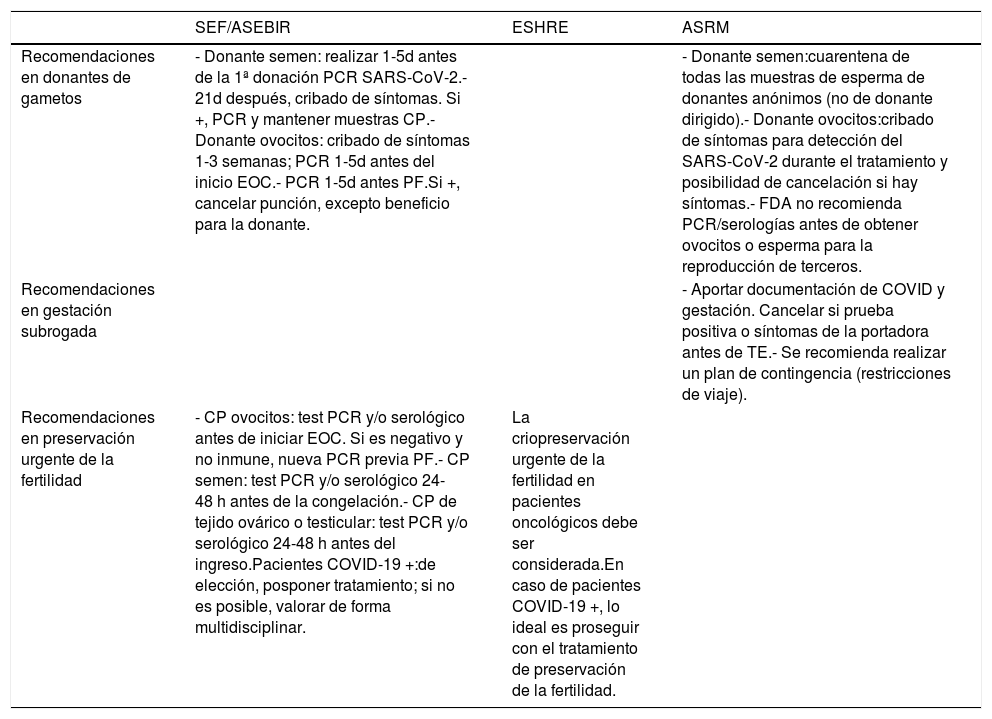
Finalmente, determinadas situaciones específicas, como los casos de donación de gametos, preservación de la fertilidad o gestación subrogada, que han sido abordados también por las diferentes organizaciones médicas profesionales, dependiendo, como es lógico, de la legislación vigente y del conocimiento científico actual (tabla 3).
Recomendaciones de las principales sociedades en situaciones específicas
| SEF/ASEBIR | ESHRE | ASRM | |
|---|---|---|---|
| Recomendaciones en donantes de gametos | - Donante semen: realizar 1-5d antes de la 1ª donación PCR SARS-CoV-2.- 21d después, cribado de síntomas. Si +, PCR y mantener muestras CP.- Donante ovocitos: cribado de síntomas 1-3 semanas; PCR 1-5d antes del inicio EOC.- PCR 1-5d antes PF.Si +, cancelar punción, excepto beneficio para la donante. | - Donante semen:cuarentena de todas las muestras de esperma de donantes anónimos (no de donante dirigido).- Donante ovocitos:cribado de síntomas para detección del SARS-CoV-2 durante el tratamiento y posibilidad de cancelación si hay síntomas.- FDA no recomienda PCR/serologías antes de obtener ovocitos o esperma para la reproducción de terceros. | |
| Recomendaciones en gestación subrogada | - Aportar documentación de COVID y gestación. Cancelar si prueba positiva o síntomas de la portadora antes de TE.- Se recomienda realizar un plan de contingencia (restricciones de viaje). | ||
| Recomendaciones en preservación urgente de la fertilidad | - CP ovocitos: test PCR y/o serológico antes de iniciar EOC. Si es negativo y no inmune, nueva PCR previa PF.- CP semen: test PCR y/o serológico 24-48 h antes de la congelación.- CP de tejido ovárico o testicular: test PCR y/o serológico 24-48 h antes del ingreso.Pacientes COVID-19 +:de elección, posponer tratamiento; si no es posible, valorar de forma multidisciplinar. | La criopreservación urgente de la fertilidad en pacientes oncológicos debe ser considerada.En caso de pacientes COVID-19 +, lo ideal es proseguir con el tratamiento de preservación de la fertilidad. |
EOC: estimulación ovárica controlada; CP: criopreservación; TE: transferencia embrionaria.
En cuanto a las normas de funcionamiento en los centros de reproducción humana asistida se recomiendan una serie de pautas:
- •
La firma, por parte de los pacientes, de un consentimiento informado sobre los riesgos específicos de la COVID-19, aceptando la posibilidad de cambios en el tratamiento, incluso la cancelación del mismo, si aparecen síntomas respiratorios.
- •
Se aconseja, además, reflejar esta información claramente en la historia clínica del paciente.
- •
Restringir el número de acompañantes por visita, recomendando las visitas telemáticas siempre que sean posibles.
- •
Instruir a los pacientes sobre las medidas de higiene, distanciamiento social y la necesidad de comunicación de cualquier cambio en el estado de salud.
En consideración a la protección del personal sanitario las distintas guías clínicas aconsejan:
- •
Realizar teletrabajo siempre que sea posible.
- •
La formación a los trabajadores en cuanto a prácticas de seguridad.
- •
Protocolos específicos de limpieza y desinfección; así como proporcionar el material de protección necesario.
- •
Se acepta la posibilidad de cribado sistemático al personal sanitario, pero se debe considerar la validez temporal de los resultados y el valor predictivo de los test serológicos.
Los documentos de la ESHRE y la SEF puntualizan, además: intentar reducir los momentos de interacción personal entre trabajadores y organizar grupos de trabajo diferenciados que garanticen la continuidad de la asistencia en caso de contagio de un grupo.
Recomendaciones de laboratorioComo norma general, para el tratamiento del material biológico de pacientes infectados por SARS-CoV-2 se requieren medidas de contención biológica de nivel 2 para procedimientos que no impliquen la concentración del virus. El nivel 2 de contención es aplicable a los procedimientos que se realizan habitualmente en los laboratorios de los centros de reproducción asistida, lo cual los hace estar preparados para afrontar este patógeno que, en definitiva, es fundamentalmente un virus de transmisión respiratoria. No obstante, siguiendo las recomendaciones publicadas por las sociedades científicas de referencia en medicina reproductiva, se aplicarán, de forma resumida, las medidas de actuación que se resumen a continuación48.
Medidas generales de laboratorio:
- •
Cumplimiento de las normas de higiene y técnicas antisépticas.
- •
Uso de ropa protectora adecuada, gorro y guantes sin polvo y mascarillas quirúrgicas.
- •
Uso de campanas de flujo laminar vertical y dispositivos de pipeteo mecánico.
- •
Eliminación inmediata de los consumibles de un solo uso en contenedores de residuos adecuados.
- •
Mantener precauciones y procedimientos habituales para evitar la contaminación entre muestras crioalmacenadas. Usar guantes criogénicos y máscara de protección.
En casos específicos de BAJO RIESGO (cribado negativo o prueba negativa) se recomienda:
- •
Uso de guantes y mascarilla quirúrgica si CSBII o cabina cerrada; centrífuga con tapas antiaerosoles; mascarilla FFP2 y gafas si no se dispone de CSBII o cabina cerrada y centrífuga con tapas antiaerosoles; y siempre saneamiento tras realizar el procedimiento.
Se crioconservarán las muestras en tanques criogénicos habituales siempre que el resultado de la prueba serológica sea negativo. En caso de no realizar cribado serológico o molecular a los pacientes, se recomienda o bien mantener las muestras criopreservadas en tanques de nitrógeno líquido en fase de vapor, o bien en contenedores separados, siempre con la finalidad de minimizar el riesgo de contaminación cruzada.
En casos de ALTO RIESGO (cribado positivo o prueba positiva) se recomienda:
- •
Uso de guantes y mascarilla quirúrgica si CSBII o cabina cerrada; centrífuga con tapas antiaerosoles; mascarilla FFP2 y gafas si no se dispone de CSBII o cabina cerrada y centrífuga con tapas anti-aerosoles; disociación temporal; uso de un incubador independiente; eliminación específica de residuos y desinfección exhaustiva tras el procedimiento.
Las muestras criopreservadas deberán almancenarse en tanques independientes. En el caso de criopreservación de tejidos reproductores (tejido ovárico y testicular) se recomienda la utilización de tanques criogénicos específicos, independientemente del resultado del cribado y/o de las pruebas de cribado inmunológico a los pacientes.
Conclusiones- •
La pandemia por SARS-CoV-2 ha supuesto un desafío para el conjunto de la sociedad y la práctica médica. No sólo en la fase más aguda y dramática si no también en la del reinicio y retorno a la actividad programada.
- •
El conocimiento de la fisiopatología del nuevo virus es rápido y exponencial. Sin embargo, hay que valorar con sentido crítico la diversidad de publicaciones aparecidas hasta el momento, debido a su calidad variable y que ha de consolidarse.
- •
Hay que profundizar en la posible afectación de la fertilidad femenina y su potencial afectación sobre gametos y embriones aunque, previsiblemente, no parece alta.
- •
Es importante la valoración de un posible daño testicular a largo plazo tras la infección.
- •
Las diferentes sociedades científicas profesionales han aportado guías de recomendaciones, en continua revisión y actualización.
- •
Es necesaria una valoración estricta de las pacientes teniendo en cuenta posibles factores de riesgo basales.
- •
Es aconsejable el cribado de las pacientes que inician un ciclo de TRA para conseguir una gestación.
- •
Los laboratorios de las clínicas de fertilidad han de estar preparados, con los niveles de bioseguridad adecuados, para afrontar potenciales casos positivos.
Los autores declaran no tener financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A tu, Dolors, perquè sense tú aquest article no exitiria tal i com és ara. Moltes gràcies per totes les correccions, trucades, ànims… gràcies!