Definimos acidosis láctica en presencia de pH<7,35, lactato en sangre >2,0mmol/l y PaCO2 <42mmHg. Por otro lado, la definición de acidosis láctica grave es controvertida. La causa principal de acidosis láctica grave es el estado de choque. La acidosis láctica por metformina es rara, pero alcanza una mortalidad del 50%. La acidosis metabólica, incluyendo a la acidosis láctica, puede recibir tratamiento específico o tratamiento general con bicarbonato de sodio, trihidroxiaminometano, carbicarb o hemodiafiltración continua. El éxito del tratamiento de la acidosis láctica yace en el control de la fuente etiológica; la terapia de reemplazo renal intermitente o continua está perfectamente justificada, y el argumento para decidir cuál utilizar es el estado de choque. Presentamos el informe de un caso de un paciente masculino con intoxicación por metformina como intento suicida, quien desarrolló acidosis láctica y falla orgánica múltiple; la base para el éxito del caso fue el tratamiento con hemodiafiltración continua.
Lactic acidosis is defined as the presence of pH<7.35, blood lactate>2.0mmol/L and PaCO2<42mmHg. However, the definition of severe lactic acidosis is controversial. The primary cause of severe lactic acidosis is shock. Although rare, metformin-related lactic acidosis is associated with a mortality as high as 50%. The treatment for metabolic acidosis, including lactic acidosis, may be specific or general, using sodium bicarbonate, trihydroxyaminomethane, carbicarb or continuous haemodiafiltration. The successful treatment of lactic acidosis depends on the control of the aetiological source. Intermittent or continuous renal replacement therapy is perfectly justified, shock being the argument for deciding which modality to use. We report a case of a male patient presenting with metformin poisoning as a result of attempted suicide, who developed lactic acidosis and multiple organ failure. The critical success factor was treatment with continuous haemodiafiltration.
La acidosis láctica se define como la presencia de pH <7,35, lactato en sangre >2,0mmol/l y PaCO2 <42mmHg. Por otro lado, la definición de acidosis láctica grave es controvertida. Muchos médicos asocian la gravedad de la acidosis láctica con pH<7,2 o ante efectos deletéreos principalmente hemodinámicos, lo que conlleva a tratamiento inmediato1-3. La causa principal de acidosis láctica grave es el estado de choque, que alcanza una mortalidad hasta del 50% a pesar del tratamiento etiológico adecuado y del 100% cuando el pH es menor a 7,04,5.
Sin embargo, una etiología poco común de la acidosis láctica es la intoxicación por metformina, la cual puede alcanzar una mortalidad del 50%. La incidencia es de 3 casos por cada 100.000 pacientes tratados por año. El principal factor de riesgo para que ocurra acidosis láctica por metformina es la lesión renal que acompaña al paciente diabético. La intoxicación voluntaria es poco habitual, y sus características y su pronóstico son pocas veces reportados en la literatura. Al parecer, los niveles de metformina en sangre no son determinantes en los resultados del paciente intoxicado por metformina, mientras que el lactato en sangre >15mmol/l, el pH<7,2, la disfunción orgánica (≥4puntos) y la actividad disminuida de la protrombina ≤50% se consideran factores de riesgo para mortalidad6,7. Presentamos el informe de un caso de un paciente intoxicado intencionalmente con metformina que evolucionó a disfunción orgánica múltiple y cuya base para la resolución del cuadro clínico fue la hemodiafiltración continua.
Caso clínicoSe presenta el caso de un paciente masculino de 74años de edad originario de la ciudad de Veracruz, México, con los antecedentes de diabetes mellitus tipo2 de 26años de diagnóstico, en tratamiento con metformina 850mg/día y glibenclamida 10mg/día, y diagnóstico de trastorno psiquiátrico tipo esquizofrenia con tratamiento irregular a base de olanzapina. Sin otros antecedentes de importancia. Inició cuadro clínico posterior a la ingesta intencionada de 20tabletas de metformina caracterizado por náusea, vómito y somnolencia; 24h más tarde se agregó al cuadro clínico epistaxis, diaforesis y pérdida del estado de alerta, motivo por el cual es llevado a valoración médica.
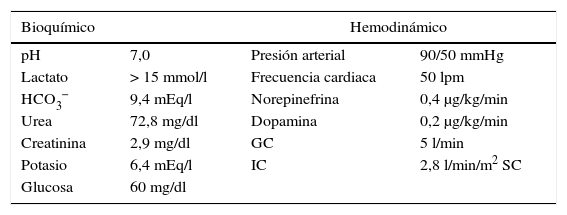
A su llegada a urgencias ameritó ventilación mecánica invasiva debido al estado neurológico, así como uso de vasopresor por inestabilidad hemodinámica; cursó con trastornos de ritmo cardiaco de tipo nodal. En los análisis sanguíneos iniciales destaca la presencia de hiperlactatemia >15mmol/l, hipoglucemia, hipercalemia y lesión renal aguda AKI3 (tabla 1).
Variables bioquímicas y hemodinámicas de ingreso hospitalario
| Bioquímico | Hemodinámico | ||
|---|---|---|---|
| pH | 7,0 | Presión arterial | 90/50 mmHg |
| Lactato | > 15 mmol/l | Frecuencia cardiaca | 50 lpm |
| HCO3− | 9,4 mEq/l | Norepinefrina | 0,4 μg/kg/min |
| Urea | 72,8 mg/dl | Dopamina | 0,2 μg/kg/min |
| Creatinina | 2,9 mg/dl | GC | 5 l/min |
| Potasio | 6,4 mEq/l | IC | 2,8 l/min/m2 SC |
| Glucosa | 60 mg/dl | ||
GC: gasto cardiaco; HCO3−: bicarbonato; IC: índice cardiaco; pH: logaritmo negativo de la concentración de hidrogeniones; SC: superficie corporal.
Fuente: autores.
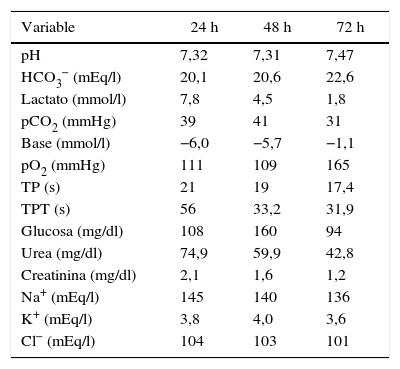
Fue ingresado en la unidad de cuidados intensivos (UCI) con el diagnóstico de acidosis láctica grave secundaria a intoxicación por metformina con score APACHEII de 25 puntos y SOFA de 9 puntos. Se inició terapia de reemplazo renal lenta continua (TRRLC) en hemodiafiltración con equipo Prisma-Flex®, misma que se proporcionó por 48h con dosis de efluente de 25ml/kg/h; con esto presentó mejoría clínica y de laboratorio caracterizado por disminución de los niveles de potasio, disminución de azoados, reversión de acidosis y depuración de lactato mayor del 50% en 24h y 90% a las 48h, lo que permitió la extubación, el retiro del vasopresor y el egreso de la UCI a las 72h (tabla 2). El paciente proporcionó autorización para el reporte de caso, así como la validación por parte del comité local de ética del hospital.
Comportamiento de las variables bioquímicas del paciente durante la TRRLC y al egreso de la UCI
| Variable | 24 h | 48 h | 72 h |
|---|---|---|---|
| pH | 7,32 | 7,31 | 7,47 |
| HCO3− (mEq/l) | 20,1 | 20,6 | 22,6 |
| Lactato (mmol/l) | 7,8 | 4,5 | 1,8 |
| pCO2 (mmHg) | 39 | 41 | 31 |
| Base (mmol/l) | −6,0 | −5,7 | −1,1 |
| pO2 (mmHg) | 111 | 109 | 165 |
| TP (s) | 21 | 19 | 17,4 |
| TPT (s) | 56 | 33,2 | 31,9 |
| Glucosa (mg/dl) | 108 | 160 | 94 |
| Urea (mg/dl) | 74,9 | 59,9 | 42,8 |
| Creatinina (mg/dl) | 2,1 | 1,6 | 1,2 |
| Na+ (mEq/l) | 145 | 140 | 136 |
| K+ (mEq/l) | 3,8 | 4,0 | 3,6 |
| Cl− (mEq/l) | 104 | 103 | 101 |
Cl−: cloro; HCO3−: bicarbonato; K+: potasio; Na+: sodio; pCO2: presión parcial de dióxido de carbono; pH: logaritmo negativo de la concentración de hidrogeniones; pO2: presión parcial de oxígeno; TP: tiempo de protrombina; TPT: tiempo parcial de tromboplastina.
Fuente: autores.
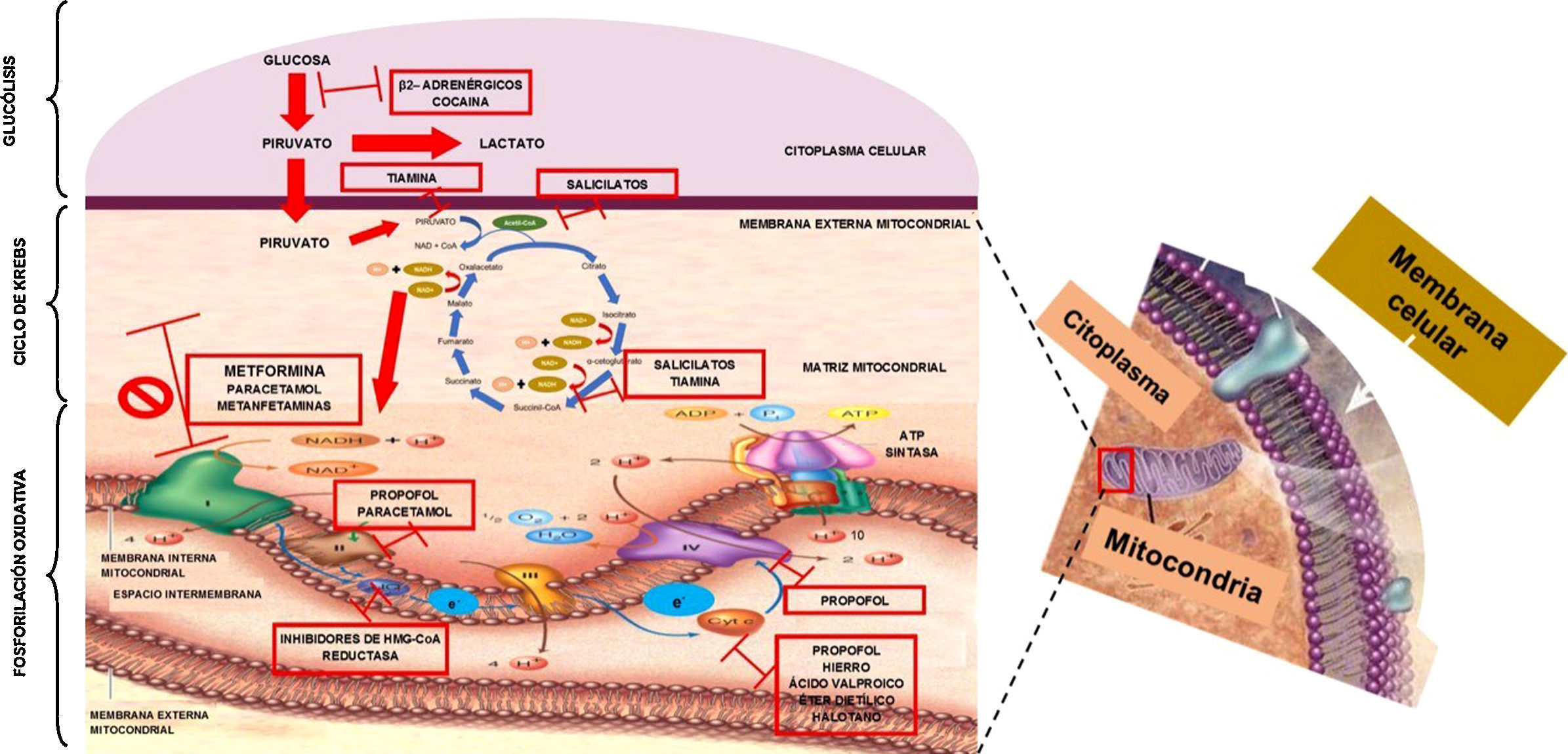
La metformina es una biguanida, y es el medicamento de primera elección para el control glucémico en pacientes con diabetes mellitus tipo2 por sus beneficios metabólicos y cardiovasculares8. Sus efectos adversos más frecuentes son de tipo gastrointestinal: náusea, vómito y diarrea; sin embargo, el efecto adverso más temido es la acidosis láctica7,9. El lactato derivado del piruvato es el producto final de la glucólisis en condiciones anaerobias. Producimos 1.500mmol de lactato al día (0,8mmol/kg/h) en tejidos como músculo esquelético (25%), piel (25%), eritrocitos (20%), cerebro (20%) e intestino (10%). Para mantener un equilibrio, el lactato necesita ser removido, y esto se logra en órganos como hígado (60%), riñones (30%), corazón y músculo esquelético (10%)10-12. Un desbalance, ya sea el aumento en su producción, la disminución en su remoción, o ambos, provocará un aumento sérico (normal <2mmol/l). El lactato como molécula se encuentra en forma de anión y no como ácido láctico; para que esto suceda, anteriormente se estipulaba que los hidrogeniones (H+) necesarios para convertirlo debían generarse por la hidrólisis de adenosín trifosfato (ATP) no utilizada en el citoplasma. Recientemente, a través de la teoría fisicoquímica de Stewart, se ha tratado de explicar la generación de acidosis láctica, en donde los cambios en el pH dependen de la presión parcial de dióxido de carbono (PCO2), de la concentración total de ácidos débiles no volátiles y la diferencia de iones fuertes (DIF), que es la diferencia entre cationes y aniones en el líquido extracelular (Na++K++Mg++Ca2+) − (Cl−+lactato−), es decir, un aumento de lactato disminuirá la DIF y a su vez el pH, generando o perpetuando la acidosis láctica13. Tradicionalmente, y de acuerdo con la clasificación de Cohen, la acidosis láctica se divide en hipoxémica tipoA y no hipoxémica tipoB14,15 (tabla 3).
Clasificación etiológica de las acidosis metabólicas
| Clasificación | Causas | |
|---|---|---|
| Tipo A | Hipoperfusión tisular | Estado de choque (circulatorio, séptico, cardiogénico y distributivo), insuficiencia respiratoria, anemia, isquemia mesentérica, ejercicio excesivo |
| Tipo B | B1. Enfermedad subyacente | SIRS, asma, insuficiencia hepática, insuficiencia renal, malignidad, hipofosfatemia severa, VIH |
| B2. Medicamentos y/o tóxicos | Metformina, paracetamol, alcoholes, agonistas β2 adrenérgicos, salicilatos, cianuro, CO, cocaína, retrovirales, propofol, halotano, isoniacida, linezolid, ácido valproico, deficiencia de tiamina, NP | |
| B3. Errores innatos del metabolismo | Deficiencia de glucosa-6-fosfatasa, deficiencia de fructosa-1, 6-difosfatasa, deficiencia de piruvato carboxilasa, síndrome de Pearson |
CO: monóxido de carbono; NP: nutrición parenteral; SIRS: síndrome de respuesta inflamatoria sistémica; VIH: virus de la inmunodeficiencia humana.
Fuente: autores.
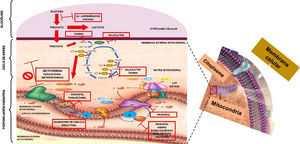
El mecanismo por el cual se produce la acidosis láctica se ha considerado multifactorial: por expresión genética, supresión de la oxidación metabólica y de enzimas del ciclo de Krebs16,17. Sin embargo, la más aceptada es la descrita por Owen et al.18, que reportan que la metformina afecta el transporte de electrones incrementando la concentración de nicotidamina adenina dinucleótido reducido o NADH+ e inhibe la oxidación metabólica, lo que induce metabolismo anaeróbico. Para comprender el mecanismo por el cual la intoxicación por metformina causa acidosis láctica tipo B2 es importante entender el proceso de la respiración celular. El ATP es la «moneda energética celular» por excelencia, indispensable para la función celular fisiológica. Para obtener esta moneda energética en un metabolismo aeróbico se necesita un proceso llamado «respiración celular», la cual se define como la generación de energía a partir de la oxidación de nutrientes. Esta respiración consta de tres etapas: glucólisis, ciclo del ácido cítrico (ciclo de Krebs) y fosforilación oxidativa. La glucólisis es un conjunto de reacciones enzimáticas cuya finalidad es convertir glucosa en dos moléculas de piruvato con producción de energía (2ATP +2NADH) en el citoplasma celular. Para iniciar el ciclo de Krebs se necesita que el piruvato entre en la matriz de la mitocondria, y al término del ciclo habrá más energía metabólica (2ATP +8NADH+ +2FADH2). Durante las vías de glucólisis y ciclo de Krebs se obtienen acarreadores de energía (NADH+ y FADH2) para que sean utilizados en la fosforilación oxidativa a través de los complejos mitocondriales, que tienen la función de movilizar electrones a través de ellos. Este proceso se inicia cuando el NADH+ se oxida a NAD+ y cede 2electrones al complejoi; estos se transportan entre los complejosii, iii, iv y llegan a la matriz mitocondrial para unirse a media molécula de oxígeno y a 2H+ para formar agua. Cada vez que los electrones atraviesan los complejos, bombean H+ hacia el espacio intermembranoso mitocondrial, generando un gradiente de protones en los complejosi (4H+), iii (4H+) yiv (2 H+), y este gradiente es nuevamente transportado hacia la matriz mitocondrial a través del complejo ATP sintasa para fosforilar el ADP y así generar 4moléculas de ATP, obteniendo un resultado de toda la respiración celular 38ATP (2ATP se utilizan como moneda de cambio para iniciar la glucólisis); en conclusión, las tres etapas de la respiración celular tienen como objetivo generar energía necesaria para mantener un metabolismo celular óptimo19-22 (fig. 1). Cuando por alguna razón no se sigue la vía aeróbica, se activará la vía anaeróbica para producir energía. En la sobredosis por metformina esta se une a las membranas mitocondriales, específicamente al complejoi, inhibiendo el sistema de transporte de electrones (fosforilación oxidativa); al no ser oxidado el NADH, este se acumula, hay un cambio hacia el metabolismo anaerobio, siguiendo a una mayor producción de lactato para tratar de generar energía necesaria para mantener las condiciones fisiológicas de la célula, pero esta es menor, generando solo 4 moléculas de ATP. Se acumula lactato en sangre, altera la DIF y produce acidosis láctica.
DiscusiónLa metformina es una molécula pequeña de 165dalton con una biodisponibilidad oral del 55% y un volumen de distribución de 1-5l/kg. Se elimina prácticamente sin cambios por los riñones, su aclaramiento corporal total en sujetos con función renal íntegra es de 500ml/min, con diálisis intermitente de 200ml/min y finalmente 50ml/min en pacientes con TRRLC. Las concentraciones terapéuticas son de 1,5-3,0mg/l. La semivida de eliminación es desde 8 a 20h en personas con función renal normal23-28.
Reconocer los factores de riesgo para desarrollar acidosis láctica como deterioro de la función renal o hepática, alcoholismo, disminución de la perfusión tisular por infección, edad mayor a 60años y falla cardiaca en pacientes con tratamiento a base de metformina, además de que el diagnóstico se realice de forma temprana y la terapia de reemplazo renal se inicie oportunamente, mejorará los resultados29,30. La gran mayoría de los pacientes que presentan acidosis láctica causada por metformina que ingresan en la UCI son mayores de 65años, presentan inestabilidad hemodinámica y lesión renal aguda31. La terapia de reemplazo renal intermitente o continua con hemodiafiltración para eliminar metformina y lactato en sangre es recomendada, argumentando correlación entre disminución de los niveles plasmáticos de metformina y mejoría de la acidosis láctica32.
La hipotensión se trata inicialmente con líquidos intravenosos, seguidos de vasopresor si es necesario. Para los pacientes con intoxicación por metformina la terapia extracorpórea con hemodiálisis es el tratamiento preferido siempre y cuando el paciente se encuentre hemodinámicamente estable. Aunque la evidencia es limitada respecto a la TRRLC, se prefiere en pacientes con inestabilidad hemodinámica por ser mejor tolerada que la hemodiálisis33. El grupo de trabajo de tratamientos extracorpóreos en envenenamientos (EXTRIP, por sus siglas en inglés), integrado por expertos internacionales que representan a diversas sociedades y especialidades, realiza recomendaciones respecto al tema. El tratamiento extracorpóreo está recomendado en intoxicación grave por metformina (1D), principalmente si el lactato es ≥15mmol/l, el pH≤7,0 y la terapia estándar (incluido el NaHCO3−) ha fallado (1D) o en presencia de choque (uso de vasopresores) o deterioro de la función renal (1D). El cese del tratamiento extracorpóreo está indicado cuando los niveles de lactato son menores a 3mmol/l y el pH es mayor a 7,35 (1D). La hemodiálisis intermitente siempre será la primera opción (1D), aunque la TRRLC se preferirá en presencia de inestabilidad hemodinámica del paciente (1D)34. La acidosis láctica causada por metformina versus otro origen tiene menor mortalidad (50% vs 74%) y mejor pronóstico, aunque el pH se encuentre por debajo de 7,035.
Por otra parte, el tratamiento de cualquier alteración del equilibrio ácido-base debe dirigirse a la causa subyacente. La acidosis tiene un efecto protector en las células anóxicas o isquémicas, pero esta protección se perderá en algún punto determinado que es controvertido (pH<7,2, HCO3− <10mEq o déficit de base >−10 mmol/l). La corrección de la acidosis podría condicionar, entre otras cosas, un efecto paradójico («perjuicio y no beneficio»). Tal vez la protección de la acidosis podría estar relacionada con un efecto «ahorrador» enzimático. El tratamiento de la acidosis metabólica debe ir dirigido a evitar la disfunción celular, la cual ocurrirá como consecuencia del incremento intracelular de los niveles de Na+ y Ca2+, situaciones propiciadas por las alteraciones en el pH intra y extracelular36.
Una estrategia controversial que no está del todo validada en el escenario clínico de acidosis láctica e inestabilidad hemodinámica, independientemente de la etiología, es el uso de bicarbonato de sodio (NaHCO3−). Esta medida es considerada como tratamiento puente mientras se instaura el tratamiento etiológico. Incluso las guías internacionales de la campaña sobreviviendo a la sepsis recomiendan el uso de NaHCO3− cuando el pH se encuentre menor o igual a 7,15 con el fin de mejorar el estado hemodinámico o reducir la cantidad de vasopresores del paciente con acidosis láctica inducida por hipoperfusión37. Recientemente se publicó un estudio de revisión que evaluó la administración de NaHCO3− en el tratamiento de acidosis láctica por sepsis, y se reportó que el empleo rutinario de NaHCO3− continúa siendo controversial, concluyendo que es necesario realizar más estudios para determinar un potencial beneficio38. La administración de NaHCO3− puede condicionar efectos secundarios, entre los que destacan incremento en la producción de dióxido de carbono (CO2) y disminución del calcio ionizado, que pueden contribuir a la disminución de la contractilidad ventricular y del tono vascular, además de un posible efecto paradójico por mejoría del pH extracelular pero no del pH intracelular (hipercapnia intracelular)39.
El empleo de NaHCO3− en el tratamiento de acidosis metabólica ha mostrado efectos benéficos en aquellas patologías donde existe evidencia de pérdida de HCO3−. En cambio, cuando ha sido usado para corregir acidosis metabólica de otras causas no se ha observado ningún beneficio40. Adicionalmente al uso de NaHCO3− como tratamiento, se ha planteado emplearlo como método de diagnóstico del origen de la acidosis metabólica, siendo propuesto como reto de bicarbonato, principalmente en pacientes con choque séptico y acidosis metabólica grave con alto riesgo de presentar complicaciones asociadas a la hipoperfusión, particularmente hepatitis hipóxica, entidad que suele presentarse cuando ha habido hipoperfusión prolongada, así como inflamación, hipoxemia e hipoxia. Por ello, sería prudente suponer que el diagnóstico certero y rápido del origen de la acidosis metabólica (hipoperfusión) puede facilitarnos el tratamiento dirigido más temprano o pensar de manera más temprana en otro origen de la acidosis (producción exógena de ácidos), con el fin de modificar nuestro enfoque diagnóstico y terapéutico41.
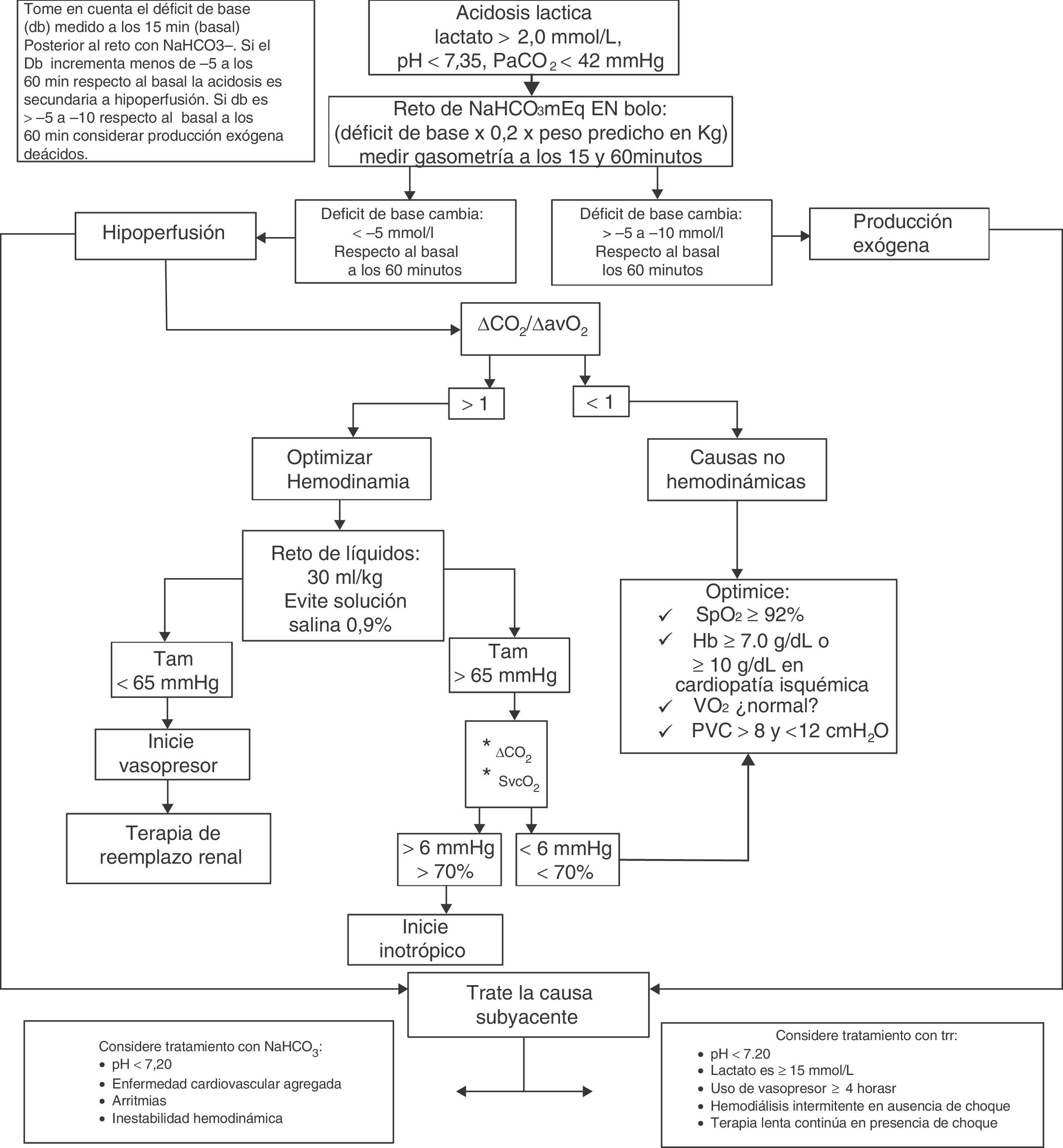
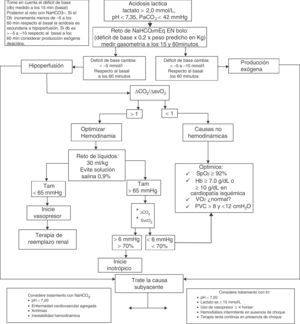
El algoritmo de manejo empleado en nuestra unidad de medicina crítica ante la acidosis láctica se muestra en la figura 2.
Algoritmo de diagnóstico y tratamiento para acidosis láctica. NaHCO3–: bicarbonato de sodio; pH: logaritmo negativo de la concentración de hidrogeniones; PaCO2: presión arterial de dióxido de carbono; ΔCO2: diferencia de dióxido de carbono; ΔCO2/ΔavO2: diferencia de dióxido de carbono entre diferencia arterio-venosa de oxígeno; TAM: tensión arterial media; SvcO2: saturación venosa central de oxígeno; SpO2: saturación periférica de oxígeno; Hb: hemoglobina; VO2: consumo de oxígeno; PVC: presión venosa central; TRR: terapia de reemplazo renal.
Fuente: autores.
La acidosis láctica es común en los pacientes críticamente enfermos y es correlacionada con gravedad y pronóstico. Sin embargo, la etiología de la acidosis láctica es determinante en los resultados. Diagnosticar el mecanismo y la causa de la acidosis láctica de manera rápida favorecerá al tratamiento dirigido de forma temprana. El éxito del tratamiento yace en el control de la fuente etiológica. Definitivamente, la acidosis láctica condicionada por metformina tiene mejor pronóstico respecto a la inducida por choque séptico. La terapia de reemplazo renal intermitente o continua debería ser utilizada como primer eslabón de tratamiento con la acidosis láctica por metformina.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores declaramos no haber recibido financiamiento externo para la realización de la investigación.
Conflicto de interesesLos autores declaramos que no existe conflicto de intereses.
Agradecemos al equipo médico y de enfermería de los diferentes turnos de la terapia intensiva, quienes colaboraron en la atención integral del paciente.