La cirugía cardiaca con circulación extracorpórea en pacientes obstétricas representa un capítulo especial, debido a los cambios fisiológicos producidos por el embarazo y factores como el manejo anestésico, la monitorización y la perfusión durante el bypass cardiopulmonar que se producen sobre el binomio madre-feto, organismos en situaciones diferentes y con intereses opuestos. Describimos el manejo anestésico de una paciente de 26,2semanas de embarazo con un tromboembolismo pulmonar y trombo auricular adherido a catéter central con comunicación interauricular.
Cardiac surgery with extracorporeal circulation in obstetric patients is a separate chapter because of the physiological changes brought about by pregnancy and factors such as anesthetic management, monitoring and perfusion during the cardiopulmonary bypass that affects both the mother and the child; both experience different circumstances and have dissimilar interests. The paper discusses the anesthetic management of a patient in her 26.2weeks of gestation with a pulmonary thromboembolism and atrial intracavitary thrombus attached to the central catheter with atrial septal defect.
El primer caso reportado de una mujer en estado de embarazo sometida a cirugía cardiaca con circulación extracorpórea fue descrito por Dubourg en 1958, para una valvulotomía pulmonar y cierre de una comunicación interauricular en una paciente con 6semanas de gestación1.
La enfermedad cardiaca es la primera causa de muerte no obstétrica durante el embarazo; ocurre en el 1-3% de los embarazos y representa el 10-15% de las muertes maternas1,2. La cardiopatía congénita se ha convertido en una enfermedad prevalente en mujeres en edad fértil, y si esta no es tratada pone también en riesgo al feto. Tras la cirugía cardiaca la mortalidad y la morbilidad no son más elevadas en la paciente gestante que en la paciente en ausencia de embarazo; sin embargo, en el neonato y en el feto llegan a ser del 9 y del 30%, respectivamente3,4.
La cirugía cardíaca con circulación extracorpórea en la embarazada representa un capítulo especial debido a los cambios fisiológicos que se producen en la mujer grávida y a los efectos (factores quirúrgicos, anestésicos y del bypass cardiopulmonar) sobre el binomio madre-feto. Presentamos un reporte de caso inherente al tema.
Caso clínicoMujer de 34años con embarazo de 26,2semanas por ecografía que ingresa en urgencias. Es valorada por ginecoobstetricia por un cuadro de un día de evolución consistente en dificultad respiratoria progresiva, sin dolor torácico, asociada a cefalea frontal opresiva y a dolor en el hipogastrio tipo cólico ocasional. Movimientos fetales presentes. Antecedente de migraña, fecha de última regla (FUR)19-10-2010, G2P1V1. Ecografía del 11-04-2011, embarazo de 26semanas, bienestar fetal, peso 910g. Monitorización fetal negativa insatisfactoria, categoría i, hemograma con leucocitosis y neutrofilia, sin anemia. Glucemia de 115mg/dl, azoados, bilirrubinas, transaminasas y electrólitos normales, parcial de orina contaminado, deshidrogenasa láctica 577U/l, orina gramnegativa, radiografía de tórax sin consolidaciones, gases arteriales acidosis metabólica. En el examen físico de ingreso, aceptable estado general con presión arterial (PA) de 98/66, frecuencia cardiaca (FC) 140, afebril, SPO2 92%, sin hallazgos positivos en el examen físico.
Diagnóstico inicial: a)embarazo de 26semanas por ecografía; b)sepsis severa con foco sospechoso de origen urinario; c)corioamnionitis a descartar.
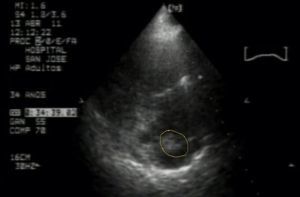
Se hospitaliza para estudios complementarios, repitiendo análisis de orina, que descarta infección, Gram de orina sin bacterias. Surge la sospecha de tromboembolismo pulmonar, por lo que desde ginecología se solicita realizar ecocardiograma transtorácico, que muestra una masa adherida a catéter central sugestiva de trombo vs vegetación de gran tamaño, hipertensión pulmonar severa (PSAP 70mmHg) con dilatación de cavidades derechas y signos de sobrecarga de presión, movimiento paradójico del septum (fig. 1).
Valorada por cardiología, encuentran una paciente con cuadro clínico de 7días consistente en dolor torácico opresivo constante asociado a disnea de medianos esfuerzos y palpitaciones, por exacerbación de los síntomas, además de disnea en reposo; niega síntomas urinarios, genitales o digestivos. Niega fiebre o escalofríos y refiere antecedente de embarazo con amenaza de aborto, por lo cual estuvo en reposo prolongado en el último mes. Examen físico sin disnea, sin dolor torácico, FC: 100/min, PA: 120/76mmHg, frecuencia respiratoria: 18/min, temperatura: 36°C, SAT: 94% sin requerimiento de oxígeno suplementario. Y como hallazgos positivos: ruidos cardiacos rítmicos con soplo sistólico iii/vi en focos de la base de predominio aórtico. Cardiología considera los siguientes diagnósticos:
a)tromboembolismo pulmonar (TEP); b)trombo intracavitario auricular bilateral adherido a catéter central; 3)¿endocarditis infecciosa?
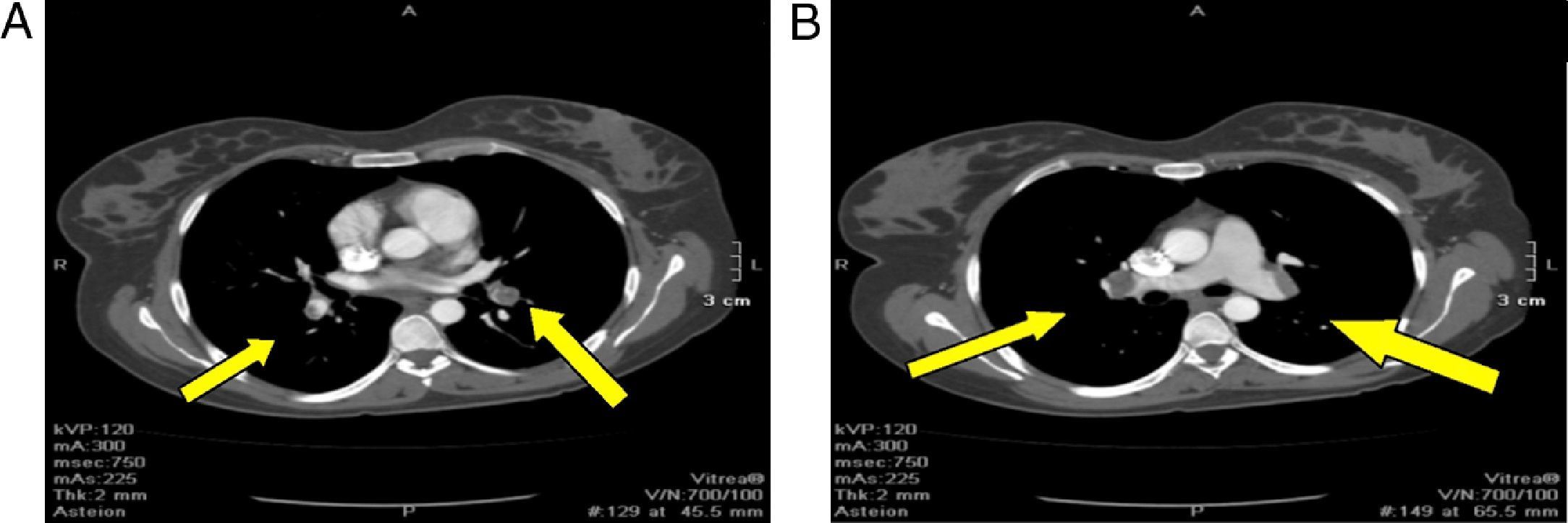
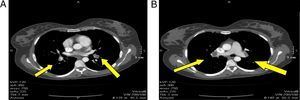
La angioTC reporta: estudio positivo para TEP de ambas arterias pulmonares principales lobares y segmentarias, segmento anterior y posterior del lóbulo superior, extensión del trombo en dirección caudal hacia la arteria interlobar, la cual oblitera parcialmente; se observa defecto de opacificación a nivel de la aurícula izquierda, con extensión hacia una de las venas pulmonares izquierdas en relación con trombo intracavitario, defecto de opacificación a nivel de la aurícula derecha en probable relación con trombo intracavitario con diámetro mayor de 36mm. Importante dilatación de las cavidades derechas con desplazamiento del septum que colapsa parcialmente el ventrículo izquierdo (fig. 2).
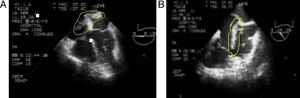
Con estos hallazgos se confirma el diagnóstico de TEP. Se inicia anticoagulación con heparina de bajo peso molecular (HBPM) y traslado a la unidad de cuidados críticos intermedios (UCI-I). El ecocardiograma transesofágico reporta: gran trombo cabalgando sobre foramen oval permeable, muy móvil, con alto riesgo de embolismo, hipertensión pulmonar severa (PSAP 70mmHg), con regurgitación tricúspide moderada y dilatación de cavidades derechas (fig. 3).
Cirugía cardiovascular define reparación de defecto del tabique interauricular y tromboendarterectomía pulmonar, procedimiento que se realiza 6días después de su ingreso. En la sala de cirugía se realiza monitorización invasiva de la PA, monitorización del gasto cardiaco continuo con Flotrac/Vigileo y monitorización fetal, inducción anestésica con midazolam 3mg, fentanilo 500μg, propofol 100mg y relajación neuromuscular con rocuronio 50mg. Tras la intubación orotraqueal se procede a la colocación de catéter venoso central subclavio, sin complicaciones. Durante el procedimiento se dio mantenimiento con isoflurano, requiriendo bolos adicionales de midazolam y fentanilo; se administra un total de 10mg de midazolam y 2,5mg de fentanilo hasta el final de la cirugía, y con el fin de mantener la PAM>70mmHg se inicia infusión de fenilefrina titulable.
Para la anticoagulación se dio una dosis de heparina de 400U/kg, por lo que venía recibiendo previamente dosis de heparina, para lograr mantener un tiempo de coagulación activado superior a los 380s como mínimo e ideal por encima de los 600s; no se lograron tiempos mayores a 400s a pesar de las dosis aumentadas de anticoagulación.
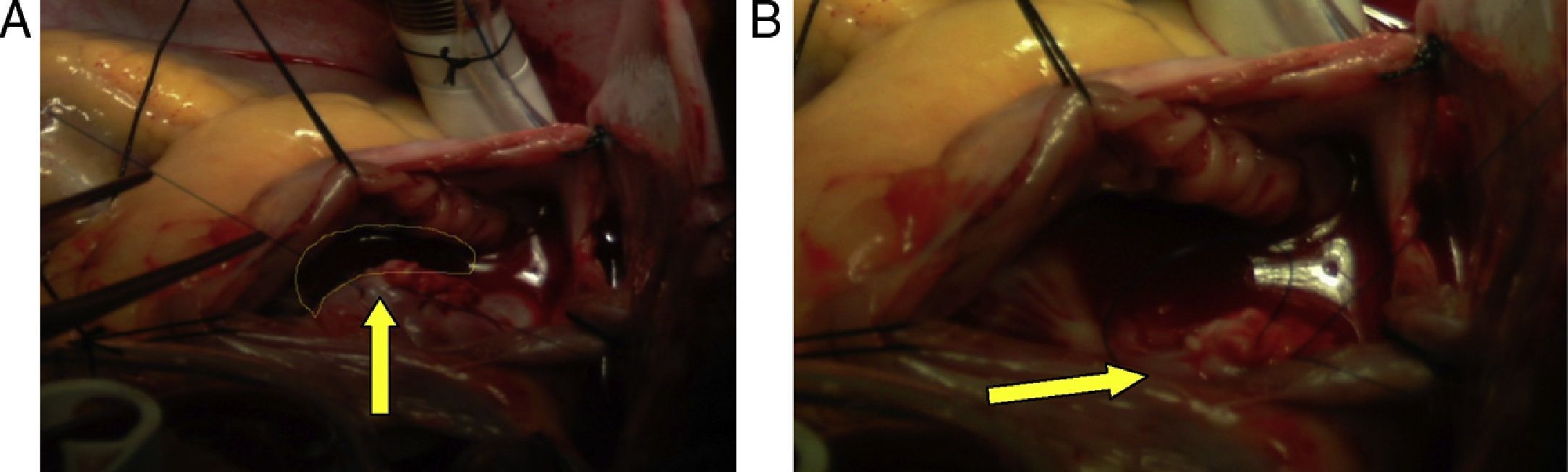
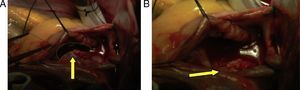
Hemodinámica (tabla 1)Cardioplejía: cristaloide tipo Custodiol 1.000cc infusión anterógrada, sangrado 500cc, se transfunden intraoperatoriamente 2unidades de glóbulos rojos empaquetados y 2 unidades de plasma fresco. Hallazgos intraoperatorios: coágulo de 6cm de longitud aproximada ubicado desde vena cava superior hasta la aurícula derecha y que pasa a través de la comunicación interauricular (CIA), defecto de la CIA tipo ostium secundum aproximadamente de 3cm de diámetro, pequeños coágulos en la arteria pulmonar izquierda (fig. 4).
La monitorización fetal antes de la cirugía muestra una línea de base 140 y variabilidad moderada; monitorización fetal continua durante bypass con línea de base 130 y variabilidad moderada; durante el clamp aórtico la FC fetal oscilante entre 180 y 60latidos/min, monitorización sin estrés reactiva al finalizar el procedimiento quirúrgico.
La paciente se entrega en la UCI con soporte ventilatorio invasivo, con infusión endovenosa de fenilefrina, con PA: 104/50, FC: 97, Sat: 96%, índice cardiaco de 3,1, variabilidad del volumen sistólico del 13%, PVC 12mmHg, glucometría 157mg/dl, pH 7,34, PO2 88mmHg, relación PO2/FiO2 220, PcO2 34mmHg, HCO3 17mEq/l, BE –3mEq/l. Se realiza extubación a las 24h del postoperatorio, egreso hospitalario exitoso.
Ecocardiograma día 2 postoperatorio: cierre de CIA y trombectomía satisfactorios, hipertensión pulmonar moderada (PSAP: 54mmHg) y discreto crecimiento de cavidades derechas. Embarazo que continúa sin complicaciones y termina en parto vaginal a las 36semanas de gestación, con recién nacido sano.
DiscusiónEl manejo anestésico de la paciente embarazada para cirugía cardiaca implica varios retos. La monitorización hemodinámica invasiva es clave por los cambios fisiológicos de las embarazadas y el estado basal de su patología cardiaca, y estos podrían tener información no confiable5. De todas maneras es un requisito para la cirugía y el bienestar fetal, teniendo en cuenta que las principales causas de bradicardia fetal durante la cirugía incluyen la hipotensión, la hipoxia, las contracciones uterinas, la disminución del flujo sanguíneo uterino, la mala posición materna, los medicamentos y la hipotermia4.
El uso de anticoagulación durante el embarazo tiene sus indicaciones específicas, como son la trombosis venosa profunda, la presencia de prótesis valvular cardiaca mecánica, la fibrilación auricular de reciente inicio, la miocardiopatía dilatada y durante el bypass cardiopulmonar. La heparina no fraccionada y la HBPM no atraviesan la placenta y no tienen efectos teratogénicos en el feto; por tal razón, para los efectos en el bypass cardiopulmonar la heparina puede usarse de manera segura en las dosis habituales para la anticoagulación sin crear riesgos para el feto6.
El bypass cardiopulmonar tiene efectos nocivos sobre el flujo sanguíneo uteroplacentario y el feto, que pueden ser exacerbados por la activación de los procesos inflamatorios, el flujo no pulsátil, la hipotensión y la hipotermia7,8. Si el feto es viable, es recomendada la monitorización del tono uterino y la FC fetal. La bradicardia fetal, los patrones sinusoidales y las desaceleraciones tardías son indicadores de asfixia fetal y puede ocurrir durante el inicio del bypass.
Las recomendaciones actuales de bypass materno para la protección fetal incluyen4,7:
- 1)
Mantener la tasa de flujo de la bomba de 2,5l·min–1·m–2 y la presión de perfusión>70mmHg.
- 2)
Mantener el hematocrito superior al 28%.
- 3)
Uso de la perfusión normotérmica cuando sea posible.
- 4)
Uso de flujo pulsátil si es posible.
- 5)
Valoraciones del pH para control y homeostasis del CO2.
Todos los anestésicos inhalados y la mayoría de los anestésicos endovenosos son altamente liposolubles y cruzan libremente la membrana uteroplacentaria. Los anestésicos volátiles también producen relajación del tono uterino y del flujo uteroplacentario. El efecto del etomidato no ha demostrado efectos metabólicos deletéreos sobre el feto o hemodinámicos sobre el flujo uteroplacentario y proporciona estabilidad en la PA9-11. Todos los opiáceos pueden causar bradicardia fetal, depresión respiratoria y pérdida de la variabilidad latido a latido, ya que atraviesan fácilmente la barrera placentaria; sin embargo, dada su estabilidad hemodinámica son excelentes coadyuvantes para la anestesia balanceada12. Los relajantes neuromusculares no atraviesan la barrera uteroplacentaria, por lo tanto no afectan el tono muscular neonatal13.
La circulación de la mujer embarazada experimenta cambios significativos, y el efecto adicional de bypass cardiopulmonar induce un estado hemodinámico no fisiológico que puede producir efectos adversos en la madre durante la cirugía cardiaca14. Dadas por la hemodilución, las alteraciones en la coagulación, en la activación del complemento, en la liberación de sustancias vasoactivas por los leucocitos, en el embolismo de partículas y de aire y en la hipotensión durante el bypass añaden un efecto deletéreo8.
La muerte fetal es principalmente generada por contracción uterina sostenida. Su causa durante la cirugía es aún desconocida, y ha sido descrita como posible la dilución de la progesterona que se produciría con la circulación extracorpórea8,15,16. La hipotermia y la fase de recalentamiento también se asocian a este efecto sobre el útero grávido17.
Los efectos en el feto del bypass son hipoxia, hipotensión, acidosis y principalmente bradicardia. Su mecanismo es aún desconocido, pero se postulan como posibles causas la disfunción fetoplacentaria, la hipotermia materna y los medicamentos que atraviesan la barrera placentaria, como los β-bloqueadores18,19.
Los factores de riesgo de mortalidad materna durante la cirugía cardiaca incluyen el uso de medicamentos vasoactivos, la edad, el tipo de cirugía, la reintervención y la clase funcional materna20. Los factores de riesgo para mortalidad fetal son edad materna >35años, clase funcional, reintervención, cirugía de urgencia, tipo de protección miocárdica y tiempo de anoxia20. Sin embargo, tasas aceptables de mortalidad materna y fetal pueden lograrse a través de medidas tales como la detección precoz de la descompensación cardiovascular preoperatoria materna, el uso de monitorización fetal perioperatoria, la optimización de la circulación extracorpórea mediante la monitorización y optimización del gasto cardiaco, y programar la cirugía en forma electiva en el segundo trimestre.
FinanciaciónLos recursos empleados fueron de fuente propia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.