La transfusión rápida de hematocomponentes y la presencia de alteraciones iónicas como la hipocalcemia y la hiperpotasemia son frecuentes en el trasplante hepático. El objetivo de este trabajo es brindar al lector una descripción ordenada y práctica de los factores etiológicos, mecanismos bioquímicos, diagnóstico y tratamiento de las alteraciones del calcio y del potasio asociadas a la transfusión masiva. Se destacan las particularidades del contexto clínico de la cirugía de trasplante hepático y se describe la intoxicación por citrato y sus factores predisponentes. Se realizó una revisión no sistemática de la literatura en las bases de datos MEDLINE, OVID y Cochrane. El manejo anestésico correcto y precoz de las alteraciones del calcio y del potasio evita complicaciones graves en el intraoperatorio de las cirugías con riesgo de hemorragia, como el trasplante de hígado.
Rapid transfusion of blood products and the presence of ionic changes as Hypocalcaemia and HyperKalaemia are common in liver transplantation. The objective of this paper is to give the reader a clear and practical description of the etiological factors, biochemical mechanisms, diagnosis and treatment of the calcium and potassium plasmatic disorders associated with massive transfusion. The peculiarities that arise in the clinical setting of liver transplant surgery and citrate intoxication are highlighted. A non- systematic review of literature was conducted in MEDLINE, OVID and Cochrane databases. Correct and early anesthetic management of calcium and potassium disorders prevents serious complications in intraoperative bleeding risk surgeries such as liver transplantation.
El trasplante hepático es una de las cirugías que frecuentemente requiere la transfusión de grandes volúmenes de hematocomponentes. Ello genera alteraciones complejas del medio interno que pueden llevar a situaciones de riesgo vital durante el intraoperatorio del trasplante. La identificación inmediata y la anticipación a esos trastornos es un pilar del manejo anestésico. El objetivo de esta revisión es desarrollar ordenadamente los mecanismos y el tratamiento de los trastornos más frecuentes del calcio y del potasio sérico que ocurren frente a la reposición con grandes volúmenes de hematocomponentes. Se detallarán las particularidades de la intoxicación por citrato, la hipocalcemia y la hiperpotasemia en el contexto de la hemorragia aguda masiva durante la cirugía de trasplante de hígado.
MetodologíaSe realizó una revisión no sistemática en la literatura en las bases de datos MEDLINE, OVID y Cochrane usando como palabras claves: «hipocalcemia», HyperKalaemia, «massive transfusion», «acidosis» y «liver transplantation». Se seleccionaron los artículos relevantes y las citas relacionadas que ayudan a comprender la etiopatogenia, el diagnóstico y el tratamiento de los trastornos del calcio y del potasio durante la hemorragia masiva. Se incluyeron además artículos relevantes para la interpretación de dichos trastornos durante la cirugía de trasplante hepático.
Hemorragia masivaLa hemorragia masiva es una de las principales causas de muerte y paro cardíaco intraoperatorio tanto en adultos como en niños1–4. Suele definirse en relación al volumen de hematocomponentes transfundidos en 24h por kilos de peso: 10 volúmenes de sangre desplasmatizada (SD) en un paciente de 60kg5. También puede considerarse la sangre perdida en un período de tiempo: reemplazo mayor a 50% de la volemia en 3h, o transfusión de más de 4 volúmenes de SD en una hora.
Sin embargo, cuando la hemorragia es aguda y se presenta en pocos minutos, es necesario identificarla inmediatamente para no retrasar las medidas terapéuticas. Por ello en anestesia se prefiere tomar en cuenta los mililitros de sangre perdidos en pocos minutos: 150ml/min o más de 1,5ml/kg/min por más de 20min6. La mortalidad está relacionada con la presencia de acidosis (pH<7,1), hipotermia, coagulopatía, número de concentrados hemáticos transfundidos y relación de volumen entre los diferentes hematocomponentes administrados7. Las complicaciones agudas de la hemorragia masiva se relacionan con el estado de shock y con la terapia transfusional8,9. Dentro de estas últimas centraremos la atención en 2: la intoxicación por citrato7,10,11 y la hiperpotasemia4,7,12. La hipomagnesemia es otra disionía frecuente (58%) en los pacientes con hemorragia masiva pero no parece tener relación significativa con la mortalidad13.
HipocalcemiaSe define como la concentración de calcio sérico total menor 8,5mg/dl (4,5mEq/l, 2,10mmol/l)14, pero la hipocalcemia clínica puede presentarse con valores de calcio total normal cuando la concentración sérica de calcio iónico es menor a 4,5mg/dl. En cirugía, las causas más común de hipocalcemia son la hiperventilación y la infusión de sangre citratada mayor a 1,5ml/kg/min. La alcalosis respiratoria aguda reduce el calcio iónico mediante el descenso de la concentración del ion hidrógeno que libera sitios de unión a la albúmina, llevando a un aumento de la unión a proteínas con el calcio iónico. La clínica de hipocalcemia se debe a un descenso en la concentración de calcio iónico, pues es esta fracción libre la que actúa a nivel de los potenciales de membrana15. Por eso se manifiesta en los tejidos excitables: cambios en el estado mental (sistema nervioso central), tetania (músculos esqueléticos), hipotensión (músculo liso) y arritmias, prolongación del intervalo QT o actividad eléctrica sin pulso (miocardio)9,14. Los niveles de calcio plasmático son un pobre reflejo del calcio corporal total, constituyendo solo el 0,1-0,2% del calcio extracelular y el 1% del calcio corporal total. A su vez, el calcio iónico constituye en general un 40-50% del calcio plasmático. La concentración de calcio sérico total debe ser interpretada en relación con la albúmina sérica. En presencia de hipoalbuminemia existe menos sustrato para unirse con el calcio, quedando un porcentaje mayor de calcio libre: iónico. En esta situación los valores de calcio plasmático pueden subestimar el valor de calcio iónico16. La concentración de calcio sérico se corrige en referencia a una concentración de albúmina de 40g/l: por cada 1g/l de albúmina por encima o debajo de este valor, el calcio se ajusta disminuyendo o aumentando, respectivamente, en 0,02mmol/l. Esta estimación puede no ser precisa en situaciones de enfermedad crítica17. La utilización de albúmina al 5% y de hematocomponentes durante el trasplante hepático determina unión del ion calcio a las proteínas18. Por otra parte, en pacientes hospitalizados y críticamente enfermos con hipoalbuminemia puede existir descenso del calcio total sin descenso en el calcio iónico16. En estos casos no es necesaria la corrección aguda de la calcemia, pero se debe mejorar la nutrición14.
Durante la transfusión sanguínea la magnitud de la hipocalcemia depende de la volemia del paciente, del volumen de productos sanguíneos administrados, de la velocidad de transfusión y de la función hepática2.
La hipocalcemia durante la hemorragia masiva es un predictor de mortalidad, y la relación entre los valores de calcemia y mortalidad es lineal. La disminución del calcio plasmático es un mejor indicador de mortalidad hospitalaria que la concentración mínima de fibrinógeno, la acidosis o la trombocitopenia19.
Intoxicación por citratoSe manifiesta por signos de hipocalcemia20. La sangre almacenada es anticoagulada con citrato (3g/unidad de SD) que actúa como quelante del calcio. En el adulto sano el hígado metaboliza 3g de citrato en 5min. Los ritmos de infusión mayores de una unidad de SD/5min, o la disfunción hepática, determinan la elevación del citrato y la disminución del calcio iónico plasmático21. Cuando el volumen circulatorio es bien mantenido, las manifestaciones cardiovasculares ocurren con infusiones de 150ml/70kg/min de sangre citratada. Sin embargo, cuando hay hipotermia de 31¿C el ritmo del metabolismo del citrato está disminuido en un 50% y la intoxicación se puede producir con menores ritmos de infusión. Con los nuevos conservantes (contienen menos citrato) la intoxicación es menos probable21. Una situación similar se produce al administrar rápidamente bicarbonato de sodio (HCO3): el calcio libre se une al HCO3 y disminuye el porcentaje de calcio ionizado16. En estados de bajo flujo (paro cardiaco o paro hemodinámico con actividad eléctrica) hay disminución del calcio ionizado22, que es independiente de la concentración total. El mecanismo es la alteración de la distribución del calcio libre. En consecuencia, si se administra sangre con citrato a un paciente que presenta hipoperfusión tisular, el descenso del calcio ionizado será mayor que en situaciones de estabilidad. Es necesario mejorar el estado hemodinámico del paciente para permitir la movilización del calcio ionizado desde los depósitos corporales. La administración de sangre, paradójicamente, puede mejorar los niveles de calcio iónico plasmático al mejorar el estado circulatorio. La acidosis y el volumen total de plasma fresco transfundido se asocian con hipocalcemia severa en pacientes con hemorragia masiva19.
Los neonatos tienen riesgo de desarrollar fallo cardiaco por hipocalcemia durante las transfusiones porque la función cardiaca (relajación y contracción) depende en gran medida de la concentración de calcio ionizado en plasma2. Cuando los neonatos presentan un fallo hepático que disminuye la metabolización del citrato y ese riesgo es muy elevado, se puede producir la muerte del niño3. La intoxicación por citrato puede prevenirse en estos casos si se mantiene una velocidad de transfusión menor a 1ml/kg/min2.
Durante el trasplante hepático la hipocalcemia es multifactorial15,23: transfusiones, disminución de la capacidad metabólica del hígado24 y la reducción del flujo sanguíneo hepático. Como resultado, es necesario infundir dosis altas de calcio durante el trasplante de hígado (1g/h de gluconato de calcio)21.
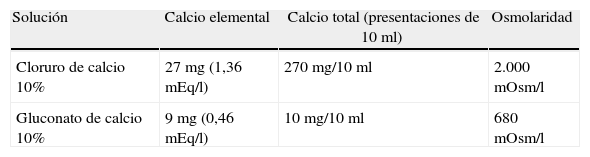
Tratamiento de la hipocalcemia: gluconato y cloruro de calcioLa administración de calcio intravenoso es el tratamiento apropiado de la hipocalcemia aguda o severa: cloruro de calcio al 10% (1,36mEq/l) o gluconato de calcio (0,45mEq/l). El cloruro de calcio al 10% provee 3 veces más de calcio que un volumen igual de gluconato de calcio al 10%, ya que el cloruro tiene una masa molecular de 147 y el gluconato una masa molecular de 44821. Las diferencias químicas entre el cloruro y el gluconato de calcio se detallan en la tabla 1. Si se administra una dosis equivalente de calcio en cualquiera de las 2 presentaciones25 la respuesta terapéutica es similar, sin que existan diferencias significativas en la velocidad de disociación de ambos compuestos25. Ambas preparaciones pueden ser usadas con eficacia similar para el tratamiento de la hipocalcemia intraoperatoria26,27. El gluconato de calcio es la forma preferida de calcio intravenoso, ya que el cloruro de calcio tiende a causar irritación local cuando se usa por vía periférica y debe administrarse por vía venosa central14. Si existen signos de hiperpotasemia o de hipocalcemia la administración se debe realizar en bolo, siendo indispensable la monitorización electrocardiográfica por el riesgo de aparición de arritmias28. La dosis recomendada para tratar la hipocalcemia intraoperatoria si hay hemorragia que requiere transfusión de hematocomponentes es de 5-10mg/kg de cloruro de calcio o de 15 a 30mg/kg de gluconato de calcio, siendo mayor el requerimiento en niños y neonatos2. Esto otorga generalmente una mejoría temporal (ya que ambos preparados presentan una vida media corta) y es necesaria la administración continua de calcio para prevenir la recurrencia de la hipocalcemia o las fluctuaciones plasmáticas peligrosas17,29.
HiperpotasemiaSe define como el nivel de potasio sérico mayor a 5,5 mEq/l. Suele considerarse leve hasta valores de 6mEq/l, moderada entre 6 y 7mEq/l y severa mayor de 7mEq/l. Puede ser causada por alteraciones del balance externo o interno30,31. Las causas más frecuentes son el fallo renal severo, la iatrogenia, el consumo de fármacos inhibidores de la enzima convertidora de angiotensina (IECA)32 y las transfusiones de sangre de banco4,33. En anestesia y cirugía la perfusión de un lecho vascular extenso previamente isquémico produce liberación a la circulación de grandes cantidades de potasio generadas por la salida de potasio intracelular a causa de la acidosis local que altera las bombas de membrana. En el trasplante de hígado la perfusión del injerto recién colocado (isquémico y conservado en solución con alto contenido de potasio) produce aumentos bruscos del potasio plasmático que pueden llevar a la muerte del paciente34,35.
Hiperpotasemia y acidosisLa acidosis incrementa la concentración de potasio plasmático mediante la inducción de salida desde la célula hacia el compartimento extracelular en intercambio con hidrógeno (alteración del balance interno)31. A nivel renal, el aumento de H+ lleva a la disminución de la secreción tubular de potasio, alterando también el balance externo31.
Hiperpotasemia y transfusión de sangreLa transfusión rápida de SD puede resultar en paro cardiaco4,33. La concentración plasmática de potasio aumenta en la sangre almacenada en forma directamente proporcional al tiempo de almacenamiento (0,5 y 1mEq/l/día), pudiendo alcanzar valores entre 7 y 77mEq/l en SD36. El mecanismo es la salida de potasio de los glóbulos rojos por la inactivación de la bomba Na2+-K-ATPasa de la membrana debido a la falta de ATP. Además, la SD contiene solución de citrato-fosfato-dextrosa (CPD) o citrato-fosfato-dextrosa-adenina (CPDA) con un pH de 5,5, lo que lleva a un descenso del pH desde 7,0 hasta 6,6 a los 21-35días de almacenada. El resultado es una acumulación de potasio, ácidos fijos y CO2 que puede generar depresión miocárdica al ser transfundida en el contexto de una hemorragia masiva37. La concentración de potasio de las unidades de SD aumenta con la irradiación y se reduce con el lavado de los glóbulos rojos38. La transfusión rápida por un catéter venoso central puede entregar mayores concentraciones de potasio a la circulación coronaria que una vía venosa periférica, y esto puede contribuir con el riesgo de paro cardiaco9,37. Al mismo tiempo, algunos dispositivos de infusión presurizados pueden traumatizar los glóbulos rojos causando mayor salida de potasio de la célula39. Los nuevos dispositivos de infusión rápida y calentamiento de fluidos no generan destrucción celular significativa. El volumen de hematocomponentes infundido por minuto parece ser el principal factor asociado al paro por hiperpotasemia en los niños, siendo preferible el uso de catéteres venosos periféricos y no centrales en caso de necesitar reponer rápidamente4.
Hiperpotasemia en el trasplante hepáticoLa concentración plasmática de potasio elevada en el preoperatorio es el factor más importante que predice el desarrollo de hiperpotasemia durante la cirugía23. Otros factores son la presencia de acidosis, la osmolaridad, el tratamiento con insulina y catecolaminas, la transfusión de glóbulos rojos y la presencia de fallo renal23.
El control de las cifras de potasio plasmático previo a la perfusión del injerto durante el trasplante de hígado es un pilar fundamental para prevenir el paro cardiaco intraoperatorio. Las causas del colapso cardiovascular pueden ser muchas (hipotermia, acidosis, hipocalcemia, embolismo pulmonar)40, siendo la hiperpotasemia frecuente y evitable41,42.
Manifestaciones clínicasLos cambios en el potasio plasmático determinan cambios en el potencial eléctrico de reposo de las membranas celulares, lo que se expresa como debilidad o parálisis muscular y alteraciones en la conducción o repolarización cardiaca. El signo más precoz y más típico del ECG es la alteración de la onda T, que se vuelve pronunciada. Esa alteración puede progresar a un intervalo PR prolongado, ensanchamiento del complejo QRS, fibrilación ventricular y asistolia a partir de los 7mEq/l37,43. El tratamiento incluye la estabilización eléctrica del corazón, la redistribución del potasio desde el plasma hacia las células y la eliminación del potasio del organismo44. La diálisis remueve 50 a 80mEq/l de potasio en 4h y puede usarse en casos excepcionales, como en pacientes con insuficiencia renal severa o en los trasplantes simultáneos de hígado y riñón45.
ConclusionesLa conjunción de hemorragia, disionías y complicaciones cardiacas en el contexto de la cirugía de trasplante hepático es frecuente y potencialmente mortal.
Los pacientes trasplantados de hígado suelen presentar uno o varios factores de riesgo para desarrollar complicaciones cardiacas en el intraoperatorio. Los trastornos séricos del calcio, magnesio y potasio se presentan con frecuencia en el paciente cirrótico o con hipertensión portal, siendo más frecuentes en los pacientes tratados con diuréticos. La obesidad está asociada a 2 patologías hepáticas habituales del trasplantado: la esteatosis hepática y el hepatocarcinoma46, siendo la obesidad un factor de riesgo para enfermedad vascular coronaria. Algunas de las enfermedades que lleva al trasplante hepático pueden asociarse a cardiopatía, como es la hemocromatosis. En tercer lugar, y como se desarrolló en este trabajo, las alteraciones del medio interno producidas durante la hemorragia y la transfusión generan riesgo de intoxicación por citrato47 con fallo contráctil ventricular22,48 y arritmias cardiacas.
La presencia de hemorragia aguda durante el trasplante de hígado es frecuente y suele requerir transfusiones sanguíneas masivas que conllevan riesgos de disionías. Ello predispone al fallo cardiaco, trastornos del ritmo e incluso la muerte. Se recomiendan estrategias preventivas para evitar dichas complicaciones:
La selección de los volúmenes de hematocomponentes con menor tiempo de almacenamiento y el lavado de los glóbulos rojos4,49.
La administración sistemática de calcio si se requiere la administración de hematocomponentes durante la cirugía de trasplante. Puede usarse en infusión a dosis de 5mg/kg/h de cloruro de calcio o de 15mg/kg/h de gluconato de calcio mientras exista hemorragia significativa que requiera transfusión.
Tratamiento intensivo de la hipocalcemia durante la cirugía de trasplante: bolos de 5-10mg/kg de cloruro de calcio o de 15 a 30mg/kg de gluconato de calcio.
La corrección inmediata de los factores que favorecen la intoxicación por citrato: acidosis e hipotensión22,50.
La corrección de la hiperpotasemia (con diuréticos, soluciones de glucosa insulina, bicarbonato o beta-agonistas), de la hipocalcemia y de la hipomagnesemia que pueden presentar los candidatos a trasplante en el preoperatorio inmediato.
Uso de diuréticos de asa para evitar el aumento excesivo de la precarga cuando son necesarios grandes volúmenes de plasma para tratar la coagulopatía.
Evaluar en conjunto con los cirujanos actuantes la necesidad de realizar un lavado del injerto con al menos 500ml de fluidos previo a la reperfusión del mismo para evitar aumentos del potasio sérico que lleven al paro cardiaco42.
Evitar la disminución de la oferta y el aumento de la demanda de oxígeno al miocardio (hipotensión, anemia, taquicardia, hipertensión) para minimizar la isquemia, ya que ella es otro factor etiológico de las arritmias y el fallo cardiaco.
El abordaje de los trastornos del calcio y del potasio en pacientes con hemorragia masiva intraoperatoria durante la cirugía de trasplante hepático debe ser agresivo, multidisciplinario y dinámico.
FinanciaciónRecursos propios de los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.