El dolor crónico es una de las principales causas de consulta médica, produce limitación funcional, altera el estado del ánimo y disminuye el rendimiento laboral. En muchas ocasiones es de difícil manejo y pobre respuesta a terapias farmacológicas, generando un reto para el equipo interdisciplinario que trata esta enfermedad. Cada día se investigan más métodos enfocados a aliviar el dolor, entre ellos la aplicación de sustancias como la toxina botulínica en los puntos dolorosos.
ObjetivoRealizar una revisión narrativa no sistemática sobre la evidencia científica disponible acerca del uso de la toxina botulínica en el tratamiento del dolor crónico.
Métodos y materialesSe realizó una búsqueda en la base de datos PUBMED, que incluyó artículos de metaanálisis, revisiones sistemáticas, revisiones de Cochrane, ensayos clínicos, revisiones narrativas y series de casos, entre 1997 y 2013, para la realización de una revisión narrativa no sistemática.
ResultadosSe tuvieron en cuenta un total de 66 artículos para la realización de la actualización en el tema propuesto.
ConclusionesLa toxina botulínica presenta propiedades que posiblemente puedan tener algún beneficio en el área del dolor crónico. Sin embargo, no existe suficiente evidencia que soporte su uso en la mayoría de sus indicaciones en este grupo de pacientes. Se requieren más estudios para recomendar su uso. La guía ultrasonográfica es considerada una herramienta útil en su aplicación.
Chronic pain is one of the primary reasons why people seek medical help. It produces functional limitation, affects mood, and impairs job performance. Many times it is difficult to manage and responds poorly to pharmacological therapies, posing a challenge for the multidisciplinary team in charge of treating this disorder. A number of approaches to relieve pain are the subject of growing research, including the application of agents such as botulinum toxin on painful points.
ObjectiveTo carry out a non-systematic narrative review of the scientific evidence available on the use of botulinum toxin for the treatment of chronic pain.
Materials and methodsA search was conducted in the PUBMED database, including meta-analyses, systematic reviews, Cochrane reviews, clinical trials, narrative reviews and case series, published between 1997 and 2013, in order to carry out a non-systematic narrative review.
ResultsOverall, 66 articles were considered for an update on the proposed topic.
ConclusionsBotulinum toxin has certain properties that might have a beneficial effect on chronic pain. However, there is not sufficient evidence supporting its use in the majority of indications in this group of patients. Additional studies are required to recommend its use. Ultrasound is considered a useful tool to guide its application.
El dolor crónico es una de las principales causas de consulta médica y de ingreso a servicios de urgencias. Es una experiencia desagradable que perdura en el tiempo, afecta la calidad de vida, altera el estado del ánimo, genera limitación funcional, distorsiona el sueño, destruye relaciones interpersonales y es causa de múltiples incapacidades laborales. Todo esto se ve reflejado en altos costos a los sistemas de salud.
Por lo anterior es fundamental lograr controlar el dolor crónico, para lo cual existen muchas alternativas terapéuticas, siempre iniciando con terapias conservadoras como medidas locales, analgésicos simples, supresión de desencadenantes y cambios en el estilo de vida, y luego escalando en potencia analgésica según la respuesta individual a las terapias iniciales.
En muchos pacientes no es posible controlar el dolor con fármacos o es necesario suspender la medicación por efectos adversos, lo cual genera un reto para el equipo interdisciplinario en búsqueda de otras alternativas, entre ellas la aplicación de toxina botulínica (BT). El tema objeto de esta revisión pretende brindar recomendaciones basadas en la evidencia científica disponible en la actualidad.
Métodos y materialesSe realizó una búsqueda en la base de datos PUBMED, que incluyó artículos de metaanálisis, revisiones sistemáticas, revisiones de Cochrane, ensayos clínicos, revisiones narrativas y series de casos, entre enero de 1997 y diciembre de 2013, para la realización de una revisión narrativa no sistemática.
ResultadosSe tuvieron en cuenta un total de 66 artículos para la realización de la actualización en el tema propuesto (fig. 1).
HistoriaEn 1897 Van Ermangen identificó la BT como causa de un envenenamiento alimentario fatal. En 1949 se demostró que la BT tipoA (BTA) bloquea la transmisión en la unión neuromuscular. En 1989 la administración de drogas y alimentos de los Estados Unidos (FDA) aprobó el uso de la BTA en el manejo del estrabismo, el blefarospasmo y el espasmo hemifacial en pacientes mayores de 12años. En 1992 William Binder, otorrinolaringólogo, reportó que la aplicación cosmética de la BTA, para la corrección de líneas faciales en sujetos con migraña, producía una notable mejoría de esta. En el año 2000 la BT fue aprobada por la FDA para distonía cervical, y en el 2002 fue aprobada para el manejo temporal de línea glabelar en pacientes menores de 65años1.
CaracterísticasLa BT es un producto de fermentación de la bacteria Clostridium botulinum. Es una bacteria grampositiva y anaerobia que se encuentra en el agua y en la tierra. Las neurotoxinas producidas son proteínas, y se han identificado 7 serológicamente distintas (A, B, C1, D, E, F, G). Existe otra proteína además de las mencionadas (C2), pero no es considerada una neurotoxina2,3.
Se encuentran disponibles comercialmente la A y la B. De estas, la A es la más estudiada y utilizada, aunque la toxinaB se ha estudiado en varias condiciones, como dolor miofascial, migraña, cefalea tensional y distonía cervical, donde se ha demostrado eficacia, duración de acción y efectos adversos similares a la toxinaA, cuando se usan dosis equivalentes. Son complejos moleculares entre 300 y 900kDa, formados por una neurotoxina de 150kDa constituida por una cadena ligera de 50kDa y una pesada de 100kDa, que se unen no covalentemente con otras proteínas no toxinas, con o sin hemaglutininas que ayudan a estabilizar y proteger la neurotoxina de la degradación. Los diferentes serotipos son activados por medio de proteasas, generando un mayor efecto terapéutico; la tipoA es dividida por proteasas endógenas hasta en un 95%.
Mecanismo de acciónLa toxina se inyecta en el vientre muscular, donde está su sitio efector principal, que es la placa motora. La mayor parte de los efectos terapéuticos son secundarios a la inhibición de la liberación de acetilcolina de las terminales nerviosas, incluyendo neuronas motoras, simpáticas y parasimpáticas; allí produce un estado de denervación química con la consecuente relajación muscular. Como reacción a esta denervación, se originan nuevas ramificaciones dendríticas hacia la célula muscular, permitiendo la recuperación parcial de su efecto, lo que se traduce en una duración terapéutica de 3 a 4meses (figs. 2 y 3).
En circunstancias normales, en las terminales nerviosas motoras se encuentran las vesículas que contienen acetilcolina, y estas se unen a la membrana celular por medio de complejos proteínicos N-ethylmaleimide-sensitive factor attachment protein receptor (SNARE) que incluyen la vesicle-associated membrane protein (VAMP), donde actúa principalmente la tipoB, y la synaptosome-associated protein of 25 kDa (SNAP-25), donde actúa la tipoA; luego liberan su contenido a la hendidura sináptica por medio de exocitosis. La acetilcolina atraviesa el espacio sináptico, donde se une a los receptores nicotínicos que se encuentran en las células musculares y produce la contracción muscular.
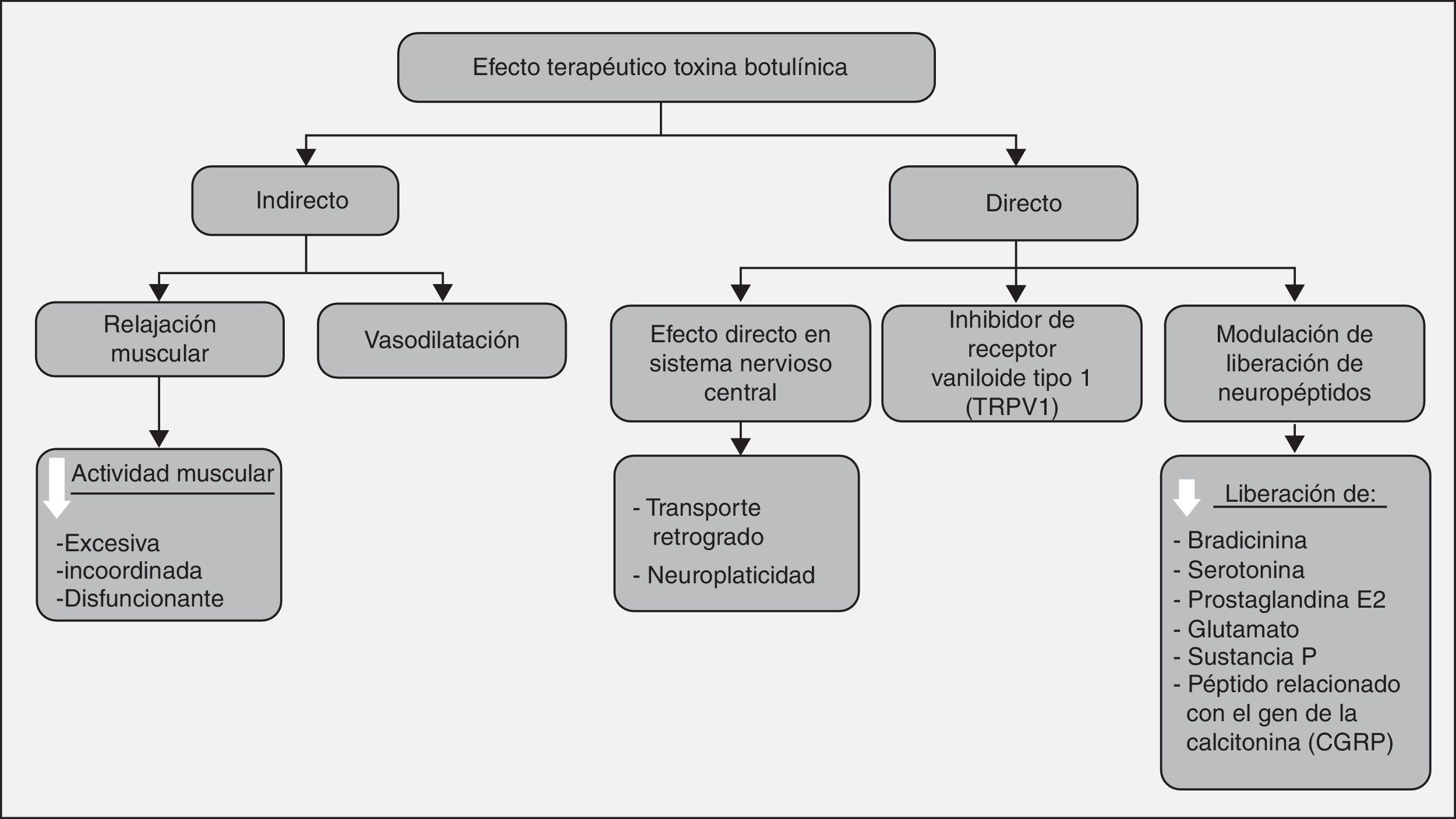
Se ha propuesto que la BT disminuye el dolor de forma directa al producir cambios moleculares sobre la función de las fibras nociceptivas e indirecta al disminuir la actividad excesiva o disfuncionante muscular. Otros dividen su forma de actuar en 3: capacidad de producir bloqueo neuromuscular, modulación de la liberación de diferentes neuropéptidos involucrados en la génesis del dolor y el efecto que tiene al mejorar la circulación teniendo en cuenta la isquemia como una causa de dolor4.
El mecanismo más estudiado es el indirecto, y se presenta en 3 pasos:
- -
Unión. La cadena pesada por la región C terminal se une de forma irreversible a receptores colinérgicos presinápticos con gangliósidos como parte de su estructura, que son específicos para las diferentes neurotoxinas. Se ha visto que existen sitios de unión de alta y de baja afinidad, y a partir de esto se ha creado la hipótesis de receptor dual que consiste en que el gangliósido es la parte de baja afinidad que, cuando se une la neurotoxina, induce un cambio conformacional en la toxina que permite el reconocimiento por el receptor proteico. Esta unión es independiente de la actividad del nervio.
- -
Internalización. Sucede a través de endocitosis de la toxina. Es mediada por los receptores, dando lugar a la formación de vesículas con la neurotoxina en su interior. Este proceso es parcialmente dependiente de la estimulación nerviosa.Las vesículas tienen un pH ácido en su interior, permitiendo unos cambios en la conformación de la estructura proteica facilitando el paso por la capa bilipídica en la que se formarán canales iónicos, que son necesarios para la translocación de la cadena ligera del endosoma al citoplasma neuronal.
- -
Bloqueo neuromuscular, también llamado proteólisis. Ocurre cuando es translocada la cadena ligera que se caracteriza por poseer actividad catalítica. Por medio de endopeptidasas dependientes de cinc, dividen las diferentes proteínas SNARE según la especificidad de cada tipo de toxina. De esta manera impiden por diferentes mecanismos moleculares el acoplamiento y fusión de las vesículas con los receptores, inhibiendo la exocitosis de la acetilcolina al espacio sináptico5.
De esta manera se logra inhibir la transmisión colinérgica de las motoneuronas alfa y gamma produciendo un efecto relajante muscular, y este a su vez produce una disminución en la compresión de los vasos sanguíneos y libera nervios de la compresión, disminuyendo la activación de receptores nociceptivos. Estos cambios producen analgesia, ya que el dolor en los casos de distonías, contracturas y espasmos es producido principalmente porque se presenta una isquemia focal por compresión de los vasos sanguíneos musculares, lo que produce un estado de hipersensibilización de los receptores nociceptivos periféricos (fibras del grupoiv) a cambios bioquímicos como bradicinina, disminución de pH y liberación de ATP, por el daño de la membrana celular muscular. Anteriormente se creía que era el ácido láctico el que desencadenaba dolor por causa de la fatiga muscular, pero se ha reevaluado. Además, se disminuye el umbral de activación de los receptores de dolor, haciendo que la actividad muscular desencadene dolor. Por otro lado, las contracciones de baja intensidad, a pesar de no comprimir vasos, producen dolor al llevar a un exceso de ATP por medio de glucólisis anaerobia6.
Se ha visto que la toxina podría ser útil en otras condiciones en donde el dolor no es relacionado con contracción muscular, por lo que la relajación muscular no es requisito para producir analgesia, como es el caso de la migraña. Esto se logra por un mecanismo de acción directo.
En estudios in vitro y en animales produce una desensibilización y cambio en el patrón de respuesta de las fibras nociceptivas periféricas del grupoiii y iv, que indirectamente reduce la sensibilización central. Estas fibras se activan por sustancias sensibilizantes donde interviene la toxina al disminuir la liberación de bradicininas, serotonina, potasio, prostaglandina E2, glutamato, sustanciaP y péptido relacionado con el gen de calcitonina (CGRP). Lo anterior, en una fase consecuente, disminuye la actividad neuronal del asta dorsal implicada en la transmisión del estímulo doloroso al sistema nervioso central, con disminución en neuropéptidos en las neuronas de los ganglios dorsales7.
A nivel autonómico es complejo, ya que es un sistema en el que no solo intervienen los receptores nicotínicos sino también los muscarínicos. Además, hay intervención de otros neurotransmisores diferentes a la acetilcolina, como encefalinas, neurotensina, somatostatina y sustanciaP. El mecanismo de acción a este nivel ocurre de diferentes maneras; la principal es al suprimir la inflamación neurogénica, donde intervienen efectos vasculares, citoquinas y neuropéptidos, como la sustanciaP, que al liberarse produce vasodilatación y contribuye a la extravasación del plasma. Todos estos cambios facilitan la acumulación de agentes que sensibilizan los nervios periféricos, como se mencionó anteriormente. Ocurre un cambio en el patrón del flujo sanguíneo por el efecto de las neuronas autonómicas en el músculo liso vascular. El flujo sanguíneo está relacionado con la inflamación y el dolor isquémico, y probablemente está involucrado en la sensibilización de nociceptores. Además se cree que la toxina altera la percepción del dolor o la respuesta a este, por efecto directo en el sistema nervioso central8.
Produce una inducción de cambios neuroplásticos en el procesamiento de la actividad somatosensitiva aferente a múltiples niveles del neuroeje, por eventos que alteran la sensibilización periférica. Se han propuesto diferentes mecanismos como patrones excitatorios e inhibitorios de la actividad espinal, como el aumento en la activación de señales aferentes mediadas por NMDA, además de otras mediadas por efectos no NMDA. Se demostró que al inyectar BT marcada con un componente radiactivo en el nervio ciático, esta dejaba parte de material radiactivo en la médula, lo que sugería un posible transporte retrógrado, aunque se evidenció que lo que se transportaba no era la toxina intacta, sino restos. Hasta el momento no hay evidencia concluyente acerca de este fenómeno de transporte retrógrado en neuronas periféricas.
Por último, se ha visto que los receptores vaniloides tipo 1 (TRPV1) se han encontrado aumentados cuando se estimula in vitro el ganglio de la raíz dorsal, causando el desarrollo y el mantenimiento de la hiperalgesia inflamatoria, donde se ha encontrado también intervención de la toxina tipoA.
Dolor craneofacialLa BT ha sido usada en pacientes con bruxismo9, dolor temporomandibular10, neuralgia del trigémino11, neuralgia occipital12, cefalea tensional y migraña crónica, con resultados contradictorios.
Varios ensayos clínicos aleatorizados en pacientes con dolor orofacial o disfunción temporomandibular han reportado que no existe ningún beneficio en la disminución del dolor con la aplicación de BTA comparado con el placebo con un seguimiento hasta por 24semanas13,14.
En migraña episódica y en migraña crónica existen cientos de estudios con resultados contradictorios. Recientemente se ha publicado un metaanálisis que evaluó los ensayos clínicos aleatorizados que comparaban la BTA versus placebo u otras intervenciones en pacientes con cefalea tensional y en pacientes con migraña crónica realizados entre 1966 y marzo de 2012, reportando que es poco el beneficio de la BTA comparada con el placebo en la disminución de los días con cefalea al mes en pacientes con migraña crónica (–2,06días por mes) y que no hay diferencia en el número de días de crisis al mes, ni en cefalea tensional; tampoco hay beneficio cuando se compara con ácido valproico, topiramato y amitriptilina, con la desventaja que los pacientes que recibieron BTA presentaron mayor incidencia de ptosis palpebral, piel tirante, parestesias, rigidez de nuca, debilidad muscular y dolor en el cuello15. Otro metaanálisis comparando BTA versus placebo también reportó que no hay beneficio en la disminución de crisis en pacientes con migraña crónica16.
El estudio PREEMPT 1 y 2, patrocinado por el laboratorio Allergan, propietario de los derechos de la BTA marca registrada Botox, se trata de un ensayo clínico en un total de 1.384 pacientes, aleatorizados en 2 grupos, BTA (n=688) y placebo (n=696), donde se encuentra una diferencia estadística significativa a favor del uso de BTA en pacientes con migraña crónica, en cuanto a la disminución del número de días con cefalea al mes (–8,4 vs –6,6; p<0,001), teniendo una media previa de días con cefalea por mes de 19,9 y 19,8, respectivamente. No se encontró diferencia en el número de días de crisis al mes, ni en la necesidad de medicamentos de rescate en dolor agudo. Y se reportaron más eventos adversos en el grupo de BTA (62,4 vs 51,7%)17.
Dolor miofascialEl síndrome de dolor miofascial es un trastorno causado por una contracción muscular persistente cuya forma de presentación puede ser aguda o crónica y que se caracteriza por la identificación de los llamados «puntos gatillo», que son bandas fibrosas que al ser sometidas a presión o estimulación transfieren dolor irradiado al área de distribución del músculo afectado. La fisiopatología de esta entidad es incierta, pero parece que incluye varias interacciones complejas de numerosos mecanismos patogénicos, incluyendo isquemia inducida por espasmo muscular, hiperactividad del huso neuromuscular o de la placa motora y sensibilización central o periférica.
Dentro de las terapias que se han utilizado hasta ahora para su manejo se han considerado los medicamentos vía oral, la aplicación local de anestésicos locales y/o corticoides en el punto doloroso, la punción seca y diversos ciclos de terapia física, la mayoría de ellos con beneficio limitado y con presencia de algunos efectos secundarios.
La BT tiene propiedades antinociceptivas y relajantes musculares, por lo que se ha utilizado desde 1968 de manera exitosa en dolor crónico originado en diversos trastornos por sobreactividad focal muscular, como la distonía cervical; se ha planteado que la BT podría ser muy útil en el tratamiento del síndrome miofascial rompiendo el círculo vicioso doloroso18; sin embargo, algunos estudios han evidenciado que la aplicación simple de BT no es suficiente para aliviar el dolor y que, junto con el tratamiento activo, la terapia física debe ser uno de los pilares básicos19.
La colaboración Cochrane publicó en 2011 una revisión de la literatura acerca de la aplicación de BT y dolor cervical subagudo y crónico en la que se analizaron 9 estudios (503 pacientes), de los cuales se concluyó que con la evidencia disponible hasta la fecha no es posible demostrar un beneficio de la BT cuando se compara con la aplicación de placebo, solución salina normal, analgésicos comunes o terapia física, en este tipo de pacientes, incluyendo los que padecen cefalea cervicogénica20.
En 2012 se publicó otra revisión de la literatura (colaboración Cochrane) cuyo objetivo era determinar la efectividad y la seguridad de la BT en el tratamiento del síndrome miofascial excluyendo los músculos de cabeza y cuello; los autores determinaron, con base en 4 estudios (233 pacientes), que la evidencia es inconclusa para soportar el tratamiento con BT debido a que los estudios incluidos son de buena calidad metodológica pero cuentan con pocos pacientes y son muy heterogéneos en cuanto a las medidas de evaluación y el tipo de desenlace analizado21. En otra revisión sistemática comparan 5 ensayos clínicos. De ellos, solamente uno aporta evidencia favorable al uso de BT en el síndrome miofascial, mientras que en los otros 4 ensayos no se obtienen diferencias significativas en las distintas variables frente a placebo22. En otra revisión se evalúa el uso de BT en el dolor miofascial en 9 ensayos clínicos, y solo 2 ensayos aportan evidencia a favor del uso, mientras que en el resto los resultados no muestran diferencias frente a placebo. Al igual que en la anterior revisión, la heterogeneidad de los estudios dificulta la obtención de una conclusión clara4.
Es una revisión sistemática y metaanálisis que incluye 12 ensayos en los que se trató el dolor miofascial con BT. De ellos, tan solo 3 mostraron resultados positivos frente a placebo u otros tratamientos en lo referente al alivio del dolor. En análisis de subgrupos, la utilización de BT en dosis superiores a 25UI muestra una reducción significativa del dolor, mientras que dosis inferiores no muestran beneficio clínico23.
Dolor neuropáticoRecientemente se ha explorado el potencial analgésico de la BT para el tratamiento del dolor neuropático debido a su mecanismo de acción, que implica no solo el bloqueo de la liberación de acetilcolina en la placa neuromuscular, sino la inhibición de la liberación de sustanciaP, del CGRP, del glutamato y la expresión del receptor vaniloide TRPV1, implicados de manera importante en el mantenimiento de la hiperalgesia. Estudios preclínicos soportan las cualidades analgésicas de la BT cuando se utiliza como pretratamiento para modelos de dolor neuropático inducidos por formalina en ratas y por capsaicina en seres humanos24,25.
En el ámbito clínico se han realizado múltiples estudios con BT, la gran mayoría series o reportes de casos, para el tratamiento del dolor neuropático localizado (neuralgia postherpética, neuralgia del trigémino, dolor facial crónico, dolor cervical postoperatorio y síndrome del túnel del carpo)26–32.
Dentro de los estudios relevantes encontramos los realizados por Yuan et al.33 y Ranoux et al.34 (series de casos), que incluyeron 18 y 29 pacientes, respectivamente, para el tratamiento de dolor neuropático localizado (pie diabético y alodinia por trauma, dolor posoperatorio o neuralgia postherpética), los cuales, luego de la aplicación de BT (5 y 4U) por vía subcutánea en diferentes puntos alrededor del sitio afectado, encontraron que más del 40% de los pacientes en ambos estudios presentaron alivio de más del 50% con respecto al dolor inicial o disminución de 3 puntos en la escala análoga visual (EVA), beneficio que se obtuvo desde la semana de aplicación hasta un máximo de 12 y 14semanas, respectivamente, sin la presencia de efectos secundarios relevantes en ninguno de los 2 estudios, resultados concordantes con los encontrados por otros autores.
Síndrome de miembro fantasma dolorosoComo en muchos de los usos de la BT, lo que prima en la literatura son reportes de casos con resultados heterogéneos35,36. En un ensayo clínico comparan aplicación de BT versus lidocaína con esteroide, y encuentran que hay disminución en el dolor del muñón en ambos grupos, con más duración en los pacientes de BT, y en ninguno de los 2 grupos se encontró mejoría en el dolor del miembro fantasma37.
Isquemia periféricaLa inyección intradigital de la BTA en dosis de 10 a 100U viene siendo estudiada desde el 2004, cuando se realizó un estudio piloto con 2 pacientes que reportó tanto disminución de los síntomas clínicos como mejoría del flujo sanguíneo. Por esto se ha considerado como una terapia prometedora en el tratamiento de la isquemia periférica refractaria al manejo farmacológico o incluso quirúrgico en pacientes diagnosticados con fenómeno de Raynaud, tanto primario como en casos de esclerosis sistémica38. Posteriormente se han realizado diversos estudios, entre ellos una serie de casos con 11 pacientes, de los cuales 9 reportaron disminución en la severidad y frecuencia de los episodios vasoespásticos39, al igual que un reporte de caso en donde se encontró una disminución notable del dolor en reposo, inmediatamente posterior a la inyección40. Un estudio retrospectivo reportó que 16 pacientes de 19 (84%) presentaron una disminución marcada del dolor en reposo, y todos presentaron cicatrización de las úlceras digitales en 60días41. Sin embargo, aunque se ha visto que la BTA confiere beneficios en pacientes con isquemia digital, diferentes estudios recomiendan la realización de estudios adicionales antes de que pueda ser considerada dentro de las opciones terapéuticas42–44.
Dolor articularOtro de los usos de la BT es intraarticular. Un estudio en 36 pacientes con dolor crónico de hombro por osteoartritis y artritis reumatoide, en el que se infiltraron 43 articulaciones con 100U de BTA más lidocaína comparada con solución salina más lidocaína, demostró una disminución en 2,4 unidades en la EVA durante el primer mes45.
Igualmente, en 43 pacientes con dolor severo de rodilla se utilizaron 100U de BTA más lidocaína comparada con solución salina más lidocaína, y se demostró una disminución en la escala de dolor articular de McGill de 4,2unidades a los 3meses. Sin embargo, no hubo mejoría al mes46.
ComplicacionesAunque la electromiografía ha demostrado que las uniones neuromusculares en todo el cuerpo se pueden ver afectadas luego de la inyección con BTA, la parálisis generalizada es muy rara. La BTA carece de efectos sistémicos, lo que la hace un medicamento seguro47. A pesar que es raro, existen reportes de irritación cutánea y reacciones anafilácticas desencadenadas por su aplicación48,49.
Dependiendo de la región inyectada y de la indicación de su uso, se pueden encontrar diferentes eventos adversos50:
- •
Estrabismo: ptosis, hemorragia subconjuntival, y desviación vertical transitoria del globo ocular.
- •
Blefarospasmo: ptosis, diplopía, parálisis hemifacial y epífora.
- •
Espasmo hemifacial: el efecto adverso más común es la ptosis y la parálisis facial transitoria.
- •
Distonía cervical: disfagia, debilidad cervical, dolor cervical, dolor de hombro y dolor de manos.
Entre el 3% y el 10% de los pacientes tratados con BTA desarrollan resistencia.
En un metaanálisis de ensayos clínicos en pacientes con cefalea, publicado recientemente51, los principales efectos adversos reportados fueron: blefaroptosis (RR: 9,5; IC95%: 4,7-18,9), parálisis muscular (RR: 8,9; IC95%: 2,5-30,9), cervicalgia (RR: 4,7; IC95%: 3,2-6,9), rigidez de nuca (RR: 3,2; IC95%: 1,9-5,6), parestesias (RR: 3,3; IC95%: 1,3-7,9) y entumecimiento de la piel (RR: 3,6; IC95%: 1,6-8,3).
Otros efectos adversos reportados son malestar gripal52, fiebre y escalofrío53,54.
Utilización de la guía ultrasonográfica para la infiltración de la toxina botulínicaExiste consenso universal en que la forma más segura de la administración del BT en los diferentes tejidos es evitando las punciones «a ciegas». Se han publicado diversos reportes que demuestran la eficacia y la seguridad del uso del ultrasonido en diferentes enfermedades, como en pacientes con sialorrea55-59, opérculo torácico60, disinergia del esfínter externo vesical61 y espasticidad por parálisis cerebral62,63.
Adicionalmente se recomienda para la realización de lavados percutáneos, punción seca, electrocauterización, infiltración de esteroides y anestésicos locales y proloterapia64,65.
ConclusionesEl dolor crónico continúa siendo una enfermedad de alta prevalencia en las instituciones de salud. De manera frecuente se requiere de un equipo interdisciplinario para su control, lo que implica la utilización de múltiples herramientas terapéuticas. La BT posee propiedades farmacocinéticas y farmacodinámicas que abren una luz para el tratamiento de algunas entidades que causan dolor crónico. Sin embargo, la evaluación de la evidencia actual nos indica que no es posible demostrar un beneficio clínico importante de la BT en el dolor craneofacial y miofascial debido a la heterogeneidad de los artículos que impide calcular medidas de impacto ajustadas que soporten una recomendación absoluta.
En dolor articular, enfermedad isquémica, síndrome de miembro fantasma doloroso y dolor neuropático la evidencia tan solo se limita a reportes de casos, con resultados igualmente heterogéneos.
Lo anterior debe aumentar la motivación por realizar más estudios de investigación en los que se elijan pacientes con enfermedades que cumplan criterios diagnósticos claros que permitan su comparabilidad, utilizar protocolos adecuados para el uso de la BT y en los que se evalúen puntos finales óptimos con seguimientos adecuados para poder sacar conclusiones más certeras.
Finalmente, el uso del ultrasonido, en escenarios que impliquen la colocación de una aguja en algún tejido del organismo, es considerado una herramienta infaltable.
FinanciaciónLa financiación de esta revisión es con recursos propios y asesoría de la Universidad CES (Medellín, Colombia).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
A los señores Camilo Figueroa y Diego Salazar Uribe por su colaboración en la elaboración de las figuras.