La hiponatremia es el trastorno electrolítico más frecuente después de la cirugía intracraneal. Su etiología es multifactorial. A continuación presentamos un caso de un paciente sometido a una descompresión microvascular (cirugía de Janetta) como tratamiento de la neuralgia del trigémino que en el postoperatorio inmediato desarrolló una magnificación sintomática de su hiponatremia basal. Se diagnosticó un síndrome pierde sal, cuyo manejo supone un reto para los médicos implicados en los cuidados neuroquirúrgicos postoperatorios.
Hyponatremia is the most common electrolyte disorder following intracranial surgery. Its etiology is multifactorial. We present a case of a patient taken to microvascular decompression (Janetta surgery) for the treatment of trigeminal neuralgia who developed a symptomatic magnification of basal hyponatremia in the immediate post-operative period. Cerebral salt wasting syndrome was diagnosed. The management of this condition poses a challenge for physicians involved in postoperative neurosurgical care.
Los trastornos hidroelectrolíticos son una de las complicaciones de los traumatismos y procedimientos quirúrgicos craneales, siendo la hiponatremia el más común. Excluyendo el aporte excesivo de líquidos o fármacos, las causas más frecuentes de hiponatremia asociada a poliuria es el síndrome pierde sal de origen cerebral (SPS).
Caso clínicoPaciente de 58 años con neuralgia trigeminal (NT) programado para craneotomía suboccipital descompresiva microvascular con antecedentes de esclerosis múltiple (EM), termocoagulaciones previas y tratamiento domiciliario: oxcarbazepina, triptizol, tapentadol y fentanilo transcutáneo. Se realizó el procedimiento quirúrgico bajo anestesia general en decúbito supino con rotación cervical para abordaje retromastoideo. No se precisaron osmodiuréticos. Fue trasladado a la unidad de reanimación para vigilancia neurológica postoperatoria. Durante su estancia desarrolló un cuadro de cefalea holocraneal intensa, náuseas de difícil control, calambres musculares y tendencia a la poliuria (3ml/kg); fue valorado por neurocirugía, que no consideró indicado la realización de una TAC urgente. Se solicitó una bioquímica de control, con el hallazgo de una natremia de 117mEq·l−1(consulta de preanestesia 130mEq·l−1) y bioquímica urinaria con valores de sodio de 170mEq·l−1, iniciándose la reposición de la volemia con suero salino isotónico y corrección hidroelectrolítica con suero salino hipertónico al 3%, obteniéndose 24h después un sodio plasmático de 128mEq·l−1 y una diuresis de 150ml·h−1, con remisión completa del cuadro clínico.
DiscusiónLa NT consiste en descargas paroxísticas eléctricas en la zona de inervación del trigémino1. Puede presentarse de forma aislada o como consecuencia de enfermedades neurológicas mayores como la EM o tumores benignos de fosa posterior1. Los pacientes con EM tienen un riesgo 20 veces mayor2 de desarrollar una NT1. Mientras que la incidencia anual de NT en la población general es de 0,015%, en la EM es de 1,9 a 4,9%1. La hipótesis más probable de esta afección es la irritación de la arteria cerebelosa superior sobre la raíz del vpar craneal3,4. En los casos de NT y EM se asocia además a una lesión en la vía de las aferencias trigeminales presinápticas por la presencia de una placa desmielinizante1,5,6. En la actualidad existen 4 posibles terapias7: farmacológica, radiofrecuencia, rizotomía percutánea por termocoagulación, glicerol o por balón, y la descompresión microvascular (técnica de Jannetta)3. Esta última consiste en interponer un material autólogo o artificial entre el nervio y el vaso que produce la compresión, mediante una craneotomía retromastoidea3.
El cuadro de hiponatremia severa sintomática que presentó este paciente puede asociarse a múltiples factores que deben ser correctamente analizados e identificados. La hiponatremia supone el trastorno hidroelectrolítico más común en los pacientes hospitalizados8. Se define por valores plasmáticos de sodio inferior a 135mmol l−1. La gravedad del cuadro clínico depende de su curso agudo (menos de 48h) o crónico(más de 48h) y de su intensidad(grave si <115mmol l−1), siendo su etiología variable (tabla 1). Los síntomas más frecuentes son somnolencia, apatía, anorexia, calambres musculares, cefalea, náuseas, vómitos y estupor, pudiendo evolucionar a respiración de Cheyne-Stokes, convulsiones, coma y muerte. Desde el punto de vista perioperatorio, los diuréticos, los IECA y las carbamazepinas9 habitualmente empleadas en la NT constituyen las causas farmacológicas más frecuentes de hiponatremia. La oxcarbazepina9, tanto en monoterapia como en combinación con otros fármacos, puede conllevar un cuadro conocido como hiponatremia inducida por oxcarbazepina (HIO), dosis dependiente, con una incidencia del 23 al 73%, habitualmente asintomático9. Los mecanismos etiopatogénicos son diversos y la hipótesis más aceptada parece ser la liberación inadecuada y/o una mayor sensibilidad de la vasopresina tubular10, así como el incremento de agua y la pérdida secundaria de sodio. El cuadro de HIO suele presentarse de forma leve y asintomática, secundario a un proceso de hiperhidratación neuronal11 cuya gravedad se asocia a la rapidez de instauración del descenso absoluto del sodio plasmático, siendo clínicamente significativo con cifras menores de 125mmol l−1. Está ampliamente descrita en la literatura la asociación entre consumo de carbamazepina y derivados con la aparición de una secreción inadecuada de hormona antidiurética (SIADH)12.
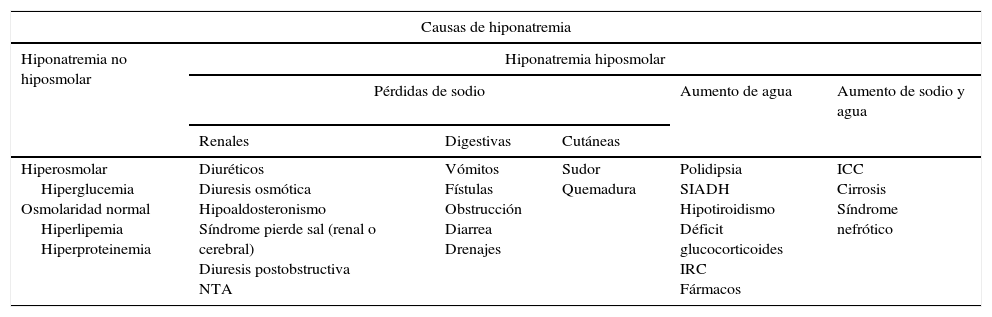
Causas de hiponatremia
| Causas de hiponatremia | |||||
|---|---|---|---|---|---|
| Hiponatremia no hiposmolar | Hiponatremia hiposmolar | ||||
| Pérdidas de sodio | Aumento de agua | Aumento de sodio y agua | |||
| Renales | Digestivas | Cutáneas | |||
| Hiperosmolar Hiperglucemia Osmolaridad normal Hiperlipemia Hiperproteinemia | Diuréticos Diuresis osmótica Hipoaldosteronismo Síndrome pierde sal (renal o cerebral) Diuresis postobstructiva NTA | Vómitos Fístulas Obstrucción Diarrea Drenajes | Sudor Quemadura | Polidipsia SIADH Hipotiroidismo Déficit glucocorticoides IRC Fármacos | ICC Cirrosis Síndrome nefrótico |
ICC: insuficiencia cardiaca congestiva; IRC: insuficiencia renal crónica; NTA: necrosis tubular aguda; SIADH: secreción inadecuada de ADH.
Fármacos relacionados con el desarrollo de hiponatremia: diuréticos (especialmente tiazidas), antipsicóticos (fenotiazinas y haloperidol), antidepresivos (ISRS, tricíclicos e IMAO), antiepilépticos (lamotrigina, carbamazepina, oxcarbazepina, ácido valproico), antibióticos, antiarrítmicos (amiodarona), antihipertensivos (IECA, ARA II, amlodipino), antineoplásicos y otros (AINE, IBP, etc.).
Fuente: autores.
Los datos de hiponatremia severa sintomática inducida por oxcarbazepina están muy limitados en la literatura9. Cuando se asocia con otras complicaciones frecuentes de los pacientes neuroquirúrgicos, que incluyen poliuria e hiponatremia, puede evolucionar de forma mortal.
Las 2 entidades que se asocian con mayor frecuencia a poliuria en el paciente neuroquirúrgico son la DI y el SPS, mientras que las que cursan con hiponatremia son el SPS y la SIADH13, condicionando ambas un cuadro de hiponatremia hipotónica con natriuresis elevada8. Tanto la DI como el SPS comparten algunos datos clínicos con la SIADH, como son la hiponatremia y la historia de lesión cerebral, mientras que otros hallazgos permiten establecer una clara diferencia (tabla 2), como la hipovolemia, la uresis excesiva y la natriuresis importante, con hormona antidiurética normal14.
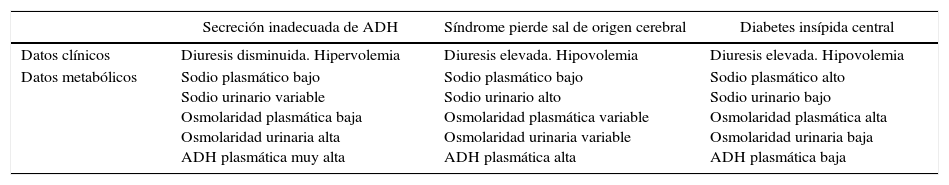
Diagnóstico diferencial clínico y metabólico entre la diabetes insípida central, secreción inadecuada de ADH y síndrome pierde sal
| Secreción inadecuada de ADH | Síndrome pierde sal de origen cerebral | Diabetes insípida central | |
|---|---|---|---|
| Datos clínicos | Diuresis disminuida. Hipervolemia | Diuresis elevada. Hipovolemia | Diuresis elevada. Hipovolemia |
| Datos metabólicos | Sodio plasmático bajo Sodio urinario variable Osmolaridad plasmática baja Osmolaridad urinaria alta ADH plasmática muy alta | Sodio plasmático bajo Sodio urinario alto Osmolaridad plasmática variable Osmolaridad urinaria variable ADH plasmática alta | Sodio plasmático alto Sodio urinario bajo Osmolaridad plasmática alta Osmolaridad urinaria baja ADH plasmática baja |
Fuente: modificado de Escudero Teixidó et al.13.
La distinción de los 3 cuadros clínicos descritos es fundamental por su diferente manejo, ya que deben ser rápidamente abordados mediante una reposición de las pérdidas hídricas en la diabetes insípida y el SPS, y una restricción de los líquidos en el SIADH. Por otro lado, en el SPS debe aportarse sodio; en la diabetes insípida, vasopresina, y en el SIADH, diuréticos13. Las determinaciones analíticas corroboraron nuestra sospecha de SPS: diuresis horaria elevada, sodio plasmático bajo, sodio urinario elevado y osmolaridad plasmática baja, que exacerbó un cuadro de HIO que presentaba basalmente el paciente (sodio plasmático preoperatorio de 130mEq l−1), evolucionando a una hiponatremia severa sintomática subsidiaria de corrección iónica.
El SPS fue inicialmente descrito por Peters et al. en 195013. El mecanismo por el cual una patología intracraneal causa un SPS es pobremente conocido8, habiéndose descrito varias hipótesis, como un descenso de la secreción de hormona adrenocorticotropa13, o la más aceptada en la actualidad, la liberación excesiva de péptido natriurético auricular (PNA) y cerebral (PNC)15,16, que inhiben directamente la reabsorción de sodio en el túbulo proximal e indirectamente aumentan la natriuresis por la inhibición del eje renina-angiotensina-aldosterona8, disminuyendo el volumen vascular efectivo, al mismo tiempo que el tono simpático8,13. EL PNC primariamente producido en los ventrículos cardiacos e hipotálamo es el más implicado en el desarrollo del SPS8. Esta entidad se presenta como un cuadro clínico consistente en poliuria y polidipsia, y como datos analíticos: hipernatriuria, hiponatremia, osmolaridad plasmática disminuida y urinaria variable13. La diferencia entre el SPS y la SIADH, ambos condicionantes de un estado de hiponatremia16, es la disminución del volumen extracelular y poliuria presentes en el SPS a diferencia del SIADH, con volumen extracelular aumentado y oliguria. El tratamiento del SPS consiste en la reposición del volumen intravascular mediante suero salino isotónico, reposición del sodio, en función de la gravedad del cuadro clínico, vía oral o parenteral, de forma lenta (no aumentando más de 8-10mEq l−1 en 24h) para evitar una mielinólisis central pontina, y la administración de fludrocortisona, que por su efecto potencial mineralocorticoide puede reducir la natriuresis8.
La hiponatremia es el trastorno hidroelectrolítico más común en los pacientes neuroquirúrgicos, siendo el SPS el más frecuente en este subgrupo17.
Su determinación etiológica y el manejo precoz resultan fundamentales para evitar un déficit neurológico permanente. La etiología de este trastorno es en muchos casos multifactorial, influido por tratamientos farmacológicos previos, como diuréticos y anticonvulsivantes, así como por los síndromes que cursan con hiponatremia, el SPS y la SIADH. Dado su manejo opuesto, una confusión en la identificación de la entidad responsable de este trastorno puede condicionar consecuencias nefastas.
Perspectiva del pacienteEl paciente percibió el manejo anestésico realizado como el que mayores beneficios aportaba dada la intervención quirúrgica y sus riesgos anestésicos asociados.
Consentimiento informadoSe obtuvo consentimiento informado.
FinanciaciónNuestro trabajo no ha sido financiado.
Conflicto de interesesNo existen conflictos de intereses.
Comité de éticaContamos con la aprobación por el comité de ética.
Identificación de datosSe han ocultado todos los datos de la paciente.