La hemorragia intracraneana (HIC) es la tercera causa indirecta no obstétrica de muerte materna. Describimos el manejo anestésico de una mujer de 32años con 22semanas de gestación, quien presentó hemorragia intracraneana debida a la rotura de una malformación arteriovenosa (MAV). Para el manejo de esta clase de pacientes se requiere un enfoque complejo con un plan altamente individualizado en el que participen neurocirujanos, neurorradiólogos, anestesiólogos, obstetras y neonatólogos a fin de evaluar los riesgos y los beneficios de las diferentes alternativas terapéuticas. Considerando el riesgo elevado de sangrado ulterior durante el embarazo y la localización de la MAV, se consideró que la mejor alternativa terapéutica en este caso era la craneotomía para extirpar por completo la lesión.
Intracranial haemorrhage (ICH) is the third leading non obstetric indirect cause of maternal death. We describe the anaesthetic management of a 32-year-old woman at 22weeks gestation with intracranial haemorrhage due to a ruptured arteriovenous malformation (AVM). Managing these patients requires a complex approach with a highly individualised plan involving neurosurgeons, neuroradiologists, anaesthetists, obstetricians and neonatologists to assess the risk and benefit of all the different therapeutic alternatives. Given the high risk of further bleeding during pregnancy and the location of the AVM, the best therapeutic option in this case was considered to be a craniotomy and complete removal of the lesion.
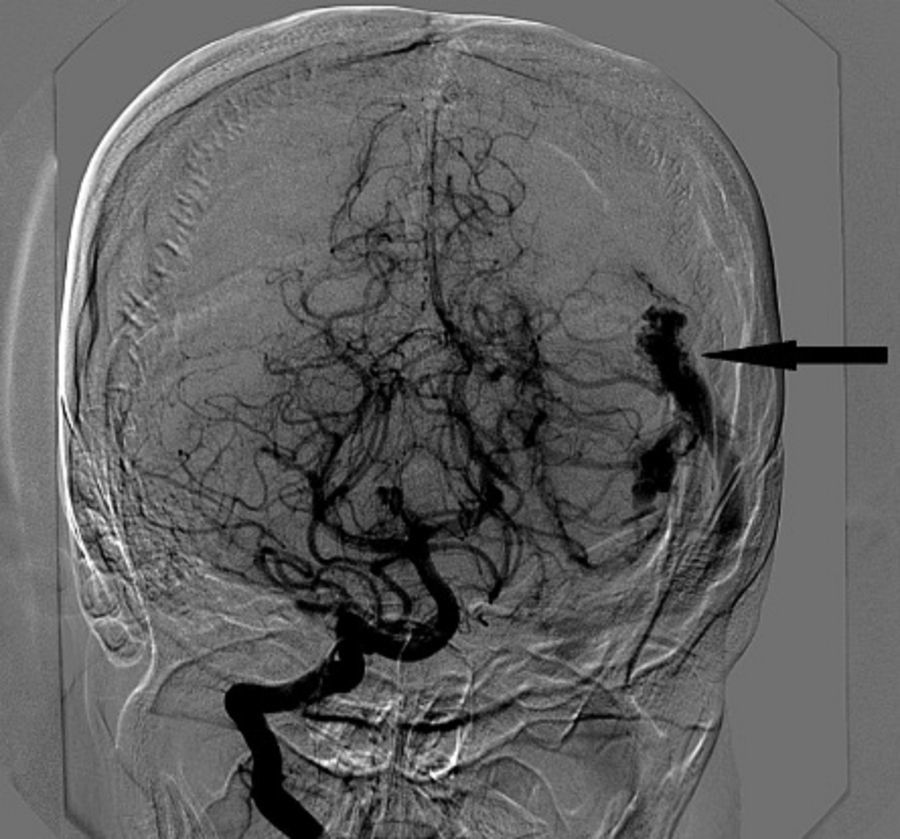
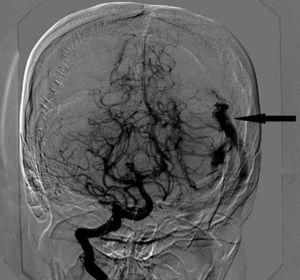
Reportamos el manejo anestésico de una mujer de 32años con 22semanas de gestación, quien presentó hemorragia intracraneana (HIC) a causa de la rotura de una malformación arteriovenosa (MAV) (fig. 1). La decisión de un equipo médico multidisciplinario fue realizar la craneotomía a fin de resecar la MAV bajo anestesia general.
Reporte de casoMujer de 32años de edad de 54kg de peso, P1D0, con 22semanas de gestación, sin historia médica previa, hospitalizada con cefalea severa asociada con náuseas y vómito.
Al examen físico se encontró un puntaje en la escala de coma de Glasgow (GCS) de 14, afasia, desorientación y hemianopsia derecha súbita. La ecografía abdominal mostró un solo feto vivo.
El estudio con tomografía computarizada del cerebro reveló un hematoma agudo de 37×27×45mm (volumen de 22ml) en la región temporooccipital izquierda, con edema circundante y un desplazamiento de 4mm de la línea media.
La angiografía cerebral reveló una MAV izquierda con vasos alimentadores de las arterias cerebral media y cerebral posterior izquierdas, y drenaje venoso a través del seno transverso superior (fig. 1).
La MAV era pequeña y se consideró que era fácilmente accesible a la resección quirúrgica. Un equipo médico multidisciplinario decidió realizar una craneotomía para resecar la MAV bajo anestesia general.
Se inició un esquema de corticoides 5días antes de la cirugía con el objetivo principal de reducir el edema cerebral. El monitoreo en el quirófano se basó en electrocardiografía, monitoreo no invasivo de la presión arterial, oximetría de pulso, capnografía y medición de la producción de orina cada hora. El monitoreo de la presión intraarterial se estableció antes de la inducción de la anestesia. El grupo de obstetricia decidió en contra del monitoreo de la frecuencia cardíaca fetal.
Se realizó inducción de secuencia rápida de la anestesia con presión cricoidea mediante el uso de 150μg de fentanilo, 160mg de propofol y 60mg de rocuronio (1mg kg−1) para facilitar la intubación traqueal y la ventilación con presión positiva. Después de la inducción de la anestesia se pasó una línea venosa central a la vena yugular interna derecha. La anestesia se mantuvo con oxígeno al 60%, sevoflurano al 1-1,5% e infusión continua de remifentanilo. El bloqueo neuromuscular se mantuvo con rocuronio.
Durante la cirugía, la paciente permaneció estable desde el punto de vista hemodinámico y respiratorio. La presión arterial sistólica se mantuvo entre 110 y 120mmHg, la frecuencia cardíaca en 85latidos/min, la saturación periférica de oxígeno (SpO2) en 99%, y la PaCO2 en el rango de 30 a 35mmHg.
El grupo de neurocirugía reportó condiciones adecuadas de relajación cerebral y no se requirieron medidas adicionales para prevenir el edema cerebral. La resección quirúrgica de la MAV fue exitosa.
La pérdida de sangre se calculó en 600ml, y se infundieron 3l de solución de Ringer1. La cirugía duró 4h. Al final de procedimiento se administraron 4mg de ondansetrón para reducir el riesgo de náuseas y vómito en el postoperatorio, y el bloqueo neuromuscular se revirtió con 2mg de neostigmina y 0,8mg de atropina.
La paciente despertó de la anestesia general sin déficit neurológico y se extubó en el quirófano. Los resultados postoperatorios de la frecuencia cardíaca fetal y la ecografía fueron normales. Se dio de alta a la paciente de la unidad de cuidado crítico al día 2, y el día 10 regresó a su domicilio.
DiscusiónLa incidencia de la HIC durante el embarazo es aproximadamente de 1 en 10.0002. Esta condición se asocia con una tasa de mortalidad del 40%3. Una de las causas posibles de la HIC durante la gestación son las malformaciones arteriovenosas. La mayoría de los autores recomiendan el manejo conservador de las MAV no rupturadas en las gestantes4. Sin embargo, una MAV por lo general solo se diagnostica durante el embarazo cuando se rompe. Se calcula que el riesgo de repetirse la hemorragia en las pacientes gestantes oscila entre el 25-50%5. Esto se explica con base en los cambios hormonales que pueden contribuir al reblandecimiento del tejido conectivo vascular y el aumento fisiológico del gasto cardíaco5.
Por esta razón, las alternativas terapéuticas son limitadas durante el embarazo, lo cual exige un tratamiento proactivo y precoz que permita controlar la lesión de manera definitiva a fin de prevenir una nueva hemorragia3,4. Esta fue la razón por la cual se descartó el manejo conservador en este caso.
Entre las alternativas terapéuticas se cuentan la embolización endovascular, la radiocirugía y la resección quirúrgica6. Los mejores resultados se obtienen con una terapia multimodal y un enfoque multidisciplinario, con altas tasas de recuperación y la prevención de la hemorragia6. El régimen de tratamiento se debe planear cuidadosamente con base en la edad de la paciente, la condición neurológica y el grado Spetzler-Martin de la MAV.
La embolización de la MAV como único tratamiento se traduce en una tasa de recuperación del 20%3. Por consiguiente, no se la considera una terapia definitiva en la mayoría de los casos. La utilidad de la embolización de las MAV se hace más relevante cuando se utiliza antes de la resección quirúrgica con el propósito de reducir el tamaño de la lesión.
Con ella se logra reducir el flujo sanguíneo en la MAV y se facilita la resección quirúrgica posteriormente6. Durante la neurorradiología intervencionista, la dosis máxima de radiación para el feto no debe ser mayor de 0,5 a 1rem (10mSievert)5. La exposición fetal se puede reducir adoptando medidas de protección radiológica5. El agente embólico líquido Onyx® (ev3 Neurovascular, Irvine, California) es un copolímero del alcohol de vinilo de etileno disuelto en dimetilsulfóxido (DMSO)2. Aunque se considera que es químicamente inerte, todavía está por determinarse su seguridad durante el embarazo2. Por tanto, la embolización de una MAV durante la gestación sigue siendo tema de controversia4.
La radiocirugía consiste en aplicar la radiación en el nido de la MAV a fin de promover la proliferación endotelial para que ocluya progresivamente la malformación en el transcurso de 2 a 3años. Además, la radiación requerida para el procedimiento excluye la posibilidad de este tratamiento en el caso de las pacientes gestantes6.
La resección neuroquirúrgica representa la mejor alternativa de tratamiento para la rotura de una MAV, sola o en combinación con la embolización preoperatoria6. Las tasas de curación con la resección quirúrgica son cercanas al 90%4. Es el tratamiento más definitivo, puesto que al extirpar la lesión se evita la posibilidad de que se repita una hemorragia5. Hay pocos casos reportados anteriormente de resecciones de MAV durante el embarazo. La decisión de operar depende del grado en el sistema de Spetzler-Martin, para el cual se toman en consideración la localización, el tamaño y el patrón de drenaje venoso. En este caso, la MAV era accesible, estaba localizada en un área no elocuente del cerebro, y era de gradoiii en el sistema de clasificación de Spetzler-Martin.
A la luz de la baja morbimortalidad maternofetal asociada con este procedimiento, la resección quirúrgica se ha convertido en el tratamiento estándar de estos casos raros en nuestra institución.
La fisiología maternofetal y el control de la presión arterial determinan las consideraciones anestésicas durante el embarazo7. Los objetivos principales durante la cirugía fueron mantener la estabilidad hemodinámica para así garantizar perfusión uteroplacentaria y oxigenación fetal adecuadas, y mantener al mismo tiempo una profundidad apropiada de la anestesia y evitar episodios de hipertensión intracraneana y el riesgo de nuevo sangrado5. La presión arterial se debe monitorear de manera invasiva para mantener un control hemodinámico estrecho y el flujo sanguíneo cerebral, además de la perfusión uteroplacentaria. En la literatura hay pocos casos de preservación fetal en los cuales se haya utilizado una técnica anestésica con hipotensión durante procedimientos neurológicos8. Descartamos esa estrategia al sopesar el riesgo quirúrgico de hemorragia materna de una MAV accesible versus el riesgo de asfixia fetal. En nuestro caso decidimos preservar el embarazo en vista de la edad gestacional, de manera que evitamos una presión arterial media inferior a los 70mmHg9.
En las pacientes gestantes con rotura de MAV es prioritario determinar si hay una emergencia neuroquirúrgica10 que requiera manejo urgente independientemente de la edad gestacional. Si la edad gestacional es avanzada11, se recomienda terminar el embarazo para permitir la recuperación y más adelante proponer la resección quirúrgica de la lesión con base en los algoritmos3.
La mejor modalidad de parto en las pacientes con MAV no tratadas sigue siendo tema de controversia (parto vaginal instrumentado modificado o cesárea) y al parecer no modifica el desenlace para el feto o la madre6. La necesidad de mantener un sistema cardiovascular estable influye en la selección de la técnica anestésica. Debido a la rareza de esta condición no existe una guía definitiva7. Ningún método anestésico es superior a otro.
Podría ser preferible una técnica de anestesia regional si se considera el parto antes de practicar la neurocirugía6 porque permite el monitoreo neurológico con la paciente despierta y evita los cambios hemodinámicos que se producen durante la anestesia general. Sin embargo, puede haber complicaciones.
La anestesia raquídea proporcionaría un bloqueo simpático denso con hipotensión secundaria, requiriéndose soporte con vasoconstrictores. Una disminución de la presión arterial puede desencadenar náusea y vómito, lo cual a su vez puede aumentar la presión intracraneana (PIC)3.
La técnica epidural permite incrementar la dosis de anestésico local, evitando así aumentos de la PIC y garantizando unos cambios hemodinámicos graduales. Sin embargo, una punción accidental de la dura con una aguja Tuohy calibre18 y escape de líquido cefalorraquídeo puede producir un descenso de la PIC con tracción sobre la dura, lo cual puede dar lugar a un nuevo sangrado o incluso herniación3.
La anestesia general evitaría eventos neurológicos debidos a una punción accidental de la dura y permitiría mantener controlados los niveles maternos de PaCO2 en un rango de 25-30mmHg. Sin embargo, durante la inducción de la anestesia pueden ocurrir cambios hemodinámicos. Un aumento de la presión arterial lleva a cambios de las presiones transmurales de la MAV, incrementando el riesgo de rotura3. Además, las mujeres en estado avanzado de embarazo tienen un mayor riesgo de broncoaspiración e intubación difícil de la tráquea. Durante la anestesia general es importante prestar atención a un sangrado vaginal6.
Si la resección de la MAV y el parto ocurren en el mismo tiempo quirúrgico, es obligatoria la anestesia general.
En resumen, después de que un equipo médico multidisciplinario10 evaluase el riesgo elevado de sangrado ulterior de la lesión, asociado con una elevada morbimortalidad maternofetal, se decidió que la conducta más apropiada era la resección quirúrgica de la MAV a través de una craneotomía. La función del anestesiólogo durante la craneotomía para la resección de una MAV durante el embarazo consiste en asegurar la estabilidad cardiovascular materna y la perfusión uteroplacentaria, garantizando al mismo tiempo unas condiciones óptimas para el procedimiento neuroquirúrgico.
Perspectiva de la pacienteLa paciente percibió que el manejo anestésico fue el más seguro para ella y el feto.
Consentimiento informadoSe obtuvo el consentimiento informado.
Conflictos de interesesNo hay conflicto de intereses.
Comité de éticaContamos con la aprobación del comité de ética.
Datos de identificaciónNo se identifican los datos de la paciente.
Conflicto de competenciaNo se recibieron fondos externos y no hay conflicto de competencia.