El embarazo gemelar monocorial (MC) se presenta en uno de cada 250 embarazos y representa una proporción significativa de morbi mortalidad perinatal en los embarazos gemelares y en general. El manejo óptimo de los MC se basa en 2 aspectos fundamentales: clasificación temprana de la corionicidad y seguimiento estricto. El diagnóstico diferencial de las complicaciones del MC sigue siendo todavía un reto para el especialista de medicina fetal. Esto se debe a la frecuente superposición de signos clínicos y a las relaciones complejas entre las potenciales complicaciones. La experiencia clínica demuestra que en la mayoría de los casos la clasificación y el manejo adecuado se pueden lograr mediante la aplicación sistemática de conceptos sencillos. Esta revisión proporciona una visión global que permite una compresión integral de los embarazos gemelares MC, sus posibles complicaciones y los conceptos claves que permiten un diagnóstico diferencial adecuado y un manejo específico.
Monochorionic twin pregnancy (MC) occurs in one in 250 pregnancies and represents a significant proportion of perinatal morbidity and mortality in twin pregnancies, and in general. The optimal management of MC is based on two fundamental aspects: early classification of chorionicity and close monitoring. The differential diagnosis of the complications of MC is still a challenge to the fetal medicine specialist. This is due to the frequent overlap of clinical signs and the complex relationships between the potential complications. However, the differential diagnosis and subsequent decisions are based on relatively simple rules. While some cases can be really complicated, clinical experience shows that in most cases proper classification and management can be achieved through the consistent use of simple concepts. This review provides an overview that allows a comprehensive understanding of MC twin pregnancies, the typical complications and the key concepts that allow an appropriate differential diagnosis and specific management.
El embarazo gemelar monocorial (MC) se presenta en uno de cada 250 embarazos y representa cerca del 20% de los gemelares y el 70% de los monocigóticos1. Los MC son responsables de una proporción significativa de morbi mortalidad perinatal en los embarazos gemelares2,3. La tasa de mortalidad perinatal es aproximadamente 2 veces mayor que la de los bicoriales y 4 veces mayor que la de los embarazos únicos4. En cuanto a la tasa de morbilidad neurológica es de 4 a 5 veces más alta que la de los bicoriales y por lo tanto de 25 a 30 veces más alta que la de los únicos. Podemos decir entonces, que uno de cada 3 MC va a tener algún tipo de complicación durante el transcurso del embarazo5.
El manejo óptimo de los MC se basa en 2 aspectos fundamentales: clasificación temprana de la corionicidad y seguimiento estricto. El diagnóstico de la corionicidad debe ser llevado a cabo antes de la semana 15, demostrando la presencia del signo T (unión directa de las 2 membranas amnióticas sin interposición de corion), lo cual es posible en casi el 100% de los casos a esta edad gestacional6. El diagnóstico temprano y el manejo oportuno pueden mejorar sustancialmente el pronóstico de las complicaciones de los MC.
El diagnóstico diferencial de las complicaciones del MC sigue siendo todavía un reto para el especialista de medicina fetal. Esto se debe a la frecuente superposición de signos clínicos y a las relaciones complejas entre las potenciales complicaciones. Sin embargo, el diagnóstico diferencial y las decisiones posteriores se basan en reglas relativamente simples. Mientras que algunos casos pueden ser realmente complicados, la experiencia clínica demuestra que en la mayoría de los casos la clasificación y el manejo adecuado se pueden lograr mediante la aplicación sistemática de conceptos sencillos.
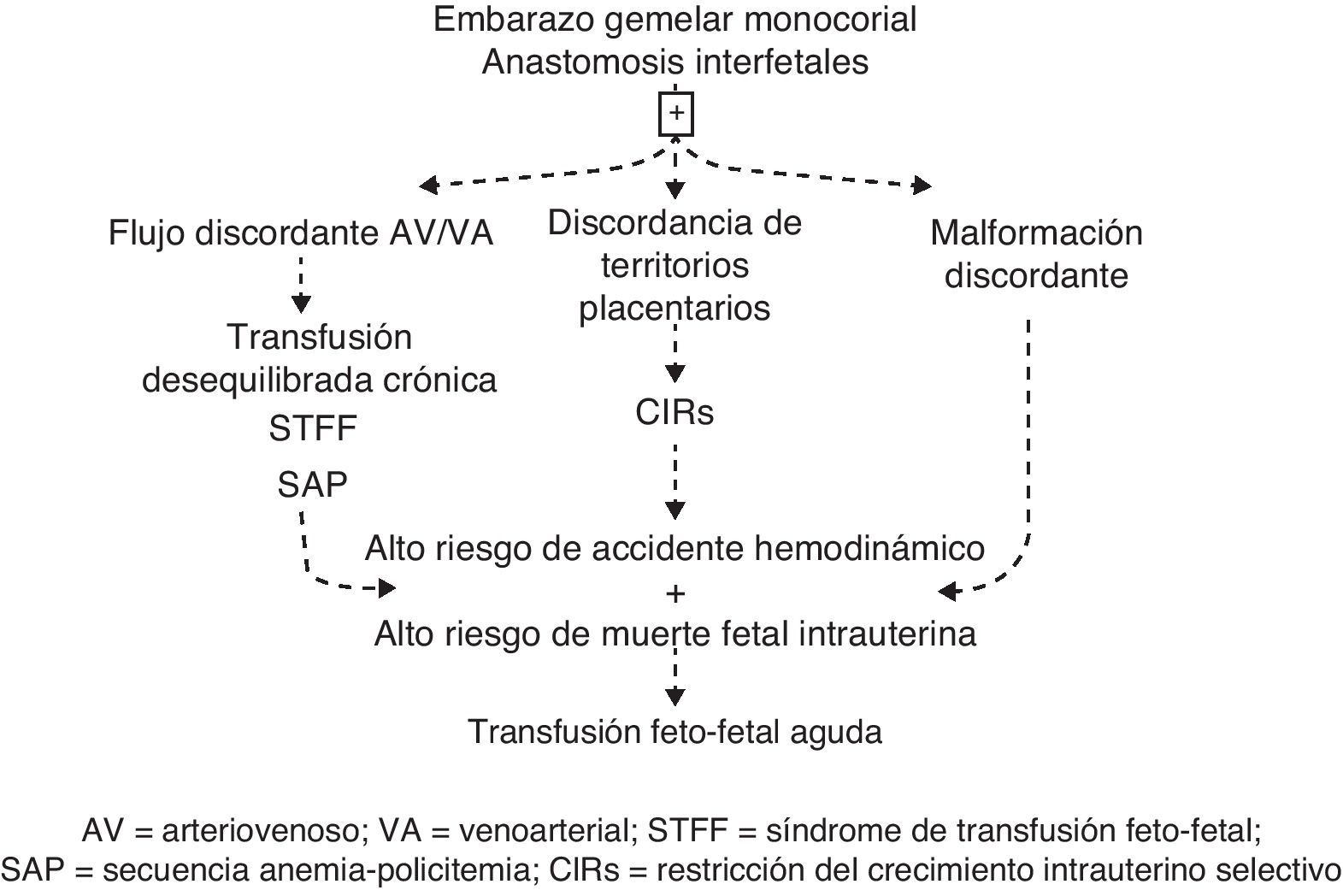
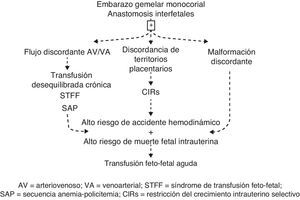
Características únicas de la placenta del embarazo monocorialLa característica fundamental de los embarazos gemelares MC es la presencia de anatomosis vasculares placentarias, las cuales pueden ser arterio-arterial (AA), veno-venosa (VV) o arterio-venosa (AV)7. Estas conexiones placentarias ocasionan un flujo sanguíneo feto-fetal en ambas direcciones, lo que representa una especie de tercera circulación entre los gemelos, lo cual es una característica única en la patología humana. Las anastomosis pueden ocasionar las complicaciones del MC por sí mismas o por combinación con otros factores, tales como discordancia de los territorios placentarios y/o malformaciones fetales8.
Como se mencionó, una de las dificultades del manejo clínico de los MC es que la existencia de una complicación no excluye las otras. Con frecuencia hay cierta superposición, especialmente entre los síndromes de transfusión y la restricción del crecimiento. No obstante, un enfoque sistemático permitirá establecer el diagnóstico que prevalece en cada caso particular, lo cual determinará el tipo de manejo a seguir.
En esta revisión proponemos agrupar las complicaciones del embarazo gemelar MC en 4 tipos principales de problemas clínicos: la transfusión crónica, la transfusión aguda, la restricción del crecimiento y la malformación discordante. Las interrelaciones entre estas complicaciones se ilustran en la figura 1.
Resumen del control y seguimiento en embarazos gemelares monocorialesEl control del embarazo MC se puede dividir en 3 fases principales, en las que los objetivos principales son diferentes:
- -
12-14 semanas: el diagnóstico precoz de la corionicidad y descartar malformaciones estructurales evidentes.
- -
15-28 semanas: la detección precoz y el tratamiento de complicaciones graves susceptibles de terapia fetal (síndrome de transfusión feto-fetal [STFF] y restricción del crecimiento intrauterino selectivo [CIRs] de aparición temprana).
- -
29-36 semanas: la detección precoz de complicaciones principalmente, pero no exclusivamente, susceptibles de parto electivo (STFF y CIRs de aparición tardía, secuencia anemia-policitemia [SAP]).
Independientemente de estas fases principales, el seguimiento de los embarazos MC debe hacerse en intervalos de 2 semanas para poder detectar lo antes posible el STFF, el cual puede aparecer días después de un examen normal. El uso de predictores a la semana 12 como el doppler del ductus venoso, translucencia nucal y la discordancia de los perímetros abdominales puede ayudar a identificar casos de alto riesgo9. Sin embargo, la sensibilidad de estos marcadores no es muy alta, de tal forma que desde un punto de vista práctico todas las gestaciones MC deben ser seguidas, de todos modos, cada 2 semanas. El seguimiento debe incluir un control ecográfico, que podría limitarse a la evaluación subjetiva del líquido amniótico y de los perímetros abdominales fetales junto con evaluaciones ecográficas estándares en las semanas 20, 28 y 32. Aunque la probabilidad de complicaciones graves es menor más allá de las 28 semanas, estas pueden ocurrir y aún progresar rápidamente. Teniendo en cuenta la baja prevalencia de los embarazos MC creemos que el régimen de seguimiento cada 2 semanas hasta el final de la gestación es el método más razonable. Aunque el riesgo de muerte fetal intrauterina en gestaciones MC aparentemente sin complicaciones parece ser muy bajo, sus consecuencias pueden ser devastadoras10. Por lo tanto hay cierto consenso en que para los embarazos MC sin complicaciones, el parto electivo alrededor de las 36-37 semanas constituye un enfoque razonable11.
Objetivos de esta revisiónEsta revisión no pretende hacer un resumen completo de todas las complicaciones de los MC, lo que superaría ostensiblemente el alcance de una única revisión. Nuestro objetivo principal es proporcionar una visión alternativa a las habituales, con el objetivo de aportar una compresión más integral de los embarazos gemelares MC, sus posibles complicaciones y los conceptos claves que permiten un diagnóstico diferencial adecuado y un manejo específico.
Síndromes de transfusión feto-fetal crónicos: síndrome de transfusión feto-fetal y secuencia anemia-policitemiaLa transfusión crónica interfetal, y en particular el STFF, es la complicación más conocida de los MC. Tanto el STFF como la SAP son el resultado de un flujo sanguíneo neto desequilibrado de un gemelo al otro a través de anastomosis AV, pero con una notable diferencia en la magnitud de dicho flujo. Por lo tanto encontramos diferencias sustanciales entre ellos en diferentes aspectos, tales como la fisiopatología, la presentación clínica y el pronóstico.
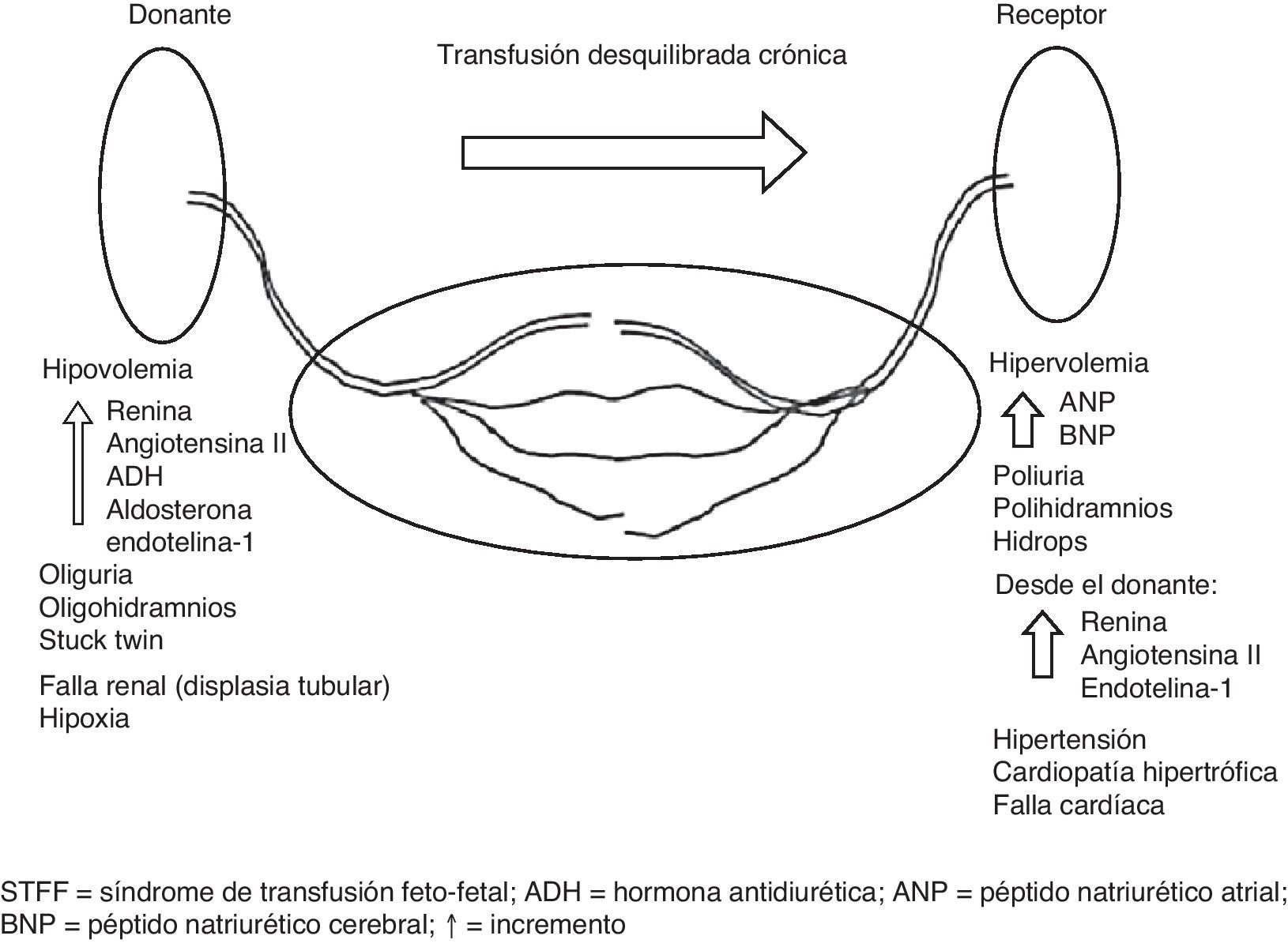
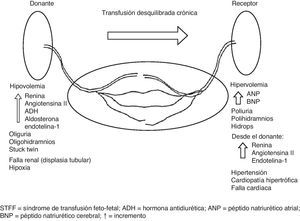
Síndrome de transfusión feto-fetalEl STFF se presenta en el 10-15% de todos los MC12. La base para su desarrollo es la presencia de flujo discordante a través de anastomosis AV y VA13. En la mayoría de los casos hay una predominancia en el número y/o diámetro de las anatomosis AV que van del donante hacia el receptor14. Es muy probable que dicho flujo desequilibrado asociado a otros factores como la discordancia de peso fetal, el crecimiento de la placenta, las inserciones de los cordones o las malformaciones fetales sean el factor desencadenante para la presencia de este síndrome en casos individuales.
El STFF es un desorden hemodinámico severo que lleva a cambios adaptativos importantes, los cuales están resumidos en la figura 215,16. Independientemente de la fisiopatología compleja de este síndrome, se acepta en general que el STFF está asociado a cambios en la diuresis fetal que llevan a diferencias obvias tanto de la columna máxima de líquido amniótico (CM-LA) como del tamaño de las vejigas. Mientras hay diferencias en el punto de corte de la CM-LA que se usa por encima de la semana 20, hay consenso general en los criterios diagnósticos (tabla 1). Estos se basan en el uso de la CM-LA y del tamaño de la vejiga como signos claves para el diagnóstico del STFF. Hay también consenso en que se deben usar criterios estrictos para definir y tratar un caso como STFF17.
Criterios diagnósticos y estadios de severidad del STFF
| Criterios diagnósticos |
| Embarazo gemelar monocorial confirmado |
| Polihidramnios en el receptor con una CM-LA ≥ 8 cma |
| Oligohidramnios en el donante con una CM-LA < 2 cm |
| Vejigas fetales discordantes con una muy grande en el receptor y una muy pequeña o no visible en el donante durante la mayor parte del examen |
| Estados de severidad |
| I La vejiga del donante es aún visible en el donante |
| II La vejiga del donante ya no es visible |
| III Doppler críticamente anormal en cualquiera de los 2 gemelos: arteria umbilical con flujo diastólico ausente-revertido en el donante o en el receptor y/o ductus venoso con flujo ausente-revertido en la onda A o vena umbilical con flujo pulsátil en el receptor |
| IV Hidrops en cualquiera de los 2 fetos |
| V Muerte intrauterina de uno o ambos gemelos |
El punto de corte por encima de las 20 semanas sigue siendo tema de debate. Un punto de corte ≥10cm más allá de las 20 semanas ha sido utilizado en estudios aleatorizados y es usado comúnmente por los grupos europeos mientras que un punto de corte ≥8cm se usa generalmente en los Estados Unidos. Ambos puntos de corte se consideran aceptables para el diagnóstico.
Es importante destacar que el diagnóstico del STFF no tiene en cuenta las diferencias en el peso fetal ni la información dada por el doppler. Desde el punto de vista clínico, un número considerable de casos de STFF se combinan con CIRs, más comúnmente en el gemelo donante. Sin embargo, esto es irrelevante para las decisiones terapéuticas. Una vez se ha hecho el diagnóstico, se puede clasificar en estadios de severidad. La clasificación de Quintero es la más utilizada y la resumimos en la tabla 118.
El STFF es, siempre, una condición grave que tiene una alta tasa de morbilidad perinatal (discapacidad neurológica 40-80%) y mortalidad fetal (100% antes de las 20 semanas, 80% entre las 21 y 26 semanas) si no se trata. En consecuencia, se requiere una terapia urgente debido a que puede progresar rápidamente e incluso causar la muerte, aun en estadios tempranos19. El tratamiento de elección entre las semanas 15 y 28 es la coagulación con láser de las anastomosis placentarias, la cual revierte las manifestaciones del síndrome, y se asocia con una supervivencia global del 80-90% para por lo menos uno de los fetos20. En lugares en donde la cirugía láser no sea posible, se podría usar el amniodrenaje como medida paliativa. Este puede ser útil prolongando la gestación y mejorando la supervivencia (50-60% en al menos un feto), pero corriendo con los riesgos de una tasa mucho más alta de discapacidad neurológica (29-35% vs 11-16% con cirugía láser)21,22.
Secuencia anemia-policitemiaLa SAP se presenta de forma espontánea en el 3-5% de los MC, por lo general como una complicación del tercer trimestre23. Se desarrolla en presencia de anastomosis AV muy pequeñas, lo que lleva a un flujo interfetal discordante, pero con una velocidad y/o magnitud mucho menor que en el STFF24. Esta transfusión crónica sutil lleva a la SAP, pero al parecer permite una adaptación suficiente del feto evitando los grandes trastornos hemodinámicos del STFF.
La SAP también puede ocurrir como una complicación de la cirugía láser para el STFF al coagularse de forma incompleta las anastomosis placentarias. Esta SAP «iatrogénica» se presenta en el 2-6% de los casos, dependiendo de las definiciones usadas y de la experiencia25.
Ya sea de una forma espontánea o «iatrogénica», se debe buscar activamente por medio del uso rutinario del doppler de la arteria cerebral media (ACM), ya que no se presentan otras manifestaciones. El diagnóstico prenatal se establece con base en las diferencias de los picos de velocidad de la sístole (PVS) de la ACM26. Una proporción importante de casos de SAP se diagnostican después del nacimiento. Los criterios de diagnóstico neonatal se basan en la presencia de discordancia severa en los valores de hemoglobina y reticulocitos. Los criterios de diagnóstico pre- y postnatal se muestran en la tabla 2.
Criterios diagnósticos de la secuencia anemia-policitemia
| Prenatal | PVS-ACM > 1,50 MoM en el donante y PVS-ACM < 0,80 MoM en el receptor |
| Postnatal | Diferencia de hemoglobina > 8,0 g/dl y tasa de reticulocitos (donante/receptor) > 1,7 |
PVS-ACM: pico de velocidad sistólica de la arteria cerebral media.
Basada en: Slaghekke et al.26.
El pronóstico en los casos espontáneos es generalmente bueno y la mayoría de las veces puede ser manejado de forma expectante27. La SAP iatrogénica es generalmente más agresiva y requiere tratamiento. La terapia se indica normalmente si la discordancia de los PVS de la ACM progresa rápidamente o si se observan signos pre-hidrópicos en el donante. El único tratamiento etiológico es la cirugía láser. Los desafios técnicos de una segunda operación, tales como LA normal en el saco del donante o LA teñido debido a la cirugía anterior, podrían dificultar o aun impedir dicha opción. Un esquema de tratamiento alternativo, que ha conseguido buenos resultados, lo constituyen las transfusiones intrauterinas periódicas en los donantes28. Estas se deben realizar preferiblemente por vía intraperitoneal para reducir al mínimo el paso rápido de sangre al receptor.
Transfusión feto-fetal agudaLa transfusión feto-fetal aguda ocurre cuando hay una caída repentina de la tensión arterial y/o de la frecuencia cardíaca en uno de los 2 fetos. Esto conduce a una masiva transfusión unidireccional y a una exanguinación aguda de un gemelo en la circulación del otro feto29. Las consecuencias dependen de la magnitud y de la duración de la transfusión. La magnitud de la transfusión aguda depende del tamaño, tipo y dirección de las anastomosis entre los fetos. Fetos con muy pocas anastomosis pequeñas están mucho menos expuestos que aquellos con grandes anastomosis AV o AA. Por lo tanto pueden variar desde ninguna consecuencia hasta el daño cerebral o incluso la muerte del feto normal.
La transfusión feto-fetal aguda puede ocurrir en 3 situaciones:
Después de la muerte de un fetoLa transfusión se produce desde el feto que sobrevive hacia el feto muerto. El gemelo sobreviviente tiene un riesgo de lesión cerebral del 18-34% y de muerte como consecuencia de la exanguinación aguda del 15%30. La muerte fetal única puede representar el estadio final de cualquiera de las complicaciones conocidas de los MC. Por lo tanto su prevención es uno de los objetivos primordiales en estos casos.
Con los 2 fetos vivosSe cree que estos accidentes son la causa de lesiones cerebrales postnatales inexplicables en embarazos gemelares MC de evolución aparentemente normal y es una de las complicaciones típicas del CIRs tipo iii, como explicaremos más adelante. La causa más probable es la aparición de un episodio de bradicardia/hipotensión en uno de los gemelos. Los estudios doppler han demostrado una masiva transfusión feto-fetal aguda durante episodios de bradicardia fetal en gemelos con anastomosis AA grandes, lo que puede implicar consecuencias devastadoras31. El «donante agudo» estará expuesto a un alto riesgo de lesión cerebral o muerte. A su vez, el «receptor agudo» puede tolerar la transfusión repentina o morir a causa de la hipervolemia. La muerte fetal puede ser tanto la causa como la consecuencia de una transfusión feto-fetal aguda. Por lo tanto, cuando se diagnostica una muerte fetal única o doble en gemelos MC, normalmente es imposible saber lo que pasó en primer lugar.
Durante el partoEste es un accidente poco frecuente, con una incidencia del 1,8-5,5%, que se presenta en el segundo feto después del nacimiento del primer gemelo, llevando a valores de hemoglobina muy discordantes32. El diagnóstico diferencial con la SAP se hace basado en el recuento de reticulocitos, el cual es normal en la transfusión intraparto debido a la naturaleza aguda del evento. A pesar de que no hay grandes series, la experiencia clínica sugiere que el pronóstico de esta entidad es bueno. No obstante hay algunos casos reportados de muerte fetal33,34.
Restricción de crecimiento intrauterino selectivoRestricción de crecimiento intrauterino selectivo precozEl CIRs precoz afecta el 10% de los MC35. Se define como la presencia de un peso fetal estimado (PFE) inferior al percentil 10 en uno de los fetos36. Su asociación con una discordancia de PFE ≥ 25% es muy frecuente.
La razón principal para su desarrollo es la discrepancia en el tamaño de los territorios placentarios. Sin embargo, la característica fundamental del CIRs es la coexistencia de anastomosis interfetales, las cuales tienen una fuerte injerencia en la evolución de la restricción del crecimiento37. Gracias al intercambio de flujo sanguíneo, el feto con CIRs recibe sangre oxigenada del feto normal, lo que ha sido denominado como una «transfusión de rescate», debido a que induce efectos claramente beneficiosos en el feto con CIRs.
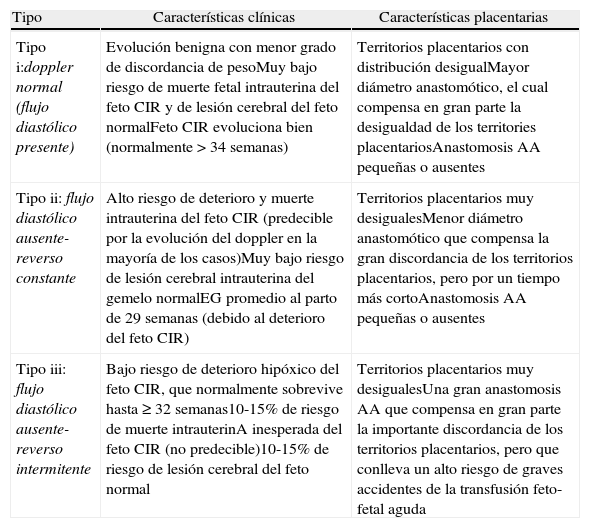
La cantidad y el tipo de flujo interfetal cambia en función del número y tipo de anastomosis, lo cual determinará una amplia variación en el comportamiento clínico del CIRs. Sin embargo, desde un punto de vista práctico, el tipo de doppler de la arteria umbilical (AU) del feto con CIRs refleja 3 patrones clínicos relativamente bien definidos (tabla 3)38.
Tipos de CIRs de acuerdo a las características del doppler de la arteria umbilical del feto con CIRs. Principales características clínicas y placentarias de cada tipo
| Tipo | Características clínicas | Características placentarias |
| Tipo i:doppler normal (flujo diastólico presente) | Evolución benigna con menor grado de discordancia de pesoMuy bajo riesgo de muerte fetal intrauterina del feto CIR y de lesión cerebral del feto normalFeto CIR evoluciona bien (normalmente > 34 semanas) | Territorios placentarios con distribución desigualMayor diámetro anastomótico, el cual compensa en gran parte la desigualdad de los territories placentariosAnastomosis AA pequeñas o ausentes |
| Tipo ii: flujo diastólico ausente-reverso constante | Alto riesgo de deterioro y muerte intrauterina del feto CIR (predecible por la evolución del doppler en la mayoría de los casos)Muy bajo riesgo de lesión cerebral intrauterina del gemelo normalEG promedio al parto de 29 semanas (debido al deterioro del feto CIR) | Territorios placentarios muy desigualesMenor diámetro anastomótico que compensa la gran discordancia de los territorios placentarios, pero por un tiempo más cortoAnastomosis AA pequeñas o ausentes |
| Tipo iii: flujo diastólico ausente-reverso intermitente | Bajo riesgo de deterioro hipóxico del feto CIR, que normalmente sobrevive hasta ≥ 32 semanas10-15% de riesgo de muerte intrauterinA inesperada del feto CIR (no predecible)10-15% de riesgo de lesión cerebral del feto normal | Territorios placentarios muy desigualesUna gran anastomosis AA que compensa en gran parte la importante discordancia de los territorios placentarios, pero que conlleva un alto riesgo de graves accidentes de la transfusión feto-fetal aguda |
Modificada de: Gratacós et al.38.
CIRs: restricción del crecimiento intrauterino selectivo; EG: edad gestacional.
Desde el punto de vista del pronóstico, los tipos descritos en la tabla 3 se pueden dividir en 2: aquellos con un pronóstico bastante bueno (tipo i) y aquellos con alto riesgo de complicaciones graves (tipos ii y iii). De hecho, los CIRs tipo ii y iii tienen también un alto riesgo de parto muy prematuro, muerte fetal intrauterina y secuelas neurológicas. Además de estas características comunes, el CIRs tipo iii se caracteriza por la presencia de grandes anastomosis AA, que son las que determinan el aspecto típico de flujo intermitente en la AU, una supervivencia intrauterina más larga de lo esperado del feto con CIRs y un mayor riesgo de lesiones neurológicas en el feto normal. Se cree que estas últimas son ocasionadas por episodios de transfusión aguda como se discutió anteriormente.
El manejo de los fetos con CIRs está fuera del alcance de esta revisión. Sin embargo podemos decir que el tipo i puede ser manejado de forma expectante hasta las 34-35 semanas ya que en la mayoría de los casos el pronóstico es bueno. Por el contrario, los tipos ii y iii tienen un mal pronóstico. Sin embargo, a diferencia del STFF, el pronóstico y la evolución de los CIRs tipos ii y iii pueden estar en gran medida condicionados por la edad gestacional (EG) al diagnóstico y la severidad del mismo. Además los deseos de los padres y sus expectativas acerca del resultado del feto con CIRs y de los riesgos del gemelo normal pueden influir sus decisiones. Por lo tanto, las diferentes opciones que van desde el manejo expectante hasta la terapia activa pueden ser igualmente aceptables. La oclusión del cordón umbilical y la cirugía láser se pueden ofrecer, logrando de esta forma una supervivencia sin secuelas del feto normal y una prolongación del embarazo.
Restricción de crecimiento intrauterino tardíaEn el 5% de los casos de una gran cohorte de gemelos MC se describió un crecimiento concordante en el segundo trimestre que va a mostrar señales progresivas de discordancia a partir del tercer trimestre39. Su angioarquitectura placentaria y evolución clínica son diferentes cuando se comparan con el CIRs temprano y tienen en general un buen pronóstico.
Diagnóstico diferencial entre el síndrome de transfusión feto-fetal y la restricción precoz del crecimiento intrauterino y el manejo de «nada por el momento»El diagnóstico diferencial entre estas 2 complicaciones de los gemelos MC ha sido históricamente una fuente de confusión. Posiblemente, series no propectivas de complicaciones de los embarazos MC incluyen proporciones variables de casos con diagnósticos equivocados, lo que sería la causa de las notables diferencias que se encuentran al revisar la literatura. Afortunadamente esta situación ha mejorado considerablemente en los estudios publicados en la última década.
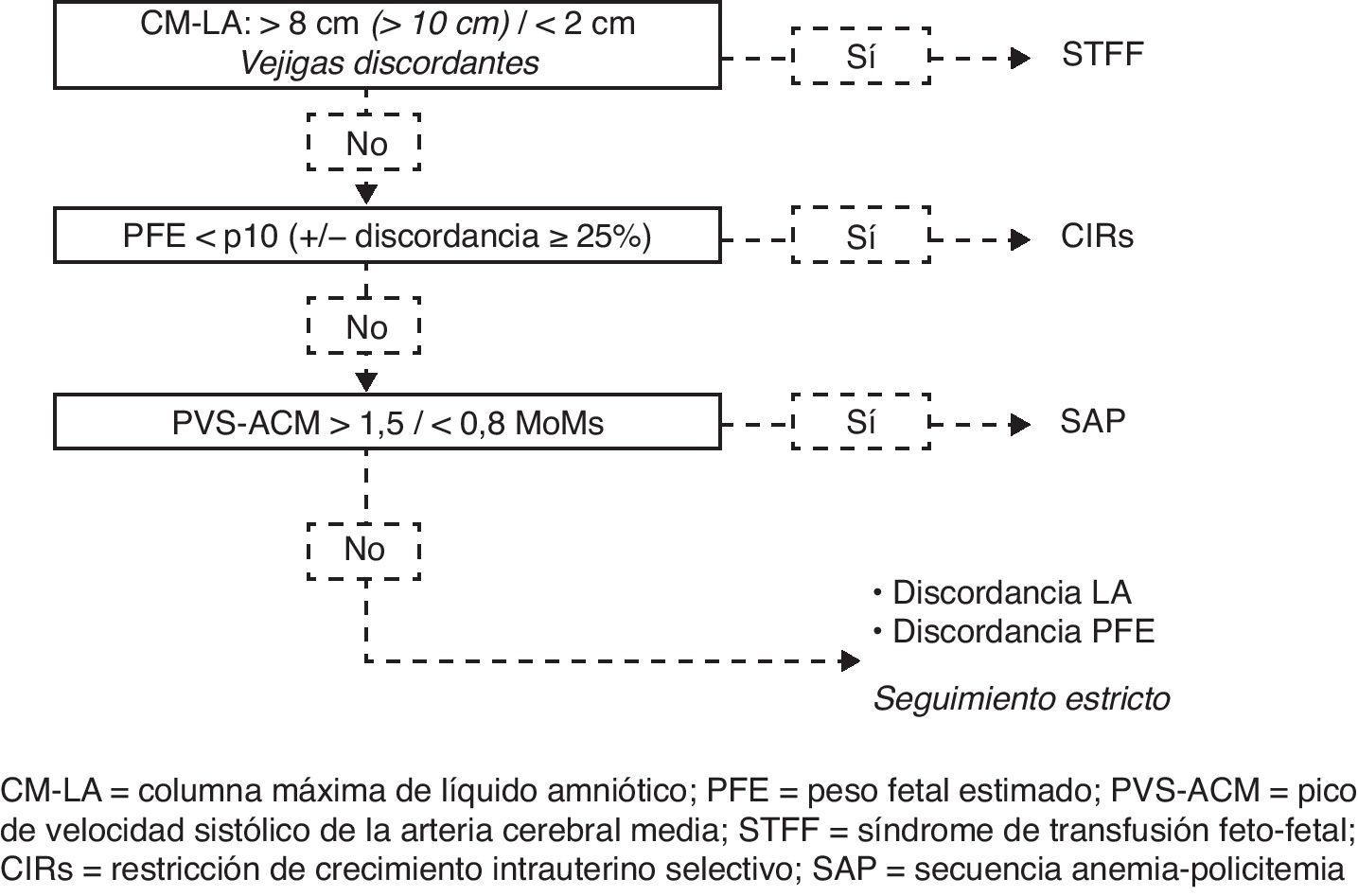
El alto riesgo de complicaciones en los embarazos MC hace necesario un seguimiento estricto. Sin embargo, esto no debe llevar a que se haga un tratamiento excesivo de los casos límite en donde no se necesita «nada por el momento». De hecho, una de las situaciones más difíciles en el seguimiento de los embarazos MC es la presencia de casos con diferencias subjetivas de LA y/o PFE pero con características intermedias o que se superponen. En la práctica clínica, incluso para los especialistas en medicina fetal con alguna experiencia en embarazos MC, la clasificación correcta de estos casos puede ser un reto. Un enfoque sistemático es la clave para tomar la decisión adecuada. En pocas palabras podemos decir que una vez que se hayan descartado malformaciones anatómicas fetales debemos tener en cuenta que solo puede haber 4 escenarios posibles: STFF, CIRs, SAP o discordancia en la CM-LA y/o PFE.
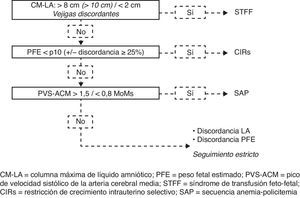
Un algoritmo estructurado dará lugar a una clasificación precisa y a un manejo adecuado en casi todos los casos. Proponemos usar una secuencia de preguntas, cuyo orden se determina por la importancia y la urgencia del tratamiento (fig. 3). La primera entidad a descartar siempre será el STFF ya que tiene un mal pronóstico y requiere un tratamiento urgente. Si se diagnostica el STFF, la coexistencia o no del CIRs es irrelevante ya que de todas formas se necesita una cirugía láser. Si se descarta el STFF, la segunda pregunta determina si se presenta un CIRs, y si este es el caso, se debe evaluar el doppler de la AU, asesorar a los padres e iniciar alguna de las opciones de manejo.
Discordancia aparente en LA y/o PFE en MC. Algoritmo para el diagnóstico diferencial.
CIRs: restricción de crecimiento intrauterino selectiva; CM-LA: columna máxima de líquido amniótico; PFE: peso fetal estimado; PVS-ACM: pico de velocidad sistólico de la arteria cerebral media; SAP: secuencia anemia-policitemia. STFF: síndrome de transfusión feto-fetal.
La tercera pregunta señala la presencia o ausencia de la SAP. En la práctica su respuesta será negativa en la gran mayoría de los casos, especialmente en el segundo trimestre.
Por último, si todas las condiciones anteriores han sido descartadas, nos quedamos con una discordancia subjetiva sin cumplir los criterios diagnósticos. Estos casos se suelen denominar en la literatura como «discordantes de líquido amniótico», aunque es común que coexista cierto grado de discordancia en el PFE. Nosotros recomendamos describir exactamente los hallazgos en el informe, escribiendo claramente en las conclusiones del mismo que «actualmente no se cumplen los criterios diagnósticos del STFF (y/o CIRs)». La discordancia de las CM-LA representa por sí misma una condición específica y requiere un cambio en el esquema de seguimiento. De hecho el riesgo de que el embarazo desarrolle un STFF o CIRs es de casi el 50%40. Un seguimiento estricto, usualmente con intervalos de semanales o de forma más frecuente si la sospecha es alta, debe permitir, si se requiere, un tratamiento oportuno en la mayoría de los casos. A pesar de ello sigue habiendo un riesgo real de una evolución clínica rápida inesperada e incluso de muerte fetal y esto debe quedar claro en la consejería. Sin embargo, los padres deben tener claro que este riesgo es mucho menor que el de la terapia fetal invasiva y que en el 50% de los casos la evolución y el resultado del embarazo serán normales. Por lo tanto de acuerdo a la evidencia actual, la sola discordancia de las CM-LA nunca debería ser tratada.
Malformación discordanteLos gemelos MC discordantes debido a anomalías fetales representan una de las características clínicas relativamente frecuentes en el manejo de los embarazos MC. Las malformaciones estructurales fetales se presentan en hasta el 3% de los MC y son por lo tanto 3 veces más frecuentes que en los embarazos gemelares dicoriales o en los embarazos únicos41. Estas afectan a un solo gemelo en más del 80% de los casos42. Con mucha menor frecuencia los MC también pueden tener discordancias en el cariotipo43,44.
Los gemelos discordantes implican 2 problemas: la ansiedad de los padres y el miedo a la muerte intrauterina con sus respectivas complicaciones. En realidad, la frecuencia de los casos en los que la malformación se asocia a un alto riesgo de muerte intrauterina es baja. Por lo tanto, el problema suele ser la ansiedad de los padres de tener un feto con una malformación grave. Obviamente, el feticidio selectivo, independientemente de la técnica, supondrá una amenaza para el embarazo y por lo tanto para la supervivencia del feto estructuralmente normal. A pesar de estos riesgos una buena parte de los padres solicitará un feticidio selectivo, en países en donde la legislación lo permita. La oclusión del cordón por medio de láser o de coagulación bipolar es el método de elección para la mayoría de estos casos. La radiofrecuencia es también una opción particularmente en los casos de un gemelo acardio45. Sin embargo su tasa de éxito es menor cuando se usa en fetos vivos, especialmente a una EG avanzada46. Independientemente de la técnica utilizada para el feticidio selectivo, la tasa de supervivencia del gemelo normal es del 80-90% en manos experimentadas47. Si bien estas cifras pueden sugerir una alta tasa de pérdida del embarazo, el feticidio selectivo entre las 15-26 semanas en embarazos gemelares dicoriales se asocia también con una tasa de pérdida de hasta el 15% de los embarazos.
Un ejemplo particularmente común de malformacion discordante (1% de los MC) es la presencia de un feto acardio que sobrevive gracias a la secuencia de perfusión arterial reversa48. Si bien muchos casos pueden evolucionar normalmente hasta el tercer trimestre, la pérdida del embarazo puede ser hasta del 50% debido a los accidentes del cordón umbilical, la insuficiencia cardíaca del feto normal y a las complicaciones relacionadas con el polihidramnios. La tasa de supervivencia con oclusión y sección del cordón umbilical en embarazos MC monoamnióticos es del 80-90%49.
ConclusionesSe puede lograr un seguimiento y un manejo adecuado de los embarazos MC con una visión integral que debe guiarse por principios básicos. La complejidad y, en algunos casos, la superposición de las complicaciones que presentan los gemelos MC pueden desenfocar las decisiones clínicas de tal forma que se olviden estos principios básicos. Nosotros proponemos un enfoque simplificado, pero clínicamente útil, para el seguimiento y manejo de los embarazos gemelares MC, que en esencia contiene los principios básicos de diagnóstico precoz, seguimiento adecuado e intervención oportuna (tabla 4). Las reglas aquí propuestas pueden parecer demasiado simplistas para condensar el vasto conocimiento concerniente al embarazo gemelar MC. Por supuesto, siempre habrá casos excepcionales de alta complejidad que no esténn cubiertos por estas normas. Sin embargo la experiencia clínica de más de 15 años demuestra que, aun hoy, la mayoría de los casos con malos resultados debido a un manejo incorrecto se deben al incumplimiento de por lo menos uno de este conjunto de principios básicos. Ellos resumen en pocas palabras los puntos claves descritos a lo largo de esta revisión. Su aplicación permitirá al especialista en medicina fetal un manejo adecuado de la vasta mayoría de la situaciones clínicas que se presentan en los embarazos gemelares MC.
Principios básicos del manejo de los embarazos gemelares monocoriales
| 1. Diagnóstico precoz (antes de las 15 semanas de EG) y descarte de malformaciones fetales |
| 2. Seguimiento cada 2 semanas (PFE, CM-LA, doppler de la ACM) por el especialista en medicina fetal |
| 3. Si hay sospechas: seguimiento semanal |
| 4. Si está presente la secuencia polihidramnios/oligoamnios y se cumplen los criterios diagnósticos de STFF: tratamiento inmediato |
| 5. Si el PFE < p10 en un feto = CIRs: doppler de la arteria umbilicala) Normal: manejo expectanteb) Anormal: discutir opciones con los padres |
| 6. Si no hay complicaciones: parto electivo a las 36-37 semanas de EG |
ACM: arteria cerebral media; CIRs: restricción del crecimiento intrauterino selectivo; CM-LA: columna máxima de líquido amniótico; EG: edad gestacional; PFE: peso fetal estimado; STFF: síndrome de transfusión feto-fetal.
Los autores declaran no tener ningún conflicto de intereses.