Hasta 2006, en España no existe una política uniforme para el cribado y diagnóstico prenatal de anomalías cromosómicas. La SEGO (Sociedad Española de Ginecología y Obstetricia) recomienda descartar la edad materna avanzada comoúnica indicación para realizar prueba invasiva y propone el test combinado del primer trimestre.
ObjetivoConocer el grado de implantación de las recomendaciones SEGO y los cambios en la práctica hospitalaria del cribado en España.
Material y métodosEncuesta a hospitales a la que respondieron 54 centros en 2007, que atendieron a 149.320 gestantes y 53 centros en 2011, que atendieron a 147.195 embarazadas. Los resultados se compararon mediante el test de McNemar.
ResultadosEn total, 26 centros hacían pruebas invasivas por edad materna avanzada en 2007 y 11 en 2011 (p=0,01); 31 tenían disponible BVC en 2007 y 33 en 2011(p=0,005); 42 tenían implantado el cribado del primer trimestre en 2007 y 50 en 2011 (p=ns); en 30 el único marcador era TN en 2007 y 36 en 2011 (p=ns); 26 desconocían el tipo de analizador empleado en 2007 y 17 en 2011 (p<0,01); y en 34 el laboratorio calculaba el índice de riesgo en 2007 y en 36 en 2011 (p=ns).
ConclusionesEl cribado combinado del primer trimestre está ampliamente extendido en los hospitales españoles, y la tendencia es a no considerar la edad materna como indicación para prueba invasiva, disponer de BVC, realizar prueba combinada, solo con TN como marcador ecográfico, desconocer el analizador utilizado y que el laboratorio calcule el índice de riesgo.
There was no uniform policy for prenatal screening and diagnosis of chromosomal abnormalities in Spain until 2006. The Spanish Society of Obstetrics and Gynaecology (SEGO) recommends rejecting advanced maternal age as the only indication for invasive procedure, and proposes the first trimester combined test.
ObjectiveTo determine the level of implementation of the SEGO recommendations and the changes in hospital screening practice in Spain.
MethodsA total of 54 Hospitals, that had attended to 149,320 pregnant women, and 53 hospitals with147,195 pregnancies, responded to an e-mail survey, in the year 2007 and 2011, respectively. The McNemar test was used to compare the results.
ResultsA total 26 hospital centres performed invasive procedures for advanced maternal age only in 2007, and 11 in 2011 (P=.01); 31 had chorionic villus sampling (CVS) available in 2007, and 33 in 2011 (P=.005); in 42 implemented first trimester combined screening in 2007, and 50 in 2011 (p=ns); in 30 hospitals the only ultrasound marker was Nuchal translucency in 2007, and in 36 in 2011 (p=ns); 26 did not know the type of analyser used for determining biochemical markers in 2007, and 17 in 2011 (P<.01); and 34 the laboratory performed risk calculation in 2007 and 36 in 2011 (p=ns).
ConclusionFirst trimester combined screening test is widely available across Spanish hospitals, and most centres, do not consider advanced maternal age as the only indication for the invasive procedure, have CVS available, perform combined first trimester test only with nuchal translucency as an ultrasound marker, do not know the analyser used for measure biochemical markers, and that the laboratory provide risk calculations.
Durante los años 70, el cribado prenatal de las cromosomopatías fetales más frecuentes dependía exclusivamente de la edad de la madre y algunos otros datos de la historia. El incremento de la edad en el momento del parto, el alto número de pruebas invasivas necesarias y el riesgo de perder el embarazo asociado a las mismas, hizo desarrollar un método de cribado o screening que disminuyera los procedimientos en estas mujeres mayores y fuera también aplicable a mujeres más jóvenes, donde se concentran el 70% de los síndromes de Down (SD)1. En los años 80 se desarrollaron métodos bioquímicos aplicados inicialmente en el segundo trimestre, que asociados a la edad materna, mejoraron las tasas de detección2, y en los años 90 se incorporaron los marcadores ecográficos para obtener tasas de detección cercanas al 90%3.
En España, no ha habido una política única para el cribado y diagnóstico prenatal de las anomalías cromosómicas para todo el territorio, y clásicamente ha existido una gran diversidad respecto a lo que se aplica en las distintas comunidades autónomas (CC. AA.) y, dentro de estas, en las distintas áreas sanitarias. En 2005 la Sociedad Española de Ginecología y Obstetricia (SEGO) decidió iniciar un proceso de reflexión sobre los distintos métodos para establecer una recomendación común en base al método más eficiente4.
La SEGO recomendó descartar la indicación de pruebas invasivas basadas únicamente en la edad materna, debido a su baja efectividad y alto coste tanto económico como en posibles pérdidas fetales, y propuso la realización del screening combinado del primer trimestre (test combinado) y su implantación en todo el territorio nacional para todas las gestantes que acudieran al obstetra antes de la semana 14.ª (nivel de evidencia IIb, grado de recomendación B)5,6.
Este test combinado está integrado por la edad materna, la medida de la translucencia nucal (TN) y los marcadores bioquímicos β-hCG libre y proteína plasmática A asociada al embarazo (PAPP-A) entre las semanas 11.ª y 13 + 6 días7–10. Sus principales ventajas son su buena sensibilidad (90% ajustado a una tasa de falsos positivos del 5%)11, y su carácter precoz, lo que permite anticipar las actitudes diagnósticas y decisiones con menos morbilidad para la madre4,12. Otros marcadores ecográficos como la presencia del hueso nasal (HN), regurgitación tricuspídea (RT) o flujo reverso en la onda A del ductus venoso (DV) han demostrado aumentar la sensibilidad hasta un 95%, con una tasa de falsos positivos del 3%9,13–16.
Para el cálculo del riesgo, una vez se disponga de los datos maternos, los marcadores ecográficos y bioquímicos, es necesario un sistema informático que lo calcule a partir del riesgo inherente a la edad materna modificado por el determinado por marcadores bioquímicos y ecográficos17–19. Actualmente existen diversos programas informáticos, algunos de ellos facilitados por las empresas que comercializan los analizadores de los marcadores bioquímicos y otros que incluyen un sistema de verificación de la formación de los obstetras y un control de calidad de los resultados obtenidos20.
A la vista de la información proporcionada por el cribado, puede ofrecerse a los padres la realización de un procedimiento invasivo, amniocentesis o biopsia corial (BVC)21,22, para la determinación del cariotipo fetal, asumiendo una tasa de pérdida fetal de alrededor del 1%23,24.
El objetivo de este estudio es conocer el grado de implantación de las recomendaciones SEGO sobre el cribado de cromosomopatías en el embarazo, analizando los cambios en la práctica hospitalaria del cribado de aneuploidías durante el período 2007–2011.
Material y métodosA través de correo electrónico se envió una encuesta a todos los centros sanitarios del Catálogo Nacional de Hospitales del Ministerio de Sanidad25, con actividad obstétrica, tanto públicos como privados, en los que se pudo averiguar una dirección del centro o de alguno de los responsables del área obstétrica.
La encuesta (fig. 1) constaba de 6 preguntas referentes a la forma de realizar el cribado, y una última referente al número de partos que atendió el centro el año anterior, lo que se consideró indicativo del número de embarazos atendidos.
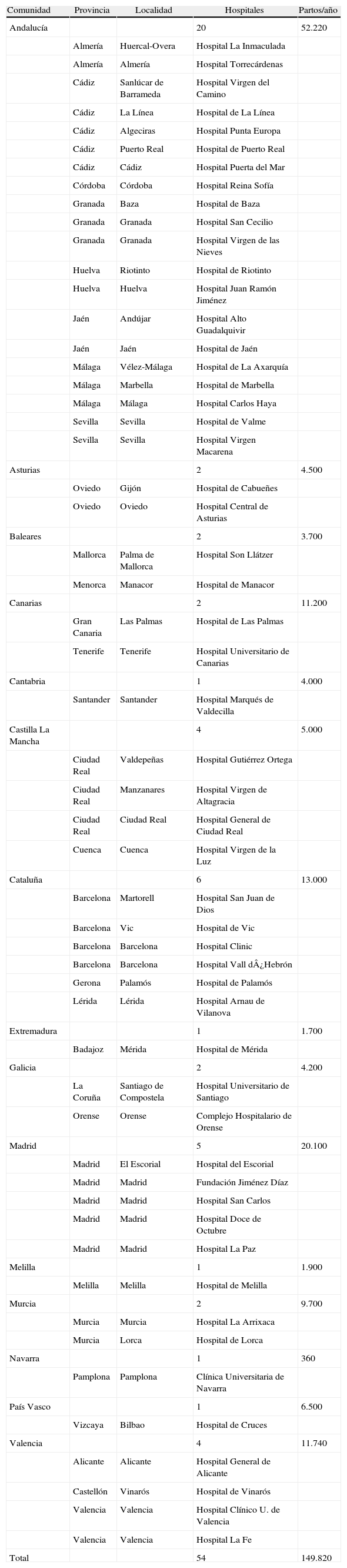
La encuesta se envió en dos ocasiones, la primera en el año 2007 a la que respondieron 54 hospitales (tabla 1). La relación de centros participantes y el número de partos atendidos por cada uno de ellos, y la distribución por comunidades autónomas se recogen en la tabla 1. Esta primera encuesta incluye datos correspondientes a 149.320 partos (31% de los nacimientos en España en 2006 [481.295])26.
Hospitales participantes en la encuesta
| Comunidad | Provincia | Localidad | Hospitales | Partos/año |
| Andalucía | 20 | 52.220 | ||
| Almería | Huercal-Overa | Hospital La Inmaculada | ||
| Almería | Almería | Hospital Torrecárdenas | ||
| Cádiz | Sanlúcar de Barrameda | Hospital Virgen del Camino | ||
| Cádiz | La Línea | Hospital de La Línea | ||
| Cádiz | Algeciras | Hospital Punta Europa | ||
| Cádiz | Puerto Real | Hospital de Puerto Real | ||
| Cádiz | Cádiz | Hospital Puerta del Mar | ||
| Córdoba | Córdoba | Hospital Reina Sofía | ||
| Granada | Baza | Hospital de Baza | ||
| Granada | Granada | Hospital San Cecilio | ||
| Granada | Granada | Hospital Virgen de las Nieves | ||
| Huelva | Riotinto | Hospital de Riotinto | ||
| Huelva | Huelva | Hospital Juan Ramón Jiménez | ||
| Jaén | Andújar | Hospital Alto Guadalquivir | ||
| Jaén | Jaén | Hospital de Jaén | ||
| Málaga | Vélez-Málaga | Hospital de La Axarquía | ||
| Málaga | Marbella | Hospital de Marbella | ||
| Málaga | Málaga | Hospital Carlos Haya | ||
| Sevilla | Sevilla | Hospital de Valme | ||
| Sevilla | Sevilla | Hospital Virgen Macarena | ||
| Asturias | 2 | 4.500 | ||
| Oviedo | Gijón | Hospital de Cabueñes | ||
| Oviedo | Oviedo | Hospital Central de Asturias | ||
| Baleares | 2 | 3.700 | ||
| Mallorca | Palma de Mallorca | Hospital Son Llátzer | ||
| Menorca | Manacor | Hospital de Manacor | ||
| Canarias | 2 | 11.200 | ||
| Gran Canaria | Las Palmas | Hospital de Las Palmas | ||
| Tenerife | Tenerife | Hospital Universitario de Canarias | ||
| Cantabria | 1 | 4.000 | ||
| Santander | Santander | Hospital Marqués de Valdecilla | ||
| Castilla La Mancha | 4 | 5.000 | ||
| Ciudad Real | Valdepeñas | Hospital Gutiérrez Ortega | ||
| Ciudad Real | Manzanares | Hospital Virgen de Altagracia | ||
| Ciudad Real | Ciudad Real | Hospital General de Ciudad Real | ||
| Cuenca | Cuenca | Hospital Virgen de la Luz | ||
| Cataluña | 6 | 13.000 | ||
| Barcelona | Martorell | Hospital San Juan de Dios | ||
| Barcelona | Vic | Hospital de Vic | ||
| Barcelona | Barcelona | Hospital Clinic | ||
| Barcelona | Barcelona | Hospital Vall d¿Hebrón | ||
| Gerona | Palamós | Hospital de Palamós | ||
| Lérida | Lérida | Hospital Arnau de Vilanova | ||
| Extremadura | 1 | 1.700 | ||
| Badajoz | Mérida | Hospital de Mérida | ||
| Galicia | 2 | 4.200 | ||
| La Coruña | Santiago de Compostela | Hospital Universitario de Santiago | ||
| Orense | Orense | Complejo Hospitalario de Orense | ||
| Madrid | 5 | 20.100 | ||
| Madrid | El Escorial | Hospital del Escorial | ||
| Madrid | Madrid | Fundación Jiménez Díaz | ||
| Madrid | Madrid | Hospital San Carlos | ||
| Madrid | Madrid | Hospital Doce de Octubre | ||
| Madrid | Madrid | Hospital La Paz | ||
| Melilla | 1 | 1.900 | ||
| Melilla | Melilla | Hospital de Melilla | ||
| Murcia | 2 | 9.700 | ||
| Murcia | Murcia | Hospital La Arrixaca | ||
| Murcia | Lorca | Hospital de Lorca | ||
| Navarra | 1 | 360 | ||
| Pamplona | Pamplona | Clínica Universitaria de Navarra | ||
| País Vasco | 1 | 6.500 | ||
| Vizcaya | Bilbao | Hospital de Cruces | ||
| Valencia | 4 | 11.740 | ||
| Alicante | Alicante | Hospital General de Alicante | ||
| Castellón | Vinarós | Hospital de Vinarós | ||
| Valencia | Valencia | Hospital Clínico U. de Valencia | ||
| Valencia | Valencia | Hospital La Fe | ||
| Total | 54 | 149.820 |
En 2011, se repitió la encuesta a los mismos centros que habían contestado en 2007. En esta ocasión contestaron 53 centros (uno menos que en 2007) y se incluyeron los datos de 147.195 (30,4% de los nacimientos en España en 2010)23.
Se realizó un estudio comparativo del resultado obtenido en 2011 con respecto al de 2007 de las seis preguntas incluidas en la encuesta,mediante el test de McNemar para muestras relacionadas, considerando significativo un valor de p<0,05.
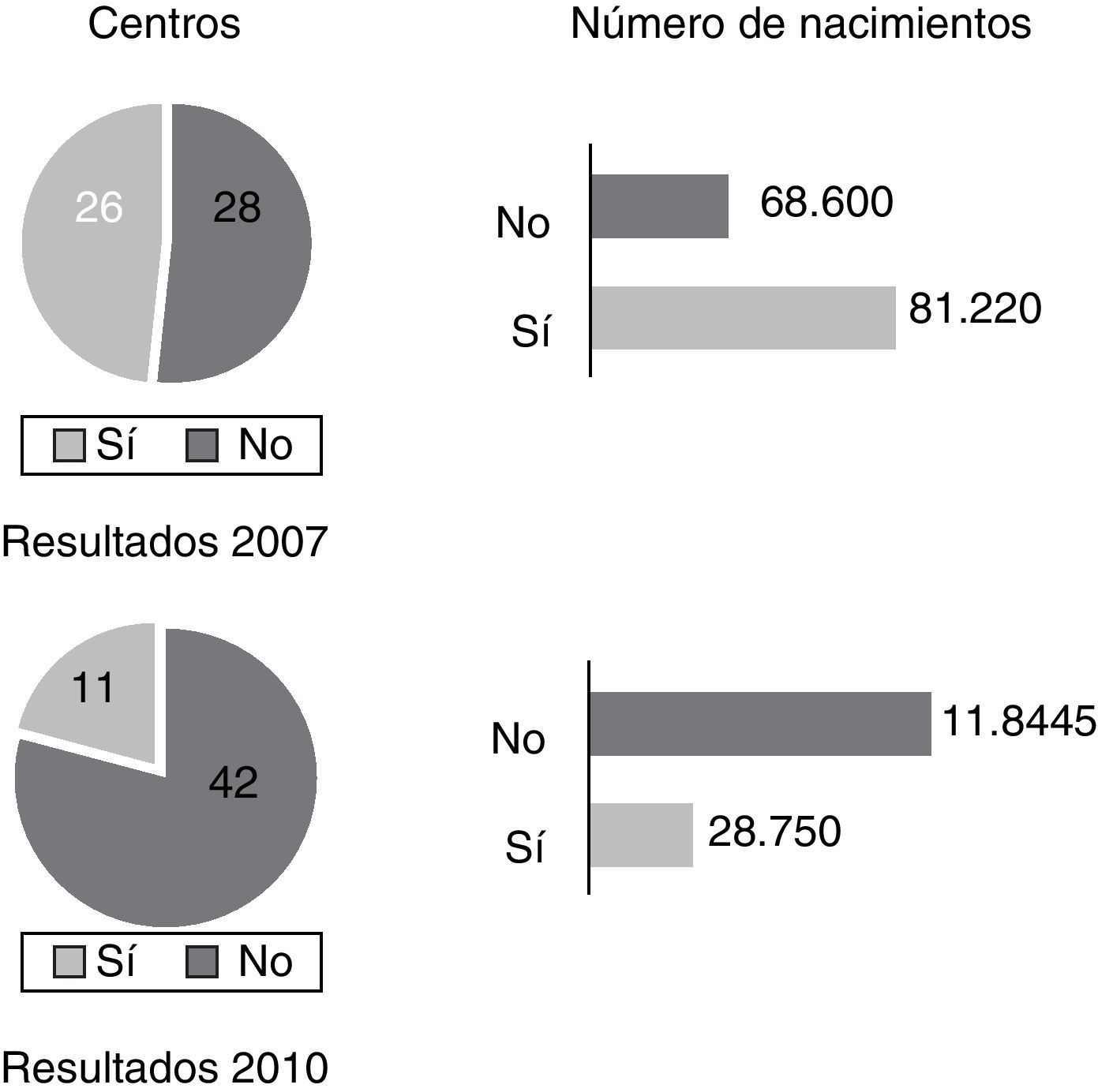
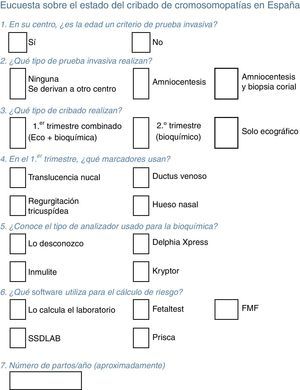
ResultadosPregunta 1. En su centro, ¿es la edad un criterio de prueba invasiva?En 2007, el 48% de los centros (26/54) que respondieron, que atendían al 54% de las gestantes, consideraban la edad materna como indicación por sí sola para realizar procedimiento invasivo.
En 2011, ya solo el 20% de los centros (11/53), que atendían al 19,5% de las embarazadas, declararon realizar pruebas por edad materna (p=0,01, fig. 2).
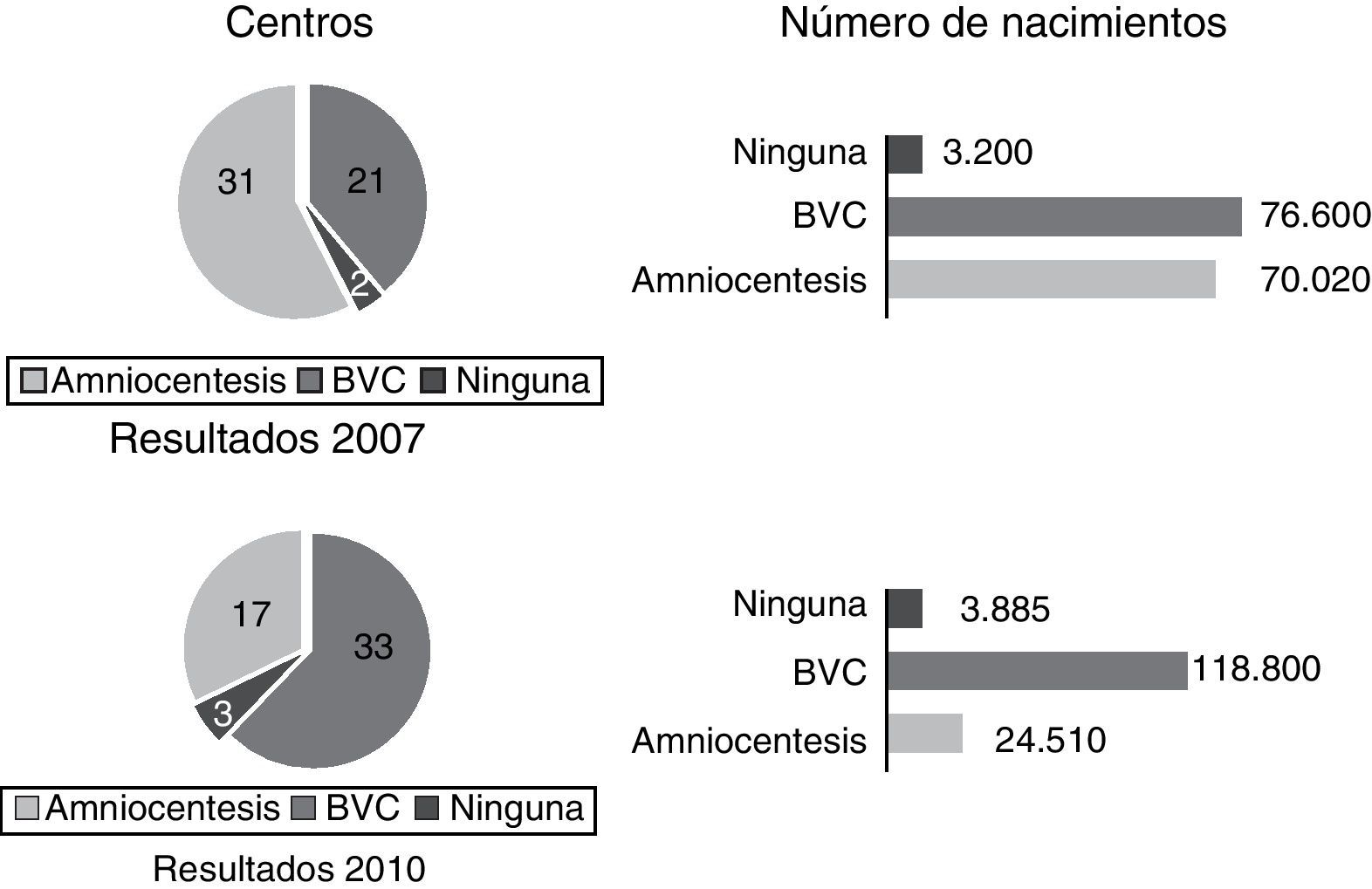
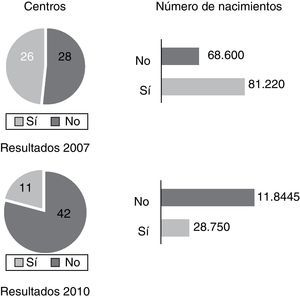
Pregunta 2. ¿Qué tipo de prueba invasiva realizan?En 2007, el 38% de los centros (21/54) tenían disponible la BVC como procedimiento invasivo para determinar, cuando era necesario, el cariotipo fetal. En el 57% (31/54) solo estaba disponible la amniocentesis. Sin embargo el número de gestantes atendidas en centros donde se ofrecía BVC era superior al grupo atendido en centros donde solo se ofrecía la realización de amniocentesis (51,1% vs. 46,7%). El 3,7% de los centros (2/54) no ofrecían ninguna.
En 2011, el 62% de los centros (33/53) que atiende al 80% de las embarazadas tiene ya disponible BVC (p=0,005, fig. 3).
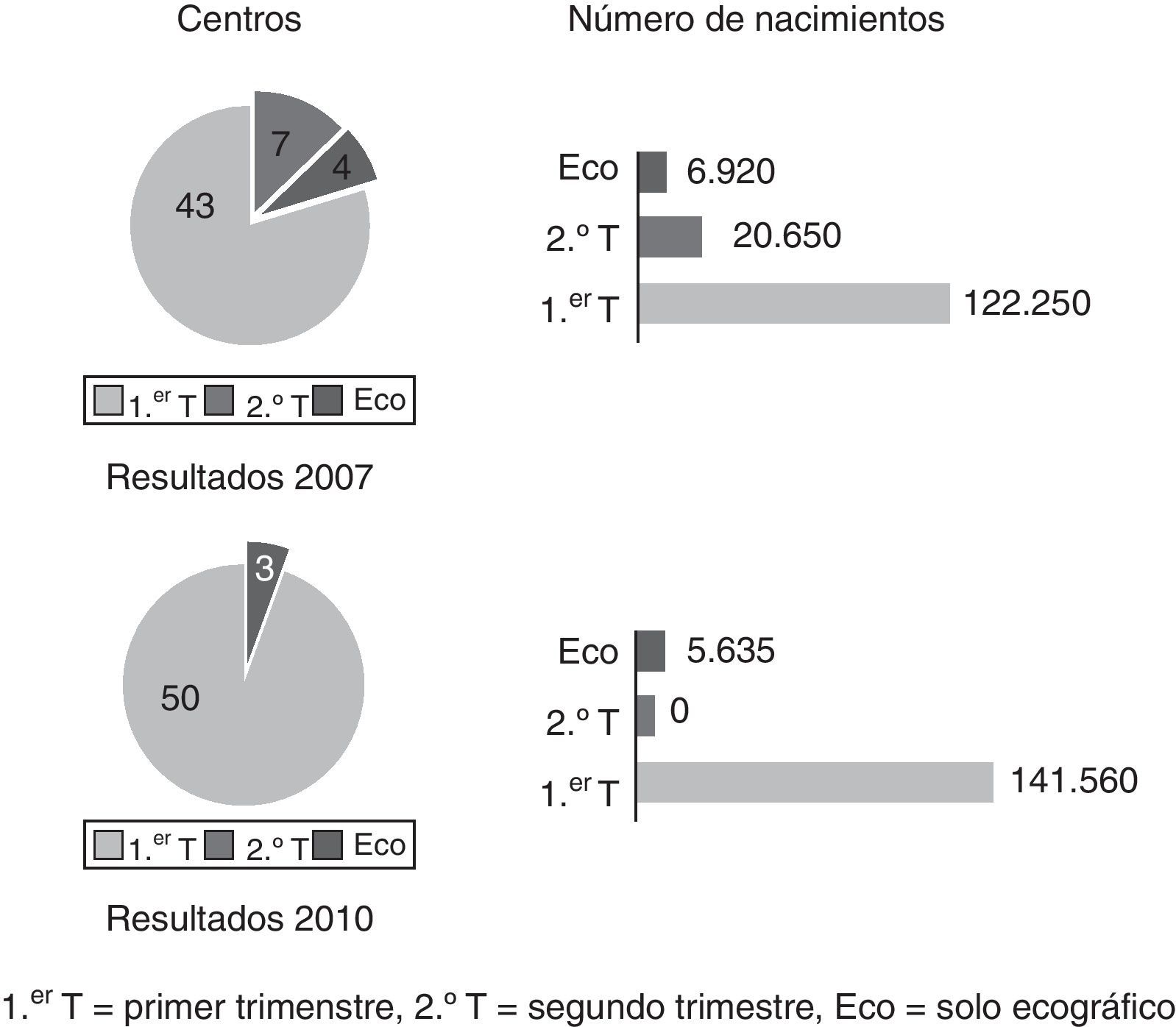
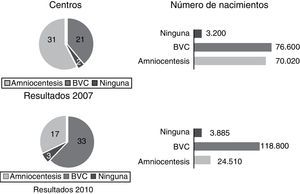
Pregunta 3. ¿Qué tipo de cribado realizan?En 2007, el 77% de los centros (42/54) tenían ya implantado el test combinado de primer trimestre como método de cribado, y el 81% de las gestantes incluidas en la encuesta tenían acceso a esta forma de cribado. Ocho centros realizaban exclusivamente cribado bioquímico de 2.°trimestre, y 4 centros cribado solo con marcadores ecográficos.
En 2011, ya el 94% de los centros (50/53) declaraba realizar cribado combinado del 1.er trimestre. Esta forma de cribado estaba al alcance del 96% de las gestantes.Las diferencias no alcanzan la significación estadística (fig. 4).
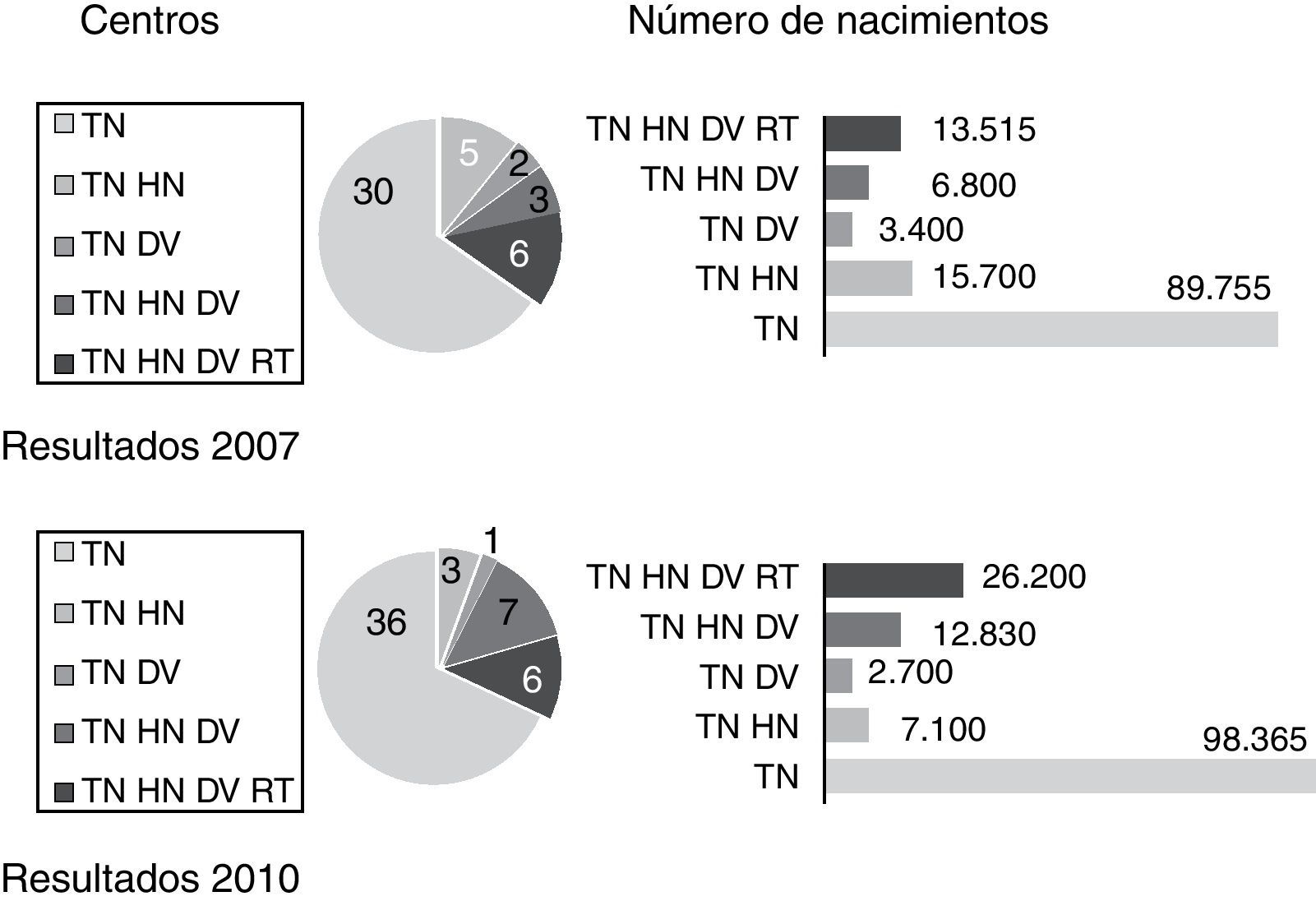
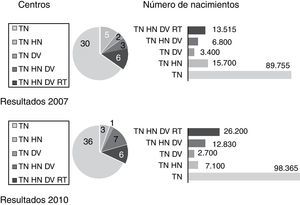
Pregunta 4. En el primer trimestre, ¿qué marcadores usan?En 2007, todos los centros encuestados que tenían implantado el cribado del primer trimestre (46) usaban TN como marcador ecográfico. Otro/s marcador/es se usaban en el 34,7% de centros y en el 30,5% de las gestantes atendidas.Cuando se añadía otro marcador, la combinación más frecuente era añadir HN a la TN.
En 2011, ni el número de centros que usaba otros marcadores ni el número de gestantes atendidas varió significativamente (fig. 5), aunque cuando se usaban marcadores adicionales la combinación más frecuente era TN, HN y DV.
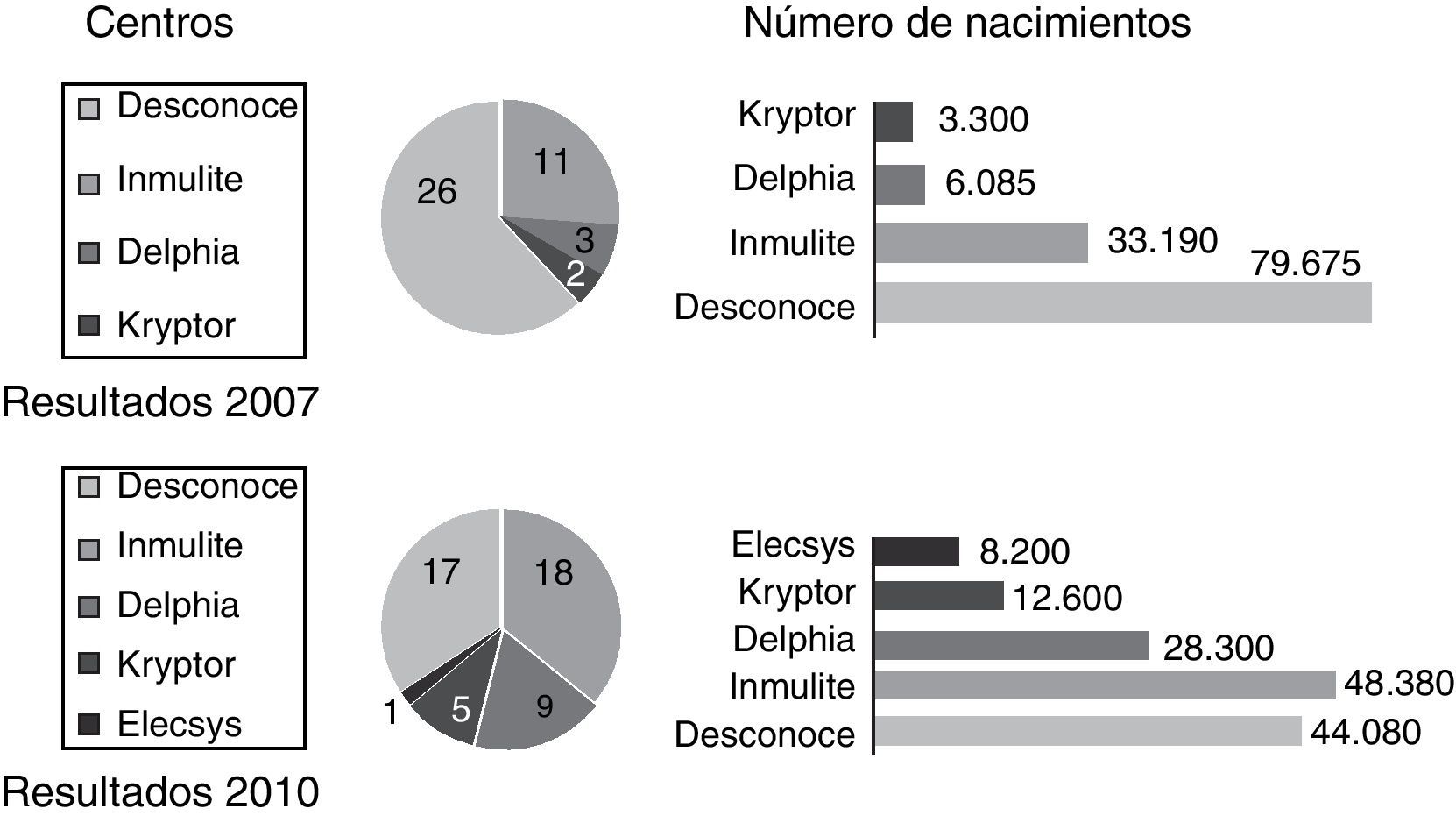
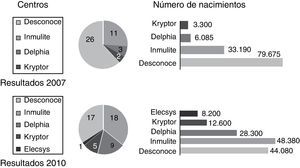
Pregunta 5. ¿Conoce el tipo de analizador usado para la bioquímica?De los 42 centros que realizaban cribado del primer trimestre en 2007, el 61% de ellos desconocía el tipo de analizador que usaban para determinar los marcadores bioquímicos, y dentro de los que lo conocían, Immulite® (Siemens) era el analizador más usado (26%).
En 2011, sobre los 50 centros que realizan cribado combinado, el porcentaje de centros que desconoce el analizador utilizado desciende al 34%, y sigue siendo Immulite® el analizador más usado (36%), aunque el 20% ha cambiado a Delfia® (Perkin Elmer) y otro 20% a Kryptor® (Brahms) (p < 0,01, fig. 6).
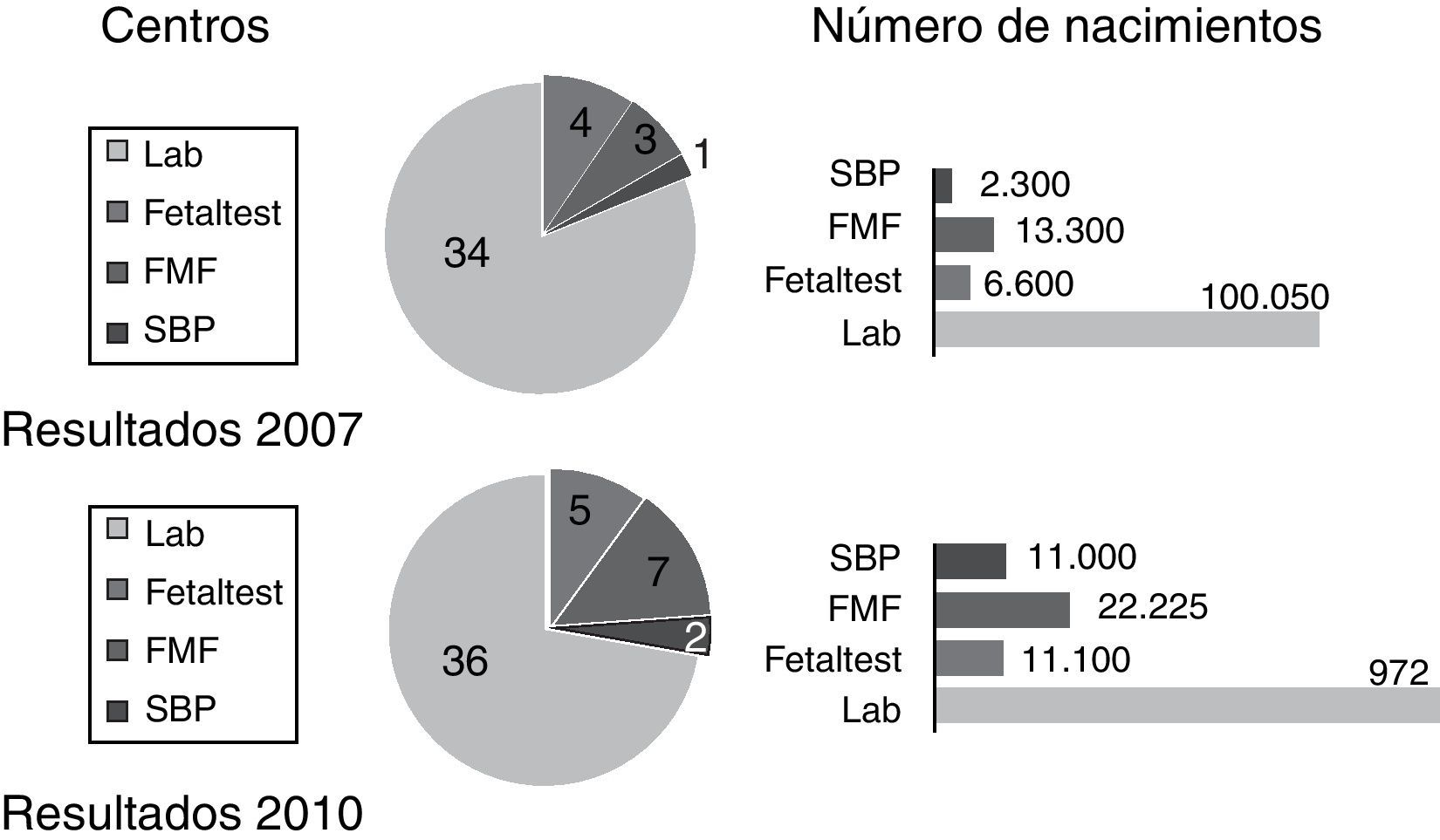
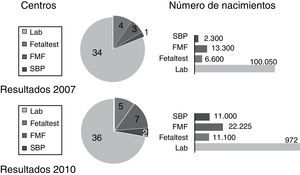
Pregunta 6. ¿Qué software utiliza para el cálculo del riesgo?De los 42 centros que realizaban cribado combinado en 2007, en la mayoría de casos (80%) es el laboratorio el que realizaba el cálculo del índice de riesgo.Este porcentaje en 2011 fue similar (72%).En 2007 el 2.°lugar de los software utilizados por centro lo ocupaba Fetaltest (9,5%), aunque el software de la Fetal Medicine Foundation (FMF) era usado en el doble de gestantes, mientras que en 2011 el de la FMF ocupa el segundo puesto con el 14% de los centros y el 15% de las gestantes. Estas diferencias no son estadísticamente significativas (fig. 7).
DiscusiónLa implantación del cribado combinado del primer trimestre en España se ha visto dificultada por la necesidad de una infraestructura compleja, tanto en entrenamiento de los profesionales como en la adquisición de ecógrafos de alta resolución, analizadores de marcadores bioquímicos específicos y sistemas computarizados de cálculo del riesgo, amén de un sistema de control de calidad de los mismos.
La información sobre el estado actual del cribado y diagnóstico prenatal de cromosomopatías fetales en España es limitada y la disponible indica que existe variabilidad entre los protocolos aplicados (tipo de cribado que se ofrece, trimestre de gestación en el que se realiza, marcadores utilizados, puntos de corte, edad materna, etc.)27. Este estudio aporta información sobre la situación en un número amplio de centros hospitalarios de 15 CC. AA. que atienden a más del 30% de las embarazadas de toda España.
Históricamente la edad materna avanzada, junto a otros elementos de la historia familiar y clínica de la gestante, fueron casi exclusivamente los criterios utilizados para el cribado prenatal de cromosomopatías fetales. El paso del tiempo y los avances tecnológicos han modificado el panorama del cribado prenatal en España, y en los 4 años de evolución de este estudio se ha constatado una tendencia clara a abandonar la edad como criterio único para realizar prueba invasiva, de forma que en 2011 el 80% de los centros considera otros elementos además de la edad materna, aunque para los autores este porcentaje sigue siendo alto.
Los primeros intentos de incorporar otros marcadores a la edad materna se basaron en la incorporación de los marcadores bioquímicos del segundo trimestre que se generalizaron en España en los años 90. En nuestros datos, en 2007 el 13% de los centros encuestados y de las gestantes por ellos atendidas aún seguían usando este método de cribado. Sin embargo en 2011este método desaparece de la muestra estudiada, y se relega exclusivamente a las gestaciones de captación tardía.
El sistema combinado del primer trimestre se ha mostrado eficaz, seguro, coste-eficiente, y como el modelo más apropiado para su adaptación a la práctica clínica5,24,28. En este estudio se ha constatado una amplia implantación del cribado combinado del primer trimestre (95% aproximadamente en 2011) y se confirma una tendencia a su generalización y homogeneidad creciente en los grandes centros de todo el Estado. La realización de marcadores ecográficos comoúnico método de cribado por un 5 a 7% de centros la interpretamos como testimonial por falta de acceso a métodos bioquímicos o no oferta por motivos religiosos. Las alternativas secuenciales que integran pruebas en el primer y segundo trimestres, aunque se les atribuye menor coste global y buen balance detección/falsos positivos24, no han tenido representación en los centros incluidos en la encuesta y por tanto puede concluirse que su implantación es muy reducida al menos en los grandes centros.
En los últimos años, se han propuesto y desarrollado diferentes marcadores ecográficos adicionales con el objetivo de mejorar las tasas de detección y disminuir los falsos positivos. Todos los centros que realizan cribado del primer trimestre usan TN, y el 35% de los centros aproximadamente usan otros marcadores ecográficos adicionales. Esta proporción se mantiene en los 4 años de intervalo de la encuesta, aunque puede observarse un ligero movimiento desde la combinación TN y HN hacia la que incorpora además DV. Así un 40% de los centros que realizaba la primera en 2007 ahora ha incorporado también DV.
El tipo de analizador utilizado en la determinación de los marcadores bioquímicos también ha sido un tema debatido29, aunque en este estudio, la mayoría de los centros encuestados desconocía el tipo de analizador que utilizaba. La FMF solo recomiendael uso para la determinación de marcadores bioquímicos de analizadores específicamente indicados y probados para el cribado de cromosomopatías30, y en concreto Delphia® (Perkin Elmer), Kryptor® (Brahms)31 y recientemente Elecsys® (Roche), y no recomienda el uso de analizadores automatizados no específicos como Immulite® (Siemens), que son más económicos ya que son usados para múltiples determinaciones en los laboratorios de hospital, pero a los que se ha atribuido una excesiva variabilidad27,32.
Una vez obtenidos los datos, el cálculo del riesgo requiere un programa informático que integre los datos de edad materna, marcadores ecográficos y bioquímicos para calcular un índice de riesgo garantizando altas tasas de detección y bajas de falsos positivos33. Según este estudio, la mayoría de los centros recibe los índices de riesgo calculados por los laboratorios que determinan los marcadores bioquímicos.
Entre los sistemas usados por los obstetras, Fetaltest34 y FMF35,36, existe una tendencia en el intervalo de la encuesta hacia el uso de este último. Las principales diferencias radican en que Fetaltest usa algoritmos de cálculo basados en múltiplos de la mediana (MOMs) de los diferentes marcadores37, mientras que FMF usa algoritmos basados en diferencias relativas con la mediana esperada (Delta)38, o más recientemente en un modelo mixto de dos distribuciones una de ellas independiente del CRL39,40. Se ha criticado al sistema Fetaltest que permite usar medianas propias a partir de 100 casos introducidos por un usuario, sin que exista control de calidad de las mediciones realizadas, mientras que al sistema FMF se le argumenta que usa algoritmos de cálculo basados en estudios poblacionales ajenos a nuestra población, ya que en España no se dispone de datos propios41–44.
Finalmente, el proceso de cribado culmina con la emisión de una información sobre el riesgo de cromosomopatía, que puede llevar a los padres a la realización de un procedimiento invasivo para la determinación del cariotipo fetal si el índice de riesgo obtenido supera un determinado punto de corte o si los padres así lo deciden. La prueba a realizar puede ser amniocentesis18, técnica que tiene el inconveniente de que los resultados están disponibles sobre la semana 16.a. Existe en todo el mundo una tendencia a desplazar el procedimiento invasivo al primer trimestre y realizar BVC45, procedimiento técnicamente más exigente46, y que permite tener los resultados en el primer trimestre, disminuyendo la incertidumbre de los padres y permitiéndoles tomar decisiones de forma más temprana.
En este estudio se puede observar una tendencia a disponer de BVC cada vez en un mayor número de centros, de forma que en 2011 llega ya al 62% de los centros que atienden al 80% de las gestantes del estudio. Los datos de 2007 donde los centros que ofrecen BVC son minoría pero con la mayoría de las gestantes se debe probablemente a que se trata de centros grandes cono alto número de nacimientos. En este sentido, hay autores que sugieren que, dado el descenso en el número de procedimientos invasivos que las políticas de cribado están produciendo, y el número de procedimientos necesarios en la curva de aprendizaje (incremento de las tasas de pérdidas fetales en aquellos centros con menos de 136 BVC/año)47, quizás esta técnica debería realizarse solo en centros especializados48.
Como conclusión, la situación en España que intenta describir este estudio revela que la edad materna está dejando de ser una indicación para realizar prueba invasiva, que la BVC está ganando terreno como procedimiento invasivo de elección, que el cribado combinado del primer trimestre tiene una amplísima implantación en el territorio nacional, que dicho cribado se realiza con TN como marcador ecográfico en la mayoría de los casos, que la mayoría de los centros desconoce el analizador que usa para determinar sus marcadores bioquímicos, siendo Immulite® el más utilizado, y que en la mayoría de los centros es el laboratorio el que proporciona el cálculo de los índices de riesgo.
La principal limitación del estudio es que constituye una aproximación a la situación del cribado poblacional en España mediante la descripción de la forma de trabajar en una muestra de hospitales que, aunque abarcan un número elevado de gestantes, no siempre son representativos del amplísimo número de consultorios privados que también atienden un elevado número de gestantes.
Sería también interesante conocer qué CC. AA. han emitido directrices de política sanitaria sobre el cribado gestacional de anomalías cromosómicas. Sin embargo el carácter asimétrico y variable en el tiempo de este tipo de recomendaciones y el grado variable de implantación de las mismas en los diferentes centros hace imposible su análisis y la valoración de su influencia en el estado actual de la práctica clínica.
También es preciso tener en cuenta el sesgo de selección que representa el hecho de que solo contestaran centros que atienden al 30% del total de la población gestante, sin que puedan valorarse tasas de cobertura de asistencia prenatal, y teniendo en cuenta la posibilidad de que los centros que contestaron sean aquellos que tengan una política más actualizada de diagnóstico prenatal.
Como perspectivas de futuro, a la vista de este estudio, de las recomendaciones SEGO3, y del Ministerio de Sanidad24, podríamos citar la necesidad de que todas las CC. AA. desarrollen programas actualizados de cribado de las cromosomopatías fetales más frecuentes, en especial SD, con garantías de calidad y equidad en el acceso.
Los autores quieren agradecer la colaboración de todos los obstetras que respondieron a la encuesta.
Resultados presentados en el XXV Simposium sobre Actualización en Ecografía Obstétrico-Ginecológica. Madrid, 17 y 18 de marzo de 2011.