La nefritis tubulointersticial asociada al virus NBK es una complicación del trasplante renal. La presencia de inclusiones virales denominadas células de «Decoy» en extensiones citológicas urinarias y los altos títulos de carga viral ADN en plasma, orina, y tejido renal, son marcadores de replicación de virus BK.
ObjetivoEn nuestro estudio nos propusimos estudiar el valor diagnóstico de la citología urinaria proponiendo 3 formas distintas de screening citológico.
ResultadosLa citología urinaria como prueba diagnóstica presentó una alta sensibilidad de 81,4% para capturar, en pacientes trasplantados renales, los enfermos infectados por virus BK, aunque con una especificidad de tan solo el 22,6%. Los 3 métodos de screening de la citología urinaria propuestos parecen ser superponibles en su eficacia a la hora de cuantificar la riqueza celular.
ConlusionesLa citología urinaria es una prueba fiable como screening para la detección de las células de «Decoy», pero no diagnóstica. La presencia de células de «Decoy», con independencia del método de screening citológico utilizado, puede ser una forma indirecta y sensible de estimar la existencia de una replicación viral de BK, aunque son el PCR urinario y la biopsia renal las pruebas diagnósticas y de alta especificidad de la nefritis por virus BK.
Tubulointerstitial nephritis associated with the BK virus is a complication of kidney transplantation. Markers of BK virus replication include the presence of viral inclusions called «Decoy cells» in urine cytology and high titers of ADN viral load in plasma, urine, and renal tissue.
ObjectiveTo evaluate the diagnostic utility of urine cytology for the early identification of BK virus infection by using 3 different types of cytological screening.
ResultsUrinary cytology as a diagnostic test showed high sensitivity (81.4%) in identifying renal transplant recipients with BK virus infection. Specificity was only 22.6%. The 3 methods of urine cytology screening appeared to have similar effectiveness in quantifying cell density.
ConlusionsUrine cytology is a reliable test for the detection of Decoy cells but is not diagnostic. Irrespective of the screening method used, detection of Decoy cells may be an indirect and sensitive method for estimating the existence of BK viral replication, although urinary polymerase chain reaction and kidney biopsy have greater specificity in the diagnosis of BK virus nephritis.
En 1933, el ruso Voronoy realizó el primer trasplante renal en humanos a una joven en coma urémico, siendo el donante un varón de 60 años1. Los riñones trasplantados funcionaron precariamente durante 2 días, seguido del fallecimiento de la paciente trasplantada. Voronoy comunicó en 1949, 15 años más tarde, otros 5 trasplantes de riñón de donante cadáver conservado, realizados sin éxito alguno.
El primer alotrasplante renal con resultado de supervivencia del receptor tuvo lugar en Boston en 1947. A una joven en coma profundo por uremia, en anuria desde hacía 10 días tras shock séptico secundario a un aborto complicado, se le trasplantó el riñón de un cadáver.
En 1950 en Chicago, se realizó en EE. UU. el primer trasplante renal con implantación intraabdominal a una mujer afectada de poliquistosis renal y con función precaria, a la que se le extrajo uno de sus riñones poliquísticos y se le sustituyó por el riñón de un cadáver. A los 2 meses se comprobó que el riñón tenía funcionalidad mantenida.
A partir de 1950, diferentes equipos europeos y americanos llevaron a cabo trasplantes renales en humanos utilizando donantes.
El primer trasplante renal con éxito absoluto se realizó en 1956 entre 2 gemelos, de 23 años de edad, uno de las cuales estaba afecto de una glomerulonefritis en fase muy avanzada2.
Desde 19543, ha habido una espectacular evolución científica gracias a un aporte multidisciplinario y al conocimiento de la patología del trasplante que ha comprometido sobre todo el campo de la inmunología y de la inmunofarmacología. El principal objetivo ha sido el control de la respuesta inmune del huésped contra el injerto, impidiendo el rechazo y la pérdida del mismo. Sin embargo, y a pesar de los importantes logros científicos, sobre todo en quimioterapia inmunosupresora, los fenómenos de rechazo, tanto agudo como crónico, continúan siendo la principal causa de disfunción y pérdida del injerto, seguida por las infecciones.
Múltiples virus pueden afectar al riñón en el contexto del tratamiento inmunosupresor. El virus del Epstein Barr, los poliomavirus (PV), el citomegalovirus o los adenovirus, estos últimos sobre todo en población pediátrica4, son los agentes virales más implicados en esta enfermedad. Los PV son pequeños virus icosaédricos, que presentan un genoma de ADN circular, covalentemente cerrado, superenrollado, de doble cadena que mide aproximadamente 5,2kb4. Los PV pertenecen a la familia Papova y se conocen alrededor de 12 especies, aunque solo 3 infectan al hombre:
- -
virus BK (VBK) (Poliomavirus hominis tipo 1)
- -
virus JC (VJC) (Poliomavirus hominis tipo 2)
- -
virus del simio 40 (SV40)
Los virus VBK y VJC fueron nombrados con las iniciales de los pacientes, de raza negra, en quienes fueron descritos por primera vez en 19711. El VBK se encontró en la orina de un paciente con trasplante renal que cursaba con estenosis ureteral y el VJC en el cerebro de un paciente afecto de enfermedad de Hodgkin con leucoencefalopatía multifocal progresiva. El VBK y el VJC presentaron un 75% de homología en la secuencia de nucleótidos. El virus SV40 también forma parte de los PV y puede infectar a humanos, presentando 70% de homología en la secuencia de nucleótidos con el VBK. El SV40 no se asocia con ninguna enfermedad específica, si bien se han detectado sus consecuencias en algunas neoplasias.
Con respecto a la infección por VBK, cabe señalar que la primoinfección por VBK ocurre durante la infancia ya sea por vía gastrointestinal o respiratoria; generalmente, es asintomática pero ocasionalmente puede dar síntomas respiratorios superiores o de infección de vías urinarias. También ha sido referida la transmisión vertical trasplacentaria5.
Después de la infección primaria, el virus permanece latente en el huésped en diferentes localizaciones, principalmente del tracto urogenital y en los tejidos hematolinfoides, y puede ser reactivado por un estatus de inmunosupresión6.
El riñón parece ser el principal sitio de latencia en el hombre, pero también puede encontrarse acantonado en el sistema nervioso central y en la sangre. Del 80 al 90% de la población adulta es seropositiva para VBK, iniciándose la seropositividad a los 10 años4. Se detectan anticuerpos contra el virus en aproximadamente el 90% de las personas a los 14 años de edad. En receptores de injertos renales se detectan anticuerpos contra el VBK entre el 55 y el 73% de los casos en el momento del trasplante.
La reactivación ocurre cuando disminuye la inmunidad celular, pero otras alteraciones, como la isquemia del injerto, aparentemente desempeñan un papel importante en la reactivación. La demostración del PV en el tejido renal es necesaria para confirmar, con certeza, la nefritis intersticial asociada al PV BK (NBK).
La nefropatía por PV (NBK) es un dilema médico que emerge en el trasplante de riñón. La mayoría de las nefritis por polioma se presentan en el primer año postrasplante, pero cerca del 25% de los casos se diagnostica posteriormente7. La pérdida del injerto oscila entre un 10 y un 80% según la serie consultada y parece ser menor en centros que tienen programas de vigilancia y screening activo.
En la década de los 90 hubo un aumento marcado en la incidencia de infectados por VBK. El incremento de la infección por VBK en adultos en los últimos años se ha atribuido a diversos factores, incluyendo un mayor conocimiento acerca de la enfermedad, el uso más frecuente de biopsias, métodos más sensibles y específicos para el diagnóstico y, sobre todo, la introducción de nuevos fármacos inmunosupresores más eficaces pero, a su vez, más potentes en el efecto inmunosupresor8.
Material y métodosEl presente trabajo se ha basado en un análisis doble, retrospectivo y prospectivo y analítico de 114 citologías urinarias, realizadas a 33 pacientes con trasplante renal en el Hospital Universitario La Fe (Servicio de Anatomía Patológica) en el último año. El estudio de la citología urinaria tenía como finalidad la búsqueda de inclusiones intranucleares compatibles con células de «Decoy», hallazgos que nos sugiere el diagnóstico de infección por VBK.
El 60% de los pacientes eran de sexo masculino y 4 casos, de edad pediátrica. A 7 de los 33 pacientes se les realizó más de una citología para el screening de la infección por BK y biopsias renales para confirmar el diagnóstico.
Se utilizó como criterios de inclusión:
- -
Extensiones citológicas con celularidad urotelial, excluyéndose las extensiones acelulares.
- -
Haber realizado de forma simultánea y en la misma orina detección de la carga viral en orina por medio de la reacción en cadena de la polimerasa (PCR), en busca de infección por VBK, a los 33 pacientes trasplantados renales.
Los resultados han sido analizados con el programa estadístico SPSS 15.0 para Windows.
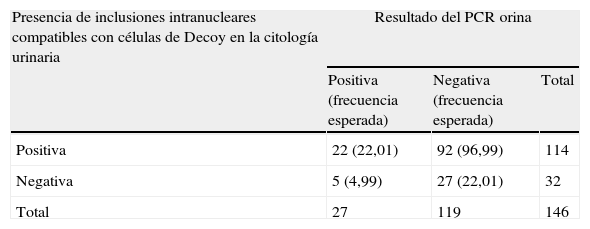
ResultadosMediante el estudio de la citología urinaria, comprobamos que la probabilidad de que un paciente trasplantado renal e infectado por el VBK tenga una citología con presencia de inclusiones nucleares compatibles con células de «Decoy» es alta (81,4%). Por tanto, el 81,4% de los pacientes enfermos de VBK y trasplantados renales tendrán una citología con presencia de inclusiones nucleares compatibles con células de «Decoy» (tabla 1).
Resultados del screening de la citología urinaria y de la determinación de la carga de PCR viral en orina de una muestra de pacientes con trasplante renal
| Presencia de inclusiones intranucleares compatibles con células de Decoy en la citología urinaria | Resultado del PCR orina | ||
| Positiva (frecuencia esperada) | Negativa (frecuencia esperada) | Total | |
| Positiva | 22 (22,01) | 92 (96,99) | 114 |
| Negativa | 5 (4,99) | 27 (22,01) | 32 |
| Total | 27 | 119 | 146 |
Sensibilidad=2222+5=2227=0,81481=(81,4%).
Especificidad=2727+92=27119=0,226=(22,6%).
VPN=2727+5=2732=0,84375=(84,3%).
VPP=2222+92=22114=0,19298=(19,2%).
Frecuencias esperadasfilas_×_columnastotal.
Por otra parte, obtuvimos que la probabilidad de que un paciente trasplantado renal presente una citología negativa, en busca de inclusiones nucleares compatibles con células «Decoy», es de 22,6%; es decir, solo el 22,6% de pacientes serán clasificados como sanos, a partir de los resultados negativos de la citología urinaria (tabla 1).
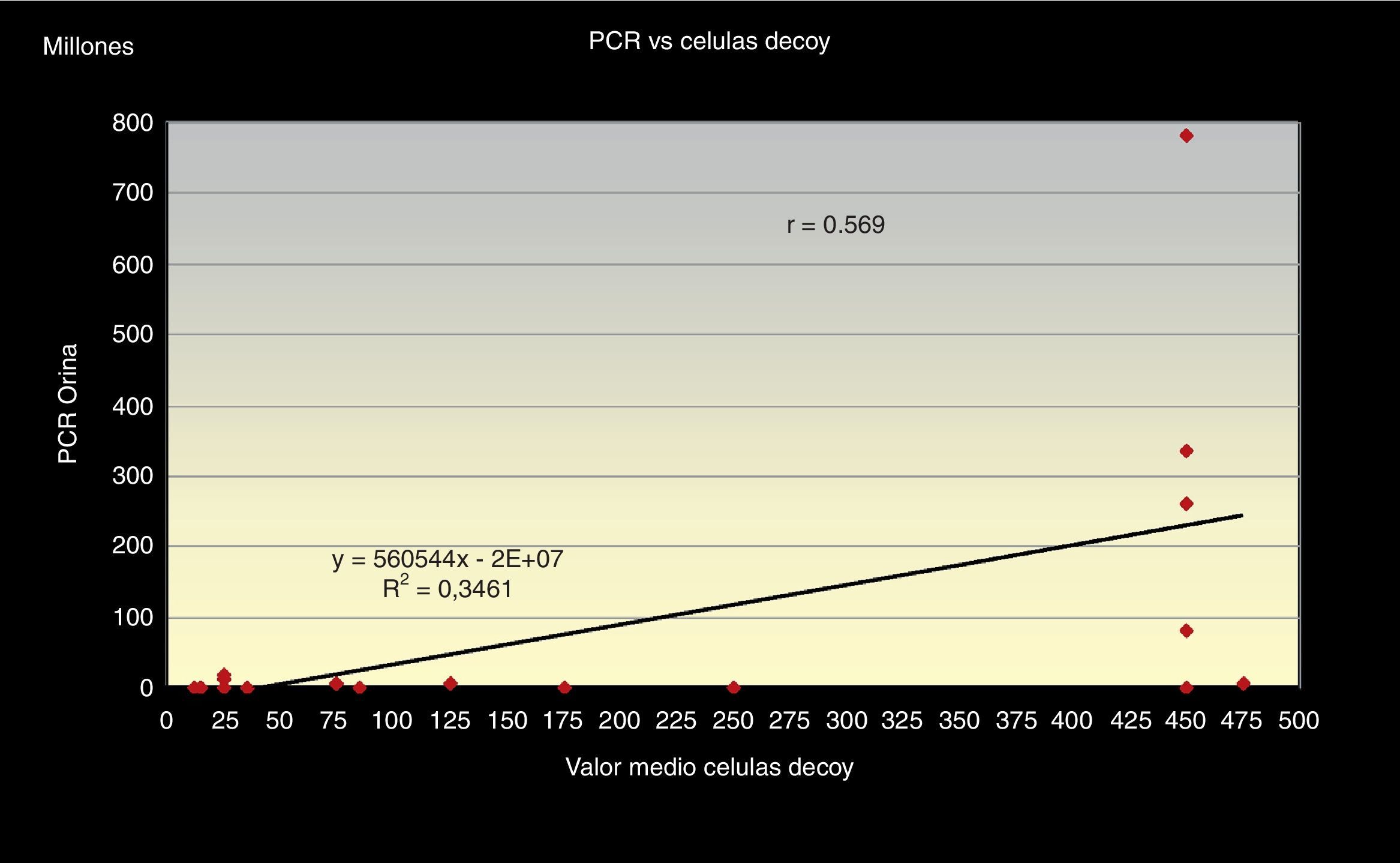
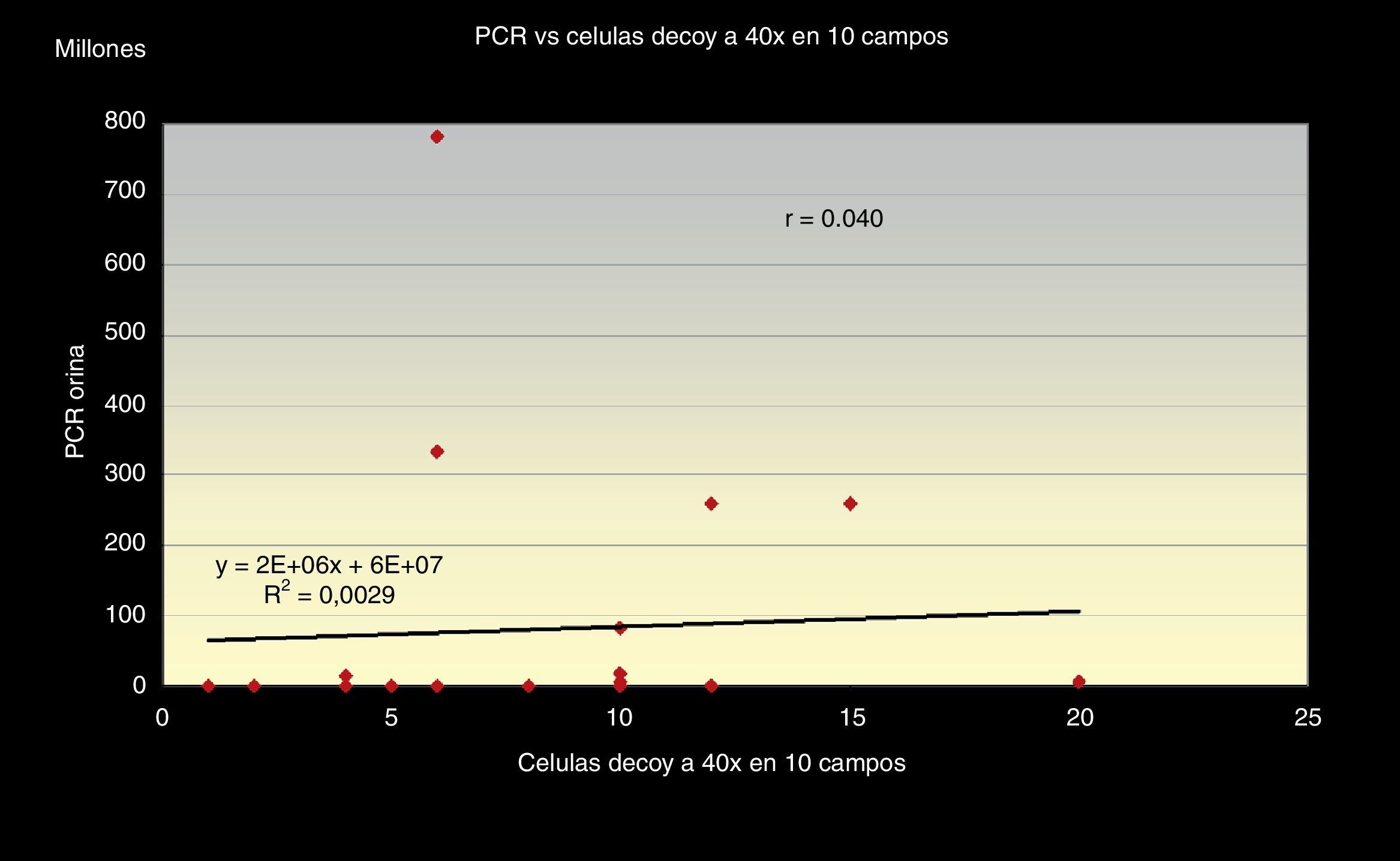
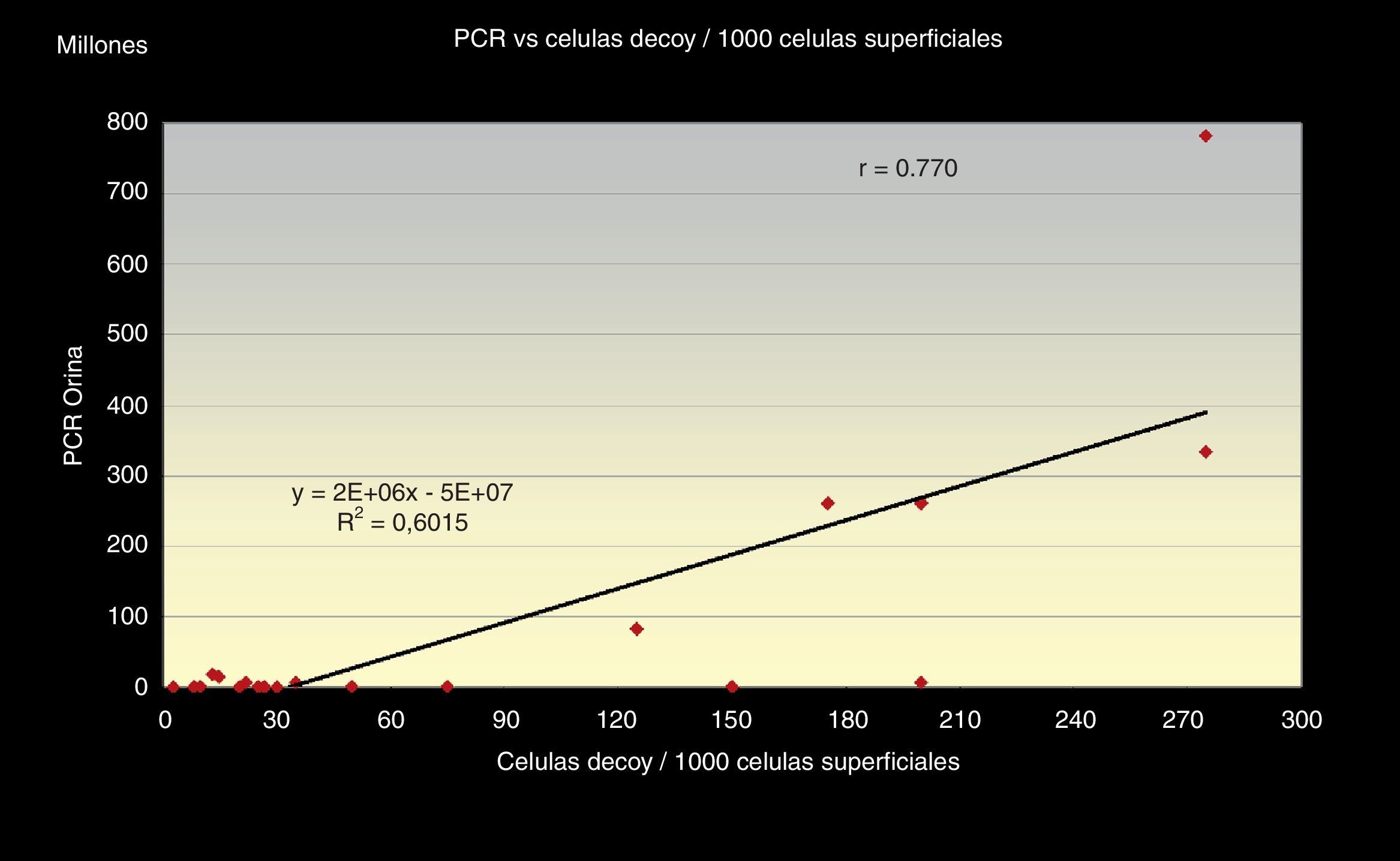
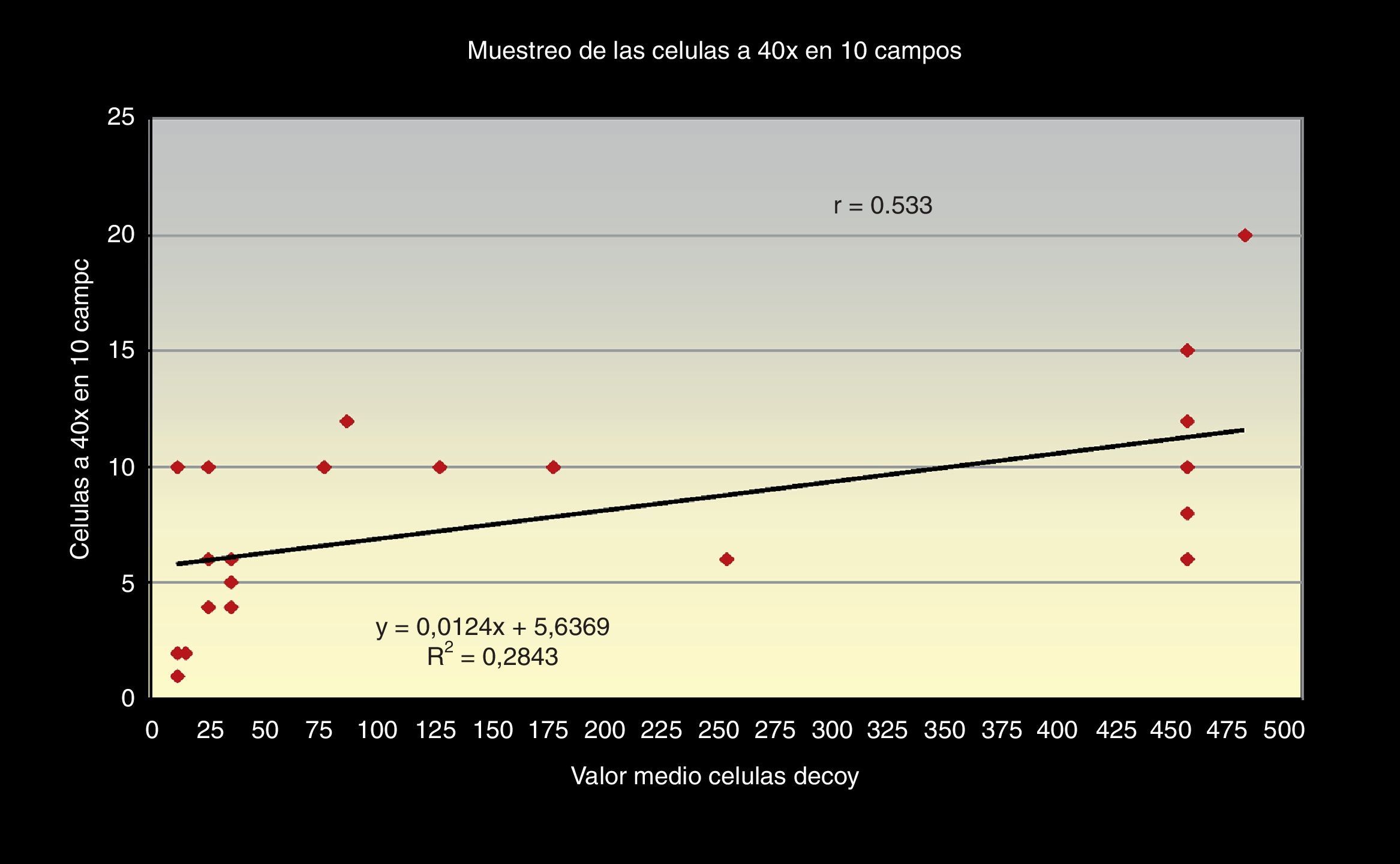
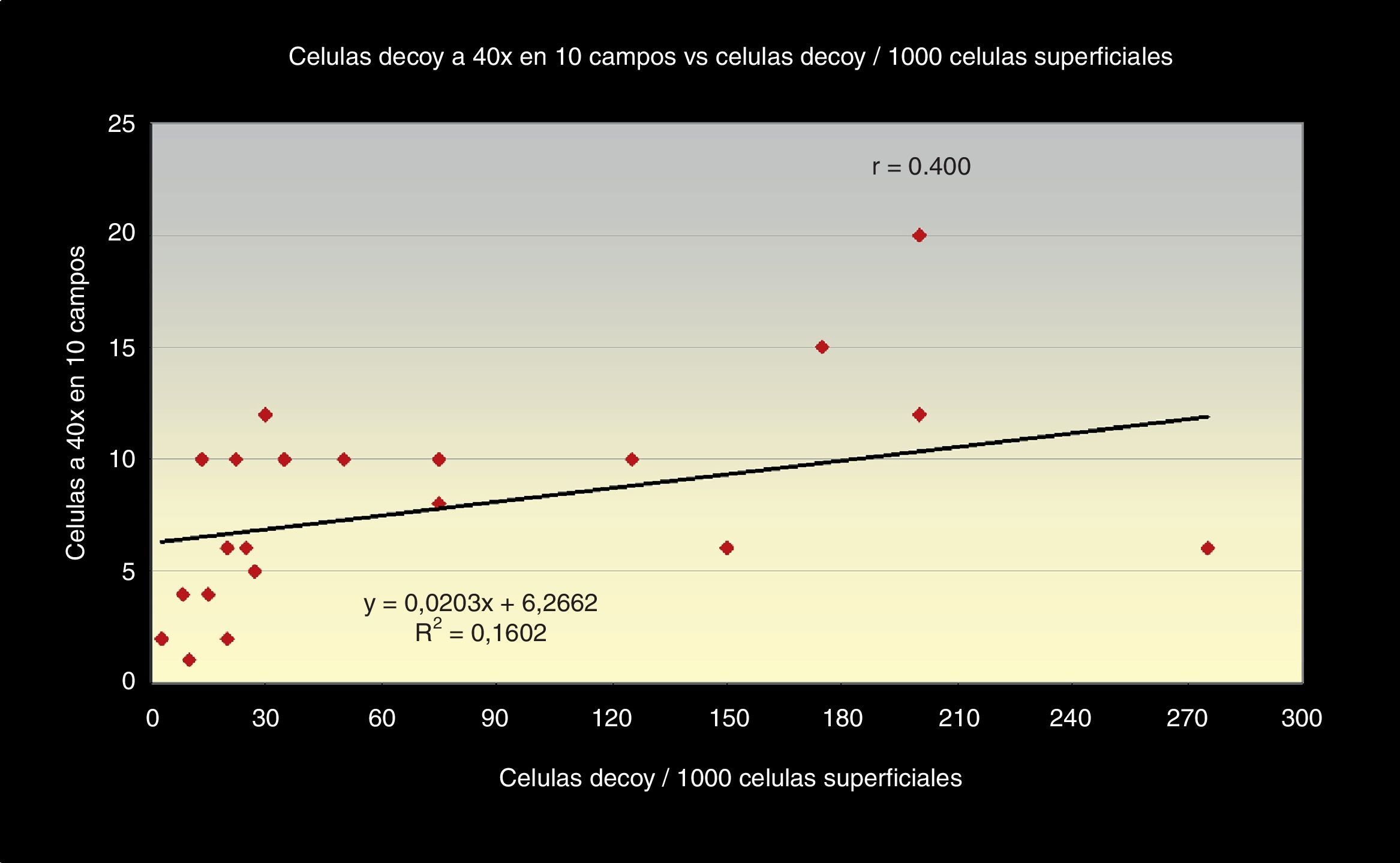
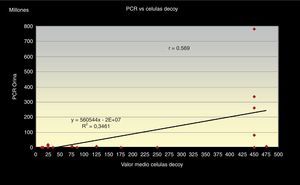
Al correlacionar los 3 métodos de screening citológico propuestos (el número total de células «Decoy», el número de células «Decoy» en 10 campos a 40x y la cantidad de células «Decoy» por cada 1.000 células del tracto urinario) con la carga viral de ADN de VBK (PCR) en orina (figs. 1–3) observamos relación directa entre sí.
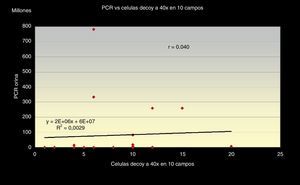
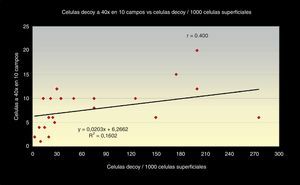
Aunque es de destacar que la correlación entre el número de células «Decoy» en 10 campos a 40x y la carga viral de PCR en orina, es también positiva, pero con una relación débil, obteniendo r=0,040 con un índice de regresión de (R2=0,0029) (fig. 2).
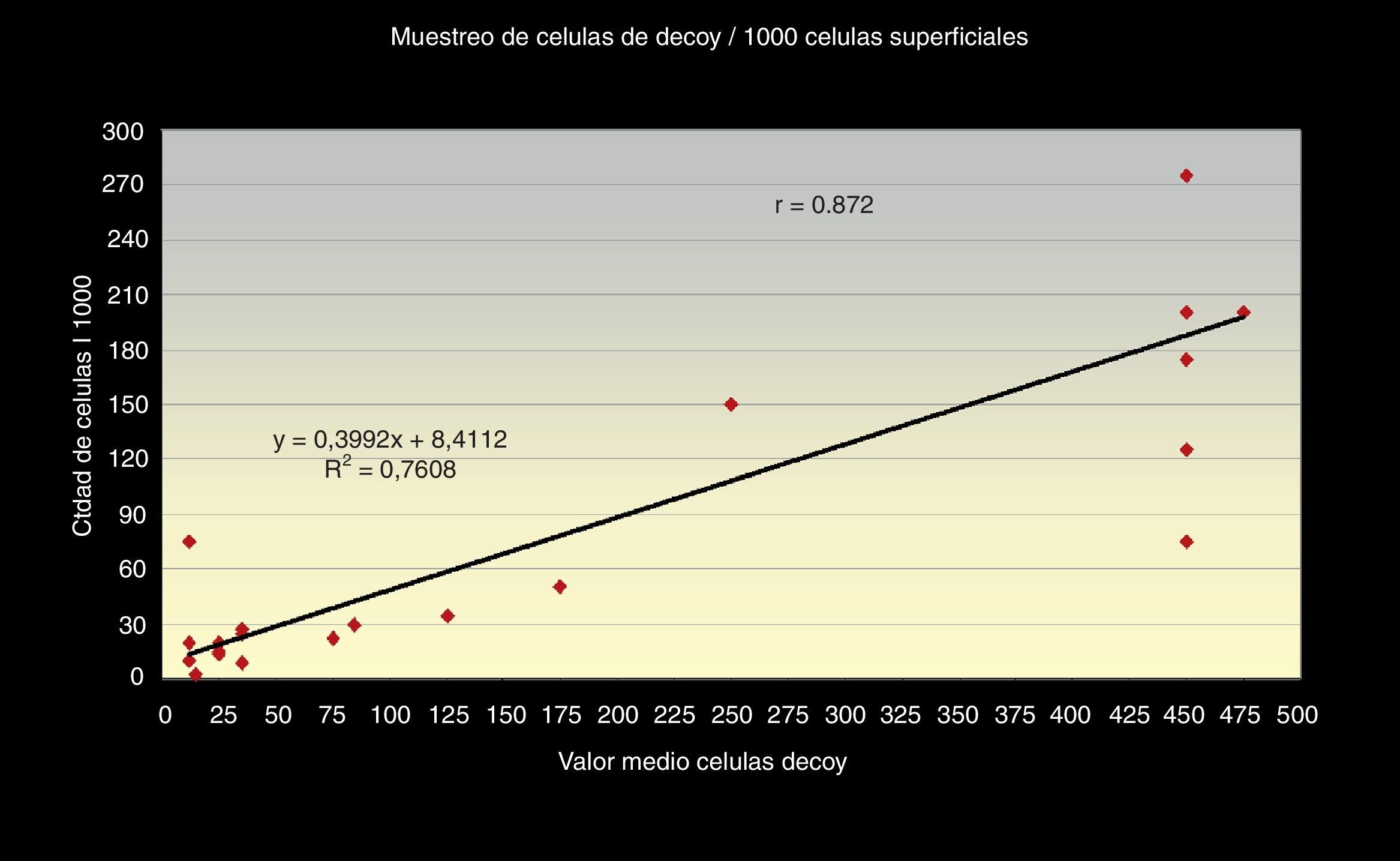
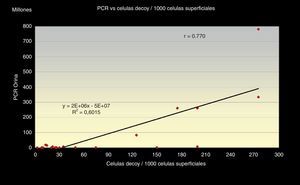
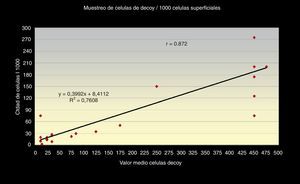
Además obtuvimos que el número total de células «Decoy» en cada extensión citológica presenta una relación directa, en sentido positivo, con la cantidad de células «Decoy» encontradas por cada 1.000 células superficiales de cada frotis r=0,872, con un índice de regresión R2=0,76 y estas últimas, a su vez, tienen una relación directamente positiva con la carga viral de ADN (PCR), r =0,77, obteniéndose una línea monotónica en ambos casos, con un R2=0,60 (figs. 3 y 4).
El resultado más notorio fue la correlación inversa o negativa que se obtuvo al analizar los valores de creatinina sérica y los valores de la carga viral de ADN en orina, reflejando una línea no monotónica con un r=−0,890 y un R2=0,0078.
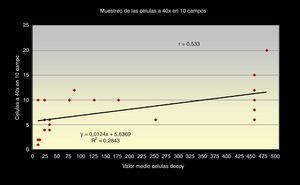
La correlación entre los 3 métodos de screening citológicos propuestos nos indica que, cuanto mayor sea el número total de células «Decoy» en un frotis citológico urinario, mayor número encontraremos en 10 campos a 40x y mayor será el número por cada 1.000 células superficiales en el frotis (figs. 5 y 6).
Además, nos refleja, a su vez, que la correlación con la carga viral de ADN en orina es fuerte en relación con el conteo del total de inclusiones en todo el frotis y a las pertenecientes por cada 1.000 células superficiales.
Por otra parte, la posibilidad de falsos positivos (92 extensiones citológicas en nuestro estudio) es otro aspecto de la citología urinaria que la hace una prueba de baja especificidad, aunque con alta sensibilidad.
Y esto, en parte, puede deberse a que como prueba diagnóstica no es capaz de distinguir entre una infección latente y la reactivación, ni con la existencia de infección por otros PV, aunque es de señalar que en nuestro trabajo no se detectó, mediante técnicas moleculares, ningún caso de infección por JC. Estos resultados concuerdan con los revisados en la literatura.
DiscusiónLa NBK se presenta a menudo clínicamente de una manera muy inespecífica: hay elevación de la creatinina sérica igual que ocurre en otras causas de nefropatía crónica/esclerosante del injerto, así que no hay ninguna característica clínica específica que sugiera esta enfermedad8. En la mayoría de los pacientes hay algún grado de proteinuria, usualmente leve, y otros hallazgos que indican daño tubulointersticial. La infección se detecta, en la mayoría de los casos, en el primer año postrasplante, y no suelen presentarse casos de la infección después de los primeros 2 años del trasplante.
Es importante definir 3 términos en relación con la infección por el virus:
- -
Infección: Evidencia serológica o virológica de que se ha tenido contacto con él o se ha desarrollado inmunidad.
- -
Replicación: Evidencia de multiplicación (infección activa o lítica), basada en demostrar células con cambio citopático en la orina («Decoy cells»), o bien en encontrar m-ARN de la proteína de replicación VP1 o demostrar ADN en orina. La infección puede ser primaria o secundaria dependiendo de si la replicación se detecta en un individuo seronegativo o seropositivo, respectivamente.
- -
Enfermedad: Evidencia de daño citopático y afectación del órgano diana (demostrado por biopsia).
La enfermedad por virus PV se define, por lo tanto, sobre la base de una evidencia histopatológica o ultraestructural del daño citopático y orgánico inducido por el virus.
La replicación por reactivación inicial parece que comienza en vías urinarias, y el hallazgo más temprano es encontrar células con inclusiones en la orina. Estas células se han conocido como «células trampa» o «células señuelo» («Decoy cells»), que nosotros las denominaremos por su apelativo en inglés debido a su uso y conocimiento generalizados. Este nombre lo utilizó inicialmente, desde los años 50, un citotecnólogo que trabajaba con el profesor Leopold Koss: Andrew Ricci, quien llamaba así a células con cambios nucleares reactivos que podrían confundirse con células malignas («células trampa»). En la primera edición del libro de citopatología del Dr. Koss, en 1968, antes de conocer la existencia del virus, ya él postulaba que muchas de estas alteraciones podrían deberse a una infección viral9.
Actualmente la denominación «Decoy cells» se utiliza exclusivamente para designar a las células con inclusiones características del PV en la orina. Es muy importante su detección porque:
- 1)
Aparecen antes de que se manifieste la enfermedad (nefritis intersticial) a través de una disfunción clínica.
- 2)
Virtualmente todos los pacientes con nefritis intersticial asociada al virus (NBK) tienen abundantes «Decoy cells» en orina: la sensibilidad es, por tanto, del 100%, aunque muchos pacientes sin la enfermedad también tienen replicación del virus en el urotelio (hasta un 20%), por lo que la especificidad es muy baja (29%); es decir, su valor predictivo negativo es muy alto (casi 100%): si no hay «Decoy cells» en orina, en 3 tomas distintas, prácticamente podemos descartar la NBK.
La detección en la orina de las células señuelo indica replicación activa del PV en el aparato genitourinario. Se recomienda como un método de detección o screening10, ya que posee una alta sensibilidad (de 100%) con una especificidad para el diagnóstico de NBK baja (71%). Por lo tanto, la presencia de cuerpos de inclusiones o células «Decoy» en orina es característica de la infección por VBK y sugiere su diagnóstico. La ausencia de células «Decoy» en orina excluye el diagnóstico de infección por PV.
La identificación del VBK en los laboratorios incluye una citología urinaria, biopsia renal, la reacción a la polimerasa (PCR) para detectar la presencia de ADN viral en orina y plasma y la detección del ARN-m para la carga viral de la proteína VPI en la orina. La mayor limitación de los métodos basados en la detección del ADN viral es que no son capaces de distinguir entre una infección latente y la reactivación.
El uso de PCR en tiempo real estudiando la expresión de ARN-m en vez de ADN en células del sedimento urinario se ha descrito como un método certero y no invasivo para establecer el diagnóstico presuntivo de NBK en pacientes adultos con trasplante renal.
Utilizando un valor de corte de 6,5×105 copias de la región VP1 del VBK por nanogramo de ARN total en orina, se puede predecir la nefritis con una sensibilidad de 93,8% y una especificidad de 93,9%11. Cabe mencionar que el uso de ARN de sedimento urinario se ha empleado con éxito para el diagnóstico de la NBK por rechazo agudo del injerto renal12.
Semple et al.13 demostraron que, tanto la citología urinaria como la PCR, tienen una sensibilidad de un 100% y una especificidad de un 93 y un 98%, respectivamente, para la detección del VBK, al compararlas con los resultados de la biopsia renal. Ambas pruebas demostraron, por lo tanto, una alta sensibilidad. Su diferencia radica en su especificidad. Así, en este estudio, en 2 pacientes con resultados positivos para supuesta infección por VBK en citología urinaria y negativo en el PCR, se confirmó infección por JC, por técnicas de biología molecular13.
En esto radica la limitación de esta prueba. La citología urinaria es una buena herramienta para investigar la reactivación por PV, pero no es diagnóstico. Las células de «Decoy» son una característica asociada pero no un hallazgo patognomónico de la NBK.
El «gold standard» para el diagnóstico de la nefritis viral sigue siendo la evaluación detallada de la biopsia renal. Siguiendo las recomendaciones de la clasificación de Banff 07, se deben examinar 2 secciones tisulares que deben contener parénquima medular para aumentar la sensibilidad. Los hallazgos histopatológicos consideran cuerpos de inclusión intranucleares en las células epiteliales, cambios citopáticos tubulares e infiltrado intersticial (fig. 2). El infiltrado puede confundirse con rechazo del aloinjerto y con la nefrotoxicidad inducida por inmunosupresores calciodiuréticos14.
La evaluación del tejido renal con microscopia electrónica o el uso de inmunohistoquímica establecen firmemente el diagnóstico. Dado que la NBK puede ser focal, existe la posibilidad de errores de muestreo, y una biopsia negativa no puede descartar completamente la posibilidad de nefritis por VBK.
En los casos con sospecha de VBK, con replicación viral por encima de los valores de corte, se recomienda realizar inmunohistoquímica y, si esta resulta negativa, considerar la realización de una nueva biopsia renal15.
Desde el punto de vista histopatológico, la nefritis intersticial solo se confirma demostrando las inclusiones en el parénquima renal por medio de la biopsia. Las inclusiones virales están presentes en las células de túbulos proximales y distales, y en el epitelio urotelial. Las inclusiones son exclusivamente intranucleares y hay varios tipos histomorfológicos diferentes9.
No existe un parámetro guía útil para todas las situaciones diagnósticas, por lo que la aceptabilidad de una prueba depende de la enfermedad estudiada. En nuestro caso nos propusimos asegurar el diagnóstico certero pues, de la detección de la infección por VBK en pacientes trasplantados, depende la conducta médica a seguir, y así se evita la consecuente neuropatía BK a que lleva dicha enfermedad.
Resumiendo todo lo anterior analizado, concluimos que lo ideal es buscar un test, de máxima especificidad, aunque eso implique que dicho test sea de baja sensibilidad.
ConclusionesLos 3 métodos de screening citológico propuestos: el conteo del número total de inclusiones nucleares compatibles con células «Decoy», referido a todo el frotis, el número total de inclusiones a 10 campos a 40x y el total de inclusiones nucleares por cada 1.000 células del estrato superficial son métodos sensibles para cuantificar la riqueza celular, aunque con baja especificidad.
La carga viral en orina es un método mucho más específico de diagnóstico, siendo la biopsia renal la prueba de mayor importancia diagnóstica.