El Grupo de Metabolismo Óseo y Mineral de la Sociedad Argentina de Nefrología ( www.san.org ) ha elaborado un consenso para ayudar al nefrólogo en el manejo del metabolismo mineral del paciente con enfermedad renal crónica, adaptado a la realidad de Argentina. Hemos tenido en cuenta las nuevas definiciones y el sistema de clasificación más integrado que recientemente propuso la Fundación KDIGO (Kidney Disease Improving Global Outcomes). En esta parte se desarrollan varios capítulos. En este artículo reseñamos la introducción del consenso de trabajo y el capítulo primero que versa sobre el metabolismo óseo y mineral en la enfermedad renal crónica estadio 3–5.
The bone and mineral metabolism group of the Argentina Nephrology Society (Sociedad Argentina de Nefrología) ( www.san.org ) has produced a consensus document to help the nephrologist in the management of mineral metabolism of the patient with chronic kidney disease, adapted to the reality of Argentina. It has taken into account the new definitions and a more integrated classification system than that recently proposed by the KDIGO (Kidney Disease Improving Global Outcomes) Foundation. In this part several chapters are presented. In this article we review the introduction to the working consensus and the first chapter that deals with bone and mineral metabolism in the treatment of hyperphosphatemia in chronic kidney disease stage 3–5.
El objetivo de elaborar este consenso fue colaborar con el nefrólogo en el manejo del metabolismo mineral del paciente con ERC.
Para su realización, partimos de formular preguntas que necesitamos respuesta para el manejo clínico de nuestros pacientes, se consultaron fuentes bibliográficas y guías internacionales intentando adaptarlas a la realidad de nuestro país, además contamos con consultores externos como los Dres. Jorge Cannata, Eduardo Slatopolsky y Víctor Lorenzo.
Hemos tenido en cuenta las nuevas definiciones y el sistema de clasificación más integrado que recientemente propuso la Fundación KDIGO (Kidney Disease Improving Global Outcomes).
DefinicionesDesorden sistémico del metabolismo mineral y óseo debido a ERC (CKD-MBD).
Este término integra todas las alteraciones bioquímicas, esqueléticas y las calcificaciones extraesqueléticas que ocurren como consecuencia de las alteraciones del metabolismo mineral en la ERC. Se manifiesta por una, o la combinación de las siguientes manifestaciones:
1) Anormalidades del calcio (Ca), fósforo (P), hormona paratiroidea (PTH) y vitamina D.
2) Alteraciones en el remodelado, mineralización, volumen, resistencia y crecimiento longitudinal.
3) Calcificaciones vasculares o de otros tejidos blandos.
El riñón participa en la mantención de la homeostasis del Ca y P en colaboración con la glándula paratiroidea, el intestino y el hueso. Es el órgano target para diferentes hormonas y lugar de síntesis de la 1,25 (OH)2 vitamina D3.
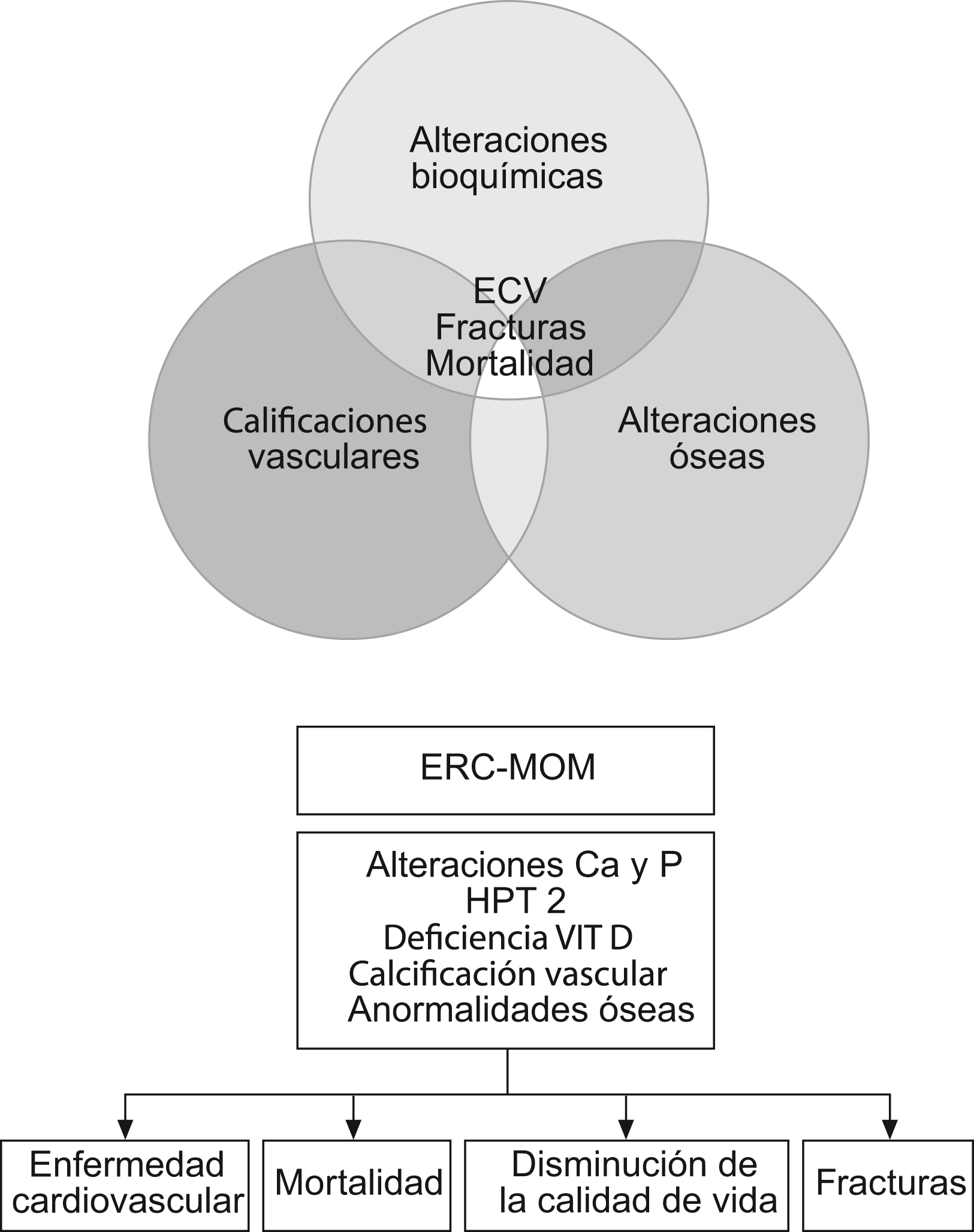
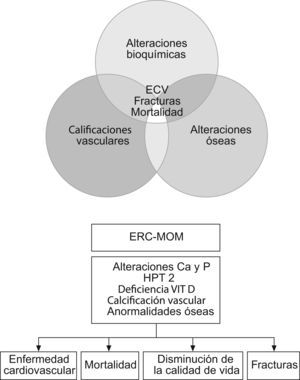
Por lo tanto, a lo largo de la progresión de la ERC varias anormalidades en el metabolismo mineral y óseo se desarrollan con las resultantes consecuencias. Tradicionalmente estos desórdenes se los consideró como relacionadas al hueso. Hoy en día sabemos que las alteraciones del metabolismo mineral y óseo tienen un rol crítico en la patogénesis de las calcificaciones vasculares y tejidos blandos, resultando en complicaciones cardiovasculares y mortalidad (figura).
Figura 1. Alteraciones del metabolismo mineral y óseo.
El marco propuesto para clasificar el desorden mineral y óseo en la enfermedad renal crónica divide a los pacientes en 4 tipos, basados en la presencia o ausencia de anormalidades en los 3 principales componentes utilizados en la definición del trastorno que se detallan en la tabla.
Tabla 1. Marco propuesto para clasificar el desorden mineral y óseo en la enfermedad renal crónica
| Tipo | Anormalidades de laboratorio | Enfermedad ósea | Calcificación vascular |
| L | (+) | (−) | (−) |
| LB | (+) | (+) | (−) |
| LC | (+) | (−) | (+) |
| LBC | (+) | (+) | (+) |
B) Enfermedad ósea, C) calcificación de tejidos extraesquelético y L) Alteraciones en el laboratorio.
Este nuevo enfoque integral está destinado a ser descriptivo más que predictivo, para que manejemos un mismo idioma, como un primer intento de mejorar la comunicación y estimular la investigación.
La utilización del término desorden mineral y óseo en la enfermedad renal crónica debe ser lo más específico posible, y limitado a las alteraciones causadas por una reducción significativa de la función renal. En general, los pacientes adultos con una tasa de filtración glomerular >a 60ml/min/1,73m2 deberían ser excluídos, dado que este es el nivel de tasa de filtración glomerular por debajo del cual las alteraciones del calcio, fósforo, PTH y metabolismo de la vitamina D son detectables. En pacientes pediátricos el nivel de tasa de filtración glomerular al cual las alteraciones del metabolismo mineral y óseo son detectables es mayor que en la población adulta (TFG<89ml/min/1,73m2).
Por otro lado, el aumento en la fragilidad ósea observada con la edad (osteoporosis senil o postmenopáusica) y enfermedad aterosclerótica con calcificación vascular que se desarrolla independiente de la ERC puede estar presente en pacientes con ERC que tienen normal o sólo levemente reducida la función renal y puede coexistir con las alteraciones minerales y óseas luego de su aparición. Esta es una consideración importante dado que la ERC puede alterar el diagnóstico, tratamiento y pronóstico de la osteoporosis y aterosclerosis.
Osteodistrofia renal (ODR): Este término queda restringido a las alteraciones de la morfología y arquitectura ósea evidenciadas a través de la biopsia ósea, propias de la ERC. Es una medida del componente esquelético del desorden sistémico mineral y óseo en la enfermedad renal crónica (CKD-MBD).
En resumen, este enfoque integral del metabolismo óseo y mineral en el paciente con ERC incluyendo los métodos diagnósticos en forma conjunta, es decir, los resultados de laboratorio, las anormalidades óseas y las calcificaciones vasculares y no cada uno de ellos de manera aislada, nos permite tomar decisiones terapéuticas más acertadas.
Metabolismo óseo y mineral en la enfermedad renal crónica estadio 3–51.1 Los valores séricos de calcio (Ca); fósforo (P); fosfatasa alcalina (FA); paratohormona (PTH); pH; bicarbonato (HCO3); reserva alcalina (CO2 total) y metabolitos de la vitamina D, deben ser determinados en los distintos estadios de la enfermedad renal crónica (ERC).
1.2 Se recomienda iniciar la evaluación de las anormalidades bioquímicas del metabolismo mineral y óseo en el estadio 3 de la ERC.
1.3 Debería iniciarse el monitoreo bioquímico de calcio (Ca+); fósforo (P); paratohormona (PTH); fosfatasa alcalina; bicarbonato (HCO3); dióxido de carbono (CO2); y metabolitos de la vitamina D, cuando tenemos un filtrado glomerular entre 60 y 30ml/min.
1.4 Hay insuficiente evidencia para determinar cuales son los valores límites de, calcio, fósforo y PTH en pacientes en los diferentes estadios de enfermedad renal crónica (ERC).
1.5 Los objetivos son prevenir la hiperfosfatemia y las calcificaciones vasculares, evitando la hipofosfatemia y el hiperparatiroidismo secundario.
1.6 La frecuencia del monitoreo debe ser establecida teniendo en cuenta la presencia y magnitud de las anormalidades del metabolismo mineral y la progresión de la enfermedad renal.
1.7 Para aquellos pacientes en tratamiento para las anormalidades minerales y óseas, debiera considerarse ajustar individualmente la frecuencia de las mediciones, para monitorear la eficacia y efectos adversos de tales tratamientos.
1.8 Los niveles y la frecuencia de las determinaciones recomendadas para calcio (Ca); fósforo (P); paratormona (PTH); metabolitos de la vitamina D, según el estadio de ERC son.
1.9 Recomendamos que la interpretación de los valores bioquímicos y hormonales debería hacerse analizando tendencias, más que un único valor, y se debiera interpretar estos valores según el método de laboratorio utilizado para tomar decisiones terapéuticas.
1.10 Recomendamos que los laboratorios clínicos deberían informar los métodos utilizados, cambios en la metodología, tipo de muestra (plasma o suero) y las especificaciones en el manejo de las muestras para así facilitar la interpretación de los resultados.
1.11 La acidosis metabólica debe ser detectada y eventualmente corregida para evitar la pérdida de masa ósea y muscular en el paciente con ERC. En estadio prediálisis una dieta baja en proteínas y fósforo contribuye a la regulación del estado ácido-base y la administración de bicarbonato por vía oral puede estar indicada en estos pacientes.
La evaluación inicial de las alteraciones del metabolismo óseo y mineral en la ERC debe incluir PTH, calcio (iónico o corregido por albúmina), fósforo, fosfatasa alcalina (ósea o total) y bicarbonato1,2,3,4,5,6,7,8,9.
Las alteraciones bioquímicas comienzan en estadios tempranos de la enfermedad renal. Con filtrado glomerular por debajo de 60ml/min se ha observado un aumento de PTH y una disminución de 25 (OH) vitamina D32,3. En orden de frecuencia de aparición de las alteraciones del metabolismo óseo y mineral, la primera es la disminución de 1,25 (OH) vitamina D, luego una disminución de la excreción urinaria de fosfato y por último la elevación de PTH, esta última, muestra una significativa variación en sus niveles cuando el FG desciende por debajo de 60ml/min4,5. Por lo tanto, se debe medir los niveles de calcio, fósforo y PTH a partir del estadio 3 de ERC5,6,7,8,9. La hiperfosfatemia en la ERC es la resultante de 3 factores: ingesta excesiva de fósforo, reducción en la depuración renal y el estado de la remodelación ósea. No existe evidencia sobre los valores objetivos de fósforo en pacientes con estadios 3–5 de ERC4. Sin embargo, la hiperfosfatemia ha sido asociada con pobres resultados clínicos y mortalidad en ERC estadio 4–5. Por cada aumento en 1mg/dl de fósforo se observó una declinación del filtrado glomerular de 0,154ml/min y un mayor riesgo de mortalidad de RR 1,2510,11,12. La hiperfosfatemia puede directamente causar o exacerbar el hiperparatiroidismo secundario, reducir los niveles de calcitriol, aumentar la enfermedad ósea y la calcificación vascular. Los niveles de fósforo deben ser mantenidos en la franja de normalidad cuando el FG disminuye por debajo de 20ml/min5.
El calcio desempeña importantes funciones fisiológicas en el organismo encontrándose el 99% del mismo distribuido en el esqueleto11. En el hueso participa de la integridad estructural del esqueleto. Una fracción importante del calcio extracelular es el Ca+ sérico, el cual es mantenido en forma constante para poder realizar y mantener numerosos procesos bioquímicos. Por tal motivo, los niveles de calcio sérico deben ser mantenidos en el rango de la normalidad11. Del Ca+ total, el 45% se encuentra unido a albúmina y el 55% restante corresponde al Ca+ iónico. En los pacientes con ERC es importante considerar los niveles de Ca+ iónico o de Ca+ unido a albúmina13. En presencia de hipoalbuminemia, se observa un aumento de Ca+ iónico en relación al Ca+ total, es decir, el Ca+ total subestima el calcio iónico en presencia de hipoalbuminemia. Una fórmula frecuentemente utilizada es estimar la modificación de Ca+ de la siguiente manera: por cada 1 mg de descenso de albúmina por debajo de 4mg/dl hay un aumento de Ca+ (iónico) de 0,8mg/dl. Otra fórmula que se puede utilizar para el calcio total corregido es Ca+ total corregido=Ca+ total medido+[(4-albúmina)×0,8]7.
Los niveles de Ca+ en los pacientes en diferentes grados de ERC dependerá de la ingesta de calcio diario, del tipo de quelante del fósforo utilizado, de la administración concomitante de vitamina D, y de los niveles plasmáticos de PTH14.
El hiperparatiroidismo secundario se desarrolla desde estadios tempranos y presenta un progresivo empeoramiento durante el curso de la ERC2. Los niveles elevados de PTH están asociados a todas las causas de mortalidad prediálisis, aún luego de ajustar a potenciales confundidores como niveles de calcio, fósforo y la utilización de vitamina D activa15. Sin embargo, no hay trabajos aleatorizados y controlados sobre el rango objetivo de PTH en estadio 3–5 de ERC, y es conveniente evaluar la tendencia de evolución de los niveles de PTH, más que un valor aislado. Además, se deben evaluar los factores modificables que pueden condicionar el aumento de PTH tales como, hiperfosfatemia, hipocalcemia y deficiencia de 25 (OH) vitamina D3. La enfermedad renal crónica puede llevar a incrementar los niveles de PTH y el objetivo de los nefrólogos en los últimos 30 años fue focalizar el tratamiento en disminuir sus niveles. Los niveles aumentados de (PTH) hiperparatiroidismo esta asociado con aumento de mortalidad y morbilidad en los estadios 3–5. Sin embargo, existe una variabilidad inter-método en la cuantificacion de los niveles de PTH, secundario a la determinación de diferentes fragmentos de la molécula de PTH16. Por lo tanto, es dificultoso establecer un valor de PTH en estadios tempranos de ERC, sobre todo debido a que es un proceso dinámico y estos valores se van modificando a medida que progresa el deterioro de FG, también existe una resistencia del hueso a la acción de PTH. El valor predictivo de la PTH en relación a los hallazgos de la biopsia ósea es pobre cuando los valores de PTH se encuentra entre 2 a 9 veces del valor normal. Así, el valor objetivo recomendado por K/DOQI para estadio 5 en diálisis fue asociado con una elevada incidencia de bajo recambio óseo, sugiriendo que otros marcadores pueden ser necesarios para medir más precisamente el recambio óseo17. Por otro lado, en los pacientes en predialisis, se observa una elevada prevalencia de bajo recambio óseo diagnosticado por biopsia ósea, aún con niveles normales o elevadzados de PTH18. Sin embargo, hasta que estudios controlados y aleatorizados se lleven a cabo es aconsejable regirse por las recomendaciones realizadas por K/DOQI en los estadios 3–5 de la ERC.
Los niveles plasmáticos de 25 (OH) representa el estado corporal de vitamina D de un individuo. Las causas de deficiencia e insuficiencia de vitamina D en la ERC son: la baja exposición solar , disminución de la ingesta de alimentos ricos en vitamina D y disminución de síntesis endógena de vitamina D, estos factores se encuentran agravados por la pérdida del filtrado renal19. En pacientes con ERC cuando el FG disminuye por debajo de 60ml/min se observa una disminución de los niveles de 25 (OH) vitamina D32. Los pacientes con ERC en sus diferentes estadios presentan un riesgo elevado de deficiencia o insuficiencia de esta vitamina, algunos estudios muestran una deficiencia mayor al 70% en pacientes con estadios 3–419,20,21,22,23,24,25. Tanto en individuos normales como en pacientes con ERC, los niveles disminuidos de 25 (OH) vitamina D3 están asociados a la progresión y severidad del hiperparatiroidismo secundario. Alcanzar y mantener los niveles séricos de 30ng/ml es clínicamente adecuado y seguro para pacientes con riesgo de desarrollar alteraciones metabólicas óseas y/o hiperparatiroidismo secundario26.
El balance ácido-base en los adultos depende de la regulación ejercida por dos órganos principales: pulmón y riñón, siendo este último, el responsable de eliminar los ácidos no volátiles para mantener el balance.
En la regulación metabólica influyen diferentes factores como son: la composición química de los alimentos (proteínas, fósforo, sodio, potasio, calcio, magnesio), la tasa de absorción intestinal de los diferentes nutrientes, la generación de sulfato proveniente de la degradación de aminoácidos sulfurados, el nivel de degradación de fósforo y de la valencia iónica del calcio y del magnesio27,28.
El riñón normal logra excretar la carga de ácidos que se produce, aproximadamente 1mEq/kg/d, que mayoritariamente derivan del metabolismo de los aminoácidos sulfurados. Esta eliminación se logra fundamentalmente a través de la eliminación urinaria de hidrogeniones, tanto en forma de ácidos titulables (fosfórico, sulfúrico) como de amonio, derivados todos, fundamentalmente de la degradación normal de las proteínas.
A la vez la alta ingesta proteica se relaciona con una mayor excreción urinaria de ácidos y se asocia con incremento de la calciuria. El incremento sostenido de la ingesta de proteínas, básicamente las de origen animal, fue relacionado con mayor desgaste óseo y fracturas en mujeres sin daño renal y en población general de mayor edad29.
A medida que se produce una reducción en la función renal, la eliminación de ácidos en principio se sostiene gracias a un incremento en la excreción de amonio por cada nefrona. Pero esta función forzada comienza a verse disminuida cuando la tasa de filtrado glomerular se aproxima a los 45ml/min30,31.
La acidosis que ocurre en la ERC es dependiente de la dificultosa excreción de aniones ácidos, fundamentalmente de fosfatos y sulfatos ácidos. Los amortiguadores (buffer) intracelular y óseo son los principales responsables del mantenimiento del bicarbonato dentro de límites aceptables, pero esto mayoritariamente se hace viable a expensas del hueso. La excreción neta de ácidos correlaciona inversamente con los cambios en la densidad mineral ósea. Por lo tanto, la hipercalciuria se incentiva con la alimentación hiperproteica que produce la movilización de calcio del hueso para actuar como buffer del efecto acidogenético de las proteínas.
En un estudio reciente donde se reevaluó los datos proveniente del estudio MDRD, se observó que el bicarbonato total se relaciona inversamente con la ingesta proteica y que una ingesta proteica reducida y controlada incrementa el bicarbonato sérico31.
A su vez, las bases provenientes de los alimentos están estrechamente relacionadas con los vegetales (tabla) y por lo tanto su ingesta podría contribuir a contrarrestar el efecto de la carga ácida promovida por las proteínas.
Además, es sabido que la acidosis estimula la degradación proteica, la oxidación de aminoácidos, e interfiere con la síntesis de albúmina, lo cual complica la situación nutricional. Esto se manifiesta dentro de un contexto de producción disminuida, o liberación modificada de hormonas como IGF-1, insulina, glucocorticoides, hormona tiroidea, hormona paratiroidea y vitamina D32,33.
Por todo lo antes expuesto sería recomendable efectuar control periódico de los niveles de bicarbonato sérico y nunca desestimar la indicación de una dieta con bajo aporte proteico y por lo tanto de fósforo, lo cual seguramente repercutirá en un mejor devenir nutricional y óseo para el paciente34,35,36,37,38.
Esto puede realizarse en paralelo con la utilización oral de Na+HCO3 pero, debemos recordar que su utilización podría estar contraindicada en pacientes hipertensos y/o con retención hidrosalina, lo que ocurre con cierta frecuencia en pacientes con ERC estadios 3 y 4. También la administración de carbonato de calcio es de utilidad porque incrementa la concentración de CO3H extracelular y el pH, en este caso, debe vigilarse la aparición de hipercalcemia.
Cuanto más tempranamente en la evolución de la ERC pueda detectarse y actuar sobre la acidosis, mejor será para lograr control sobre el desarrollo de HPS y prevenir la desmineralización ósea, conservando además, la masa muscular del individuo37.
Preguntas de importancia clínica1) ¿Cuáles son los valores bioquímicos recomendados según los estadios de la IRC?
2) ¿Cuál sería la frecuencia recomendada de monitoreo de los valores bioquímicos de Ca; P; FA; PTH; HCO3; Co2 total?
3) ¿Cuáles son los valores de Calcemia, Fosfatemia y PTH a los cuales están indicados los tratamientos adecuados y a qué valores de filtrado?
4) ¿Debe jerarquizarse la búsqueda de acidosis metabólica en todos los pacientes con IRC?
5) ¿Tiene importancia en la génesis del hiperparatiroidismo secundario?
6) ¿Debemos tratarla?
El Grupo de Trabajo de Metabolismo Óseo Mineral perteneciente a la Sociedad Argentina de Nefrología, ha realizado los esfuerzos posibles para evitar cualquier situación en relación a potenciales conflictos de intereses que puedan haber ocurrido como resultado de una relación externa de tipo personal, profesional o de interés de negocios de cualquier miembro del grupo de trabajo.
Grupo de Trabajo de Metabolismo Óseo y Mineral
Agradecimientos
A todos los socios de la Sociedad Argentina de Nefrología que participaron con sus opiniones a través de la encuesta.
A las autoridades de la Sociedad Argentina de Nefrología* , siendo Presidente: Dr. Walter Douthat.
Al Dr. Julen Ocharan-Corcuera, por su publicación en esta revista.
*Comisión Directiva de la Sociedad Argentina de Nefrología
Presidente: Dr Walter Douthat
Secretario: Dr Claudio Mascheroni
Tesorero: Dr. Juan José Di Bernardo
| Vocales: | |
| Buenos Aires: | Catamarca |
| Dr. Bruno Lococo | Dr. Segundo Fernandez |
| Dra. Mónica Calvo | |
| Dr. Heriberto Demicheli | Córdoba |
| Dr. Helio Geandet | Dr. Sergio Boni |
| Dra. Mirta López | Dr. Nestor Garcia |
| Dra. Sandra Mendez | Dr. Marcelo Orias |
| Dra. Silvia Russomando | |
| Dr. Daniel D’Errico | Entre Ríos |
| Dr. Rodolfo Piscitelli | Dr. Eugenio Bernhardt |
| Dra. María Inés Marone | |
| Dr. Eduardo Sanguinetti | Norpatagonia |
| Dra. Beatriz Rizzo | |
| Mendoza | Salta |
| Dr. Jose Ascar | Dra. NoraMarcheta |
| Dr. Carlos Abate | |
| Nordeste | |
| Dr. Marcelo Ferreyra | San Juan |
| Dr. Raul Morales | Dr. Hugo Ramirez |
| Noroeste: | Santa Fe |
| Dra. Mariela Sal | Dr. Alberto Alles |
| Dra. Sara Muhamad | |
| Vocales Suplentes | |
| Buenos Aires: | Noroeste: |
| Dra. Olga Guardia | Dr. Norberto Gomez |
Recibido 1 Junio 2010
Aceptado 2 Julio 2010
Autor para correspondencia. apenialba@arnet.com.ar