Introducción
El empleo de inhibidores de la enzima de conversión de angiotensina (IECA) en la enfermedad renal crónica avanzada (ERCA) se ha generalizado en los últimos años, con buenos resultados en el control de la presión arterial (PA) y de la proteinuria, pero con algunos efectos secundarios, especialmente problemáticos en los pacientes con ERCA, como la hiperpotasemia y la anemización, que se dan en menor medida con los inhibidores de los receptores tipo I de angiotensina II (ARA-II)1. Algunos ARA-II han sido utilizados en pacientes renales con buena respuesta en el control de la PA y también reducción de la proteinuria2-4, sobre todo en nefropatía diabética5,6. Nuestra experiencia con alguno de estos fármacos ha confirmado buenos resultados en la ERCA7 e incluso en pacientes en diálisis, sin agravar la anemia y sin incremento del potasio sérico8. Hay pocos estudios sobre el empleo de ARA-II en pacientes hipertensos con ERCA en grado IV de la clasificación de la NKF-DOQI (aclaramientos de creatinina < 30 ml/min)9 o en pacientes en grado V tratados con hemodiálisis (HD) o con diálisis peritoneal (DP)10,11.
El objetivo del presente estudio ha sido analizar el efecto de un fármaco de la familia de los ARA-II, el olmesartán medoxomilo en pacientes con hipertensión arterial y situación de ERCA grado IV y V (HD y DP) de la NKF-DOQI, solo o asociado al tratamiento antihipertensivo previo, para ello se analiza la respuesta en la PA y parámetros analíticos de anemia, potasio sérico, nutrición, inflamación, enzimas hepáticas, función renal y proteinuria.
Pacientes y métodos
Se seleccionó a 33 pacientes con hipertensión arterial no bien controlada y ERCA en estadios IV y V: 12 pacientes en estadio IV de la consulta de prediálisis, 12 pacientes en tratamiento con DP y 9 pacientes en tratamiento con HD. La media ± desviación estándar de edad de los pacientes era de 59,0 ± 14,5 años; el 81 %, varones. Los pacientes en HD y DP llevaban 19 ± 31 meses en diálisis. La etiología de la ERCA se distribuye en: el 30 %, nefropatía diabética; el 28 %, nefroangiosclerosis; el 13 %, nefropatía intersticial; el 10 %, glomerulonefritis crónica, y el 19 %, no filiadas y otras. El 46 % de los pacientes presentaban afección vascular, con cardiopatía isquémica más arteriopatía periférica en el 28 %, cardiopatía isquémica aislada en el 19 %, sólo arteriopatía periférica en el 3 % y afección cerebrovascular en el 6 %. El 47 % de los pacientes estaban en tratamiento con estatinas y ese porcentaje y su dosis no se modifican durante el estudio. La infección aguda, incluidos episodios de peritonitis, y la infección del orificio de salida del catéter peritoneal o del acceso vascular para HD se consideraron criterios de exclusión para el estudio. Tras la selección de los pacientes y el consentimiento informado por cada uno de ellos para la utilización de sus datos personales y analíticos, se prescribe olmesartán medoxomilo a dosis de 20 mg/día como tratamiento único o asociado a su tratamiento antihipertensivo habitual. Ningún paciente se trataba previamente con ARA-II o con IECA. Se analizan los datos basales, previos al empleo de olmesartán y a 1 y 3 meses de su administración. Se considera control inadecuado de la PA valores de PA sistólica > 140 mmHg y de PA diastólica > 80 mmHg. La PA se midió con un esfigmomanómetro estándar en sedestación. La media de 3 mediciones consecutivas se calculó en cada visita. El 63 % de los pacientes estaban utilizando más de 2 fármacos antihipertensivos (en ningún caso ARA-II) antes de comenzar el tratamiento con olmesartán, con una media de 2,4 ± 1,3 fármacos.
De forma basal y a 1 y 3 meses de tratamiento con olmesartán se recogen datos de PA, creatinina y urea séricas, potasio sérico, hemoglobina, AST, ALT, GGT, albúmina y prealbúmina séricas, ferritina, proteína C reactiva (PCR) por método no ultrasensible y fibrinógeno. En pacientes con diuresis residual (pacientes en prediálisis y pacientes en DP) se recogen los datos de creatinina y urea en orina para calcular la tasa de filtración glomerular (TFG) y los valores de proteinuria en orina de 24 h. La tolerancia clínica al empleo de olmesartán se valora en visita médica mensual.
El análisis estadístico se realizó mediante el paquete estadístico SPSS versión 14.0, con pruebas paramétricas y no paramétricas. Todos los valores se expresan como media ± desviación estándar. Se consideraron resultados estadísticamente significativos cuando la p fue < 0,05.
Resultados
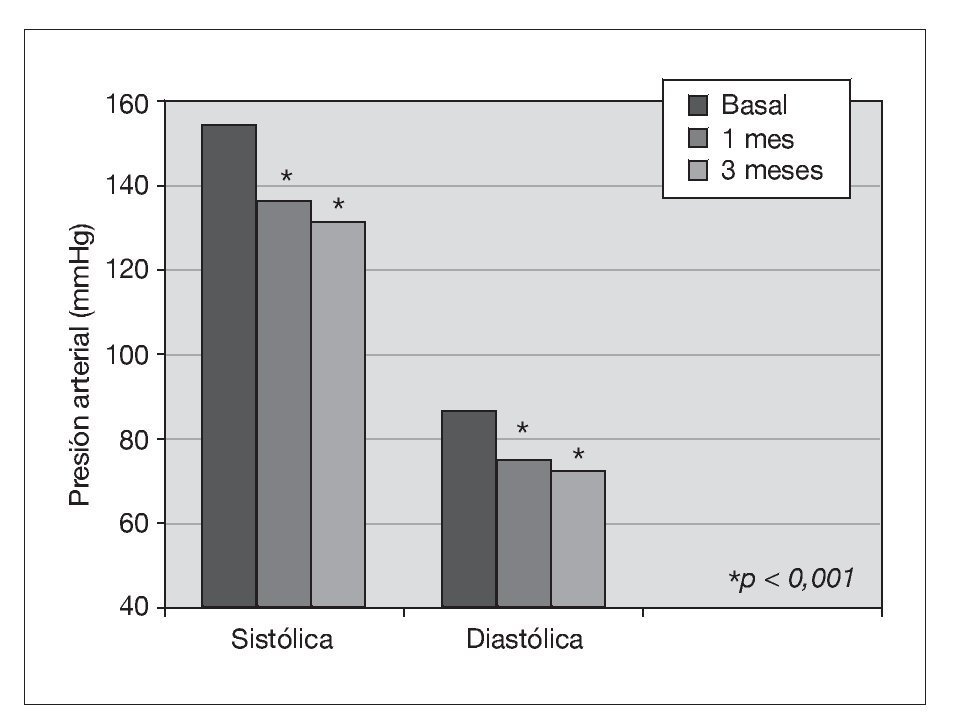
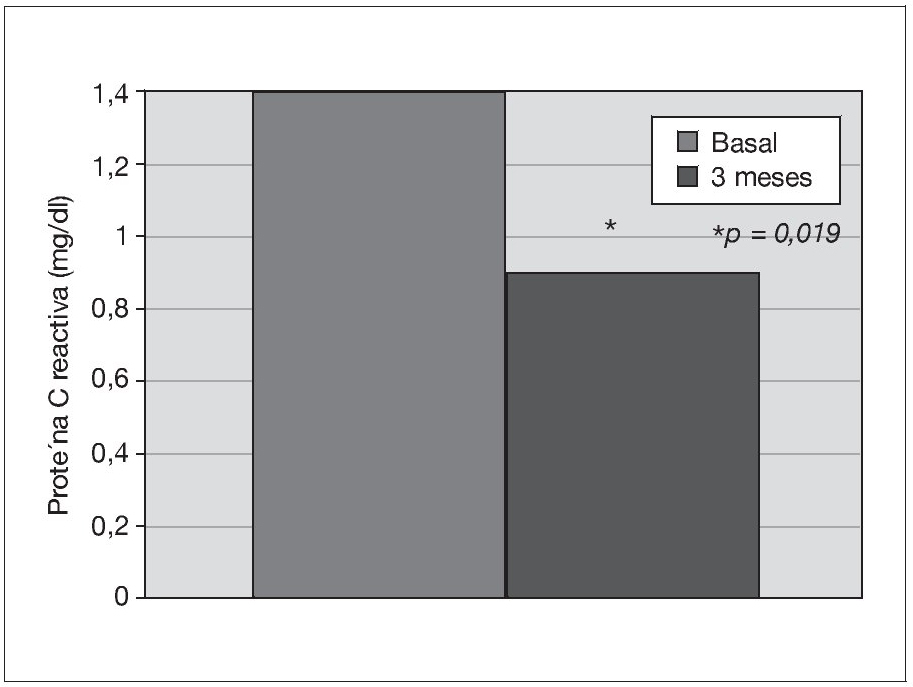
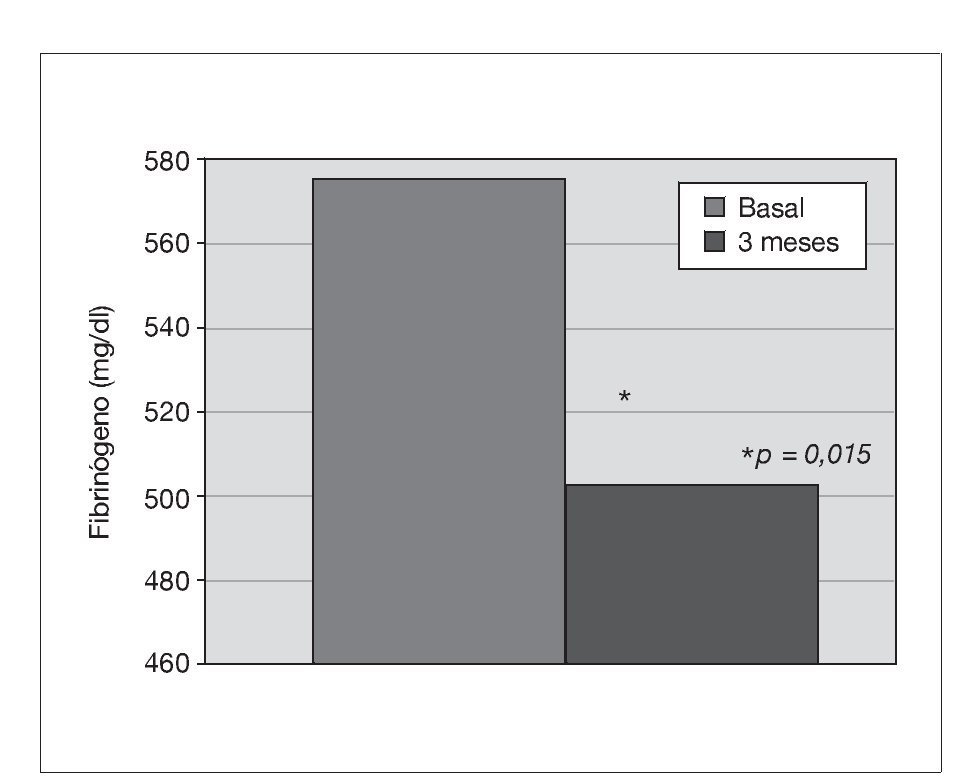
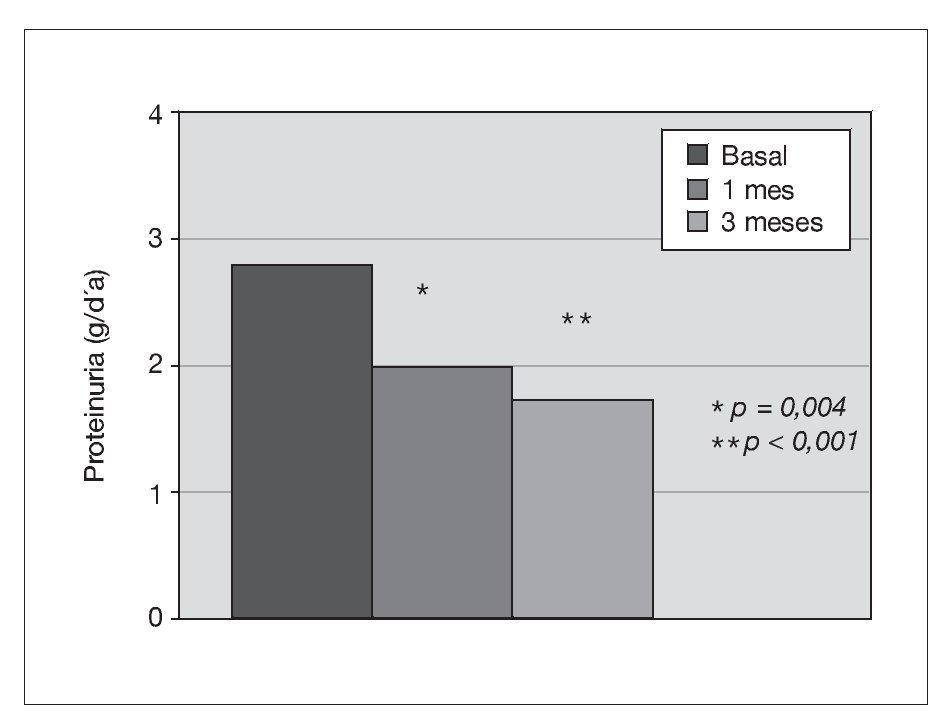
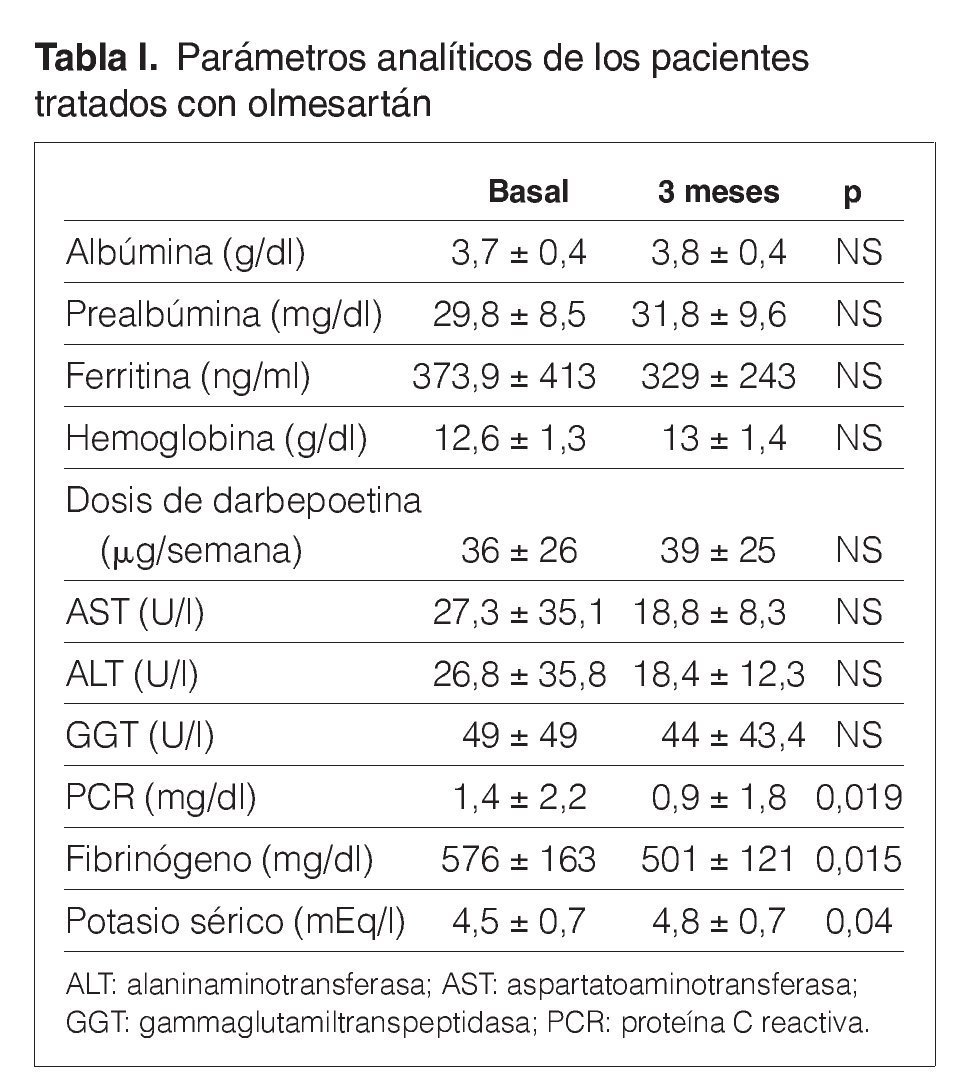
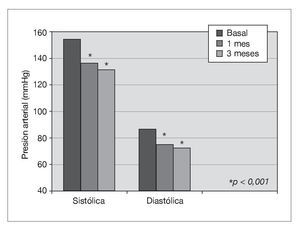
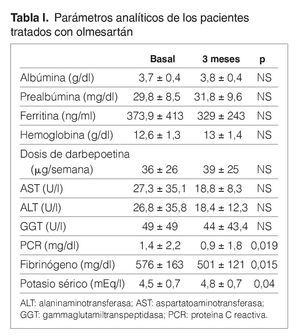
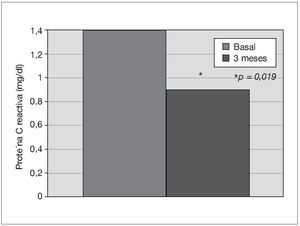
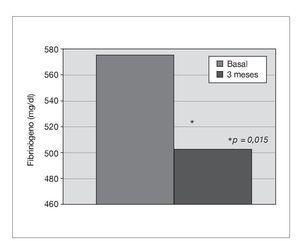
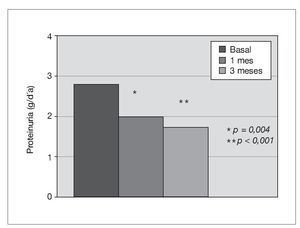
Treinta y dos pacientes completan los 3 meses de tratamiento. Un paciente de prediálisis sale del estudio por presentar edemas periféricos a los pocos días de comenzar con olmesartán, que podrían estar relacionados con el empleo del fármaco. Los pacientes se mantienen clínicamente estables, y al mes de tratamiento con olmesartán se observa una reducción significativa de la PA (p < 0,001), que se mantiene a los 3 meses (p < 0,001) (fig. 1). El potasio se sitúa en valores normales durante el seguimiento, aunque sus valores medios se incrementan de 4,5 ± 0,7 a 4,8 ± 0,7 mEq/l a los 3 meses (p < 0,05) (tabla I). No se detecta empeoramiento de la anemia en los 3 meses de seguimiento (hemoglobina basal 12,6 ± 1,3 frente a 13,0 ± 1,4 g/dl, sin significación estadística) ni diferencias significativas en las dosis de darbepoetina empleadas en el mismo período (tabla I). La PCR y el fibrinógeno disminuyen de forma significativa a los 3 meses (p < 0,02) (figs. 2 y 3 y tabla I), mientras los valores de ferritina se reducen levemente (tabla I). No se aprecian cambios en las enzimas hepáticas ni en los parámetros nutricionales (tabla I). En los pacientes en prediálisis y DP con función renal residual no se objetivó cambios significativos en la TFG al mes y 3 meses (basal, 8,8 ± 8,1; al mes, 8,7 ± 8,0; a los 3 meses, 9,0 ± 9,6 ml/min), pero sí una reducción significativa y progresiva de la proteinuria (fig. 4).
Figura 1. Efecto del olmesartán en la presión arterial.
Figura 2. Efecto del olmesartán en la proteína C reactiva.
Figura 3. Efecto del olmesartán en las concentraciones de fibrinógeno.
Figura 4. Efecto del olmesartán en la proteinuria.
No se objetivaron efectos secundarios en ninguno de los pacientes que completaron los 3 meses de tratamiento.
Discusión
Los ARA-II que han demostrado un buen efecto antihipertensivo y en la proteinuria en pacientes con enfermedad renal3,4 han sido poco estudiados en ERCA o enfermos en diálisis; son poco frecuentes los estudios que incluyen a pacientes con afectación importante de la función renal7,9,12. Nuestro estudio muestra el buen control de la hipertensión arterial (HTA) cuando se emplea un ARA-II como el olmesartán, a pesar de la severa insuficiencia renal de los pacientes desde el primer mes de su empleo. El olmesartán ha demostrado una eficacia antihipertensiva similar o superior a otros ARA-II y proporciona un mejor control diario de la PA13, pero en nuestro conocimiento no hay estudios con olmesartán en la HTA en pacientes en tratamiento dialítico. En pacientes hipertensos con proteinuria los ARA-II han demostrado una reducción de la excreción urinaria de proteínas y alguno de los trabajos publicados incluyen a pacientes con insuficiencia renal leve o moderada, con nefropatía diabética o con nefropatía no diabética3,5,6,14.
En ERCA también se ha comunicado la reducción de la proteinuria con el empleo de ARA-II7,9,15. En nuestros resultados hay que señalar el efecto beneficioso del olmesartán en la disminución de la proteinuria no sólo en los pacientes con ERCA en situación de pre-diálisis, sino también en los pacientes tratados con DP y función renal residual conservada, hallazgo no descrito hasta ahora. Si la reducción de la proteinuria es un signo de protección de la función renal, los estudios efectuados para analizar la evolución de la función renal con ARA-II no han evidenciado un efecto desfavorable en ella, pero tampoco un enlentecimiento de la progresión de la enfermedad renal cuando se ha estudiado a pacientes con deterioro leve de la función renal3, ni tampoco en aquellos con deterioro moderado4,9 o severo7,9. Solamente en un estudio con pacientes en DP, Suzuki et al10 demostraron un efecto enlentecedor del deterioro de la función renal con el empleo de un ARA-II como el valsartán. En nuestros pacientes no se observan cambios en la evolución de la función renal tras la administración de olmesartán, aunque el corto plazo de seguimiento impide una mejor valoración. En el conjunto de pacientes el potasio sérico se eleva a los 3 meses de comenzar el tratamiento con olmesartán, pero se mantiene siempre en valores dentro de la normalidad. Se ha descrito que en pacientes con insuficiencia renal con tasa de filtración glomerular de 60 ml/min/1,73 el empleo de un ARA-II como el valsartán no produce hiperpotasemia, comparado con la elevación significativa de potasio que causa un IECA como el lisinopril1. Hemos observado un efecto similar al comparar IECA con irbesartán en pacientes con ERCA7. Mientras que en pacientes en HD los ARA-II parecen incrementar el riesgo de desarrollar hiperpotasemia16; sin embargo, en DP ni IECA ni ARA-II han demostrado cambios importantes en el potasio sérico tras 4 meses de seguimiento11. Otro de los efectos negativos descritos hace años con el empleo de IECA, y en menor medida con los ARA-II, en pacientes con ERCA, como el empeoramiento de la anemia, no parece confirmarse en trabajos recientes17,18, y no lo hemos observado con el tratamiento con olmesartán en nuestros pacientes. Un aspecto a resaltar en nuestro estudio es el efecto antiinflamatorio que se aprecia tras la administración de olmesartán, con la disminución de los valores de marcadores de inflamación como PCR y fibrinógeno a los 3 meses de tratamiento. Este efecto tiene antecedentes en la literatura. La administración de dosis altas de candesartán a largo plazo en ratas hipertensas ha demostrado, en un estudio muy reciente, efectos antiinflamatorios de este ARA-II19. Previamente, en pacientes con hipertensión esencial sin afectación renal, el olmesartán redujo parámetros inflamatorios, como la PCR, en tan sólo 6 semanas de tratamiento20. En pacientes no diabéticos con daño renal en estadios 3 y 4 el olmesartán, a dosis de 40 mg/día durante 16 semanas, ha demostrado, además de disminución de la PA y la proteinuria, una reducción de la PCR y el fibrinógeno15.
El estudio tiene las limitaciones de incluir una muestra pequeña de pacientes y que, en cuestiones como la evolución de la función renal, precisaría de mayor tiempo de seguimiento; sin embargo, el efecto en los marcadores de inflamación con dosis bajas de olmesartán se produce a pesar del breve tiempo de tratamiento.
En conclusión, los resultados de este estudio a corto plazo indican que el olmesartán es un eficaz y bien tolerado fármaco antihipertensivo en pacientes con enfermedad renal crónica avanzada, incluso en pacientes en hemodiálisis y diálisis peritoneal. Olmesartán produce además una significativa reducción de la proteinuria sin empeorar la función renal, a pesar de la situación de enfermedad renal severa. El efecto en marcadores de inflamación observado con el olmesartán ofrece una nueva dimensión sobre la posibilidad de los ARA-II en la afección cardiorrenal.
Este estudio se ha realizado con la ayuda de una beca a la investigación de Pfizer.
Correspondencia: Dr. F. Coronel.
Servicio de Nefrología. Hospital Clínico San Carlos. Profesor Martín Lagos, s/n. 28040 Madrid. España.
Correo electrónico: fcoronel.hcsc@salud.madrid.org
Recibido el 14-4-2008; aceptado para su publicación el 28-5-2008.