Estudio descriptivo, con carácter retrospectivo, de 99 pacientes con enfermedad renal crónica (ERC) estadio iiib y iv, que están siendo tratados por hiperparatiroidismo secundario (HPTS) con calcio+vitamina D.
ObjetivosEl objetivo principal fue valorar la reducción de microalbuminuria y proteinuria como efecto pleiotrópico del tratamiento. De forma secundaria se analizan función renal, cifras de PTH, producto calcio y fósforo según valores recomendados por las guías.
ResultadosSe estudió a un total de 99 pacientes con una edad media de 74,8±10 años. La etiología más frecuente fue la nefroangioesclerosis en un 35% de los casos, seguida de las no filiadas en un 25%, intersticial crónica 22%, diabéticas 15%, congénitas 2%. Un 60% fueron mujeres y un 40%, hombres. Un 50% recibían IECA, un 59% tomaban ARA-II y un 10%, IDR. Un 34% eran diabéticos y un 92%, hipertensos. El tiempo medio de tratamiento fue de 430,85 días. Las cifras medias antes de iniciar el tratamiento con calcio+colecalciferol y la última analítica recibiendo el fármaco fueron de: creatinina plasmática (crp) 2,15→2,27 (p<0,05); el aclaramiento de creatinina en orina de 24h corregido por superficie corporal: 33→32ml/min/1,73m2 (NS); un filtrado glomerular estimado por la fórmula abreviada MDRD 7: 28,7→28,1ml/min (NS); un aclaramiento de creatinina por Cockroft-Gault 29→28ml/min (NS). Microalbuminuria de 352,4±318,3mg/día (NS); una proteinuria: 0,63→0,62g/24h (NS); cociente albúmina/creatinina: 651→615mg/g (NS). En sujetos diabéticos la microalbuminuria: 542→432mg/día (p<0,037); proteinuria: 1 → 0,8g/día (p<0,044). Calcio corregido con albúmina plasmática: 9,5→9,6 (p<0,05); niveles de fósforo 3,5→3,6 (NS), niveles de PTH: 187→143ng/ml (p<0,05). El producto calcio×fósforo fue de 33→34,5mg2/dl2 (NS). Cifras medias de TA: 144→141mmHg (NS).
ConclusiónEn cuanto a los efectos pleiotrópicos de la suplementación de calcio con colecalciferol en estadio iiib-iv de ERC, además de realizar un control efectivo sobre el HPTS, en pacientes diabéticos, reduce la microalbuminuria y la proteinuria de forma independiente de la acción de los bloqueadores del eje y del control de las cifras de TA.
We performed a descriptive, retrospective study of 99 patients with stage iiib-iv chronic kidney disease (CKD) receiving calcium plus vitamin D for secondary hyperparathyroidism (SHPT).
ObjectivesThe main aim of this study was to evaluate reductions in microalbuminuria and proteinuria as a pleiotropic effect of treatment. A secondary aim was to analyze whether renal function, PTH values, and calcium x phosphorus product reached values recommended by guidelines.
ResultsWe included 99 patients with a mean age 74.8±10 years (60% women and 40% men). The most frequent cause of CKD was nephrosclerosis in 35% of the patients, unknown in 25%, chronic interstitial kidney disease in 22%, diabetes in 15%, and congenital causes in 2%. A total of 50% were receiving angiotensin converting-enzyme inhibitors, 59% were receiving angiotensin receptor blockers, and 10% direct renin inhibitors. Diabetes was present in 34% and hypertension in 92%.
The mean duration of treatment was 430.85 days. The mean changes from baseline values to those at the end of the study were as follows: creatine phosphate: from 2.151 to 2.27 (P=.005); 24-hour urinary creatinine clearance corrected for body surface area: from 33±17ml/min/1.70m to 32ml/min (NS): estimated glomerular filtration rate based on the modification of diet in renal disease (MDRD) formula: from 7: 28.7ml/min to 28.1ml/min (NS); creatinine clearance estimated by the Cockroft-Gault formula: from 29 to 28ml/min (NS); microalbuminuria: from 352.4 to 318.3mg/day (NS); proteinuria: from 0.63 to 0.62 (NS); and albumin/creatinine ratio: from 651±1.3 to 615±1.1mg/g (NS).
In diabetic patients, values were as follows: microalbuminuria: from 542 to 432mg/day (P<.037); proteinuria: from 1 to 0,8g/24h (P<.044); corrected calcium: from 9.5 to 9.6 (P<.004); phosphorus levels: from 3.5±0.5 to 3.6±0.6 (NS); PTH levels: from 187 to 143pg/ml (P<.0001). Calcium × phosphorus product was 33 34.5mg2/dl2 (NS).
ConclusionCalcium and vitamin D supplementation in patients with stage iiib-iv CKD in addition to effective control of SHPT in diabetic patients reduced microalbuminuria and proteinuria independently of the action of antihypertensive medication and blood pressure control.
El hiperparatiroidismo secundario (HPTS) en estadios iniciales de la enfermedad renal crónica (ERC) es un hecho comprobado. Hay pocos estudios publicados al respecto sobre tratamiento con colecalciferol y suplementos orales de calcio, al igual que sobre su respuesta y sus repercusiones a nivel metabólico.
En pacientes con ERC estadio iiib-iv (Clcr p 45-15ml/min) se observa un ascenso claro de valores de PTH, con unas cifras de calcio y fósforo que por lo habitual son normales. Es conocida por todos la deficiencia de vitamina D en la población general y, de manera más acentuada, en ERC1,2. Sus niveles plasmáticos considerados como normales están aún pendientes de definirse con exactitud. Dosis bajas de metabolitos activos de vitamina D no suelen provocar hipercalcemia ni hiperfosfatemia en la población general y han mostrado en estudios experimentales que podrían, incluso, disminuir la progresión de ERC.
Los mecanismos fisiopatológicos implicados en la génesis del HPTS en pacientes con ERC son diversos: la disminución del calcio, aumento del fósforo, alteraciones del receptor del calcio, disminución del calcitriol y del calcidiol, disminución de los receptores de la vitamina D, acidosis, toxinas urémicas, desarrollo de resistencia esquelética a la PTH e inducción de hiperplasia nodular de las paratiroides, etc.3–5.
Por otro lado, la vitamina D es un complejo hormonal de síntesis fundamentalmente endógena. Su deficiencia es el resultado de una gran variedad de causas, incluyendo, desde una inadecuada exposición solar, pasando por una malabsorción intestinal, hasta el efecto de diversos medicamentos (como son los antiepilépticos y los corticoides, etc.). Sus niveles pueden verse incluso influidos en el periodo estacional en el que sea realizada la extracción sanguínea. El sistema hormonal de la vitamina D está formado por diferentes metabolitos, que incluyen desde precursores de origen dietético, una larga lista de metabolitos de síntesis endógena, hasta llegar al metabolito más activo, el 1-25 hidroxivitamina D o calcitriol. El calcitriol, en estadios iii-iv de ERC, controla su propio metabolismo y evita que se pierdan receptores (VDR), por lo que la respuesta de la glándula paratiroidea al calcitriol se mantiene intacta6,7.
Respecto al aporte exógeno de vitamina D, hay que tener en cuenta que son muy pocos los alimentos que contienen, de forma natural, cantidades significativas de la misma. No obstante, hoy en día ya existen en el mercado una gran cantidad de alimentos enriquecidos con esta vitamina, como son los productos lácteos, que podrían corregir el déficit de aporte exógeno. Hay, por tanto, 2 compuestos: la vitamina D2 o ergocalciferol de origen vegetal, y la vitamina D3 o colecalciferol de origen animal, que se forma a partir del 7-dihidrocolesterol, que se trataría del metabolito aportado y estudiado por nosotros junto a los suplementos orales de calcio6,8–10.
Material y métodosEstudio descriptivo de pacientes con ERC estadios iiib-iv con HPTS que reciben tratamiento con 1.200mg de calcio elemento + 800UI de vitamina D3. En estos pacientes, previa introducción del tratamiento para el HPTS, se realiza una determinación de cifras de calcio-fósforo-PTH (método utilizado para determinación de PTH: quimioluminiscencia) que nos indica la posibilidad de iniciar este tratamiento. Además, se recoge la última determinación analítica en la que el paciente estaba recibiendo el tratamiento citado. Son un total de 99 pacientes seguidos en consulta desde 2007 hasta 2010 con un tiempo medio de tratamiento de 13,7 meses.
ObjetivosEl principalValorar la reducción de microalbuminuria y proteinuria en estos pacientes, como efecto pleitrópico añadido del calcio+vitamina D3.
SecundariosValorar función renal, PTH, niveles del producto calcio y fósforo según valores recomendados por las guías.
Criterios de inclusiónPacientes diagnosticados de ERC estadios iiib-iv seguidos en la consulta de Nefrología con diagnóstico de HPTS que reciben tratamiento con 1.200mg de calcio elemento y 800 UI de vitamina D3.
Criterios de exclusiónPacientes menores de 18 años. Tomar derivados de vitamina D (ergocalciferol, hidroferol, etc.), tomar análogos de vitamina D (paricalcitol) o calcimiméticos. Hiperparatiroidismo primario, síndrome nefrótico.
Análisis estadísticoLos datos recogidos sobre las variables del estudio se han registrado en una base de datos anonimizada y se han procesado estadísticamente mediante el programa estadístico R-commander con un total de 99 pacientes, a los que se les determinó al inicio y al final del estudio: calcio corregido (mg/dl)=(4,0−albúmina sérica [g/dl])0×0,8+Ca total (mg/dl), fósforo (mg/dl), creatinina plasmática (crp) (mg/dl), PTH (pg/ml), microalbuminuria (mg/24h), proteinuria (g/24h), cociente albúmina/creatinina (mg/g), cifras de TA (mmHg), aclaramiento de creatinina con orina de 24h, aclaramiento de creatinina con Cockcroft-Gault, y estimación del filtrado glomerular mediante la fórmula de MDRD 7, corregidos con peso, edad y talla.
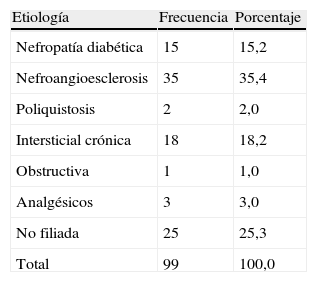
ResultadosUn total de 99 pacientes con una edad media de 74,8±10 años en los que la etiología más frecuente fue la nefroangioesclerosis en un 35% de los casos, seguida de las no filiadas en un 25%, intersticial crónica 22%, diabéticas 15%, congénitas (poliquistosis hepatorrenal autosómica dominante), 2% (tabla 1). Hubo un 60% de mujeres y un 40% de hombres. Un 50% recibían IECA, un 59% tomaban ARA-II y un 10%, IDR. El 22,2% de los pacientes toman IECA y ARA-II simultáneamente; el 4% toman IECA e IDR; el 9,1% toman ARA-II e IDR, y el 4% toman los 3 fármacos simultáneamente. En un 7% de los casos se aumentó la dosis de IECA; en el 7% se aumentó la dosis de ARA-II, y en el 4% de los casos se aumentó la dosis de IDR, sin añadir fármaco nuevo inhibidor del eje renina-angiotensina-aldosterona.
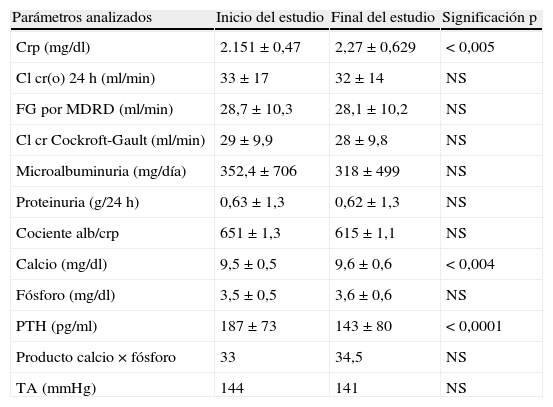
El tiempo medio de tratamiento fue algo más de un año (430,85 días). Un 34% eran diabéticos y un 92%, hipertensos. La media del crp al inicio del estudio era de 2,15±0,47 que pasa a ser crp 2,27±0,629 (p<0,005); el aclaramiento de creatinina en orina de 24h corregido por superficie corporal era de 33±17ml/min al inicio, que pasó a 32±14ml/min al finalizar el estudio (NS); un filtrado glomerular estimado por la fórmula abreviada MDRD 7: 28,7±10,3ml/min que pasa a 28,1±10,2ml/min (NS); un aclaramiento de creatinina por Cockroft-Gault: 29±9,9 que pasa a 28±9,8ml/min (NS).
En cuanto a sus efectos sobre la microalbuminuria, se evidenció que pasa de 352,4 a 318,3mg/día (NS), una proteinuria de 0,63 a 0,62 (NS), un cociente albúmina/creatinina que pasa de 651 a 615mg/g (NS).
En el análisis del metabolismo calcio×fósforo: los niveles de calcio corregido fueron de 9,5±0,5 que pasaron a 9,6±0,6 con una p<0,004; niveles de fósforo de 3,5±0,5 que pasaron a 3,6±0,6 (NS); niveles de PTH que pasaron de 187±73 a 143±80ng/ml, con una p<0,0001. El producto calcio×fósforo fue de 33 a 34,5mg2/dl2 (NS) (tabla 2).
El análisis del metabolismo calcio×fósforo
| Parámetros analizados | Inicio del estudio | Final del estudio | Significación p |
| Crp (mg/dl) | 2.151±0,47 | 2,27±0,629 | < 0,005 |
| Cl cr(o) 24h (ml/min) | 33±17 | 32±14 | NS |
| FG por MDRD (ml/min) | 28,7±10,3 | 28,1±10,2 | NS |
| Cl cr Cockroft-Gault (ml/min) | 29±9,9 | 28±9,8 | NS |
| Microalbuminuria (mg/día) | 352,4±706 | 318±499 | NS |
| Proteinuria (g/24h) | 0,63±1,3 | 0,62±1,3 | NS |
| Cociente alb/crp | 651±1,3 | 615±1,1 | NS |
| Calcio (mg/dl) | 9,5±0,5 | 9,6±0,6 | < 0,004 |
| Fósforo (mg/dl) | 3,5±0,5 | 3,6±0,6 | NS |
| PTH (pg/ml) | 187±73 | 143±80 | < 0,0001 |
| Producto calcio × fósforo | 33 | 34,5 | NS |
| TA (mmHg) | 144 | 141 | NS |
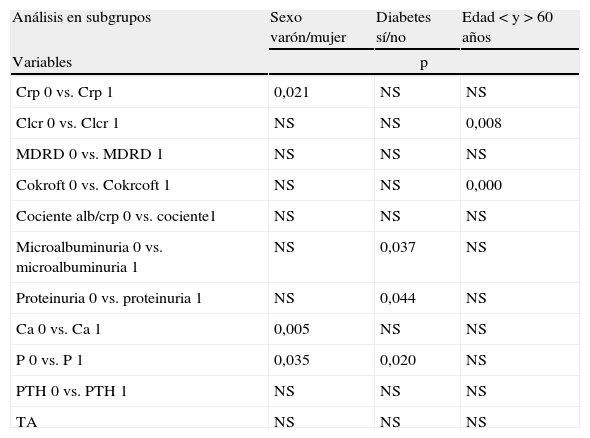
Existen diferencias significativas entre la evolución de la crp según el sexo del paciente. Realizando un mayor aumento de la crp en los pacientes varones (crp 2,2±0,48 pasó a 2,45±0,64mg/dl), con respecto a las mujeres (2±0,4 a 2,1±0,5mg/dl; p<0,021).
Existen diferencias significativas entre la evolución del aclaramiento de crp, según el grupo de edad, siendo el descenso del aclaramiento, mayor en los pacientes menores de 60 años (aclaramiento de crp de 46,76±17 a 39±19ml/min; p<0,008). Teniendo en cuenta que los pacientes con menos de 60 años eran 11, con respecto a los 88 pacientes mayores de 60 años que permanecen con la función renal estable (31a31ml/min [NS]).
En sujetos diabéticos, la microalbuminuria pasa de 542 a 432mg/día (p<0,037); sin embargo, en pacientes no diabéticos desciende la microalbuminuria, pero sin carácter significativo. En el análisis de correlación no encontramos diferencias significativas entre la evolución de la microalbuminuria, según si al paciente se le ha aumentado alguna dosis de los fármacos (18% de los pacientes), o si han variado sus cifras de TA.
En cuanto a la proteinuria de los sujetos diabéticos pasa de 1 a 0,8g/día (p<0,044). Permaneciendo estable, con una menor cuantía de la proteinuria en pacientes no diabéticos 0,52 a 0,39g/día (NS).
Con respecto al análisis del metabolismo fosfocálcico, existen diferencias entre la evolución del calcio, según el sexo del paciente. En mujeres, pasa de 9,6 a 9,8±0,6mg/dl y en hombres pasa de 9,3 a 9,5±0,5mg/dl (p<0,05), observándose en ambos grupos un ligero ascenso de los niveles de calcio. En cuanto al fósforo, existen diferencias significativas, según el sexo del paciente, presentando las mujeres una media de 3,6 a 3,7mg/dl (p<0,035) con respecto a los hombres con una media de 3,4 a 3,5mg/dl. En el caso de que presente o no diabetes, evidenciamos un fósforo de 3,4 a 3,5mg/dl (p<0,02) en los no diabéticos y de 3,7 a 3,8mg/dl en los diabéticos (tabla 3).
Evidencia de fósforo
| Análisis en subgrupos | Sexo varón/mujer | Diabetes sí/no | Edad < y > 60 años |
| Variables | p | ||
| Crp 0 vs. Crp 1 | 0,021 | NS | NS |
| Clcr 0 vs. Clcr 1 | NS | NS | 0,008 |
| MDRD 0 vs. MDRD 1 | NS | NS | NS |
| Cokroft 0 vs. Cokrcoft 1 | NS | NS | 0,000 |
| Cociente alb/crp 0 vs. cociente1 | NS | NS | NS |
| Microalbuminuria 0 vs. microalbuminuria 1 | NS | 0,037 | NS |
| Proteinuria 0 vs. proteinuria 1 | NS | 0,044 | NS |
| Ca 0 vs. Ca 1 | 0,005 | NS | NS |
| P 0 vs. P 1 | 0,035 | 0,020 | NS |
| PTH 0 vs. PTH 1 | NS | NS | NS |
| TA | NS | NS | NS |
Como recuerdo fisiopatológico, cabe mencionar que la principal fuente de obtención de vitamina D en el ser humano sigue siendo la síntesis endógena a partir del 7-dihidrocolesterol. Este proceso tiene lugar en la piel, donde la radiación ultravioleta B del sol induce la conversión proteolítica del 7-dihidrocolesterol a previtamina D3, seguida de una isomerización térmica a vitamina D3 para posteriormente sufrir las 2 últimas hidroxilaciones a nivel 1 y 25. De tal forma que la producción de metabolitos con capacidad de estimular al receptor de la vitamina D se produce en 2 etapas. La primera es la hidroxilación en el hígado a través de la 25-hidroxilasa, dando lugar a la 25-hidroxivitamina D o calcidiol. La segunda etapa es la formación del 1,25-dihidroxivitamina D o calcitriol, que se produce en condiciones fisiológicas, principalmente en el riñón por medio de la 1α-hidroxilasa. El calcitriol es la hormona biológicamente activa y ejerce su acción tanto por mecanismos endocrinos como autoparacrinos. Las funciones de la vitamina D son múltiples y se pueden resumir de forma simple en 2 grandes grupos: funciones tradicionales o clásicas que regulan la homeostasis Ca-P y el metabolismo óseo; y funciones no clásicas en las que se engloban funciones autoparacrinas y efectos pleiotrópicos que se ejercen en todo el organismo11–16.
De las funciones clásicas de la vitamina D derivan las repercusiones patológicas habitualmente vinculadas a la carencia de la misma. En población general, la deficiencia de vitamina D resulta en estímulo de la síntesis de PTH, HPTS e incremento del remodelado óseo. En pacientes con ERC, contribuye a una mayor progresión del HPTS y a la aparición de trastornos de mineralización. Dado que el aporte de colecalciferol y calcio que realizamos en nuestro estudio se produce en estadios intermedios de ERC, estos mecanismos de producción de la vitamina D están todavía inalterados y no están influidos por el deterioro del filtrado glomerular ya que los niveles de 1α-hidroxilasa se mantienen todavía intactos. Al realizar el aporte de dicha vitamina y del calcio, se produce un freno en la producción de PTH que en nuestro estudio fue estadísticamente significativo. El mecanismo por el que se podría explicar esta inhibición podría deberse al déficit basal de vitamina D en pacientes con ERC que, al ser suplementada, inhibiría su producción. Según las guías del 2006 de la National Kidney Foundation/Kidney Disease Outcomes Quality Initiative (NFK-KDOQI)7 los niveles que deben presentar los pacientes de PTH son entre 35 y 70pg/ml en estadio iii y entre 75 y 110pg/ml en estadio iv, cifras inferiores con respecto a las de nuestros pacientes, con una media más alta.
El descenso de PTH observado tras la suplementación con colecalciferol podría ser debido, al menos parcialmente, a un incremento secundario de la producción de calcitriol circulante. También podría deberse parcialmente al efecto directo del calcidiol, que es capaz de activar directamente el VDR y suprimir la transcripción del gen de la PTH. También dicho efecto podría ser explicado por los aportes de calcio, que aumentarían los niveles plasmáticos de calcio de los pacientes, inhibiendo la producción de PTH, al igual que la reducción de las cifras de fósforo mediante su actuación como quelante podría influir en la disminución de las cifras de PTH; no obstante en nuestro estudio los niveles de calcio se aumentan levemente (0,1mg/dl de media), produciéndose también un ligero ascenso sin carácter significativo de las cifras de fósforo (0,1mg/dl de media). Lo que nos aporta seguridad sobre el temor a la «elevación desmedida» de calcio y fósforo, favorecida por la vitamina D junto la suplementación de calcio10.
En cuanto a los niveles de calcio, algo más elevados en mujeres que en hombres, se mantuvieron en los niveles recomendados por las guías. Se evidenció un ligero ascenso del calcio de forma global en ambos grupos, con carácter significativo; aunque con cifras de calcio más elevadas en mujeres que en hombres; este fenómeno podría ser explicado por un mayor déficit de vitamina D en las mujeres, con una mayor respuesta al tratamiento tras su reposición. En cuanto al fósforo, aunque no se evidenciaron diferencias significativas de forma global, sí se evidenció que se hallaba más elevado en mujeres que en los hombres y más elevado en los diabéticos cuando se realizó el análisis en subgrupos.
En pacientes con ERC estadio iii, los niveles de calcio recomendados por las guías KDOQUI son de 8,4-9,5mg/dl y de fósforo de 2,5-4,5mg/dl. Con un producto calcio fósforo inferior a 55mg2/dl2. Por lo que mantuvimos dichas recomendaciones. En cuanto a las recomendaciones sobre el tratamiento con vitamina D en pacientes con ERC, las guías NFK-KDOQI recomiendan en estadios más avanzados (iii-v), valorar el tratamiento con calcitriol, α-calcidiol u otros activadores selectivos del receptor de vitamina D (AsRVD), como el paricalcitol, no recogiéndose el colecalciferol como una de las opciones14–16.
En cuanto a las acciones no clásicas de la vitamina D, destacan la patogénesis y la progresión de hipertensión, las enfermedades cardiovasculares, etc., además, de estar involucrada en la regulación del crecimiento celular, incluso en la alteración de la barrera celular en el glomérulo renal, interrelacionándose con la microalbuminuria como lo evidenciado en diversos estudios realizados con paricacalcitol17,18.
En nuestro estudio observamos que la respuesta a los suplementos de calcio más vitamina D en los pacientes diabéticos en relación con la reducción de microalbuminuria es de carácter significativo, con una mejor respuesta al tratamiento con respecto a los no diabéticos. Además, este efecto no solo se evidenció con la microalbuminuria sino que también se constató con la proteinuria. Dado el carácter retrospectivo de nuestro estudio, los niveles de calcitriol y calicidol no fueron monitorizados.
En cuanto a la función renal, en estudios experimentales se ha demostrado que la corrección del déficit de vitamina D podría ser un factor de enlentecimiento. En nuestro estudio se evidenció que, lejos de progresar la enfermedad, se mantuvo estable, con un ligero deterioro en los pacientes menores de 60 años. En el análisis por sexos, la función renal se mantiene más estable en mujeres con respecto a los varones.
Este factor de enlentecimiento del deterioro de la función renal podría ser explicado por un mayor deterioro de la barrera de filtrado glomerular que ocasiona una mayor pérdida de moléculas y, entre ellas, podría estar la vitamina D19,20. Dichos niveles de vitamina D, al ser replecionados, ocasionan un enlentecimiento del deterioro renal. Quizás, en el grupo de mujeres, el déficit de vitamina D sea mayor que en el de los hombres, lo que al replecionar sus niveles actuarían de una manera más intensa en la reparación de la barrera de filtrado glomerular. Como se comentó anteriormente, dado el carácter restrospectivo del estudio carecemos de los niveles de vitamina D por lo que solo podemos establecerlo como hipótesis.
Finalmente, como conclusión con respecto a los efectos pleiotrópicos de la vitamina D parece que en pacientes diabéticos reduce la microalbuminuria y la proteinuria de forma independiente de la acción de los bloqueadores del eje, del control del HPTS y del control de la TA. También parece que la vitamina D podría ser un factor de enlentecimiento de la función renal dada la estabilidad en nuestros pacientes. Cabe comentar que la suplementación de calcio con vitamina D en estadio iii-iv de ERC no ocasiona elevación de las cifras de calcio y fósforo más allá de los valores recomendados por las guías, siendo efectivo en el control del HPTS.
No obstante, son necesarios estudios abiertos a largo plazo con un mayor número de pacientes para valorar la eficacia y los efectos secundarios (calcificaciones vasculares, complicaciones cardiovasculares, etc.) que no fueron medidos, dado el carácter retrospectivo del trabajo, y que podrían aparecer en un futuro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.