Los pacientes en diálisis presentan frecuentemente malnutrición, lo que aumenta de forma significativa la morbimortalidad. En concreto, en diálisis peritoneal, puede afectar al 30-70% de los pacientes. Se deberían monitorizar parámetros clínicos, antropométricos, analíticos y dietéticos a fin de diagnosticar de forma temprana la malnutrición y sus causas. La utilización en estos pacientes de medidas de soporte nutricional como son los suplementos nutricionales calórico-proteicos orales mejora algunos parámetros de desnutrición. Otra aproximación es el uso de soluciones con aminoácidos esenciales como agente osmótico, bien como intercambio único diario o infundido de forma concomitante con glucosa. Estas soluciones cumplen un doble objetivo: soporte nutricional y sustitución de la glucosa. Su uso, tanto en pacientes en diálisis peritoneal continúa ambulatoria (DPCA) como en diálisis peritoneal automática (DPA), consigue un mejor balance nitrogenado positivo, acompañado por una mayor concentración de algunas proteínas séricas, permite una mejor preservación del peritoneo al disminuir el uso de glucosa, así como aminorar los efectos metabólicos sistémicos del uso de glucosa en los regímenes de diálisis peritoneal.
Malnutrition is prevalent among dialysis patients and results in increased morbidity and mortality. Around 30-70% of peritoneal dialysis patients will develop malnutrition. In these patients clinical, anthropometric, analytical and dietary parameters should be monitored for the early diagnosis of malnutrition and its causes in order to provide early treatment. We now review the diagnosis and management of malnutrition in peritoneal dialysis patients. Strategies include the use of oral supplements or more specifically the use of intraperitoneal amino-acid solution as a daily single exchange or its concomitant use with glucose solutions. Amino-acids solutions achieve better nitrogen balance and serum proteins, preserve peritoneal damage and diminish the secondary effects of the use of glucose in peritoneal dialysis regimes.
Cuando la enfermedad renal crónica conduce al fallo terminal, la función renal debe ser sustituida por la diálisis o el trasplante renal. La hemodiálisis (HD) y la diálisis peritoneal (DP) son las principales técnicas de diálisis empleadas. Tanto los pacientes tratados en HD como en DP presentan frecuentemente una situación de malnutrición; ésta aparece como una complicación no siempre diagnosticada, pero que aumenta de forma importante la morbimortalidad.
La malnutrición puede afectar al 30-70% de los pacientes en DP y se asocia a una mayor tasa de complicaciones y a una menor supervivencia1. En los pacientes en DP se deberían estudiar periódicamente los parámetros clínicos, antropométricos, analíticos y dietéticos a fin de diagnosticar de forma temprana la malnutrición y sus causas.
A continuación revisamos su diagnóstico y las distintas estrategias terapéuticas que pueden utilizarse para disminuir el impacto de este importante factor de comorbilidad.
El diagnóstico temprano y la posible corrección de causas reversibles debería ser el primer paso a realizar. Después, el conseguir una adecuada ingesta calórico-proteica, así como evitar situaciones de inflamación o hipercatabolismo, debería ser una de las principales estrategias coadyuvantes al tratamiento de la desnutrición.
La utilización en estos pacientes de medidas de soporte nutricional, como son los suplementos nutricionales calórico-proteicos orales, mejora algunos parámetros de desnutrición. Pero una más específica e interesante aproximación para disminuir la frecuencia o corregir la desnutrición en DP son las soluciones que contienen mezclas de aminoácidos esenciales como agente osmótico. Estas soluciones cumplen un doble objetivo: soporte nutricional y sustitución de la glucosa. Su uso, tanto en pacientes en diálisis peritoneal continua ambulatoria (DPCA) como en diálisis peritoneal automática (DPA), consiguen un mejor balance nitrogenado positivo, acompañado por una mayor concentración de algunas proteínas séricas. También el uso de aminoácidos como agente osmótico permite una mejor preservación del peritoneo al disminuir el uso de la glucosa, así como aminorar sus efectos metabólicos sistémicos. Su uso es de especial utilidad en dos situaciones: como parte de la estrategia para tratar la desnutrición cuando está presente y para mejorar el control metabólico de los pacientes diabéticos en DP.
Diagnóstico y tratamiento de la malnutrición en DPEn los pacientes en DP se deberían estudiar periódicamente los parámetros clínicos, antropométricos, analíticos y dietéticos a fin de diagnosticar la malnutrición de forma temprana. Una vez hecho el diagnóstico, se deberían buscar posibles causas. Así, se debería buscar evidencia de infradiálisis, infección, trastornos gastrointestinales (especialmente en diabéticos), anorexia y/o hipercatabolismo.
Una vez hecho el diagnóstico sindrómico y etiológico, se debería ofrecer un tratamiento etiológico si es posible, además de maniobras generales que resumimos a continuación, siguiendo las European Best Practice Guidelines.
Diagnóstico del estado nutricionalTodos los pacientes deberían recibir consejos nutricionales individualizados (nivel de evidencia C). El estado nutricional se debería evaluar cada 6 meses usando un panel de medidas (nivel de evidencia C). La albúmina sérica, por sí sola, no es un parámetro clínicamente útil para evaluar el estado nutricional proteico/energético en pacientes en DP (nivel de evidencia B). El panel de medidas debería incluir la valoración global subjetiva (VGS: subjective global assessment [SGA]), ingesta proteica (evaluada por el nPNA o por encuesta dietética) y una evaluación de la nutrición proteica (DEXA, medidas antropométricas o fuerza de la mano) (nivel de evidencia C). Además, se debería hacer un seguimiento periódico. Es muy importante tomar medidas de forma temprana, cuando se adivinan tendencias, sin esperar a que la malnutrición esté establecida.
Objetivos de ingesta proteica y calóricaSe suele considerar que el objetivo de ingesta proteica de la dieta debe ser 1,2 g/kg/día (nivel de evidencia C) y no debería ser inferior a 0,8 g/kg/día. Como promedio, el nPNA debería ser 1 g/kg/día, ajustando para edad y actividad física. La recomendación de valores superiores (como las de la iniciativa DOQI, > 1,2g/kg/día) estaban basadas en estudios de varones jóvenes y activos en DPCA, pero no hay datos que indiquen que > 1,2 g/kg/día mejore el estado nutricional. Incluso con consejos de un dietista, la inmensa mayoría de los pacientes en DP no alcanzan ingestas proteicas de 1,2 g/kg/día. La ingesta de 1,0-1,2 g/kg/día habitualmente se asocia con un balance nitrogenado neutro o positivo. De hecho, la ingesta de 1,0 g/kg/día es suficiente en la mayoría de los pacientes y algunos pacientes pueden tener un balance nitrogenado neutro e incluso positivo con 0,7 g/kg/ día.
Las guías (EBPG) recomiendan una ingesta calórica en pacientes no obesos de 35 kcal/kg/día (nivel de evidencia C), ajustando en función de la edad e incluido el aporte calórico de la absorción peritoneal de glucosa. En ancianos, los requerimientos calóricos bajan y puede ser suficiente una ingesta calórica de 30 kcal/kg/día. En pacientes en DPCA, con un transporte promedio de solutos se absorbe el 60% de la carga diaria de glucosa peritoneal, lo que equivale a 100200 g de glucosa/24 h (aproximadamente 8 kcal/kg/día). En pacientes malnutridos, la ingesta calórica o proteica debe normalizarse por el peso deseado y no por el peso actual.
Acidosis metabólica, dosis de diálisis e inflamaciónSe debería evitar la acidosis metabólica (bicarbonato venoso < 25 mmol/l) (nivel de evidencia A) por sus efectos favorecedores del catabolismo. La base de las soluciones de diálisis debe individualizarse con este fin. Además, se pueden usar el carbonato cálcico (si se requiere aporte de calcio) o el bicarbonato sódico oral para corregir la acidosis. Existe todavía escasa información sobre los riesgos de la alcalosis metabólica crónica, como consecuencia de intentos demasiado agresivos de controlar la acidosis, sobre la progresión de las calcificaciones vasculares.
Tratamiento de la malnutriciónEn el paciente malnutrido se debe revaluar la prescripción de la diálisis a fin de solucionar posibles situaciones de infradiálisis. Sin embargo, la sobrediálisis probablemente no resolverá el problema) (nivel de evidencia C). Además se deben estudiar otras posibles causas de malnutrición, como la inflamación. La inflamación causa anorexia e hipercatabolismo proteico, por lo que no suele responder al aumento de aportes proteicos. En estos casos es importante buscar causas tratables de inflamación.
Soporte nutricionalLas guías recomiendan valorar el soporte nutricional en pacientes con malnutrición grave y complicaciones, pacientes hospitalizados (cuya ingesta proteico-calórica suele disminuir aún más) y durante los episodios graves de peritonitis. Las posibles medidas de soporte nutricional incluyen suplementos orales de calorías y proteínas, aminoácidos intraperitoneales (“diálisis como comida”) y nutrición enteral o parenteral. Una vez más, muchas veces es preferible actuar sobre tendencias, evitando situaciones potencialmente irreversibles, con medidas como los suplementos nutricionales o el aporte peritoneal de aminoácidos. Además, en los niños frecuentemente se requiere la alimentación enteral.
Suplementos nutricionales oralesRecientemente, se han publicado dos ensayos clínicos aleatorizados, prospectivos y multicéntricos sobre el empleo de suplementos nutricionales orales en la profilaxis y tratamiento de la malnutrición en DP2,3.
En el primero se aleatorizó a 65 pacientes incidentes en DP a fin de evaluar el efecto profiláctico del suplemento sobre los parámetros nutricionales durante 12 meses de seguimiento. El estudio, planeado inicialmente para 24 meses, hubo de ser acortado debido a la alta tasa de abandonos. El suplemento (Proteinplus, Fresenius Medical Care) tenía 200 ml con 200 kcal, 9 g de carbohidratos, 7,8 g de lípidos, 20 g de proteínas, vitaminas (E, K1, B1, B2, nicotinamida, B6, B12, pantotenato, biotina, ácido fólico y vitamina C) y minerales (Na 180, K 300, Cl 265, Ca 300, fósforo 200, Mg 120, Fe 6 mg/200 ml) con una ratio EAA/NEAA 1,14, osmolaridad 400 mOsm/l y 1 kcal/ml. Quince pacientes abandonaron el suplemento por falta de cumplimiento o efectos adversos. Curiosamente, los pacientes con menor función renal residual tuvieron una menor tasa de cumplimiento, lo que sugiere que la anorexia urémica podría haber interferido con el cumplimiento. En el análisis según intención de tratar solo se evidenció un aumento significativo de los linfocitos en los pacientes que recibieron el suplemento, entre numerosos parámetros nutricionales analizados. El análisis de los pacientes que de hecho siguieron el protocolo (9 pacientes con suplemento y 20 controles) mejoró en varios parámetros nutricionales en los que estaban con el suplemento: número de linfocitos, peso corporal, tasa de generación de creatinina y parámetros antropométricos como el pliegue tricipital, la circunferencia del brazo y la masa corporal magra. Además, al inicio del estudio el porcentaje de pacientes con malnutrición moderada o grave según la VGS fue del 29% en el grupo tratado y del 33% en el control. A los 12 meses, ningún paciente que cumplió con el tratamiento tenía malnutrición moderada, comparado con el 20% de los controles. Esto indica que el inicio de la DP (el tratamiento de la uremia) mejora el estado nutricional inicialmente y que este efecto es mayor en pacientes que tomaran suplementos nutricionales orales. Estos suplementos son eficaces y seguros, y su principal problema es la falta de cumplimiento terapéutico.
En el segundo trabajo se estudió un suplemento proteico basado en la ovoalbúmina en 28 pacientes en DPCA3. En el grupo suplementado con ovalbúmina durante 6 meses (n = 13) se observó una mayor valor de albúmina sérica, ingesta proteica y calórica, nPNA y existió una tendencia hacia mejores parámetros antropométricos y VSG que en el grupo control (n = 15).
El papel de la solución de diálisis peritoneal con 1,1% de aminoácidos (1,1% AA) como agente osmótico y el de otras soluciones de diálisis peritoneal en mejorar el estado nutricional
La malnutrición proteico-energética es común en los pacientes en DP y se asocia con un incremento en la morbilidad y mortalidad. La pobre ingesta dietética y la pérdida de nutrientes por el dializado son algunos de los factores etiológicos conocidos que contribuyen a la malnutrición. Se sabe que los pacientes en DP pierden 3-4 g/día de aminoácidos (AA) y 4-15 g/día de proteínas1,4-8.
La solución comercializada de 1,1% de AA (Nutrineal®; Baxter Healthcare Corporation, Castlebar, Ireland) fue inicialmente diseñada para intentar compensar los trastornos nutricionales de los pacientes urémicos en DP. Es más, hoy sabemos que el uso de glucosa como agente osmótico favorece la aparición del síndrome metabólico y deteriora la membrana peritoneal.
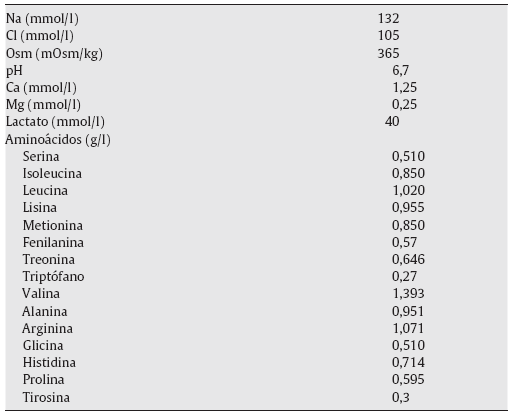
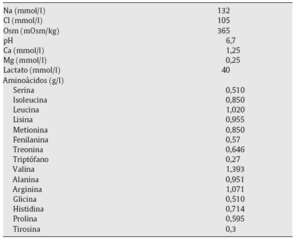
Es decir, la solución de 1,1% de AA es una solución sin glucosa que contiene una mezcla de aminoácidos que actúan como agente osmótico, con un pH de 6,7, que es más alto que el habitual de las soluciones convencionales de glucosa (DD), que tienen un pH de 5,5. El perfil de ultrafiltración peritoneal y las características sobre el transporte peritoneal son similares a los de las soluciones glucosadas al 1,5%9,10 (tabla 1).
Tabla 1 Composición de la solución de diálisis peritoneal de 1,1% de aminoácidos (Nutrineal®)
Los pacientes malnutridos se benefician del uso de dializado con 1,1% de AA a través de la absorción por la membrana peritoneal e incrementando el anabolismo proteico y esto se ha asociado a un incremento en algunos de los marcadores nutricionales bioquímicos y antropométricos.
Actualmente, las Guías Europeas de DP proponen el uso de la solución 1,1% de AA para pacientes malnutridos como parte de una estrategia para incrementar el estado nutricional. También aconsejan el uso de un solo intercambio al día durante 4-6 h para prevenir la acidosis metabólica y otros síntomas urémicos10. Es más, las Guías Españolas de DP sugieren que esta solución debería ser utilizada en todos los pacientes en que se debe de evitar el uso excesivo de glucosa, para prevenir la formación de productos de glucosilación avanzada, es decir, en diabéticos pero también en no diabéticos12. En el caso de los pacientes con peritonitis recurrentes, el uso de 1,1% de AA podría tener un beneficio para compensar la pérdida proteica incrementada en el sujeto dializado que se produce durante este evento en los pacientes en DP13.
Algunos autores han propuesto el uso de la solución de 1,1% de AA en pacientes que no están malnutridos en un intento para incrementar el bienestar de estos pacientes antes de que lleguen a presentar síntomas de desnutrición14. Sin embargo, este beneficio nutricional no se ha descrito siempre en todos los pacientes, debido a otros factores que pueden influir en el estado nutricional como la adecuación en diálisis, el estado volumétrico de los pacientes, la inflamación, etc.
Uso de la solución de diálisis peritoneal de 1,1% de AA como un tratamiento seguro que incrementa el balance nitrogenado y los marcadores nutricionalesLa solución de 1,1% de AA se ha usado como suplemento diario de la pérdida proteica a través de la membrana peritoneal y para mantener el balance nitrogenado positivo.
La cantidad de AA absorbida después de un intercambio de 6 h fue de 78,8 ± 8% (aproximadamente 16 g), que es mayor que la propia pérdida peritoneal de AA después de un intercambio de 6 h con una solución convencional de glucosa DD (0,7 ± 0,1 g del total de AA)15.
Jones et al16 confirmaron estos hallazgos preliminares en un estudio simple, abierto, cruzado en 3 días consecutivos sobre 20 pacientes en DPCA. Como objetivo primario, se determinó la cantidad de AA que se absorbían durante un intercambio con la solución comercial de Nutrineal®, así como las pérdidas proteicas que ocurrían en el dializado. Como resultado se vio que la pérdida diaria de proteínas en el dializado era de 3,4 y 5,8 g, respectivamente, mientras que la ganancia de AA en el día 3 excedía las pérdidas de proteínas y AA del día 2 (p < 0,001). Las pérdidas de proteínas totales, pero no de los AA, y la absorción neta de AA de la solución de diálisis se correlacionaron directamente con las características de la membrana peritoneal (obtenidas a través de una prueba de equilibrio peritoneal [PET], para establecer el tipo de transporte peritoneal)16.
El incremento de la nutrición proteica con la solución al 1,1% de AA se ha demostrado claramente en estudios realizados sobre el balance metabólico en pacientes malnutridos en DPCA con baja ingesta proteica. En un estudio con 19 pacientes malnutridos, que ingerían una dieta pobre proteica, se les ingresó durante 35 días en el hospital para monitorizarles el balance metabólico general y ver los cambios que se producían al pasar de un régimen convencional con soluciones glucosadas en comparación con la inclusión de la solución Nutrineal®. La primera fase del estudio (15 días) sirvió como período basal y a continuación durante otros 20 días los pacientes recibieron 1 o 2 intercambios de Nutrineal® para intentar darles un aporte proteico de 1,1 a 1,3 g/kg/peso/día. Después de iniciar la terapia con aminoácidos intraperitoneales, el balance nitrogenado se incrementó de forma significativa, hubo un incremento significativo en el anabolismo proteico, el patrón de AA séricos en ayunas por la mañana comenzó a normalizarse, a la vez que se incrementaron las concentraciones séricas de proteínas y transferrina. Los pacientes toleraron este tratamiento bien, aunque algunos pacientes desarrollaron una discreta acidosis metabólica y consecuentemente tuvieron que pasar a usar una sola bolsa al día17, recomendación que por otra parte se incluye en la ficha técnica de la solución.
También se ha visto en 10 pacientes no diabéticos estables en DPCA un incremento en la captación muscular de AA después del uso de la solución al 1,1% de AA tras 6 semanas, tanto en la fase de ayuno como en las pruebas realizadas para provocar resistencia a la insulina18.
Es muy importante remarcar la importancia de la ingestión de una comida con carbohidratos y lípidos durante el tiempo en que se infunde la solución de Nutrineal® para inhibir el catabolismo proteico y reforzar los aspectos positivos sobre el balance de AA19. Otra forma alternativa, como veremos más adelante en esta revisión, es la aplicación conjunta de la solución al 1,1% de AA concomitantemente con soluciones glucosadas convencionales o más biocompatibles en los intercambios nocturnos que se realizan en DPA.
Uso de la solución de diálisis peritoneal al 1,1% de aminoácidos a corto plazo (3-6 meses)Algunos estudios han mostrado que la solución del 1,1% de AA aporta beneficios nutricionales en el corto plazo.
El tratamiento de la malnutrición en un estudio prospectivo, aleatorizado, abierto y multicéntrico con el uso de la solución de DP al 1,1% de AA, como parte de un tratamiento convencional en DPCA frente a DPCA con soluciones glucosadas convencionales (DD) durante 3 meses en pacientes malnutridos, mostró un incremento significativo en el factor de crecimiento similar a la insulina tipo 1 (IGF1), un descenso en los valores de fósforo y potasio, un incremento en la albúmina, transferrina y prealbúmina séricas frente a los valores basales, indicando que había una respuesta anabólica general, mientras que estos valores de proteínas en suero no cambiaron a lo largo del estudio en el grupo de pacientes adscritos a soluciones DD20.
También se observó un incremento en la circunferencia del brazo y un incremento en los valores de albúmina y transferrina en pacientes con albúmina basal de menos de 30 g/l después del uso de la solución de DP al 1,1% de AA durante 3 meses21. Otros autores han encontrado resultados superponibles después de 6 meses de tratamiento22. También se han descrito beneficios en la fosforilación oxidativa del músculo después de la realización de ejercicio en pacientes no seleccionados en terapia con DP y Nutrineal®23.
De cualquier modo, en otro estudio no se vio gran mejoría después del uso continuado durante 3 meses en pacientes usando la solución con un nivel aceptable de nutrición en DPCA, a pesar de un incremento en los valores de AA séricos, con una absorción del 91% en el dializado, mejor balance nitrogenado, pero sin cambios significativos en los índices de nutrición24. Observaciones similares se vieron en otro estudio abierto, cruzado y aleatorizado durante 6 meses con la solución de DP al 1,1% de AA frente a DD. No se apreciaron cambios en los valores de albúmina ni transferrina, ni en la pérdida de proteínas25.
Tal y como se ha expresado anteriormente, el mayor beneficio con el tratamiento de un intercambio de solución de DP al 1,1% de AA, se encuentra cuando se viene acompañado de una carga glucídica concomitante o con la infusión simultánea de glucosa peritoneal, haciendo entonces que la fuente de AA se utilice para la formación de proteínas.
Hay un estudio interesante, cuyo objetivo fue comparar los efectos en la administración de la solución de DP al 1,1% de AA, bien en el período diurno o nocturno en pacientes malnutridos durante 3 meses. Se detectó un incremento en los valores de albúmina y de nPNA en los pacientes que recibían la solución durante la mañana, en vez de por la noche, lo que indica que el ayuno que acompaña al período nocturno no ayuda en la formación de proteínas, por lo que el aporte glucídico es necesario para un buen resultado con esta solución de DP. Es más, los pacientes que más se beneficiaron del uso de Nutrineal® fueron los jóvenes, no diabéticos y malnutridos26.
Estudios a largo plazo con la solución de diálisis peritoneal al 1,1% de aminoácidosAunque se han descrito y publicado distintos patrones de mejora en los parámetros nutricionales y bioquímicos en los pacientes en DP, con el uso de la solución de DP al 1,1% de AA, el hecho es que la mayoría de estos resultados provienen de estudios no controlados y realizados en el plazo < 6 meses, como hemos visto previamente.
El artículo publicado más relevante sobre el tratamiento a largo plazo con el uso de Nutrineal® se realizó en Hong-Kong, durante 3 años, con un patrón de aleatorización para pacientes que ya se encontraban malnutridos en DPCA. Los pacientes en el grupo de la solución con AA mostraron una estabilización y/o un incremento en los valores de albúmina y colesterol séricos, así como una disminución en los valores de triglicéridos de forma significativa. El nPNA, la ingesta proteica, la masa magra y otros parámetros antropométricos aumentaron en el grupo de la solución de AA, mientras que los pacientes que se mantuvieron en la rama de soluciones convencionales (DD) no mostraron cambios significativos o incluso estos parámetros se deterioraron en su evolución. Un hallazgo interesante fue el hecho de que las mujeres mostraron un mayor beneficio clínico con la solución. Durante el estudio, el coeficiente de transferencia de masas para creatinina (MTAC) se incrementó en el grupo de 1,1% AA, mientras que para otras moléculas, como urea, permanecieron estables. El Kt/Vurea total y la ultrafiltración diaria fueron similares entre ambos grupos durante todo el estudio. Un 76% de los pacientes asignados al grupo de 1,1% de AA necesitaron bicarbonato oral para mantener un bicarbonato sérico de 22-27 mEq/l durante los 3 años27.
Otro estudio a largo plazo interesante se realizó en Corea recientemente, con la intención de observar los factores que determinan los aspectos nutricionales de los pacientes en DP, así como para determinar el efecto de la solución de 1,1% de AA sobre el propio estado nutricional de pacientes malnutridos en DPCA e intentar dilucidar por qué algunos pacientes que pueden beneficiarse más positivamente. Este estudio se realizó en 46 pacientes malnutridos en DPCA, de modo observacional y con un seguimiento de 1 año, monitorizándose el estatus nutricional, bioquímico, antropométrico, la ingesta diaria calórica y proteica en intervalos de cada 3 meses hasta completar el año. Se compararon los parámetros al inicio del estudio (basal) y con la incorporación de 1 bolsa de Nutrineal® en la pauta diaria durante el año de seguimiento. Se identificaron dos tipos de pacientes, los respondedores (n = 31) y los no respondedores (n = 12). Hubo un incremento significativo estadístico (p > 0,05) en los pacientes respondedores en términos de: BUN, Cr, IGF-1 y nPNA séricos, un incremento en la masa corporal magra (LBM), en la masa magra corregida para superficie corporal, en la prueba de VGS y en la fuerza a la prensión; sin embargo, no se observaron cambios significativos en los valores de albúmina o proteínas séricas. También se produjo un incremento en el aclaramiento de creatinina semanal pero no se modificó el KT/V. Un 72% de los pacientes mostraron un beneficio nutricional sobre todo más en los que partían de una masa magra mayor, los que tenían más fuerza muscular al inicio y en los que existía una mayor función renal residual, sugiriendo que el uso temprano de esta solución puede producir mayores beneficios nutricionales clínicos, y un mejor rendimiento nutricional en el largo plazo, en vez de esperar a que los pacientes ya se encuentren malnutridos14.
Estudios con la combinación simultánea de la solución de diálisis peritoneal al 1,1% de aminoácidos y glucosa bicarbonato/ lactato en pacientes en diálisis peritoneal automáticaEl uso simultáneo de la infusión de glucosa peritoneal en los ciclos nocturnos en DPA es una terapia innovadora. La facilidad para mezclar distintas soluciones a la vez en el período nocturno en DPA se ha testado en distintos estudios en DPA.
Los primeros autores que usaron la mezcla fueron el grupo de Garibotto en un estudio abierto, cruzado de 18 pacientes en DPCA. Este estudio indica que los pacientes en DP en fase de ayuno tienen una moderada hiperinsulinemia mientras que la infusión nocturna de glucosa exclusivamente provoca una acción proteolítica, a la vez que disminuye la disponibilidad de AA séricos para la síntesis proteica. Contrariamente, el uso combinado de dextrosa y 1,1% de AA resultó en un efecto cumulativo, por una parte había menos destrucción muscular inducida por la insulina, había una estimulación para la síntesis proteica muscular, un incrementó en los valores de AA séricos y una mayor disponibilidad de AA por la menor salida desde el espacio muscular28.
Hallazgos muy similares, se observaron en pacientes infantiles en DP. La mezcla producía un retorno de la insulinemia a valores normales en sólo 3 horas de terapia en DPA y producía un incremento en los valores de AA séricos a las 2 h de haberse producido la cena que se mantenía durante todo el tratamiento de la sesión de DPA, debido a la absorción continua de AA desde el peritoneo. Es más, los valores de BUN séricos no se incrementaron a pesar del aporte de 1,1% de AA29.
Basándose en estas experiencias previas, el uso combinado de Nutrineal® y una solución más biocompatible, bicompartimental de búfer bicarbonato/lactato (Physioneal 1,36% a 3,86%, Baxter Healthcare) se han propuesto como “dializado como comida”, incrementando el anabolismo de los pacientes en fallo renal en DPA cuando la solución de 1,1% se acompaña de una fuente de calorías. En este estudio aleatorizado, cruzado con 8 pacientes en DPA durante un período de 7 días cada uno, se midió el turnover de proteínas totales medido por infusión continua de leucina L-(1-13C) durante 24 h. Aunque la síntesis de proteínas y el catabolismo proteico eran similares, la ganancia neta de proteínas se incrementó en los pacientes que estaban con la mezcla. Se ha propuesto que este sea un procedimiento a utilizar en pacientes malnutridos en DP30.
Pero dado que el ciclo diario de ayuno y alimentación también desempeña un papel en la homeostasis proteica, estos mismos autores han evaluado el papel de una mezcla en el anabolismo proteico durante la ingesta oral simultánea. Para ello la diálisis ocurrió en el período diurno, mientras que los pacientes tomaban un líquido alimenticio cada hora en idénticas proporciones. Esta aproximación se realizó de un modo aleatorizado y cruzado para 12 pacientes que estaban con una mezcla de Nutrineal® y Physioneal® (AAP) frente a Physioneal® (P) como control y durante 9 h, con el intervalo de 1 semana entre ambos tratamientos. La síntesis proteica fue significativamente mayor en el estado de alimentación que en la situación de ayunas, tanto para las combinaciones de soluciones que como para el uso de Physioneal® exclusivamente. La síntesis proteica era mayor en la situación de alimentación comparada con la situación de ayunas en ambos regímenes.
Las ratios de síntesis (media de valores en micromoles de leucina/ kg/min) usando dializado AAP fue de 2,02 (estado de alimentación; n = 12) en comparación con 1,0 (situación de ayuno; n = 8; p < 0,001) y usando P solamente en el dializado fue de 1,94 (estado de alimentación; n = 12) frente a 1,10 (situación de ayuno; n = 8; p < 0,001). El catabolismo proteico no difirió significativamente en respuesta a la alimentación entre los dos estudios tanto en AAP como con P en los dializados. Se observó una reducción en los niveles de fósforo, lo que sugiere que la ingesta proteica oral fue usada sobre todo para la estimulación de la síntesis proteica31.
Otros beneficios no nutricionales de la solución de diálisis peritoneal al 1,1% de aminoácidos BiocompatibilidadMuchos estudios in vitro y en modelos animales han mostrado que la solución al 1,1% de AA tiene un perfil más biocompatible que las soluciones convencionales con glucosa. Cuando se han medido los valores de productos de degradación de la glucosa (PDG) por cromatografía y en comparación con otras soluciones, el contenido de PDG es casi nulo32. En otros estudios experimentales, realizados con cultivos in vitro de células mesoteliales de pacientes no urémicos después de realizar intercambios ex vivo de 4 h, se ve que las células mesoteliales tienen reducida su proliferación pero mucho menos llamativamente que cuando se usan otras soluciones con glucosa como agente osmótico. En este mismo trabajo se ha visto que en presencia de 1,1% de AA hay un incremento en la liberación de interleucina 6 (IL-6) no hay liberación de lactatodeshidrogenasa y las células conservan estructuralmente su morfología de unión a otras células mesoteliales. Es más, la solución de 1,1% de AA comparada con soluciones convencionales de glucosa produce una menor alteración en la estructura, proliferación, viabilidad celular, estructura de unión celular y menos daño en el ADN33,34).
Cuando se revisan estudios animales, un estudio indica que la infusión de 1,1% de AA en la cavidad peritoneal de ratas durantes 5 semanas, en comparación con la infusión de soluciones convencionales y usando ratas sin diálisis como control, se observa que existe una menor emigración de leucocitos poscapilares y en las vénulas de recolección; esta emigración es mayor en las ratas infundidas con soluciones DD, y estas últimas presentan una respuesta angiogénica mesentérica parietal en el peritoneo, con manchas lechosas de manera más intensa.
Estos resultados indican que existe una menor inmunoactivación, una menor angiogénesis, una menor fibrosis y un menor daño mesotelial a la membrana en presencia de la solución al 1,1% de AA que cuando se infunden otras soluciones35.
En otro estudio animal, se infundieron 10 ml en la cavidad peritoneal de ratas femeninas Wistard, con distintas soluciones de DP, tales como la convencional de glucosa Dianeal® 3,86%, otra solución de glucosa pero más biocompatible con búfer de bicarbonato/lactato Physioneal® 3,86%, solución de Earl y Nutrineal® durante 12 semanas. También se realizó la prueba de PET, para valorar la funcionalidad peritoneal de la membrana, y la histológica a través de la tinción para eNOS, VEGF, MGO, AGE, RAGE y anticuerpos monoclonales específicos para MGO y anti-AGE. La ultrafiltración neta al final del estudio (12 s) fue menor para el Dianeal® (3,86%) que para el resto de las soluciones (p < 0,05). La exposición a Dianeal® 3,86% causó una sobrerregulación de la expresión de eNOS, incrementó la densidad vascular, la expresión de VEGF, produjo más número de capilares/ área, mayor fibrosis submesotelial y los AGE se acumularon más. En mucha menor medida, no se observaron diferencias en estos puntos estudiados en el resto de soluciones empleadas. La tinción de MGO y otros AGE fue casi inexistente en Nutrineal®36.
En otro estudio animal realizado en conejos de Nueva Zelanda para estudiar la biocompatibilidad de varias soluciones, se vio que el daño mesotelial y el edema submesotelial y fibrosis eran prácticamente inexistentes con la solución al 1,1% de AA37.
El efecto del estrés carbonilo con la infusión de distintas soluciones también se estudió in vitro y se observaron efluentes de pacientes en DP después de 0-2-4-6 h de la infusión. La cantidad de GO, MGO y 3-DG disminuyó en los efluentes con el uso de icodextrina y permaneció indetectable en la solución con 1,1% de AA38.
La biocompatibilidad también se ha estudiado en cultivos ex vivo procedentes de macrófagos peritoneales de 10 pacientes en DPCA, según recibieran infusión con Nutrineal® o DD 2,27%, viéndose que existía una gran capacidad de fagocitosis en los macrófagos que procedían de la solución del 1,1% de AA frente a la de glucosa convencional. También existía una mayor liberación de IL-8 por los macrófagos de la solución DD en comparación con la de 1,1% de AA39.
Otros beneficiosTradicionalmente, se considera que las soluciones que no contienen agente glucídico osmótico tienen un efecto positivo sobre el metabolismo sobre todo graso. Los valores de colesterol y/o triglicéridos disminuyeron tras el uso de la solución con 1,1% de AA durante 20 días15, 8 semanas40,41, 3 meses42, 6 meses15 y 3 años27. En otro estudio a 6 meses, se vio que había un descenso significativo en la cantidad gasa total durante el uso de la solución de 1,1% de AA, mientras que se incrementó con el uso de DD43.
Contrariamente, en algún otro estudio no se han apreciado cambios en la dislipidemia después de 6 meses44 o se han incrementado los valores basales de homocisteína de forma incierta45.
El uso de Nutrineal® como parte de un régimen combinado pobre en glucosa en un diseño cruzado también mostró un mejor control glucémico, medido a través de monitores continuos de glucosa durante 72 h y también por lecturas capilares46.
Factores que pueden justificar las diferencias en los resultados entre unos estudios y otros en relación con la solución del 1,1% de aminoácidosComo hasta ahora no se ha definido un marcador de nutrición estándar o ideal para la monitorización del estado nutricional en los pacientes en DP, podría ser que los distintos parámetros utilizados en distintos estudios sean sólo una parte del complejo mundo de la nutrición.
La mayor parte de los estudios solo incluyen un número pequeño de pacientes, lo que también limita la validez de sus resultados. En otros, los pacientes estudiados eran malnutridos graves, mientras que en otros era población no seleccionada. Otra limitación es que la mayoría de los estudios no tienen en cuenta la ingesta proteica y calórica por día, lo que hace difícil el papel de ésta en el largo plazo. También la situación de comorbilidad de estos pacientes hace extraordinariamente difícil su evaluación independiente, considerando situaciones de peritonitis, anemia, insuficiencia cardíaca, sobrecarga de volumen e inflamación concomitantes14. Otro aspecto importante que se debe considerar es que muchos estudios no se han acompañado de la recomendada carga glucídica/calórica junto a la infusión de Nutrineal®, por lo que los aspectos beneficioso han podido ser menos marcados.
Beneficios nutricionales de otras soluciones no convencionales en diálisis peritoneal y distintas del 1,1% de aminoácidosOtras soluciones de DP se han implicado en beneficios nutricionales también o presentan un perfil más fisiológico para los pacientes.
La icodextrina como un polímero no glucídico es una alternativa osmótica que permite además la depuración de moléculas de mayor tamaño molecular como la leptina, en comparación con soluciones convencionales, lo cual pudiera tener un impacto sobre el perfil de apetito47. El vaciamiento gástrico está menos enlentecido en presencia de icodextrina48 y el perfil de apetito-saciedad se mantiene mejor en pacientes con icodextrina en DPA que con soluciones DD49.
También se ha visto un beneficio nutricional a largo plazo en el estudio fase III que comparaba el uso de soluciones convencionales DD con la solución de glucosa más biocompatible de búfer lactato/bicarbonato (Physioneal®)50. Hallazgos similares se han visto en ratas no urémicas en tratamiento con distintas soluciones de DP, que muestran un mejor apetito cuando las ratas eran infundidas con la solución de Physioneal®51.
El uso de regímenes pobres en glucosa de forma combinada parece prometedor en cuanto a mejora de parámetros nutricionales en algunos estudios realizados con diseño cruzado52
INFORMACIÓN DEL ARTÍCULO
Historia del artículo:
Recibido el 18 de febrero de 2009
Aceptado el 6 de junio de 2009
* Autor para correspondencia.
Correo electrónico: belen_marron@baxter.com (B. Marrón).