El hiperparatiroidismo (HP) primario o autónomo se caracteriza clínicamente por la presencia de hipercalcemia no farmacológica con valores de PTH elevados o inapropiadamente normales. En este artículo presentamos el caso clínico de una mujer de 55 años, ERC estadio 3bA3, a la que se diagnosticó de HP autónomo. A través de él queremos subrayar la no infrecuente aparición de HP autónomo en pacientes con ERC, que su diagnóstico es bioquímico y que las técnicas de imagen solo son útiles para la localización del tejido paratiroideo hiperfuncionante pero no imprescindibles para el diagnóstico. Asimismo, revisamos los criterios quirúrgicos actuales y las alternativas terapéuticas, entre las que destaca el tratamiento médico con cinacalcet que, probablemente, merece una consideración especial en varios subgrupos de pacientes no tributarios de tratamiento quirúrgico.
Primary –or autonomous– hyperparathyroidism is clinically characterized by the presence of non-pharmacological hypercalcemia with increased or inappropriately normal parathyroid hormone (PTH) levels. We hereby report the case of a 55-year-old woman with chronic kidney disease (CKD) stage 3bA3 who was diagnosed with autonomous hyperparathyroidism. We would like to stress that autonomous hyperparathyroidism is a not infrequent development in CKD patients, that its diagnosis is biochemical and that imaging techniques are only useful to localize hyperfunctioning parathyroid tissue but are not essential for diagnosis. We also review the current surgical criteria and therapeutic alternatives. Among these alternatives, medical treatment with cinacalcet probably deserves special consideration in several patient subgroups that are not candidates for surgery.
El hiperparatiroidismo (HP) primario (HP1) representa la primera causa de hipercalcemia y la tercera endocrinopatía más frecuente, tras la diabetes y el hipertiroidismo1. Se caracteriza por la producción autónoma de paratohormona (PTH) y se manifiesta por hipercalcemia con valores de PTH elevados o inapropiadamente «normales» por lo que el diagnóstico de HP1 es bioquímico e independiente de la positividad o no de las pruebas de imagen2.
Aunque la mayor parte de los pacientes afectos se encuentran clínicamente asintomáticos en el momento del diagnóstico, el HP1 se reconoce cada vez más precozmente en la población general. Del mismo modo, dada la elevada prevalencia de enfermedad renal crónica (ERC), el HP autónomo (HP1 o más raramente terciario) también debe considerarse entre nuestros pacientes aunque no estén afectos de litiasis.
Cinacalcet es un modulador alostérico del receptor sensor del calcio, que aumenta la sensibilidad de la célula paratiroidea al calcio extracelular, disminuyendo así sus niveles plasmáticos3. El tratamiento médico con cinacalcet ha demostrado ser una alternativa razonable a la paratiroidectomía (PTX) para varios subgrupos de pacientes no tributarios de tratamiento quirúrgico4 (tabla 1). Presentamos el caso clínico de una paciente con ERC a la que se diagnosticó de HP autónomo y que se trató inicialmente con calcimimético, analizando su respuesta. Revisamos además los criterios diagnósticos y alternativas terapéuticas actuales en esta enfermedad.
Posibles indicaciones de tratamiento médico del HP1 con calcimiméticos (subgrupos de pacientes no tributarios de tratamiento quirúrgico)
| El paciente sería candidato a cirugía pero existe: |
| 1. Contraindicación quirúrgica formal |
| 2. Riesgo quirúrgico inaceptablemente elevado o inasumible |
| 3. Rechazo a la cirugía por parte del paciente |
| 4. Tiempo en lista de espera inaceptablemente largo |
| 5. Fallo de curación del HP1 a pesar de una o varias cirugías |
| 6. Sintomatología inespecífica potencialmente atribuible a hipercalcemia. (p.ej. ¿mejora el anciano su trastorno neurocognitivo o su estado general con una prueba terapéutica con cinacalcet?) |
ERC: enfermedad renal crónica; HP1: hiperparatiroidismo primario.
Se aconseja, además repleción con vitamina D nativa y monitorización de niveles plasmáticos de calcio y fósforo. Bisfosfonatos o tratamiento hormonal sustitutivo si la afectación ósea es relevante.
Se trata de una mujer de 55 años controlada en Consultas Externas de Nefrología y a la que se detectó hipercalcemia asintomática con PTH no suprimida. Como antecedentes patológicos personales destaca HTA, dislipidemia e hiperuricemia en tratamiento médico y crisis de ausencia en la juventud. Fue diagnosticada, a los 25 años, de ERC secundaria a glomeruloesclerosis focal y segmentaria por biopsia renal. En el momento de detectarse por primera vez hipercalcemia, la paciente presentaba ERC estadio 3bA35,6, con creatininas basales de aproximadamente 1,36-1,6mg/dl y con proteinurias de hasta 7g/24h, con proteínas plasmáticas normales y ausencia de síndrome nefrótico. Como tratamiento antihipertensivo recibía doble bloqueo con enalapril y valsartán, además de alopurinol y difenitoína. No recibía suplementos de calcio, vitamina D, tiazidas, litio ni otros fármacos que pudieran interferir con el metabolismo mineral. En la ecografía presentaba riñones discretamente disminuidos de tamaño con aumento difuso de la ecogenicidad sin litiasis.
En analítica de sangre se observaba calcio (confirmado y corregido por albúmina) de 10,9mg/dl con PTH intacta (PTHi, Roche Diagnostics) de 296ng/l, fosfato de 3,47mg/dl y función renal estable. La analítica de orina mostraba sedimento sin alteraciones, proteinuria de 2,2g/24h y cociente calcio/creatinina 0,28mg/mg.
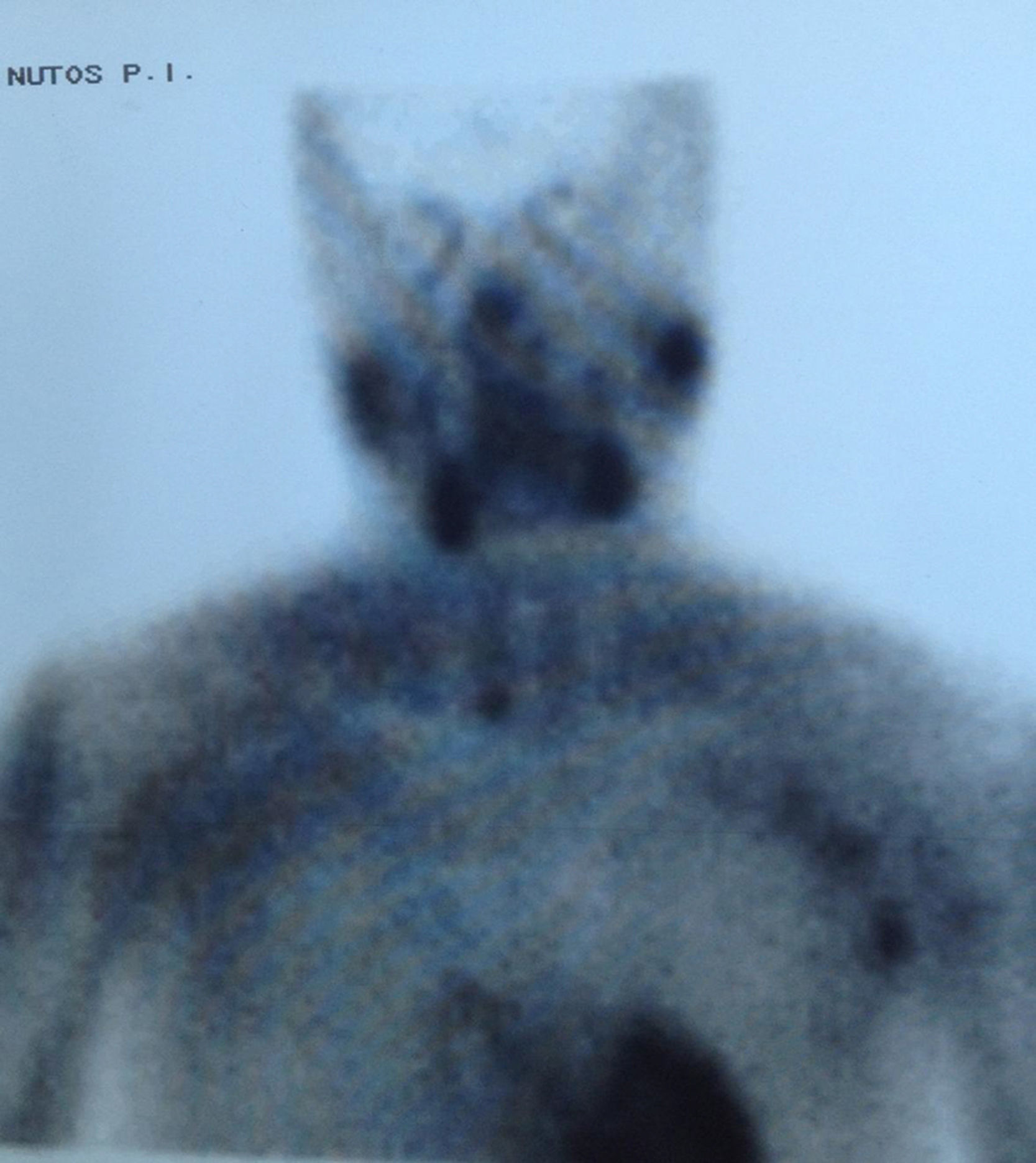
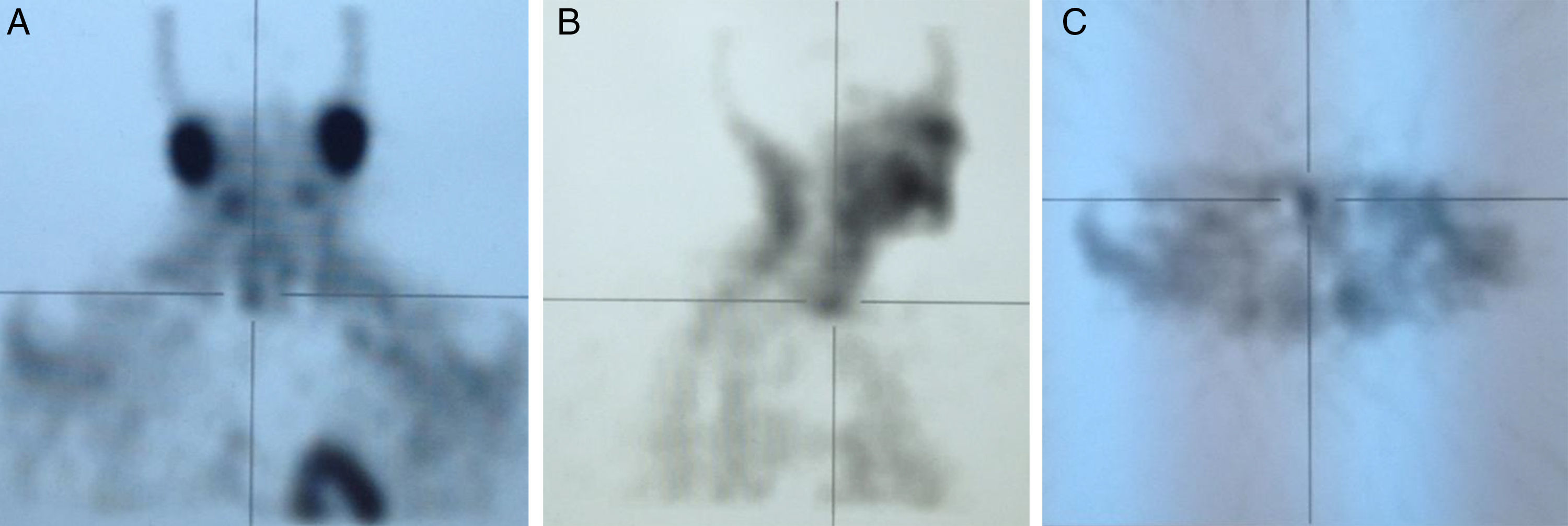
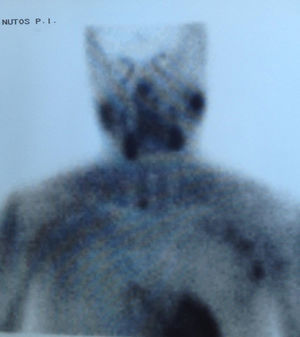
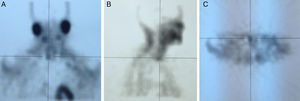
EvoluciónAnte el hallazgo de hipercalcemia con PTH elevada, la paciente es diagnosticada de HP autónomo practicándose gammagrafía de paratiroides que evidenció hipercaptación de glándula paratiroidea inferior derecha (figs. 1 y 2), remitiéndose la paciente al Servicio de Cirugía. Dada la larga lista de espera para PTX, tras 4 meses del diagnóstico de HP autónomo, se decidió iniciar tratamiento con cinacalcet por persistencia de calcio plasmático elevado>1mg/dl (0,25mmol/l) por encima del límite normal en paciente relativamente joven con ERC (filtrado glomerular [FG]<60ml/min/1,73 m2). Se inició tratamiento con 30mg/día de cinacalcet, que se aumentó a 30-60mg a días alternos y en dosis única diaria, con buena tolerancia y disminución progresiva de los niveles de calcio hasta 9,24mg/dl, así como disminución de la PTHi a 165ng/l. Después de 11 meses de tratamiento con cinacalcet, se realizó adenomectomía inferior derecha (400mg) con descenso rápido de la PTH intraoperatoria basal de 239ng/l a 79 y 51,3ng/l, a los 5 y 10 min, respectivamente, con mantenimiento de las cifras normales de calcio sin necesidad de calcimimético. Dada la presencia de déficit severo de vitamina D (4ng/ml) se inició posteriormente repleción controlada con calcidiol (Hidroferol® 0,266 mg/15 días).
Este caso muestra claramente la posible coexistencia de ERC con HP autónomo, diagnosticado no solo por la presencia de hipercalcemia con ausencia de inhibición de la PTH, sino incluso por la presencia de PTH notablemente aumentada a pesar del efecto inhibitorio de los niveles elevados de calcio. La presencia de gammagrafía paratiroidea positiva, probablemente relacionada con la severidad del caso (adenoma de unas 10 veces el peso normal de cada glándula), permite facilitar el diagnóstico y proporcionar una aproximación quirúrgica más sencilla.
El HP1 se da en aproximadamente un 1% de la población adulta, pero afecta a más del 2% de la población después de los 55 años, la edad de nuestra paciente, y es 2-3 veces más frecuente en mujeres que en varones. La causa más frecuente es el adenoma paratiroideo, único en el 80-85% de los casos. Es bien conocida también su asociación con la neoplasia endocrina múltiple (NEM1 o NEM 2A)2. La mayor parte de los pacientes afectos de HP1 se encuentran clínicamente asintomáticos en el momento del diagnóstico, dado el hallazgo casual de hipercalcemia7,8. Actualmente, incluso se reconoce la existencia de HP «normocalcémico», una forma subclínica de HP1 caracterizada por la presencia de calcemia normal y elevación confirmada de PTH sérica, descartados los estados de HP secundario7,9.
A diferencia del HP1, el HP terciario representa la evolución a largo plazo de un HP secundario y la causa más frecuente es la presencia de ERC de larga evolución, más allá del déficit de vitamina D10. El HP terciario es más habitual en pacientes en diálisis y supone la causa más frecuente de hipercalcemia postrasplante renal. Si se presenta prediálisis, se trata generalmente de casos de nefritis intersticial crónica, de muy larga evolución, en los que la progresión a ERC terminal es mucho más lenta que en enfermedades proteinúricas. De este modo, el largo tiempo de evolución de la ERC permite la progresión desde una hiperplasia paratifoidea difusa a una hiperplasia nodular o, en otras palabras, desde una proliferación policlonal a la autonomización de una o más de las glándulas por proliferación monoclonal11,12. El HP terciario, como HP autónomo que es, también se diagnostica por la presencia de hipercalcemia no farmacológica y PTH no suprimida en pacientes con ERC e HP secundario de larga evolución.
En nuestra experiencia, la presencia de ERC dificulta el diagnóstico de HP autónomo (HP1 o terciario). Es frecuente el diagnóstico inadecuado de HP secundario o la práctica innecesaria de múltiples exploraciones complementarias en búsqueda de otras causas de hipercalcemia no mediadas por PTH (tumores malignos, enfermedades granulomatosas, etc.). Debe resaltarse que la hipercalcemia no corresponde en ningún caso a la evolución natural del HP secundario en la ERC, en cuya fisiología destaca la tendencia multifactorial a la hipocalcemia (por aumento de FGF23 y retención de fósforo, disminución de calcitriol, resistencia a la PTH, etc.)10.
A modo de diagnóstico diferencial, es necesario obviamente descartar otras causas frecuentes de hipercalcemia en la ERC, como el uso de quelantes con calcio o derivados de la vitamina D, u otras menos frecuentes como tiazidas o litio. La coexistencia en el tiempo de 2 enfermedades causantes de hipercalcemia (por ejemplo HP1 y mieloma) es posible, pero muy poco frecuente a pesar de la alta prevalencia de las 2 enfermedades13. Por otra parte, debe tenerse en cuenta la hipercalcemia hipocalciúrica familiar, aunque su incidencia en la población general no es bien conocida y se desconoce su asociación a ERC. En la hipercalcemia hipocalciúrica familiar, la presencia de una fracción excretada de calcio menor del 1% o un cociente Ca/Cr menor de 0,01 podría orientar al diagnóstico de esta enfermedad familiar7. Es importante resaltar que, en presencia de ERC, la excreción de calcio puede estar también disminuida14,15. Así, Craver et al. nos muestran que la media de la calciuria en pacientes con ERC estadio 3 es inferior a 100mg/24 h14, al igual que la calciuria también está relativamente disminuida en los pacientes tratados con tiazidas o en el síndrome de leche-alcalinos16.Creemos que es muy importante enfatizar, porque se trata de un concepto erróneo frecuente, que las técnicas de imagen (gammagrafía de paratiroides, single proton emission computerized tomography [SPECT], ecografía, tomografía computarizada, resonancia magnética o PET cervicales) son útiles para la localización del tejido paratiroideo hiperfuncionante pero no imprescindibles para el diagnóstico. El hallazgo, como en nuestro caso, de una gammagrafía paratiroidea positiva tiene importancia para la planificación del tratamiento quirúrgico, sobre todo si se piensa emplear una técnica mínimamente invasiva, si ha existido cirugía cervical previa o se sospecha la presencia de tejido paratiroideo intratorácico2. De este modo, la negatividad de las técnicas de localización no debe modificar la indicación quirúrgica, si existe17,18. Entre todas ellas, la empleada de forma más habitual por su mayor sensibilidad (≅ 73%) y especificidad (≅ 94%) es la gammagrafía con 99mtecnecio (Tc)-sestamibi19,20. De hecho, aun con la mejoría en la sensibilidad de las técnicas de localización, estas todavía son inferiores a las del cirujano. Así se dice que «la mejor técnica de localización es localizar un buen cirujano»7. Teniendo en cuenta los factores previamente señalados, el diagnóstico de HP autónomo es sencillo y, probablemente más frecuente de lo sospechado tanto en las consultas generalistas como en los servicios de Nefrología, más allá de las consultas de litiasis. La importancia de un correcto diagnóstico de HP autónomo radica en la posibilidad de indicar un tratamiento adecuado para estos pacientes.
Dado el carácter asintomático del HP1, es bien conocido que no todos los pacientes con HP1 deben ser sometidos a cirugía, aunque datos aportados recientemente indican que la cirugía es adecuada en la mayor parte de ellos21–23. Sin embargo, un porcentaje significativo no va a evolucionar negativamente desde el punto de vista óseo o litiásico. Así, parece que se ha reconocido un gran subgrupo de pacientes a los que se puede realizar un seguimiento de forma segura sin cirugía gracias al avance de los conocimientos sobre el curso natural de la enfermedad, de la eficacia y de los riesgos de las diferentes intervenciones propuestas en el tratamiento del HP17 y no se ha mostrado de forma consistente un incremento de la mortalidad en estos pacientes24,25. Por todo ello, los consensos para el tratamiento del HP1 se han llegado a modificar varias veces durante los últimos 18 años7.
Uno de los temas de debate más importantes asociados al HP1 en la actualidad es que, aparte de las complicaciones clásicas del HP1 sin tratamiento (pérdida de masa ósea, nefro- o urolitiasis), se han descrito otras complicaciones no clásicas como la hipertrofia de ventrículo izquierdo, el aumento de eventos cardiovasculares, alteraciones neuroconductuales, reducción de calidad de vida o empeoramiento del pronóstico de otras enfermedades, como la insuficiencia cardíaca congestiva26. También se ha descrito, aunque los datos no son uniformes en la literatura, que en pacientes con HP1 hay un aumento de la rigidez vascular y deterioro de la función endotelial27–29. Estas complicaciones podrían mejorar con la PTX, aunque los datos aún son escasos para considerarlos criterios claros de cirugía26,24. En este sentido, se ha debatido desde hace mucho tiempo19 la necesidad de tratamiento para mejorar estas alteraciones no clásicas, muchas veces desapercibidas. Sin embargo, a pesar de numerosas evidencias de que el HP1 con hipercalcemia grave da lugar a un mayor riesgo cardiovascular, la relación con la hipercalcemia leve parece menos evidente25,30.
Es también muy debatida la relación independiente entre hipercalcemia crónica o aumento de los niveles de PTH con la supervivencia de estos pacientes25,31,32. El aumento de PTH intacta, aun en niveles muy cercanos a la normalidad, se ha relacionado de modo independiente con mortalidad cardiovascular en la población general27,33. Curiosamente, en este estudio, la elevación de la PTH en plasma (> 50ng/l) representó el 20% de la proporción de riesgo atribuible a la mortalidad cardiovascular27,33. Por otra parte, en unos estudios europeos realizados en Suecia y Dinamarca, se ha observado un aumento de la supervivencia de los pacientes después de la cirugía de HP1, pero solo apreciada 15 años después de la misma34,35. En cambio, en un estudio americano, la supervivencia global no se vio afectada en pacientes con HP1 leve, aunque los pacientes con enfermedad más grave, según el aumento de los niveles séricos de calcio, tenían un aumento de la mortalidad25. La asociación entre niveles elevados de PTH, riesgo de fractura, calcificación coronaria y mortalidad se ha descrito también en pacientes en diálisis aunque tampoco es una observación uniforme36–39. Fisiopatológicamente, el receptor de PTH está presente en cardiomiocitos y células musculares lisas vasculares40, produciéndose cambios en la función de estas células tras su activación, lo que ofrece un potencial mecanismo biológico al efecto deletéreo de los aumentos de la PTH. Además, la PTH se ha considerado clásicamente como una de las toxinas urémicas en la ERC, con efectos deletéreos que van más allá del hueso41.
La eliminación del tejido paratiroideo anormal es el único tratamiento definitivo de la enfermedad. En manos de expertos, la PTX está asociada a una tasa de curación del 95-98% y a una baja tasa (1 a 3%) de complicaciones. Por otra parte, y en comparación con los procedimientos abiertos, la cirugía mínimamente invasiva se asocia a un tiempo de operación más corto, una más rápida recuperación postoperatoria y menores tasas de complicaciones42,43. La monitorización intraoperatoria de PTH puede ser útil44. El éxito de la cirugía se evidencia por una normalización inmediata de los niveles de PTH, descenso de los niveles de calcio plasmático y aumentos graduales en la densidad mineral ósea (hasta un 10%), sobre todo durante los primeros años del postoperatorio45.
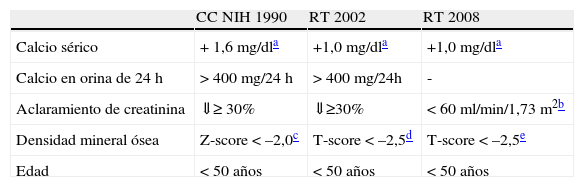
De este modo, la PTX-adenomectomía se debería recomendar a todos los pacientes con HP1 sintomático44 y, de acuerdo con el Tercer Workshop Internacional celebrado el año 2008 sobre manejo del HP1 asintomático, se recomienda también para los pacientes que cumplan cualquiera de los criterios enumerados en la tabla 246.
Comparación de las indicaciones de tratamiento quirúrgico de las conferencias para consenso sobre el tratamiento del hiperparatiroidismo primario7,46
| CC NIH 1990 | RT 2002 | RT 2008 | |
| Calcio sérico | + 1,6mg/dla | +1,0mg/dla | +1,0mg/dla |
| Calcio en orina de 24 h | > 400mg/24 h | > 400mg/24h | - |
| Aclaramiento de creatinina | ⇓≥ 30% | ⇓≥30% | < 60ml/min/1,73 m2b |
| Densidad mineral ósea | Z-score < –2,0c | T-score < –2,5d | T-score < –2,5e |
| Edad | < 50 años | < 50 años | < 50 años |
En el caso de nuestra paciente, esta presentaba como criterios principales una calcemia mayor de 1,0mg/dl (0,25mmol/l) sobre el límite superior de la normalidad y un «aclaramiento» de creatinina menor de 60ml/min. Es importante recordar que, en el último consenso mencionado, un aspecto que se matizó respecto a los previos fue el grado de disminución del FG como criterio de indicación quirúrgica. Así, se modificó la reducción del 30% del filtrado previo, expresado en el consenso anterior, a un valor absoluto estimado por la ecuación MDRD ≤ 60 ml/min47.
Aunque la presencia de un FG<60ml/min/1,73m2 en las recomendaciones de PTX pudiera parecer que se refiere a la afectación aguda de la hipercalcemia sobre el parénquima renal48, sabemos que se ha establecido ese nivel preciso (el que define un estadio 3 de ERC) tanto para el momento del diagnóstico como durante el seguimiento de la función renal de los pacientes que inicialmente no cumplían criterios para la cirugía46. De hecho, se menciona específicamente que aunque los pacientes podrían haber alcanzado ese nivel de función renal por la edad o por comorbilidades y no por la presencia de HP1, este umbral es considerado por la mayoría como un nivel preocupante46. Asimismo, es razonable pensar que, en presencia de ERC, muy prevalente en los rangos de edad en los que se diagnostica el HP1, la hipercalcemia leve persistente podría asociarse a una peor evolución a ERC terminal. Además, por debajo de este nivel podría empeorar también el HP como consecuencia de la contribución de la propia ERC46.
Aparte del tratamiento quirúrgico mencionado, en caso de optar por un seguimiento o tratamiento médico, la evolución no es equivalente. En caso de decidirse por una actitud expectante, se recomienda la monitorización y reevaluación de la calcemia, FG y medida de la masa ósea anualmente. Si se contempla la posibilidad de tratamiento médico se dispone de bisfosfonatos, tratamiento hormonal sustitutivo o raloxifeno en mujeres y, recientemente, cinacalcet4,7 aunque en la actualidad no se ha definido un tratamiento médico definitivo. Estas opciones de tratamiento deben ser especialmente consideradas, como se ha comentado antes, en pacientes que no son candidatos a cirugía (tabla 1). De todos ellos, consideramos que cinacalcet podría tratarse del tratamiento médico de elección en pacientes con ERC4, pues es especialmente efectivo en la reducción de calcio a largo plazo (80-90% de casos) y, en algunos casos de la PTH, sin cambios significativos en la calciuria, aunque es poco efectivo sobre la densidad mineral ósea (DMO)7,49–51. Por otra parte, los bisfosfonatos son más efectivos en el aumento de la DMO lumbar y femoral, y en la reducción de marcadores de remodelado óseo pero tienen poca repercusión sobre la calcemia y PTH séricas, de un modo similar a lo poco descrito con el tratamiento hormonal sustitutivo o el raloxifeno en mujeres. Todos estos últimos serían opciones a considerar en pacientes con HP autónomo en los que la protección del hueso fuera la principal razón para plantear el tratamiento activo no quirúrgico45. Recientemente se ha publicado la asociación de cinacalcet y alendronato como terapia para normalizar tanto la hipercalcemia como la DMO en pacientes con HP152.
Cinacalcet es un calcimimético de segunda generación, modulador alostérico del receptor sensor del calcio de las células paratiroideas, que aumenta su sensibilidad al calcio extracelular53,54. Cinacalcet fue inicialmente aprobado para el tratamiento del HP secundario de pacientes en diálisis y para la hipercalcemia del carcinoma de paratiroides. Recientemente se ha aprobado en Europa y los Estados Unidos para el tratamiento de la hipercalcemia moderada a severa en pacientes con HP1 en los que estaría indicada la PTX pero existe una contraindicación o no es adecuada clínicamente. Cinacalcet no está aprobado para el tratamiento del HP secundario de pacientes antes de tratamiento renal sustitutivo.
A diferencia del HP secundario, el tratamiento del HP1 se iniciaría generalmente a una dosis de 30mg 2 veces al día según ficha técnica, idealmente después de las comidas; las dosis se ajustan de acuerdo al nivel de calcio en suero. Una vez lograda la normocalcemia o la dosis máxima tolerada, los niveles de calcio sérico deben ser monitorizados cada 2 a 3 meses hasta alcanzar la estabilidad. Es importante destacar que con cinacalcet no siempre se observa una disminución de los niveles de PTH55,56. En cualquier caso, el descenso de calcio plasmático con cinacalcet, a igualdad de niveles de PTH, muestra claramente el conocido desplazamiento de la curva calcio-PTH hacia la normalidad tanto en el HP1 como en el secundario57–59. Inicialmente existió el temor de que el fármaco pudiera inducir hipercalciuria al frenar la PTH, pero en los pacientes tratados no se ha descrito aumento de la actividad litiásica y no parece producirse un aumento del calcio en orina por encima de los valores normales51.
Nosotros decidimos tratar inicialmente a nuestra paciente afecta de hipercalcemia y ERC con dosis bajas de cinacalcet por presentar los criterios quirúrgicos mencionados y en espera de la PTX. Cinacalcet fue rápidamente efectivo en el control de la calcemia con una sola dosis diaria y la cirugía posterior confirmó el diagnóstico clínico. Por otra parte, es de considerar que la hipofosfatemia característica de muchos pacientes con HP1 (presente en el 25% de pacientes) se puede resolver con cinacalcet, pero esta es probablemente menos frecuente en los pacientes con ERC por la tendencia a la retención precoz de fósforo, como sabemos hoy a partir de las mediciones de FGF-23. Es de destacar también en nuestro caso, la presencia de HP residual después de la cirugía. En presencia de normocalcemia, este HP refleja la real contribución posterior de la deficiencia de vitamina D y la propia ERC al desarrollo o evolución del HP secundario.
Finalmente queremos hacer mención también a la importancia del déficit crónico de vitamina D como elemento relacionado con la fisioenfermedad del HP1, pues este permitiría un estímulo constante a la proliferación paratiroidea y, finalmente, a la autonomización de la glándula. En el último consenso se destacó la elevada prevalencia del déficit de vitamina D tanto en la población general como en el HP1 y se puso especial énfasis en la cuantificación sistemática de calcidiol en todos los pacientes en los que se sospecha HP1, recomendándose el tratamiento de la deficiencia de vitamina D con suplementos moderados (400-600 U/día) antes de tomar cualquier otra decisión terapéutica4,46,47. Esta aproximación debería monitorizarse en pacientes con ERC que ya presentan una excreción de calcio disminuida y por ello nosotros preferimos replecionar la vitamina D tras corrección inicial de la calcemia, especialmente en estos casos más severos. El tratamiento con difenilhidantoína también favorece dicho déficit en nuestra paciente60.
En resumen, a través de este caso queremos señalar la no infrecuente aparición de HP autónomo en pacientes con ERC y hemos revisado tanto su diagnóstico como la disponibilidad de nuevos tratamientos. Así, creemos que los nefrólogos deberíamos tener un mayor índice de sospecha en pacientes que presenten hipercalcemia no farmacológica con PTH no adecuadamente suprimida, y considerar la posibilidad de tratamiento con cirugía o calcimiméticos en presencia de ERC. No obstante, debemos reconocer que aún no es sabido si el tratamiento activo de estos pacientes comporta beneficios renales o de supervivencia a largo plazo.