Los líquidos que se emplean actualmente en los tratamientos de diálisis peritoneal (DP) como terapia sustitutiva del riñón son inevitablemente bioincompatibles debido a su composición. Estos líquidos pueden dañar la membrana peritoneal, dando lugar a inflamación, angiogénesis, vasodilatación, pérdida de células mesoteliales, transición epitelio-mesenquimal de estas células, fibrosis, esclerosis encapsulante y fallo de membrana. Tanto en trabajos experimentales como en ensayos clínicos se han estudiado distintos mecanismos que disminuyan estos efectos adversos ya sea mediante la búsqueda de nuevos líquidos más biocompatibles, ya sea mediante la aplicación de medicación tanto intra- como extraperitoneal. En esta revisión se analizan los distintos estudios realizados en este sentido desde estos 3 enfoques. La contribución de este tipo de estudios será clave para el progreso en la preservación del peritoneo y la optimización de la técnica de DP.
The fluids used in the treatment of peritoneal dialysis (PD) as renal replacement therapy are inevitably bioincompatible due to their composition. These fluids may harm the peritoneal membrane, leading to inflammation, angiogenesis, vasodilatation, loss of mesothelial cells, epithelial-to-mesenchymal transition of these cells, fibrosis, encapsulating peritoneal sclerosis and membrane failure. Both experimental studies and clinical trials have investigated distinct mechanisms to reduce these effects, whether through the search for new biocompatible fluids or through the use of distinct drugs, administered intra- or extraperitoneally. In this article, we analyze the distinct studies performed in these 3 areas. The contribution of these types of study is essential to understand and improve the preservation of the peritoneum in order to optimize the technique of PD.
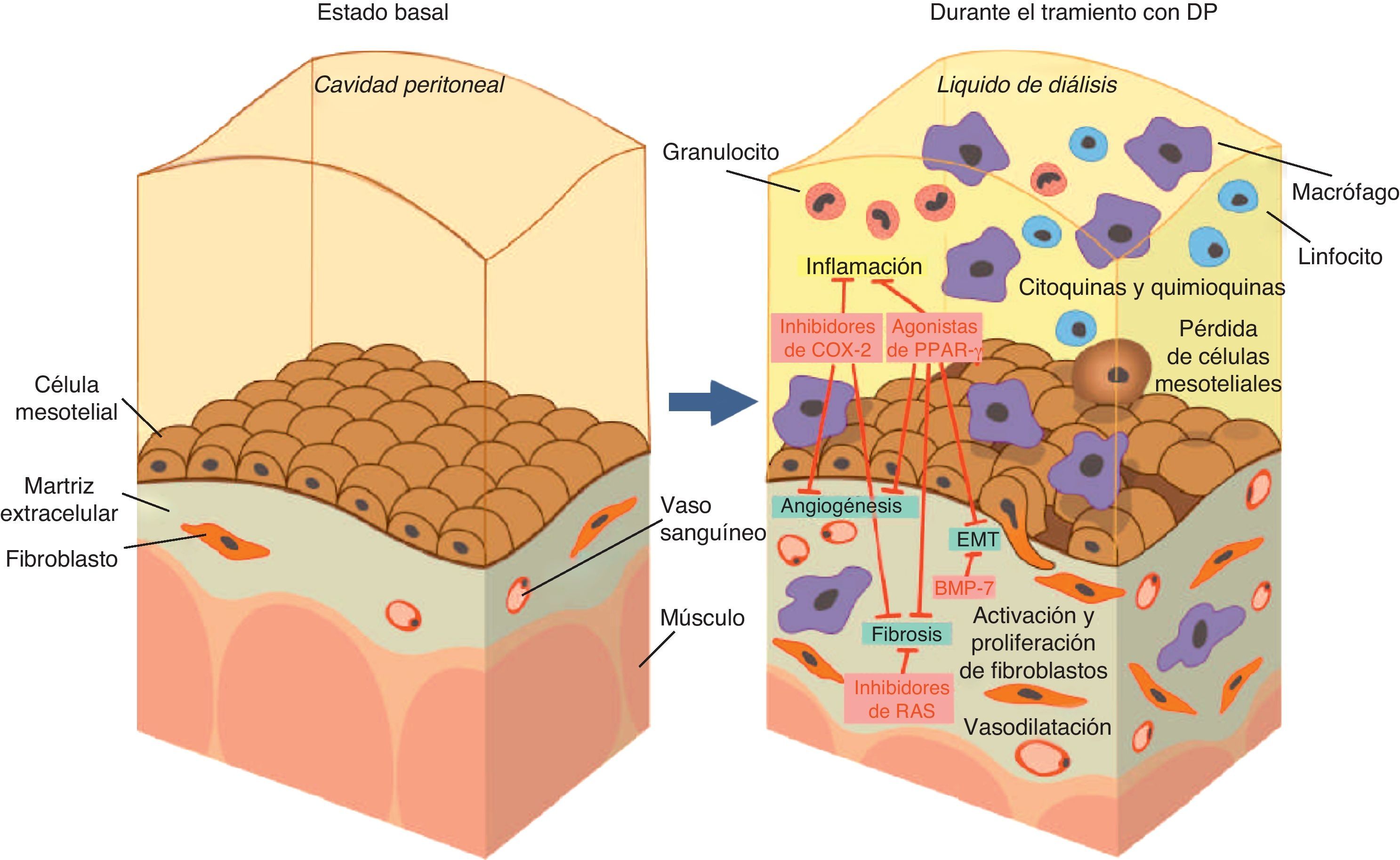
La diálisis peritoneal (DP) se utiliza para el tratamiento de la enfermedad renal en estadio final. Requiere la instilación y renovación periódica de líquidos de diálisis (LD) en la cavidad peritoneal, compuestos por soluciones hiperosmóticas generalmente basadas en glucosa, para crear un gradiente que permita el establecimiento de un balance hídrico negativo. Sin embargo, estos LD son inevitablemente bioincompatibles debido a su composición, pudiendo dañar la membrana peritoneal durante el tratamiento de DP1.
Las células mesoteliales constituyen la primera línea de contacto del organismo con el LD y son, por ello, las primeras en verse afectadas por su presencia. Así, debido tanto a la composición del LD como al propio proceso mecánico de instilación del mismo, muchas células mesoteliales mueren y otras son drenadas con el efluente, mientras que una cierta proporción sufren una transición epitelio-mesenquimal (EMT), denominada en este caso transición mesotelio-mesenquimal (MMT), adquiriendo características fibroblastoides (fig. 1)1. Esto tiene consecuencias morfofuncionales en la membrana peritoneal, puesto que estas células transformadas secretan factores solubles que colaboran en el desarrollo de fibrosis y angiogénesis.
Fotografías de cultivos de células extraídas de efluente drenado de pacientes en DP. En la imagen de la izquierda se observan células con fenotipo epitelial, con morfología redondeada, mientras que a la derecha se muestra un cultivo de células con fenotipo fibroblastoide, con morfología alargada. Imágenes tomadas mediante microscopía de contraste de fases (100X).
Por otra parte, la técnica de DP está asociada también a la aparición de un proceso inflamatorio crónico que está presente siempre en mayor o menor medida, y que contribuye de manera crucial tanto a la MMT como al resto de los procesos patológicos que pueden aparecer a lo largo del tiempo, incluyendo la vasodilatación, el desarrollo de angiogénesis, fibrosis, esclerosis encapsulante y fallo de membrana (o de ultrafiltración)1–4. Este último fenómeno, consecuencia de la DP, consiste en la aparición de una alta tasa de transporte peritoneal que implica la desaparición rápida del gradiente osmótico y la pérdida de la capacidad de ultrafiltración. Se ha comprobado que este proceso puede no tener relación con la angiogénesis, aunque sí está asociado a una alta prevalencia de MMT5. Esta inflamación es consecuencia de un proceso natural de respuesta frente a un daño tisular, cuyo fin es la reparación de la arquitectura y funcionalidad del tejido afectado, pero que, si se prolonga en el tiempo, tiene consecuencias patológicas. Además, pueden tener lugar episodios inflamatorios agudos inducidos por infección o hemoperitoneo que agravan la situación y aceleran la aparición del fallo de la capacidad de ultrafiltración2. Un adecuado control de la respuesta inflamatoria es esencial para evitar el daño peritoneal.
Prevención y tratamiento de los daños peritonealesExisten 3 posibles tipos de intervenciones para conservar y prolongar un buen status peritoneal en estos pacientes: mejorar la biocompatibilidad de los LD, añadir posibles agentes terapéuticos en los mismos que protejan el peritoneo o administrar medicación por vía extraperitoneal (oral, intramuscular o intravenoso). Combinaciones de estas posibilidades también podrían resultar de interés. Se han realizado distintas aproximaciones en este sentido en estudios experimentales con animales, e incluso en algunos casos se han trasladado estos conocimientos a ensayos clínicos con pacientes, estudiando distintos parámetros en biopsias y análisis tanto in vitro como ex vivo.
Líquidos biocompatiblesLa glucosa y sus productos de degradación (GDP) son los principales agentes causales del daño peritoneal y la inflamación6. De hecho, generalmente se emplean LD con elevada concentración de estos agentes en modelos experimentales con el fin de acelerar la aparición de los daños en el peritoneo. El lactato que se utiliza como solución tampón en muchas composiciones de estos LD parece ser también otro factor implicado en la aparición de lesiones peritoneales6. Esta bioincompatibilidad podría disminuirse utilizando agentes osmóticos alternativos, reduciendo la aparición de GDP, manteniendo un pH más fisiológico o tamponando con otros productos como el bicarbonato. Sin embargo, conseguir LD completamente biocompatibles es una meta difícil que aún no ha podido alcanzarse debido a las necesidades implícitas a la técnica de la diálisis.
La contribución de cada uno de estos componentes de los LD a la aparición de daños peritoneales se ha analizado en diferentes trabajos en modelos animales. La presencia de GDP se ha visto asociada, en un estudio de exposición prolongada en ratas, con aumento de la expresión de colágeno-I, metaloproteinasa-2, Snail y receptores de productos de glucosilación avanzada de la glucosa (RAGE) y proliferación de células mesoteliales con fenotipo mesenquimal7. En otro estudio realizado en ratas durante 8 semanas, se analizó también la contribución de un pH bajo sobre el peritoneo, aunque este no parece tener un efecto negativo, probablemente debido a la rápida capacidad tamponante del peritoneo, según los autores8. Por otra parte, en un trabajo de Aubertin et al. se concluye que, en ratas, tras una única exposición al LD, el transporte de agua libre y la capacidad de ultrafiltración difieren al comparar LD con tampón lactato o bicarbonato9. Existen evidencias en modelos de DP en rata que muestran un efecto beneficioso del empleo de soluciones bajas en GDP en contraste con soluciones con concentraciones más elevadas, mejorando la capacidad de ultrafiltración, reduciendo la expresión de VEGF, TGF-β, la angiogénesis, la fibrosis o disminuyendo la formación de productos de glucosilación avanzada de la glucosa (AGE)10.
Sin embargo, pese a estas claras evidencias estudiadas experimentalmente in vivo en modelos animales, en la clínica todavía es necesario el empleo de LD basados en glucosa. Las compañías farmacéuticas están realizando grandes esfuerzos en la carrera por alcanzar cada vez una mayor biocompatibilidad en la formulación de las nuevas generaciones de LD. Ejemplo de esos nuevos LD es «Balance» (Fresenius Medical Care® Bad Homburg, Germany), el cual contiene bajas concentraciones de GDP. En estudios clínicos se ha comprobado que este LD preserva la morfología de las células mesoteliales presentes en el efluente reduciendo la MMT tanto in vitro como ex vivo11. Además, se ha sugerido que este LD puede retrasar la aparición de anuria y reducir la incidencia de peritonitis en comparación con los LD convencionales con alta concentración de glucosa12. Otro LD con bajo contenido de GDP, que además contiene bicarbonato como solución tampón, es «Bicavera» (Fresenius Medical Care® Bad Homburg, Germany), el cual ha mostrado una reducción en la respuesta inflamatoria local en el peritoneo en un estudio a largo plazo en ratón2; además, se ha comprobado que su uso en clínica puede preservar la integridad de la membrana peritoneal13. Existen también otros LD basados en otros agentes osmóticos como icodextrina o aminoácidos («Extraneal» y «Nutrineal», respectivamente, Baxter Healthcare® McGaw Park, IL) que también reportan un mayor grado de preservación del peritoneo14,15. Estudios aún no publicados de biopsias de pacientes en DP durante 1-4 años muestran resultados prometedores con el empleo de estos LD y confirman los hallazgos obtenidos en estudios anteriores, sobre todo en cuanto a la preservación mesotelial y la reducción del fenómeno de la MMT.
Agentes terapéuticos añadidos a los líquidos de diálisisMuchos agentes farmacológicos han sido probados para prevenir o paliar los efectos adversos de la DP. La angiotensina-ii promueve la aparición de fibrosis e inflamación en varios tejidos16,17. La inhibición del sistema renina-angiotensina (RAS), mediante la administración intraperitoneal de enalapril, ha mostrado una reducción del engrosamiento peritoneal y de la pérdida de ultrafiltración inducida en ratas tras 4 semanas de exposición diaria a LD (fig. 2)18.
Otro agente que ha sido testado experimentalmente, añadido al LD, es el factor antifibrótico BMP-7. El BMP-7 promueve el cambio desde un fenotipo mesenquimal a uno epitelial, y ha mostrado la capacidad de prevenir y revertir fibrosis en modelos murinos de daño renal tanto in vitro como in vivo19,20. En ratas, administrado intraperitonealmente junto con LD rico en glucosa y GDP durante 5 semanas, disminuyó la aparición de MMT, fibrosis y angiogénesis. Sin embargo, estos efectos parecen no estar relacionados con el proceso inflamatorio, dado que el BMP-7 no modula el influjo de macrófagos activados al tejido ni el número total de células presentes en el lavado peritoneal (fig. 2)21.Otra aproximación que se ha realizado en este sentido es la administración de péptidos bloqueantes de TGF-β durante 5 semanas, intraperitonealmente junto con LD rico en glucosa y GDP, en un estudio en ratones. Este trabajo mostró una menor aparición de fibrosis y angiogénesis en los animales tratados con los péptidos bloqueantes frente a aquellos expuestos únicamente a LD, así como disminución en el número de células que expresan un fenotipo fibroblastoide en el tejido peritoneal, y una mejora en la capacidad de ultrafiltración22. Fue llamativo cómo estos péptidos ayudaron a identificar, en este modelo de ratón, que las células mesoteliales son uno de los principales orígenes de los fibroblastos presentes en la membrana tras el tratamiento, seguidas de los fibrocitos de médula ósea y en menor medida, de los fibroblastos residentes y de los de origen endotelial. Dados los resultados obtenidos, podría ser interesante estudiar en un futuro la eficacia del tratamiento con estos péptidos en pacientes.Por otro lado, es sabido que la activación del receptor de vitamina D modula la respuesta inflamatoria y la fibrosis, modificando el patrón Th1/Th2, induciendo la activación de células T reguladoras y disminuyendo la activación de NF-κB23. Además, promueve la expresión BMP-7 y MMP-8 y disminuye la fibrosis renal23. Se ha estudiado, en el mismo modelo en ratón comentado previamente, la administración intraperitoneal de paricalcitol, un activador selectivo del receptor de la vitamina D que se utiliza habitualmente para tratar el hiperparatiroidismo secundario asociado a enfermedad renal que presentan muchos pacientes en DP. En este reciente estudio, paricalcitol ha mostrado un efecto protector peritoneal debido a su acción moduladora de la respuesta inflamatoria (González-Mateo G, et al., artículo enviado para publicación). Dado que este fármaco está siendo administrado ya a un porcentaje de pacientes en DP, sería un buen candidato para un estudio clínico que confirmara estos resultados en pacientes.
Otra posibilidad, en la línea de la adición de fármacos a los LD, es el empleo de heparina. La heparina presenta actividad moduladora de la síntesis de matriz extracelular, proliferación celular, angiogénesis e inflamación, y su efecto protector ha sido analizado experimentalmente en un estudio en rata de DP, donde parece reducir el riesgo de infección24. Con respecto a estudios clínicos con pacientes, se ha comprobado que la administración intraperitoneal de tinzaparina, una heparina de bajo peso molecular, reduce la permeabilidad peritoneal a pequeños solutos y aumenta la ultrafiltración en pacientes de DP25. Recientemente ha sido publicado un trabajo por nuestro grupo que analiza el efecto de la adición de heparina (bemiparina) al LD compuesto por icodextrina. En este estudio no se observó mejora significativa, en el análisis por intención de tratar, en el transporte de creatinina ni en la capacidad de ultrafiltración de la membrana a 8-16 semanas. Sin embargo, comparando el subgrupo de pacientes con fallo de ultrafiltración y los pacientes controles, se observa una mejora, limitada en el tiempo, en la capacidad de ultrafiltración26.
Empleo de medicación oralLa administración oral de los inhibidores de angiotensina-ii enalapril, aliskiren, valsartán o lisinopril ha mostrado una disminución de la producción de TGF-β y un menor engrosamiento peritoneal, mejorando también la función peritoneal frente a los daños inducidos en ratas tras 4 semanas de exposición diaria a LD (fig. 2)27,28. Actualmente se está llevando a cabo un análisis del efecto del aliskiren y losartán en la tasa de transporte peritoneal29.
Otro ejemplo de trabajos en los que se ha estudiado el empleo de medicación oral es el tratamiento con agonistas de PPAR-γ como la rosiglitazona, que aumenta la sensibilidad a la insulina y tiene acción inmunomoduladora sobre macrófagos y células T30,31. En un estudio con ratones de exposición a LD con altas concentraciones de glucosa y GDP, de 3 semanas de duración, se analizó el efecto de la administración oral de rosiglitazona sobre el status peritoneal. El tratamiento con rosiglitazona mostró una reducción en la acumulación de AGE, aparición de fibrosis y angiogénesis, preservando la monocapa mesotelial y la capacidad de ultrafiltración de la membrana peritoneal. Esto se asoció con un aumento en la concentración intraperitoneal de la citocina antiinflamatoria IL-10, y con un mayor porcentaje de células reguladoras CD4+CD25+FoxP3+, en comparación con el grupo expuesto únicamente al LD (fig. 2)3. En este caso, el salto de estos estudios a la clínica durante tratamientos prolongados está limitado debido a los efectos secundarios que presenta este agente, responsables de su reciente salida del mercado europeo32,33. Pese a esta restricción, este estudio resulta de gran interés para aclarar la eficacia de dirigir acciones farmacológicas hacia rutas implicadas en inflamación y fibrosis. De hecho, se está estudiando actualmente en Hong Kong el efecto de la rosiglitazona en relación con inflamación, daño vascular y supervivencia en diálisis, así como el efecto de la pioglitazona en inflamación, aterosclerosis y calcificación, en pacientes de DP34,35.Otros agentes estudiados son los inhibidores de la acción de la enzima ciclooxigenasa (COX), que cataliza la síntesis de prostaglandinas (fig. 2)36. La expresión de COX-2 está regulada por estímulos mitogénicos e inflamatorios, y se relaciona con la aparición de inflamación y angiogénesis36. En un modelo en rata de diabetes e hipertensión se ha comprobado también que COX-2 induce la expresión en tejido renal de TGF-β1, fibronectina y VEGF37. Se ha comprobado en modelos de DP en rata y ratón, que la administración oral de un inhibidor de COX-2, celecoxib, reduce la inflamación, la angiogénesis y la fibrosis del peritoneo, y preserva la capacidad de ultrafiltración2,38. Al igual que sucede en el caso de los agonistas de PPAR-γ, la utilización de inhibidores de COX-2 puede conllevar efectos adversos en los pacientes39, lo que limita su posible empleo a largo plazo para paliar los daños asociados al tratamiento de DP.
Por último, recientes estudios en un modelo en rata de DP sugieren que la administración oral de atorvastatina, de la familia de las estatinas, protege el peritoneo de la formación de fibrosis, inflamación y proliferación vascular40,41. No existen aún estudios clínicos en esta línea, pese a su potencial interés dado que muchos pacientes de DP están recibiendo tratamientos con estatinas para controlar la dislipidemia.
ConclusiónLos LD existentes en el mercado resultan bioincompatibles puesto que agreden al peritoneo, ocasionando pérdida de células mesoteliales, MMT, inflamación, vasodilatación, alteración en la permeabilidad vascular, angiogénesis y fibrosis, procesos que conllevan la pérdida de la función dializante de la membrana peritoneal. Esto puede solventarse o paliarse, bien variando su composición, bien mediante fármacos, tanto añadidos al propio LD como administrados por vía oral. Se han realizado distintos estudios en modelos animales que abren la puerta al desarrollo de ensayos clínicos en pacientes. Esto permitirá, en un futuro, encontrar una solución definitiva a los problemas que plantea actualmente la DP.
FinanciaciónRS ha recibido becas no restringidas para la investigación de los efectos de los líquidos de diálisis en la transformación de la célula mesotelial otorgadas por Laboratorios Abbott, Fresenius Medical Care y Baxter Healthcare.
FIS PS09/00447, PI09/00641, PI08/1564, ISCIII-RETIC REDinREN/RD06/0016, Fondecyt 1080083. Comunidad de Madrid/FRACM/S-BIO0283/2006, SAF 2007/63648, SAF 2010-21249 (Ministerio de Ciencia e Innovación), CAM S-GEN-0247/2006. IRSIN. Laboratorios Abbott. Fresenius Medical Care. Baxter Healthcare.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.