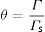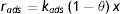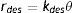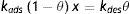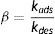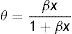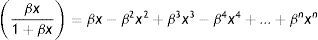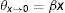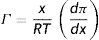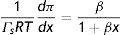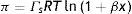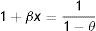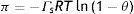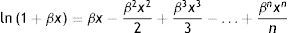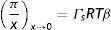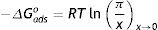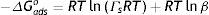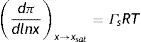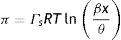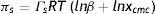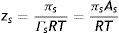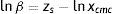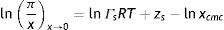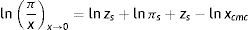La isoterma de Langmuir es uno de los modelos fenomenológicos más poderosos y descriptivos del proceso de adsorción. En el caso de superficies fluidas, aunado a la ecuación de adsorción de Gibbs, proporciona una clara descripción física del comportamiento de la tensión superficial en términos moleculares. La ecuación de estado resultante puede expresarse en composición tanto de la fase volumétrica como de la fase superficial, evaluar la concentración micelar crítica en tensoactivos y calcular de forma directa e inmediata las energías de adsorción y micelización, sin necesidad de constantes empíricas. A lo largo de este trabajo se muestran las diversas ventajas del modelo de Langmuir y su aplicación en el cálculo de estas propiedades.
The Langmuir isotherm is one of the most powerful and descriptive models for the adsorption process. Applied to fluid interfaces, in conjunction with Gibbs adsorption equation, it provides a meaningful physical description of surface tension on a molecular level. The resulting equation could be expressed as a function of volumetric phase composition or surface phase composition to calculate critical micelle concentration of surfactants in solution, as well as the adsorption and aggregation energies in a direct way, avoiding the use of empirical constants. In this work, the multiple advantages of the Langmuir model and its application to the calculation of these properties are presented.
La isoterma de adsorción de Langmuir ha sido ampliamente usada en sistemas de tipo sólido-líquido, sólido-vapor, sólido-gas, líquido-vapor y líquido-líquido. Cuando el proceso de adsorción o concentración se produce sobre una superficie sólida, la isoterma de adsorción se construye a partir del balance de material entre la fase fluida y el sólido en contacto. Para la adsorción en fases fluidas, como es el caso de líquido-vapor o líquido-líquido, es necesario emplear la ecuación de adsorción de Gibbs para evaluar la concentración del anfifilo en la superficie, mediante la medición de la tensión superficial o interfacial; procedimiento y objetivo del presente artículo.
AntecedentesIrving Langmuir desarrolló investigaciones sobresalientes en el campo de la estructura de sólidos, la adsorción de gases sobre sólidos, diseñó el filamento de wolframio para su empleo en bulbos de gas en las lámparas incandescentes (Suits y Martin, 1974) aumentando la eficiencia y la vida útil de las lámparas en comparación a los bulbos al vacío. Estas investigaciones realizadas en los laboratorios de General Electric lo hicieron acreedor del premio Nobel en Química en 1932. La experimentación efectuada con diferentes gases le permitió la observación de reacciones químicas en la superficie del filamento incandescente, hasta el desarrollo de una teoría de las reacciones químicas a altas temperaturas, con la cual logró estimar el calor de disociación del hidrógeno (Langmuir, 1912). Los trabajos de Langmuir sobre los filamentos incandescentes establecieron los fundamentos de la transmisión de electrones inducida por las altas temperaturas, lo cual contribuyó al desarrollo de la electrónica, la fabricación de tubos de alto vacío y la utilización del plasma, término que el mismo acuño (Suits y Martin, 1974). Sus estudios sobre superficies fluidas y monocapas facilitaron el análisis de películas de proteínas como técnica en la investigación bioquímica. El trabajo de Langmuir se distinguió por la búsqueda de aplicaciones prácticas, mostrando preferencia por experimentos sencillos con los cuales fuera posible el desarrollo de conceptos que permitieran extender el análisis teórico, como es el caso de la isoterma que lleva su nombre, motivo de este artículo.
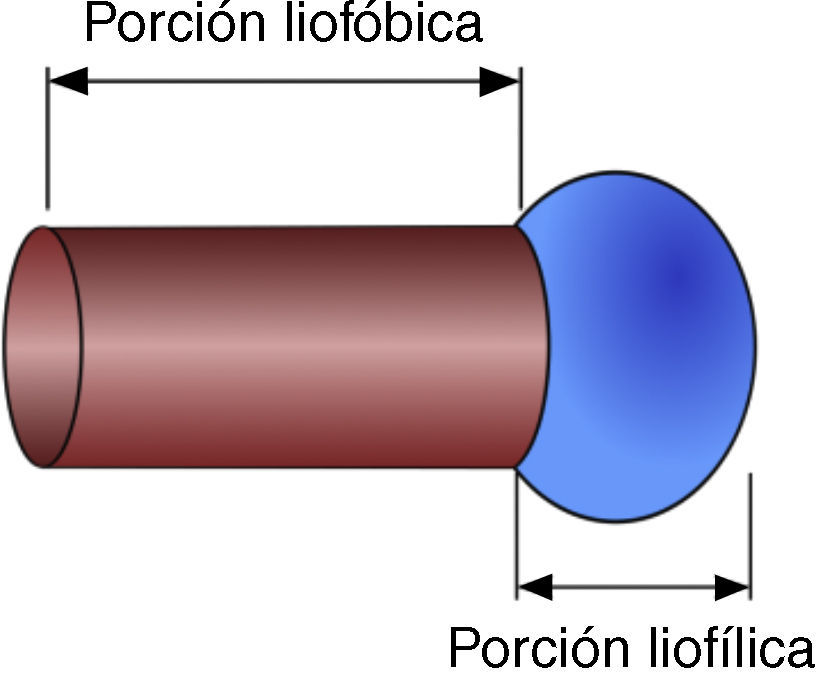
Los anfifilos son sustancias formadas por una parte con afinidad al disolvente, liofílica, y otra parte sin afinidad al disolvente, liofóbica, como se muestra en la figura 1. De forma general se distinguen 2 tipos de anfífilos, los tensoactivos, que forman agregados moleculares y los líquidos simples, que no lo hacen.
La característica principal de los anfifilos es el abatimiento de la tensión superficial del disolvente debido a la adsorción. La cuantificación de moléculas de anfifilo en la superficie es la parte fundamental en la termodinámica de superficies. De los parámetros fundamentales de la ecuación de estado superficial (EES) de Langmuir se obtienen: la concentración del anfifilo en la superficie, el área que ocupa en la superficie, el coeficiente de reparto superficie-disolución, y las energías estándar de adsorción y micelización. La información experimental previa a la obtención de los parámetros es la presión superficial en función de la concentración. La presión superficial π se define como la diferencia entre la tensión superficial del disolvente σ1 y la de la disolución σ; esta presión en dos dimensiones indica la energía por unidad de área del anfifilo en la superficie.
Modelo de adsorción de LangmuirLangmuir estableció 3 postulados para describir la adsorción o concentración del anfifilo en la superficie:
- I.
Formación de una monocapa de moléculas adsorbidas.
- II.
Todos los sitios de la superficie tienen la misma probabilidad de ser ocupados.
- III.
No hay interacción entre moléculas adsorbidas.
Las propiedades de la interfase como una región bidimensional y homogénea se reconocen en el primer y segundo postulado, respectivamente, pues se rechaza la condensación (fenómeno volumétrico) e indica que en la superficie existe una cantidad limitada de espacios con la misma probabilidad de ser ocupados. El tercer postulado indica que los cambios en las propiedades superficiales asociados a la adsorción de cada molécula son constantes, ya que no existen interacciones entre las especies adsorbidas.
La adsorción no se manifiesta de forma aislada, ya que de forma simultánea ocurre el proceso inverso, en que el adsorbato retorna hacia la fase volumétrica (Langmuir, 1917).
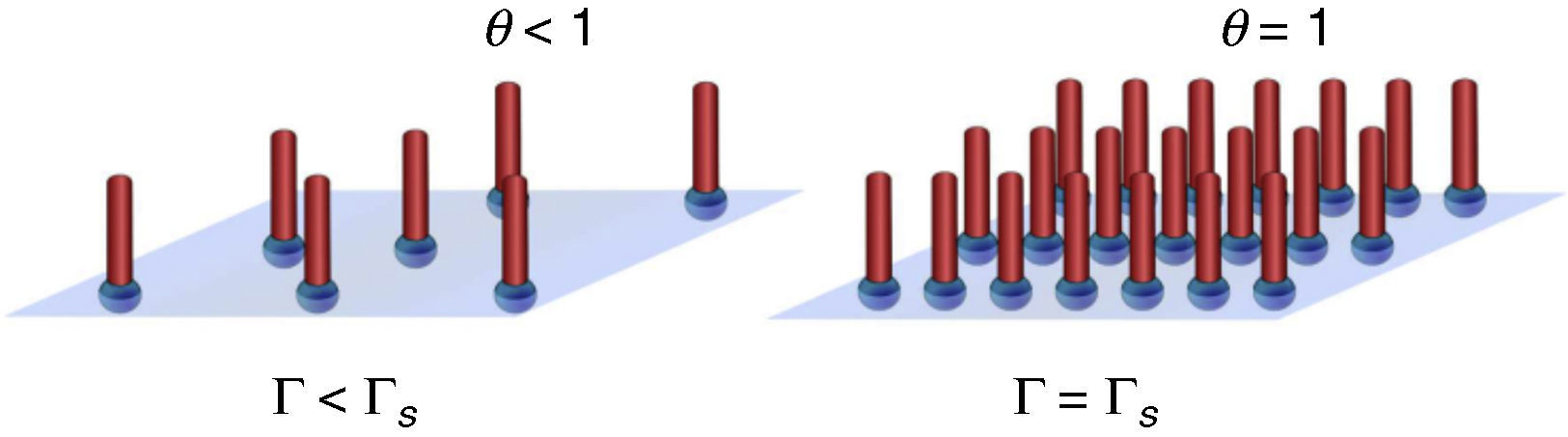
La concentración de soluto adsorbido está representada por Γmol/cm2 y, dado que la superficie es finita, la concentración de moléculas en esta región tiene como límite máximo la concentración superficial a saturación Γs; el inverso de esta concentración representa el área mínima que ocupa el tensoactivo en la superficie As. La fracción de espacios ocupados θ corresponde al grado de recubrimiento de la superficie y se define como (fig. 2):
Los factores involucrados en la adsorción son la fracción mol del anfifilo en la disolución x disponible para la adsorción y el espacio libre en la superficie para ser ocupado 1−θ, de donde la rapidez de adsorción es:
mientras que la desorción depende únicamente de las moléculas adsorbidas, representadas por los espacios ocupados en la interfase θ
donde kads y kdes corresponden a la constantes de rapidez de adsorción y desorción, respectivamente. En el equilibrio dinámico la rapidez de adsorción y desorción son iguales.El cociente de las constantes es un indicador del reparto de la especie con actividad superficial entre la interfase y la fase volumétrica, parámetro que cuantifica el efecto liofóbico.
Al sustituir el parámetro β en la ecuación (5) se obtiene la isoterma de adsorción de Langmuir Ec. (7).
El valor límite de la fracción de espacios ocupados en la región a dilución infinita x→0 se obtiene de la expansión en series de potencias de la ecuación (7). Al ignorar los términos de orden mayor a uno se obtiene la ecuación (9), la cual coincide con la isoterma de adsorción ideal, donde el número de moléculas en la interfase es directamente proporcional a la concentración de la disolución, lo que muestra que la isoterma de adsorción de Langmuir puede ser reducida al caso ideal (Novelo-Torres y Gracia-Fadrique, 2003).
La isoterma de adsorción de Gibbs contiene la relación entre la concentración de soluto en la superficie Γ y la variación de la presión superficial respecto a la composición de la fase volumétrica (Novelo-Torres y Gracia-Fadrique, 2003).
Considerando las ecuaciones (2) y (7), al igualar las isotermas de adsorción de Langmuir y de Gibbs, se obtiene una expresión diferencial de la presión de superficie, respecto a concentración en fracción mol:
Al integrar la ecuación (11) con los límites de disolvente puro, π=0 cuando x=0, a una composición arbitraria x a la que corresponde la presión superficial π, la ecuación (11) toma la forma:
El resultado de la integral se conoce como EES de Langmuir, que permite caracterizar materiales en disolución mediante los parámetros fundamentales ΓsRT, concentración máxima en la interfase y coeficiente de reparto β.
Mediante la ecuación (7) es posible expresar la ecuación (13) en términos de la ocupación superficial:
La ecuación resultante se conoce como ecuación de Frumkin.
La obtención de los parámetros ΓsRT y β se produce a través del análisis de condiciones límite del sistema.
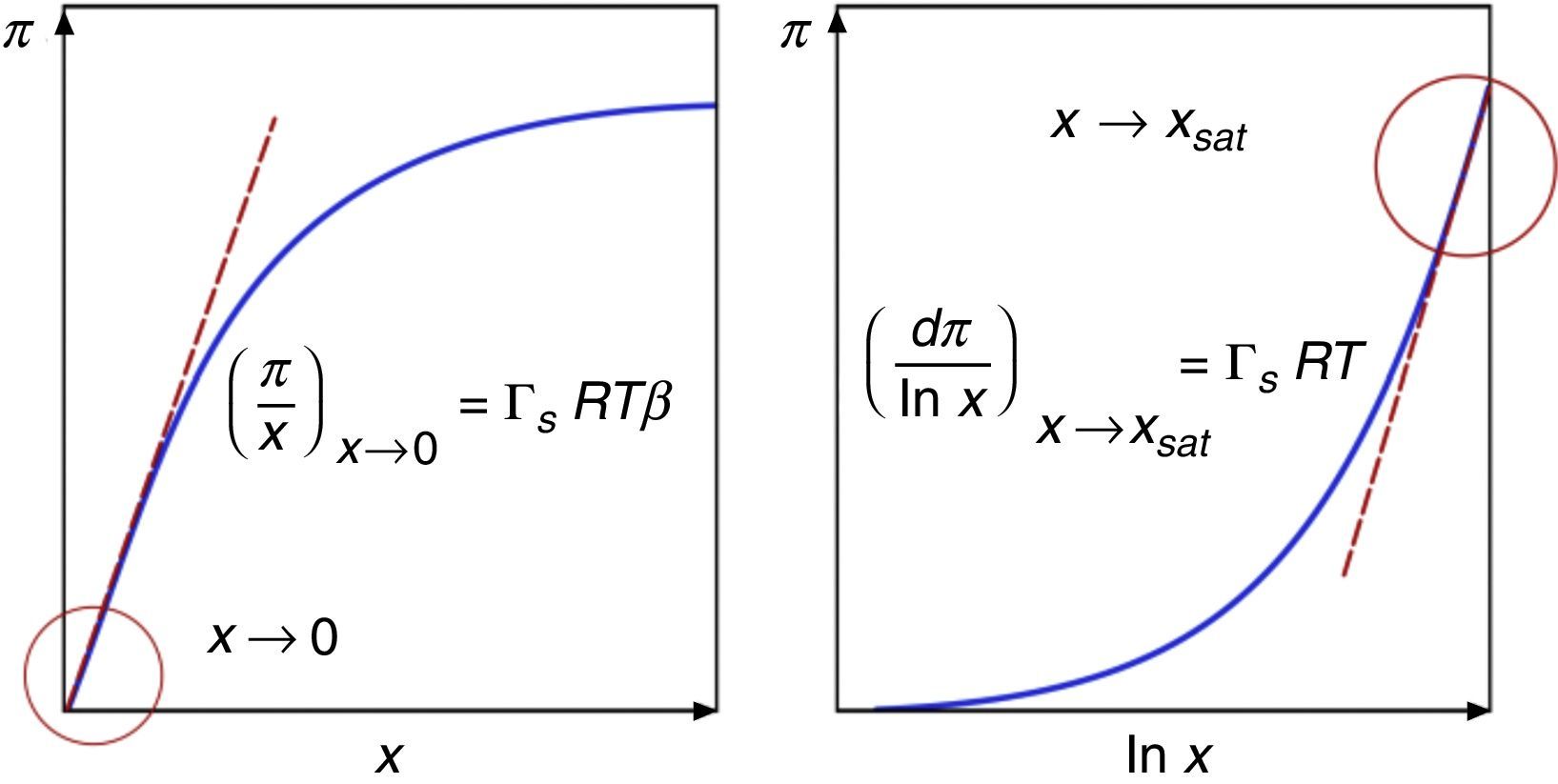
Al expandir en series de Taylor el término dependiente de la concentración x, de la EES de Langmuir (ecuación [13]) y evaluar en el régimen de dilución infinita x→0 se obtiene:
En condiciones a régimen diluido la ecuación (13) es:
De esta forma, el producto ΓsRTβ corresponde a la pendiente de los datos experimentales π -vs- x a dilución infinita. El logaritmo natural de esta pendiente multiplicado por RT corresponde a la energía estándar de adsorción −ΔGadso (Clint, Corkill, Goodman, y Tate, 1968):
La energía estándar de adsorción mide la tendencia del anfifilo de pasar del seno de la disolución a la superficie. Al sustituir la ecuación (17) en (18) la energía estándar de adsorción adquiere una nueva forma en términos de los parámetros de la EES de Langmuir:
De la ecuación (19), se observa que la tendencia del anfifilo a adsorberse depende de dos contribuciones: la energía de las moléculas en la interfase ΓsRT y la liofobicidad del soluto β.
El parámetro ΓsRT se obtiene al derivar la EES de Langmuir, (13) respecto a la concentración x y evaluar el resultado en la región de saturación x→xsat, que para líquidos simples corresponde a x→1 y para los tensoactivos a x→xcmc. De esta manera RT veces la concentración máxima de soluto en la interfase es:
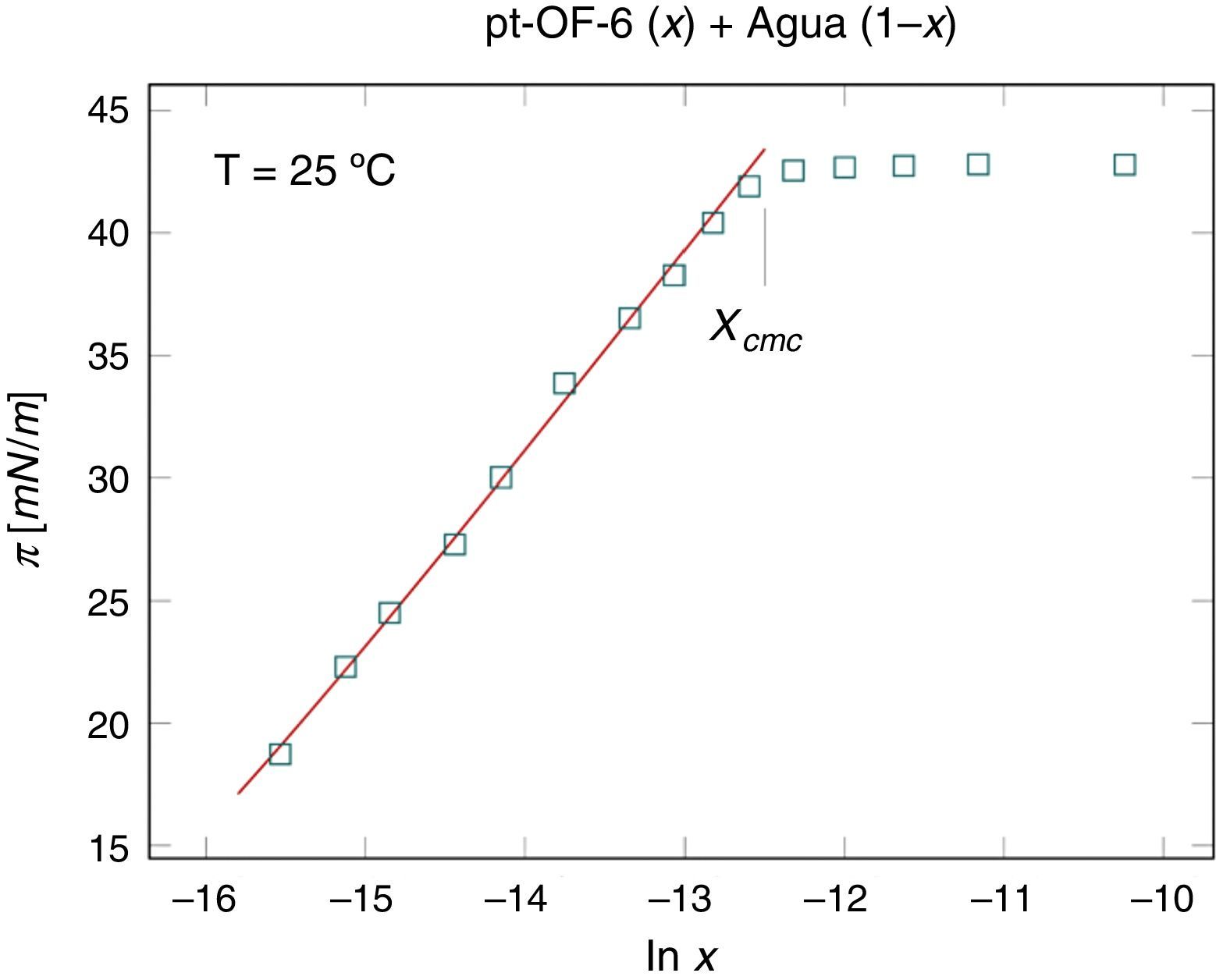
Los valores de dπdlnxx→xsat y πxx→0 resultan de los datos experimentales; por lo tanto, con las ecuaciones (17) y (20) se obtienen los parámetros ΓsRT y β. La EES de Langmuir describe un comportamiento monótono creciente de la presión superficial con el logaritmo natural de la fracción mol, como se muestra en la figura 3. En el caso de los tensoactivos, cuando se alcanza la concentración micelar crítica, la presión superficial se mantiene constante, lo que indica que se presentan interacciones del tensoactivo en la superficie que resultan en la formación de micelas (Gracia-Fadrique, 1999), de manera que la EES de Langmuir es aplicable a concentración menor o igual a la concentración micelar crítica, como se muestra en la figura 4.
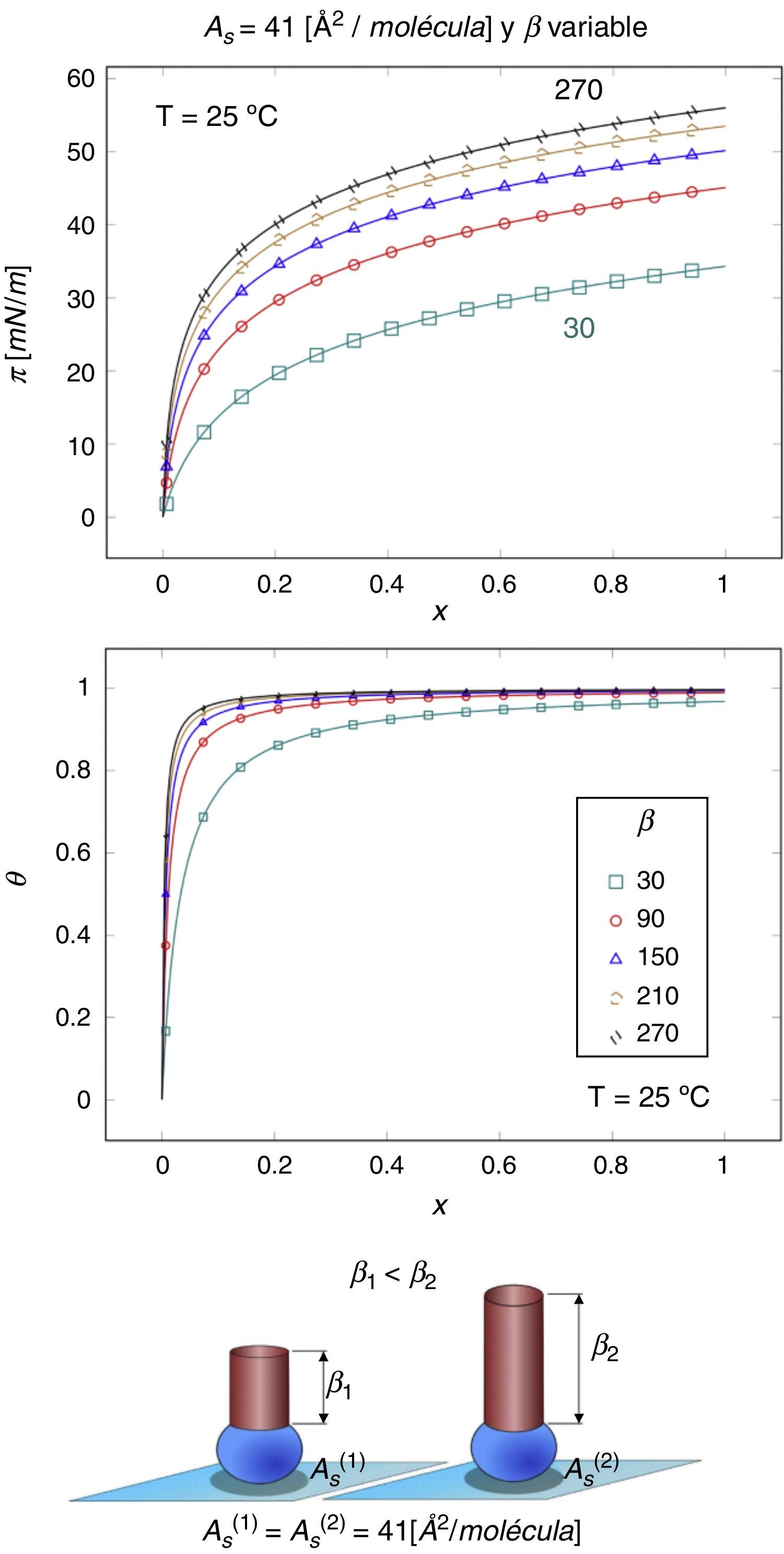
A continuación se analizan los efectos que estos parámetros tienen en el comportamiento de la presión superficial, en función de la fracción mol y su relación con la estructura del anfifilo. Si se mantiene constante el parámetro ΓsRT y, con ello, el área de saturación As, y se incrementa el valor del coeficiente de reparto (o parámetro liofóbico) β, se observa que a una misma concentración la presión superficial aumenta (fig. 5). Si el disolvente es un material polar y el anfifilo es un alcohol, la característica liofóbica se encuentra determinada por la longitud de la cadena hidrocarbonada, como se muestra en la figura 5.
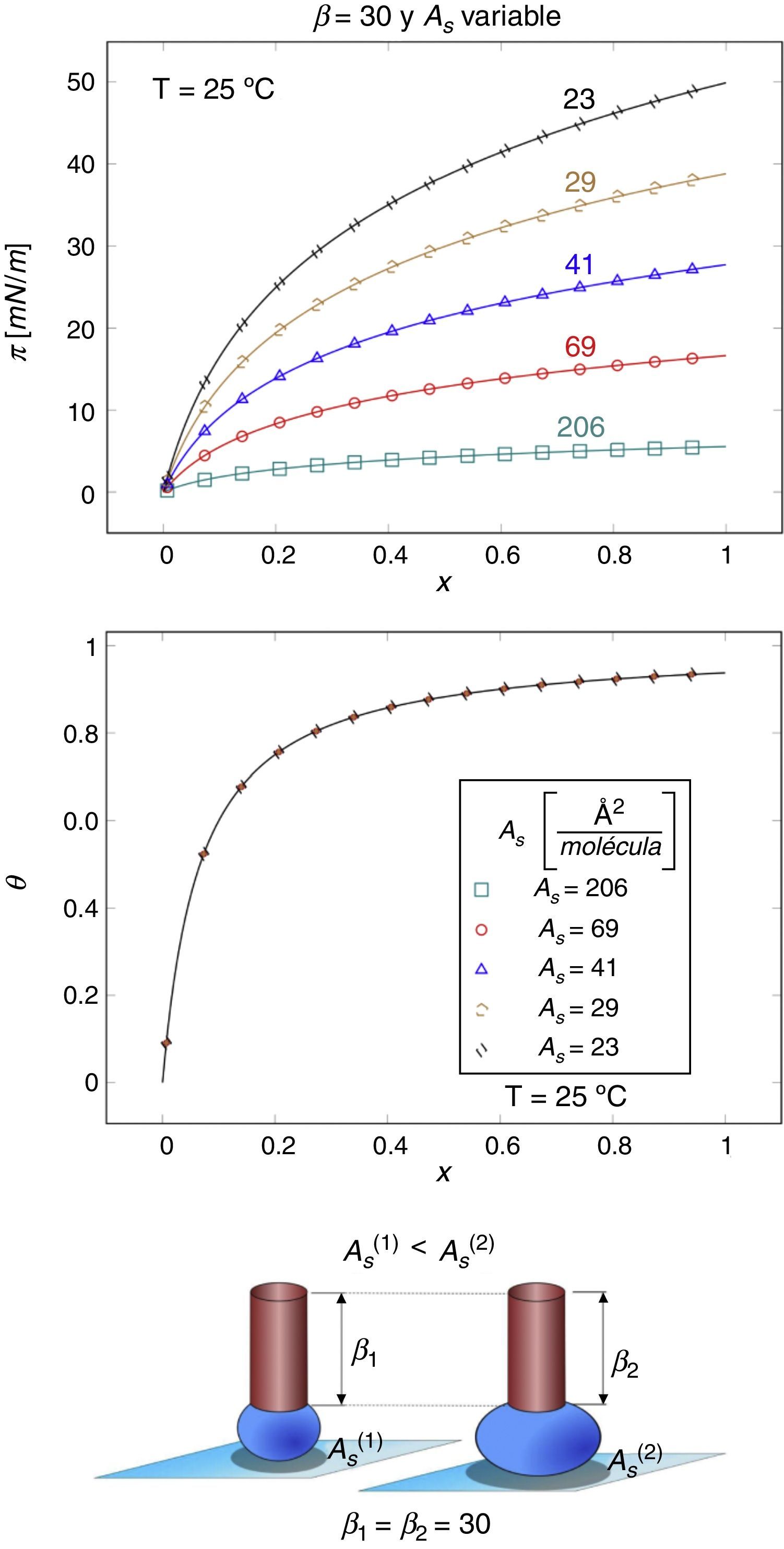
En otro caso, al mantener constante el coeficiente de reparto β e incrementar el área mínima del anfifilo en la superficie, el valor de ΓsRT de la EES de Langmuir disminuye. El incremento del área del anfifilo, que se asocia con el aumento de la masa molecular, resulta en una menor presión superficial a una misma concentración, sin que la fracción de espacios ocupados se modifique (ecuación [7]). Así ocurre en los polímeros de alta masa molecular, que prácticamente no tienen efectos en la presión superficial (fig. 6).
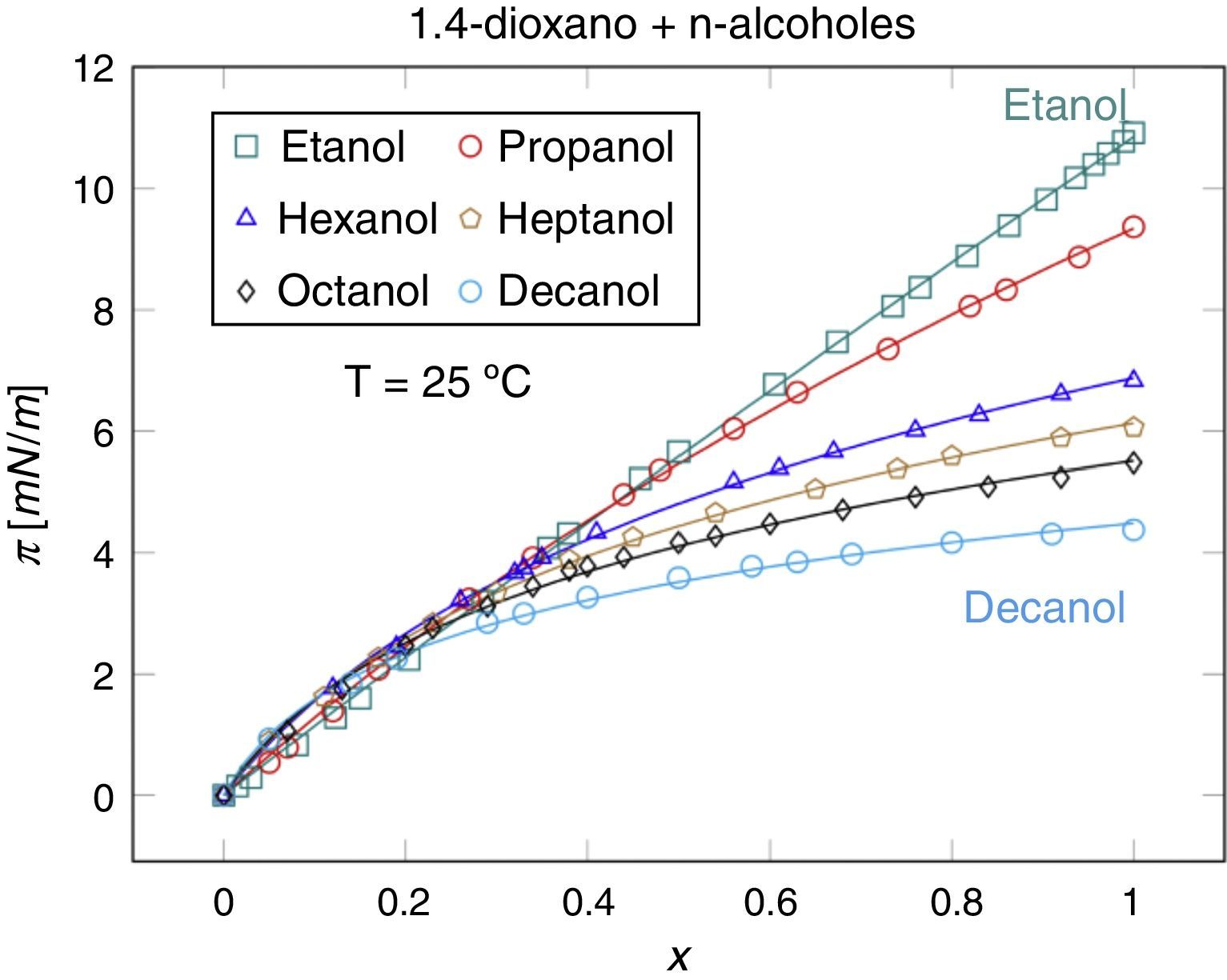
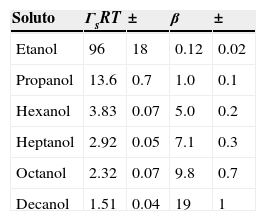
En la figura 7 se muestran los datos experimentales y la aplicación de la EES de Langmuir para una serie homóloga de alcoholes en 1,4-dioxano, donde el disolvente es el 1,4-dioxano y el anfifilo es el alcohol. El aumento de la cadena hidrocarbonada del alcohol está relacionado con el incremento de coeficiente liofóbico β, como se muestra en la tabla 1. En esta serie homóloga se observa que la disminución de ΓsRT (incremento del área de saturación), al aumentar la cadena hidrocarbonada, reduce la capacidad del anfifilo para modificar la presión superficial.
Aplicación de la ecuación de estado superficial de Langmuir a datos experimentales de una serie homóloga de n-alcoholes a T=20°C. Datos de Calvo et al. (Calvo, Penas, Pintos, Bravo y Amigo, 2001; Calvo, Pintos, Amigo y Bravo, 2002).
Los sistemas comentados hasta el momento corresponden con disoluciones de líquidos simples, donde 25<β<150. En las disoluciones de tensoactivos, que son moléculas anfifilicas de alto peso molar, este parámetro es mucho mayor 104<β<107. Otra diferencia fundamental es la formación de agregados moleculares llamados micelas, cuando la concentración x alcanza el valor crítico xcmc. Este fenómeno de interacción limita la aplicación de la ecuación (13) al intervalo de composición 0<x<xcmc, ya que la no interacción entre especies adsorbidas constituye uno de los postulados que construyen la isoterma de adsorción de Langmuir. Para estos sistemas resulta conveniente expresar la ecuación de Langmuir (13), en la forma:
Cuando la concentración de la disolución tiende al valor crítico (x→xcmc), la superficie se satura en tensoactivo (θ→1), la presión superficial alcanza el valor máximo o de saturación πs y la ecuación (21) se reduce a la forma:
El área superficial del adsorbato A es el recíproco de la concentración de superficie Γ, por analogía con la ecuación de estado del gas ideal (Lewis y Randall, 1961). El factor de compresibilidad bidimensional de saturación zs, que es un indicador de la no idealidad de la superficie, se define como:
Entonces, el parámetro hidrofóbico del soluto es una función de la no idealidad de la superficie y de las interacciones intermoleculares medidas como la concentración xcmc.
Con esta definición de β, la pendiente πx a dilución infinita (ecuación [17]), se expresa como la ecuación (25), que tiene como ventaja la capacidad de estimar la región a dilución infinita, de difícil estudio a escala experimental, a través de la región de saturación, que es más accesible con experimentos en el laboratorio.
Empleando la definición de zs en la ecuación anterior se obtiene:
Esta ecuación muestra la relación de la energía de adsorción (ecuación [18]) con la concentración micelar crítica del tensoactivo y la presión de saturación.
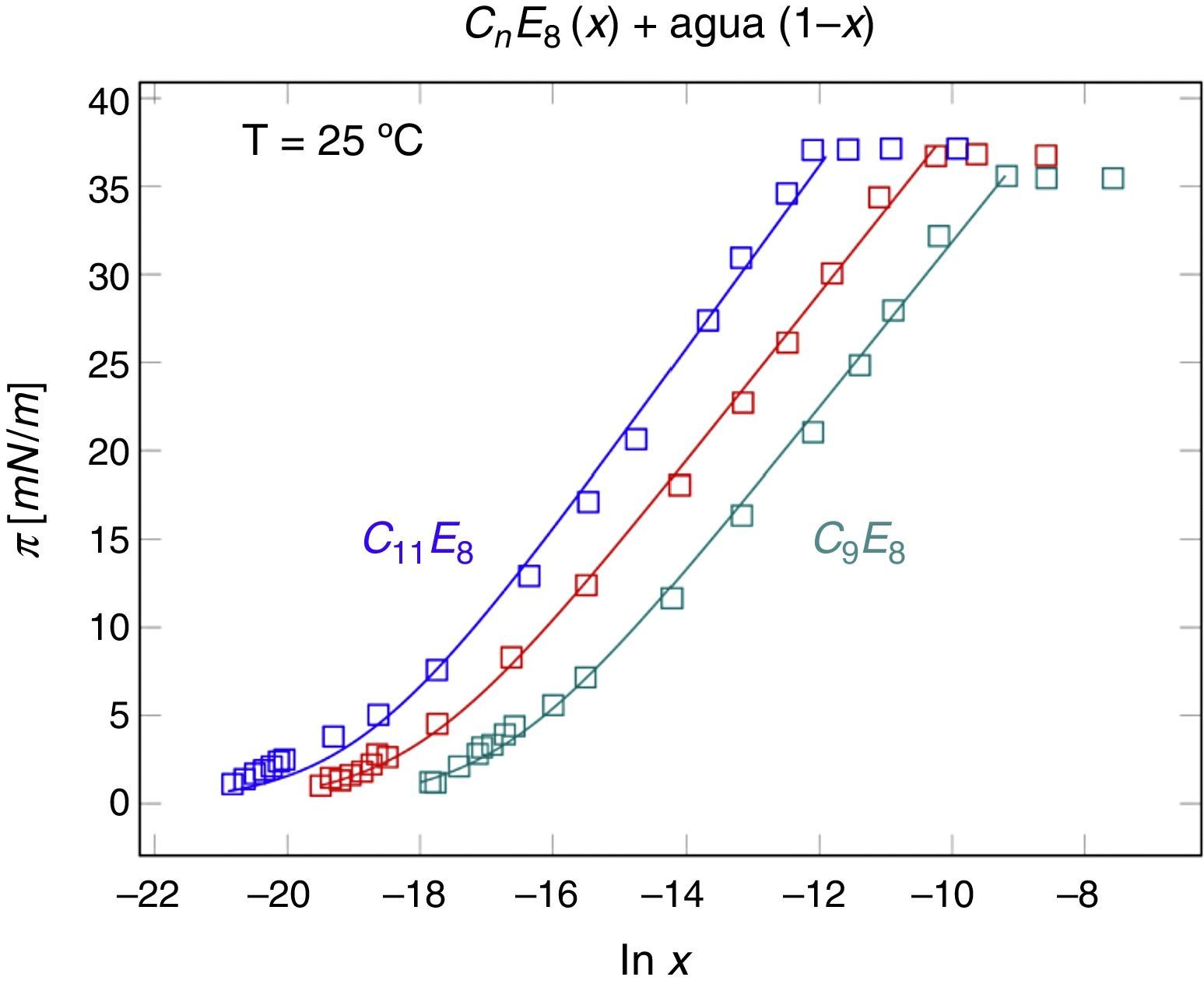
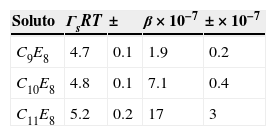
La figura 8 muestra la aplicación de la EES de Langmuir a una serie homóloga de tensoactivos CnE8 en disolución acuosa, donde la parte hidrofílica E8 corresponde a un polímero de 8 unidades de óxido de etileno y la parte hidrofóbica Cn, a una cadena hidrocarbonada con n carbonos.
Serie homóloga de CnE8. □, Datos experimentales de M. Ueno et al. (Ueno, Takasawa, Miyashige, Tabata y Meguro, 1981). Línea continua: ecuación de estado superficial de Langmuir.
La tabla 2 muestra los parámetros de la EES de Langmuir para la familia homóloga CnE8 en disolución acuosa; con el aumento de longitud de la cadena hidrocarbonada aumenta el coeficiente de reparto o coeficiente hidrofóbico β, mientras que la concentración de superficie a saturación Γs y el área mínima ocupada por el tensoactivo en la superficie As permanecen prácticamente constantes, lo que indica que el tensoactivo se adsorbe en posición vertical con la parte hidrofílica (E8) anclada a la superficie del agua, y las cadenas hidrofóbicas se instalan de forma vertical fuera del agua.
ConclusionesCada vez es más frecuente encontrar temas asociados a sistemas dispersos y nanoestructurados en materias curriculares como fenómenos de superficie, química coloidal, termodinámica de superficies, catálisis, emulsiones y otras, en distintos niveles de licenciatura en química y áreas relacionadas. En todos estos campos del conocimiento, el modelo de Langmuir, ya sea en la versión de isoterma, la más común, o como ecuación de estado bidimensional, conforma uno de los terrenos básicos del programa de estudios, debido a su carácter fenomenológico en comparación con las ecuaciones empíricas. De la representación de los datos experimentales mediante el modelo de Langmuir, en especial en fases fluidas, se obtiene la concentración superficial, el límite de saturación superficial, la concentración micelar crítica, la cobertura superficial, y las energías de adsorción y micelización, de donde se construye un panorama termodinámico integral con un claro significado físico del efecto hidrofóbico; concepto que reúne a la química, la ingeniería química, la fisicoquímica y la bioquímica en torno a un concepto termodinámico y fenomenológico común. La EES de Langmuir permite al estudiante de licenciatura adquirir una visión fundamentada del proceso de adsorción resultado del efecto hidrofóbico y la visión de la constitución de las superficies fluidas. La transformación de los valores de tensión superficial en función de la concentración de la fase volumétrica y la representación correspondiente con la EES de Langmuir proporcionan un panorama sobre la composición superficial y las condiciones coligativas de saturación, así como el conocimiento sobre el proceso espontáneo de agregación micelar que surge de la saturación previa de la superficie.
Este trabajo muestra la manera de obtener la EES de Langmuir mediante el acoplamiento de la ecuación de adsorción de Gibbs y la isoterma de Langmuir, procedimiento que no se presenta o no se muestra con claridad en un gran número de libros de fisicoquímica (Adamson, 1969; Castellan, 1998; Chang, 2008; Daniels y Alberty, 1963; Engel y Reid, 2006; Glasstone y Lewis, 1960; Guerasimov et al., 1977; Kuhn, Försterling y Waldeck, 2012; Laider y Meiser, 1995; Levine, 2004; Maron y Pruton, 1965; Moore, 1972). Los parámetros de la ecuación de estado superficial de Langmuir se analizan bajo la estructura del anfifilo y su configuración en la superficie, mostrando las relaciones mutuas entre la concentración superficial a saturación y el tamaño de la porción hidrofílica del anfifilo, así como del coeficiente de reparto con la capacidad liofóbica de la molécula.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.