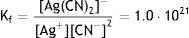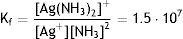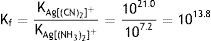El plateado electroquímico es una interesante actividad de enseñanza para la integración de la electroquímica, la química, la física y el arte. El artesano necesita producir una brillante capa de plata sobre sus obras y para ello opta por utilizar baños electrolíticos de diversa naturaleza. El costo y el grado de toxicidad son dos importantes variables que inciden en la determinación de la elección del electrólito que se utilizará. La plata se encuentra generalmente acomplejada y el estudio de los diversos complejos representa una interesante actividad en la química de los compuestos de coordinación. Resulta importante establecer una relación entre el brillo del recubrimiento y la estabilidad del compuesto complejo de plata y, por ende, de su estructura. El trabajo correlaciona las características del electrólito con el brillo de la plata depositada electroquímicamente sobre cobre y sobre níquel. Para cuantificar el brillo observado se utilizaron medidas de reflectividad con luxómetro.
Electrochemical silver is an interesting activity of teaching for the integration of electrochemistry, chemistry, physics and art. Craftsman needs to produce a bright layer of silver on his works and so chooses to use electrolyte of diverse nature. The cost and the degree of toxicity are two important variables that have an impact on the determination of the choice of the electrolyte to be used. Silver usually is find in the complex state and the study of the different complexes represents an interesting activity in the chemistry of coordination compounds. It is important to establish a relation between the brightness of the coating and the stability of the complex compound of silver and therefore of its structure. This paper correlates characteristics of electrolyte with the silver brightness electrochemically deposited on copper and nickel. In order to quantify the silver brightness, the reflectivity measurements were made with the luxmeter.
Resulta muy interesante y gratificante establecer un nexo entre el arte y la ciencia, especialmente cuando se trata de complementar o valorar obras de arte utilizando procesos electroquímicos que para el artesano orfebre, o escultor en metal, resultan extraordinariamente novedosos. En trabajos anteriores, intentamos presentar elementos de control de calidad en una planta simple de galvanotecnia (Lagos y Camus, 2016) y un trabajo de reflexión en cuanto a la tenue frontera que existe entre el arte y la ciencia, utilizando el ejemplo concreto del cobrizado electrolítico (Camus y Lagos, 2015). En este trabajo continuamos profundizando en el intento de conectar al mundo artesanal con el científico, utilizando el plateado electrolítico.
La plata es un metal muy electropositivo (+0.799V), y es desplazada de la solución por prácticamente todos los metales (Bard y Faulkner, 2001), depositándose con gran velocidad en forma de polvo negro sin ninguna adherencia, de acuerdo con la siguiente reacción:
La única manera de evitar este inconveniente es desplazando el potencial hacia valores más electronegativos; por ejemplo, mediante la disminución de la concentración de los iones de Ag+ en la solución. En la práctica esto se realiza utilizando sales complejas, como son los cianuros dobles, amoniacos dobles, etc.; en ese caso se producen las reacciones:
De esta manera los iones [Ag (NH3)2]+ o [Ag(CN)2]− no se reducen con tanta facilidad porque los ligandos estabilizan al ion de plata en su estado de oxidación +1, desplazando el potencial considerablemente (Archivero Facultad de Química UNAM, 2012), por ejemplo:
En su afán por producir recubrimientos brillantes y de alta calidad, los joyeros han intentado utilizar electrólitos que contienen plata a partir de diferentes complejos tales como K[Ag(CN)2], K2AgI3, [Ag(NH3)2]Cl, AgBF4,, este último compuesto se utiliza solo después de haber plateado inicialmente la superficie con el electrólito cianurado.
Un compuesto complejo de plata, tal como el cianuro doble de plata y potasio K[Ag(CN)2], puede caracterizarse por su constante de formación (Chang, 1997) numéricamente igual a Kf=1.0·1021.
De acuerdo con la reacción (3), se tiene que:
Similarmente para la reacción de formación del complejo amoniacal (2), se tiene que:Experimentalmente se puede demostrar cualitativamente la mayor estabilidad del complejo de plata con cianuro frente al amoniacal, al realizar una simple reacción de desplazamiento, que permitirá observar la competencia entre los dos agentes complejantes (Basolo y Johnson, 1980) por el ion de plata. Así por ejemplo, si se añade una disolución de cianuro a la disolución que contiene el complejo amoniacal [Ag (NH3)2]+ se producirá la reacción de desplazamiento:
Numéricamente se puede determinar que esta reacción está completamente desplazada hacia la formación del complejo cianurado:
Al revisar los valores de las constantes de formación de los diversos complejos que estudiaremos en este trabajo, se puede deducir que las soluciones de plateado que producirán un mejor brillo serán las que poseen las mayores constantes de formación, es decir, los complejos cianurados y amoniacales, ocupando los yodados una posición intermedia en el siguiente orden:
Entonces, se esperaría obtener las superficies más brillantes con complejos cianurados y las menos brillantes con complejos amoniacales, esperándose un brillo intermedio de los baños que contienen ligandos yoduro. Llama la atención el comportamiento de estos últimos complejos, porque poseen una estructura trigonal y tetraédrica, respectivamente, y tienen una estabilidad intermedia, superior a la de los complejos amoniacales (cuya estructura lineal es similar a los cianurados).
Los iones complejos deben disociarse continuamente en el medio acuoso, en presencia de un potencial eléctrico. Los potenciales de descarga del ion de plata varían no solo con la naturaleza del ligante, sino también con otros parámetros de la electrólisis (densidad de corriente, principalmente) y con los parámetros fisicoquímicos de la solución como el pH, la agitación y la temperatura (Ortiz González, 2011).
Los iones complejos de plata se dirigen hacia el cátodo donde deben disociarse antes de reducirse sobre la superficie metálica, de esta manera el ion libre (o hidratado) se descarga en la interface ganando electrones originando el átomo de plata que se irá reacomodando en el retículo cristalino para ir formando los microcristales que, en definitiva, producen el brillo metálico. Se ha comprobado que los iones cianurados de plata pueden reducirse como complejos para generar plata metálica Ag° (Lyons, 1954); de acuerdo con esta teoría, el ion de plata no se descarga libre, sino en forma de complejo, sin embargo, finalmente se deberá producir la reacción (4) en el cátodo.
En general, se observa que a altas densidades de corriente (o alta sobretensión) la naturaleza cristalográfica de depósito favorece la formación de un gran número de gérmenes de cristalización, es decir, de un depósito de granulación fina. Sin embargo, considerando que la electrocristalización se desarrolla en dos etapas: a) deposición del ion hidratado de plata y b) crecimiento del cristal de plata, es decir, primero el ion hidratado se deshidrata, se reduce y luego se incorpora en la red cristalina, implica entonces que los iones adsorbidos en la superficie del metal se incorporarán de manera preferencial en una zona plana del electrodo (Oniciu, 1974) o en zonas exentas de imperfecciones (rayas, ángulos, poros, etc.). En otras palabras, es de vital importancia la preparación de la superficie sobre la cual se depositará la plata. Una superficie limpia, plana, finamente pulida y exenta de rayas permitirá la obtención de un depósito de la mejor calidad.
En la práctica para aumentar el brillo de los depósitos se utilizan también abrillantadores, que son sustancias de naturaleza coloidal tensoactivas (Giudice y Pereyra, 2015), cuyo mecanismo de acción consiste en absorberse en los sitios activos de la superficie, y como regla general estas sustancias trabajan con mayor efectividad cuanto mayor sea su peso molecular; entre ellas se cuentan los péptidos, aminoácidos, (gelatinas), polipéptidos, proteínas, polisacáridos, azúcares, etc. Estas sustancias obligan a los átomos de plata a depositarse azarosamente, evitando la nucleación preferencial, es decir, los montículos arborescentes de cristales; en otras palabras, se podrían obtener dimensiones de grano del orden de 10nm los cuales reflejan muy bien la luz.
Para el artesano experimentado es muy simple diferenciar los depósitos de mayor o menor brillo (Mogollón y Franco, 2016; Paulosi, 2016), sin embargo, la obtención de tales superficies depende principalmente de la presencia de aditivos que son difíciles de conseguir o caros de adquirir, entonces resulta muy interesante cuantificar el grado de brillo del depósito obtenido; en ausencia de aditivos, esto se puede realizar con instrumentos llamados brillómetros o luxómetros (Electrónica-básica.com); por ser este último un instrumento muy versátil, es el que utilizaremos en este trabajo.
La toxicidad de los baños de cianuro (Riesgo químico-Accidentes graves, 2008) han estimulado su reemplazo, sin embargo, ninguno de los baños utilizados produce un recubrimiento similar a su calidad. La plata se utiliza no solamente en joyería, sino también en la industria eléctrica (en alto y bajo voltajes), principalmente para la fabricación de contactos; el simple recubrimiento con plata permite disminuir considerablemente la resistencia eléctrica (Osborne, 2016). Su gran capacidad de reflexión la hacen indispensable en la fabricación de espejos. Con plata se pueden recubrir piezas de cobre y sus aleaciones, en condiciones de atmósfera no corrosiva. El espesor de la capa debe fluctuar entre 3 y 6 micras. En condiciones de alta corrosividad ambiental, se debe recubrir la plata con esmaltes o lacas especiales o aumentar su espesor hasta 9-12 micras.
La composición química y los parámetros de trabajo de diferentes baños de plateado se encuentran diseminados en diversas fuentes bibliográficas (Canning, 1982; Kadaner, 1976; Helmenstine, 2016).
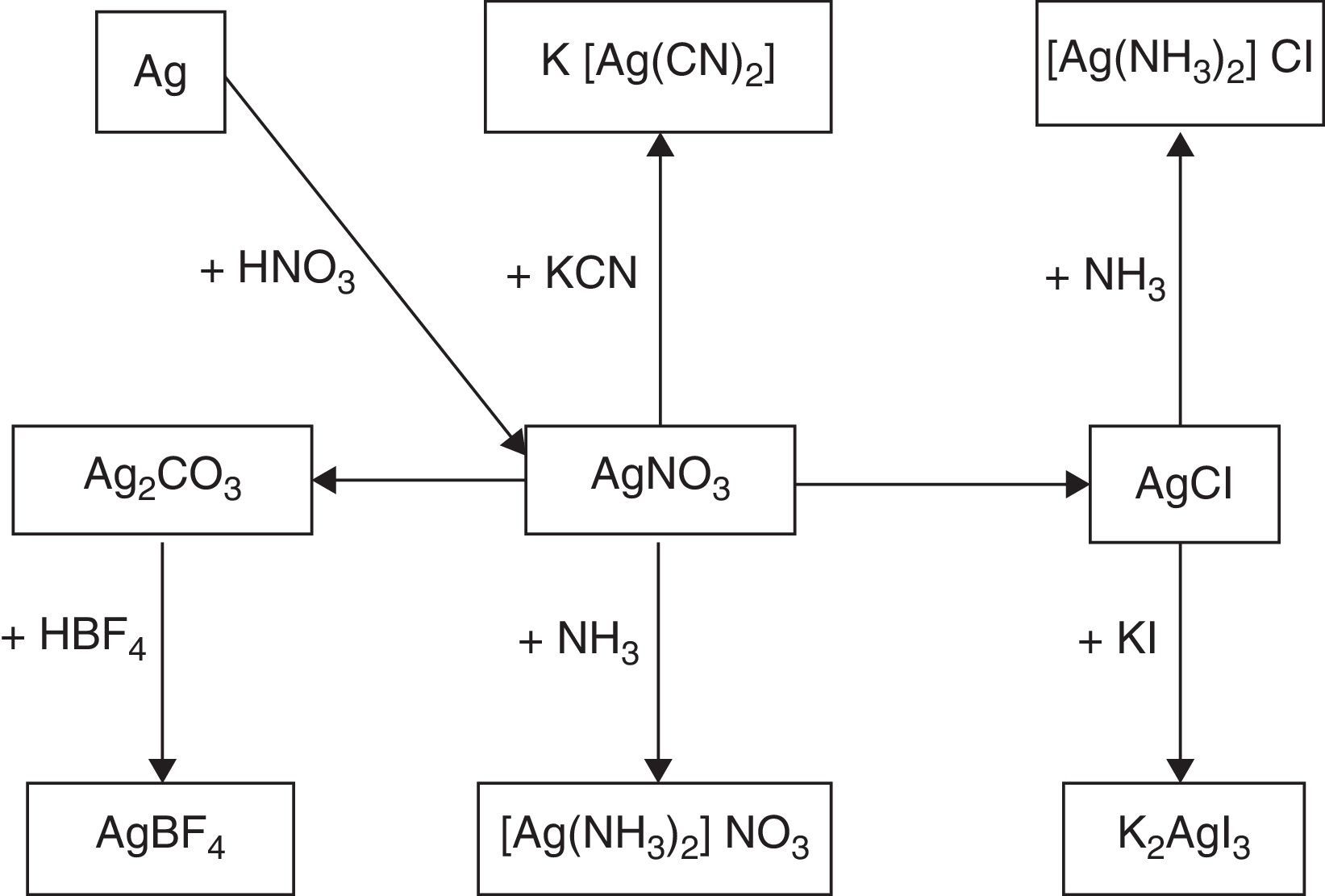
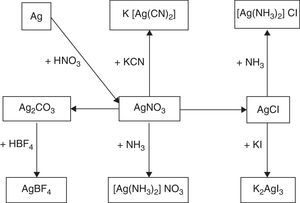
Parte experimentalDe acuerdo con el mapa de síntesis para compuestos complejos de plata, presentado en la figura 1, la materia prima para la preparación de los diferentes electrólitos de plata es el nitrato de plata, a partir del cual se deberán seguir las diferentes rutas de síntesis.
El nitrato de plata se preparó disolviendo 323.604g de plata en 147.46ml de ácido nítrico 86%, de acuerdo con los cálculos estequiométricos, con base en la reacción:
Como se observa, la reacción transcurre emanando vapores nitrosos muy tóxicos, que se deben atrapar mediante trampas de agua, trabajando bajo campana de extracción de gases. Luego el nitrato de plata resultante se evapora mediante suave calentamiento, hasta obtener cristales rómbicos incoloros que se separan al enfriar la solución. Después, se escurren las aguas madres por centrifugación, y de esta manera queda en los cristales aproximadamente un 0.3% de humedad.
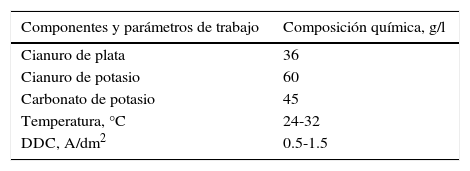
Para preparar 1l del electrólito cianurado de plata se procede de la siguiente manera: se disuelven 45.68g de nitrato de plata en 130ml de agua destilada. A esta solución se le agrega, bajo constante agitación, la cantidad exacta de cianuro de potasio al 5%, necesario para la formación del precipitado blanco de cianuro de plata, se filtra y se lava con abundante agua destilada y luego, sin permitir que se seque, se disuelve con un exceso de cianuro de potasio al 5%, para obtener el complejo de dicianoargentato de potasio («cianuro doble de plata y potasio»), de acuerdo con la siguiente reacción:
A la solución resultante se agregan, bajo constante agitación, 45g de carbonato de potasio. Una vez disuelto totalmente, se afora con agua destilada hasta 1l. El ion nitrato que permanece en la solución, cuando se produce la electrólisis, se desplaza hacia el ánodo de plata, ayudando a su disolución, lo que permite disminuir en parte el exceso de cianuro libre. En estas condiciones el electrólito se ajusta a la composición química (Kadaner, 1976) de la tabla 1.
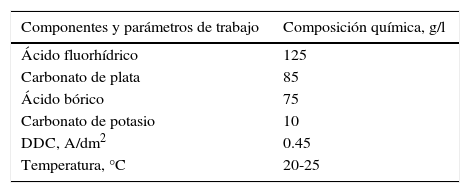
Para preparar 1l del electrólito con base en el fluoroborato de plata, se diluyen 62.5ml de ácido fluorhídrico concentrado con 62.5ml de agua destilada. Separadamente, en 100ml de agua caliente, se disuelven 42.5g de ácido bórico; esta solución se mezcla con la solución de ácido fluorhídrico (enfriándolo continuamente). De esta manera se forma el ácido fluorobórico:
Luego, a esta solución se le agregan 42.5g de carbonato de plata, que reacciona con el ácido fluorobórico, produciendo el tetrafluoroborato de plata:
Cuando el bióxido de carbono ha terminado de burbujear, se agregan a la solución resultante 5g de carbonato de potasio, agitando continuamente. Separadamente, en 100ml de agua caliente, se disuelven 75g de ácido bórico; esta solución se mezcla con la anterior y luego se afora a 1l con agua destilada. De esta manera se obtiene el electrólito de acuerdo con la composición química (Kadaner, 1976) presentada en la tabla 2. El electrólito obtenido antes de ser sometido a electrólisis debe ser filtrado, en presencia de carbón activo.
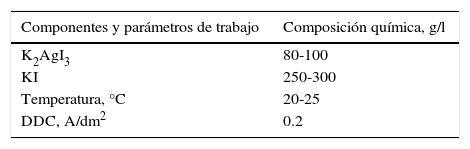
Para preparar 1l del electrólito de plateado con base en complejos de yodo, se procede de la siguiente manera: se disuelven 23.56g de nitrato de plata en 100ml de agua destilada. Separadamente se disuelven 8.25g de cloruro de sodio.
Luego se mezclan ambas soluciones para precipitar la plata como cloruro de plata, de acuerdo con la reacción:
El precipitado resultante se filtra, se lava con agua destilada y se traspasa a un vaso de precipitado al cual se agrega, agitando continuamente, una solución que se preparó disolviendo 70.32g de yoduro de potasio en 200ml de agua destilada. En estas condiciones se produce la formación del complejo de acuerdo con la siguiente reacción:
A la solución resultante se agrega, bajo agitación, 250ml de una solución que contiene 180g de yoduro de potasio. El volumen final se afora con agua destilada a 1l. En la tabla 3 se presentan los componentes, parámetros y composición química (Kadaner, 1976) de este electrólito.
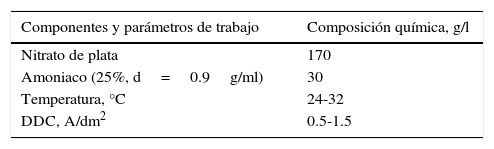
Muchos talleres prefieren utilizar la llamada «solución de plata amoniacal» para realizar la electrólisis; para ello también parten del nitrato de plata, pero podrían partir del cloruro de plata, especialmente cuando se utiliza plata recuperada (de placas radiográficas, residuos del taller, etc.). Químicamente, las reacciones que intervienen en este caso serían:
El complejo obtenido (nitrato de diamminoplata (I)) es llamado comercialmente «nitrato de plata amoniacal». Es este producto el que se somete a electrólisis para obtener plata en la industria y en talleres artesanales.
Para producir 1l de electrólito de complejo de plata amoniacal se disuelven 169.86g de nitrato de plata en 500ml de agua destilada y sobre esta solución se agregan 30ml de amoniaco concentrado (25.33% con d=0.91g/ml). La solución resultante se afora a 1l con agua destilada y se conserva en botella ámbar protegida de la luz. El complejo se produce de acuerdo con la siguiente ecuación:
En la tabla 4 se presentan la composición química y los parámetros de trabajo utilizados en la electrólisis.
Los depósitos de plata se realizaron sobre láminas de cobre pulidas y/o niqueladas. Las placas de 10×50mm2 se introdujeron en los electrólitos respectivos, durante 2min, controlando las densidades de corriente respectivas, utilizando la configuración usual (Lagos y Camus, 2016) para galvanotecnia: fuente de corriente continua-reóstato-amperímetro-electrodos-electrólito-celda electrolítica. Se utilizaron ánodos de acero inoxidable 316.
Para realizar las mediciones de brillo, se utilizó un láser rojo para iluminar las piezas plateadas, recibiendo el reflejo en un luxómetro, que se emplazó con un ángulo de incidencia de 20° sobre la superficie plana de cobre plateada, como se observa en la figura 2.
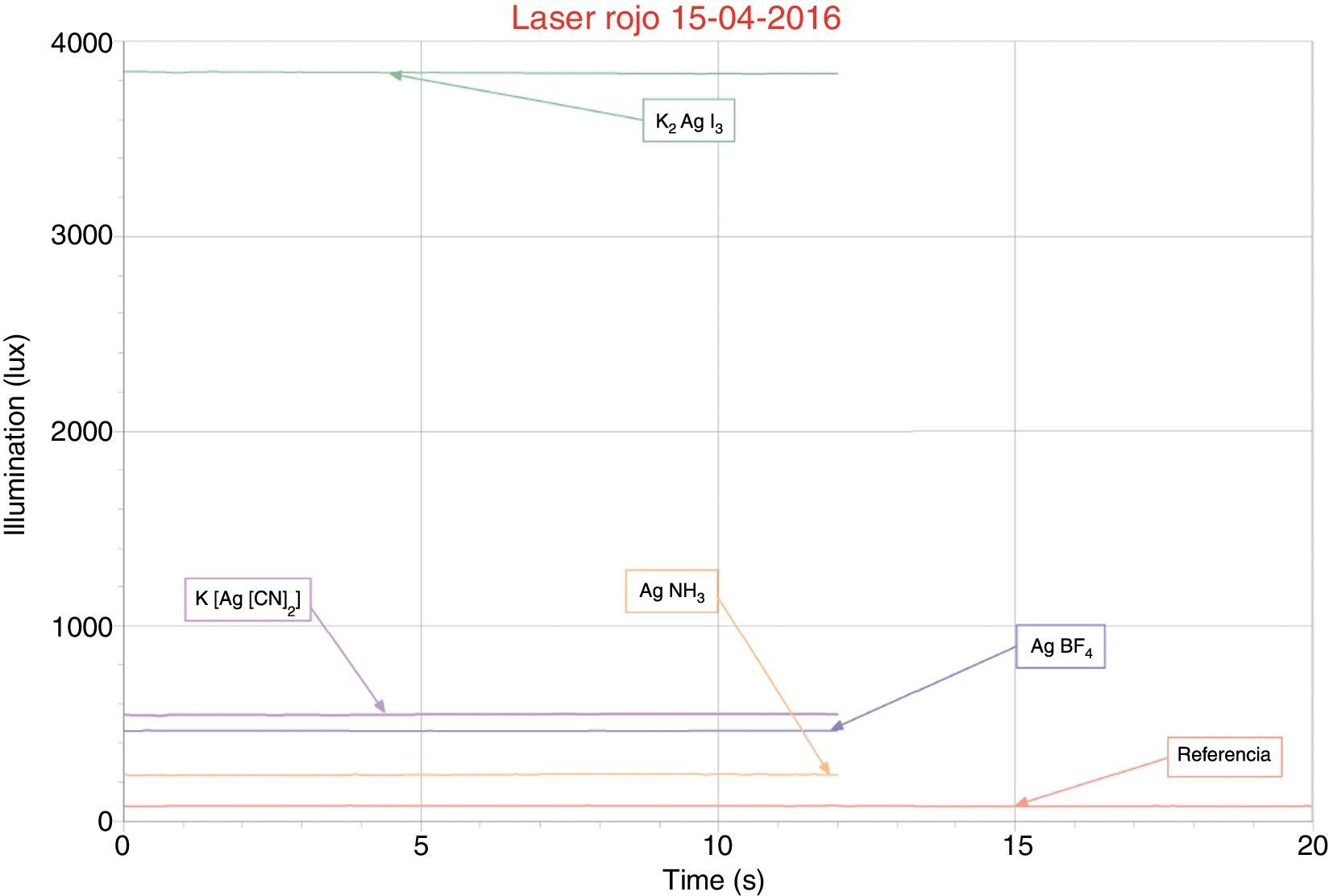
Resultados y discusionesLa especie compleja [Ag(CN)2]− tiene una constante de formación Kf=1.0·1021, en cambio la constante de la especie compleja amoniacal [Ag(NH3)2]+ es 1.5·107; esto indica que el complejo cianurado de plata es varias órdenes de magnitud más estable que el de amoniaco, y a la hora de sufrir disociación bajo los efectos de la corriente eléctrica tendrá más dificultad para hacerlo y se podría esperar que la reducción debería ser más lenta permitiendo la formación de microcristales con mayor facilidad, lo que implicará la formación de una película de metal más brillante que en el caso de platear con la solución amoniacal. Este fenómeno se verificó experimentalmente y cuantitativamente se observó un promedio de 545lux, comparado con el complejo amoniacal que mostró un promedio de 227lux, como se observa en la figura 3, en el caso de la lámina plateada directamente sobre cobre.
El complejo yodado de plata K2[AgI3], de acuerdo con los valores de las constantes de estabilidad, presenta valores intermedios entre los cianurados y amoniacales, por lo que se esperaría que estos electrólitos presentaran brillos intermedios, sin embargo, estos complejos presentan superficies muy brillantes, alcanzando 3,818lux. Cabe señalar que la superficie tuvo que limpiarse antes de someterla a mediciones con el luxómetro.
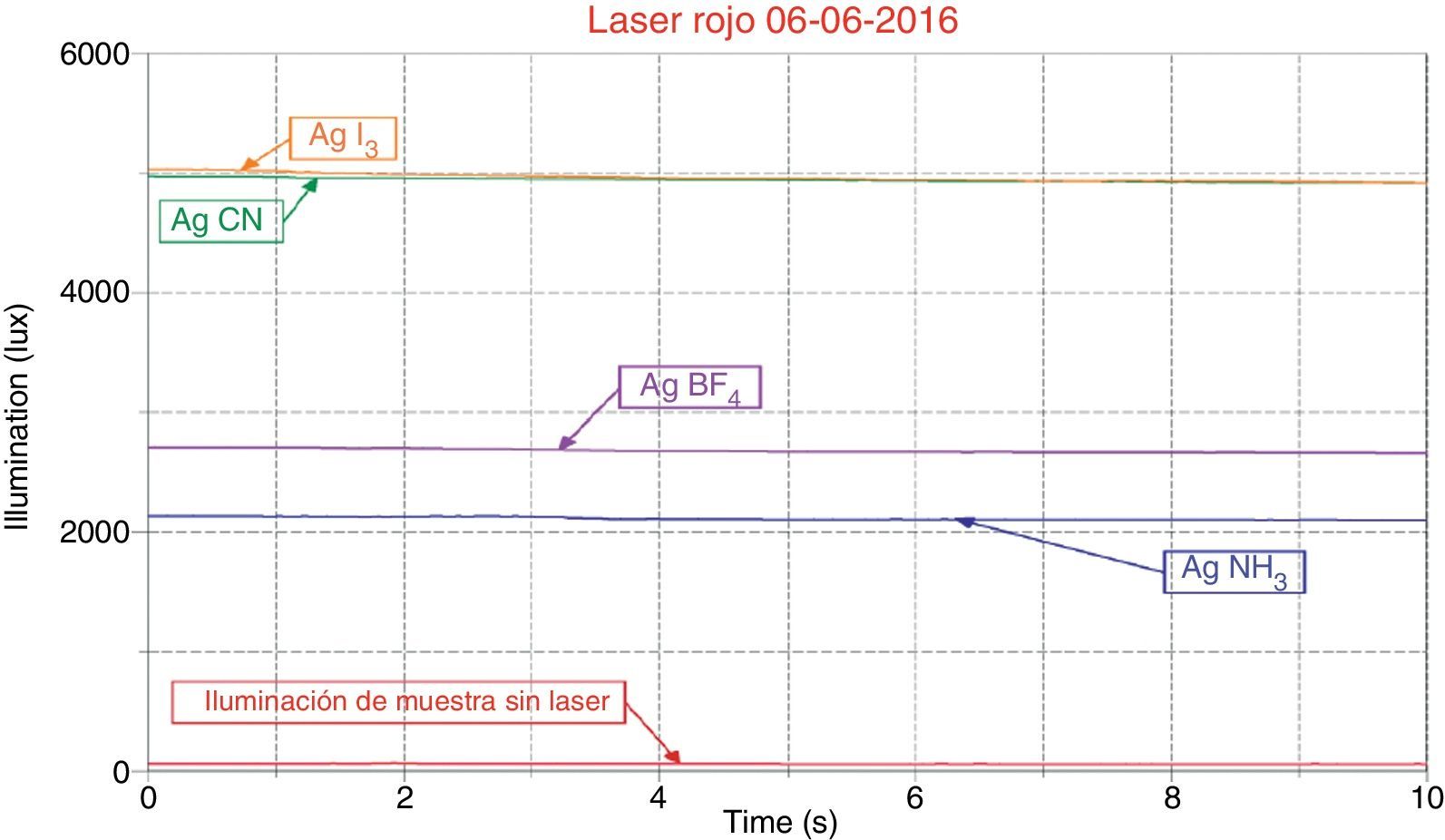
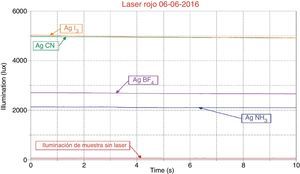
Cuando se electrodeposita la plata sobre el depósito de níquel, el complejo yodado alcanza valores de 5,000lux, cercano al cianurado con promedios de 4,929lux. El depósito de plata utilizando electrólito amoniacal, en estas condiciones, mejoró considerablemente su brillo, alcanzando 2,143lux.
La sal de plata AgBF4 se utiliza para engrosar las películas de plata y no posee un brillo considerable. Este depósito mostró un brillo de 500lux cuando se deposita sobre cobre y 2,643lux sobre níquel. Cabe señalar que al utilizar este electrólito directamente sobre el cobre, la plata se reduce inmediatamente produciendo un depósito negruzco que puede ser retirado mediante un paño seco, antes de realizar las mediciones de brillo.
En el caso de utilizar un brillómetro, la intensidad de la luz reflejada depende del material y del ángulo de iluminación, por ello se definen 3 geometrías para las mediciones: 20° como ángulo de incidencia, para superficies muy brillantes, 60° para superficies semibrillantes y 85° para superficies mate. En nuestro caso, la fuente de luz monocromática nos brindó la oportunidad de usar un ángulo de incidencia de 20°, como se muestra en la figura 2, para realizar todas las mediciones y pudimos graficar los resultados (iluminación vs. tiempo), que se presentan en las figuras 3 y 4.
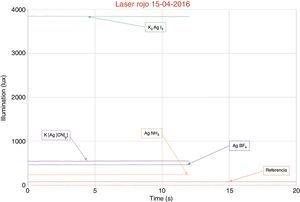
El gráfico de la figura 4 corresponde a mediciones realizadas sobre superficies de níquel plateadas y muestra la intensidad de las 4 muestras bajo luz láser de 150mW y una longitud de onda de 650nm (rojo). La curva roja inferior es la referencia del sensor sin la luz láser; la curva azul corresponde al electrólito que contienen [Ag(NH3)2]+; la curva violeta al electrólito que contiene AgBF4; la curva verde al electrólito que contiene [Ag(CN)2]−, y la curva café al electrólito que contiene K2AgI3.
Los complejos lineales de plata, que contienen ligando de cianuro y amoniaco, son históricamente reconocidos para la producción de excelentes electrólitos de plateado, debido a sus altas estabilidades y a su relativo bajo costo y fácil producción.
De acuerdo con el mapa de síntesis utilizado en este trabajo, se puede establecer que la formación de los diferentes compuestos aptos para platear electrolíticamente es perfectamente viable de ser realizada por artesanos con equipo de laboratorio de bajo costo utilizando como elemento de partida la plata metálica 99.99%, para producir a partir de ella el nitrato de plata, que será, en definitiva, la materia prima para la síntesis de los diferentes compuestos. Las rutas de síntesis representan un interesante desafío para los estudiantes de química y en este caso tienen una importante utilidad práctica, pudiendo terminar los productos en el taller de galvanotecnia de artesanos plateros.
La calidad y el comportamiento de los complejos cianurados y amoniacales son dos variables conocidas en el campo de la joyería porque históricamente han servido para sustituir piezas de plata maciza, es decir, muchas piezas ejecutadas en cobre o sus aleaciones pueden ser recubiertas («bañadas» o «enchapadas») con una película brillante y de alta adherencia, de manera que es imposible reconocerla a menos que se realice un ensayo destructivo para llegar al metal base.
La obtención de un brillo satisfactorio es de vital importancia, porque principalmente las obras de arte de compleja configuración que produce el artesano, no siempre es posible pulirlas y se prefiere la obtención de superficies especulares. Definitivamente, el electrólito de cianuro permite la obtención de las películas de mejor calidad, sin embargo, a raíz de su controversial comportamiento tóxico, se le utiliza con especial prevención. Los electrólitos agotados que contengan cianuros deben ser tratados separadamente, para ser descompuestos antes de depositarlos en sitios seguros.
El complejo yodado de plata es especialmente interesante, obteniéndose un depósito de «plata envejecida», y puede fácilmente competir en brillo y calidad con los electrólitos amoniacales y cianurados, sin embargo, el alto consumo de yoduro de potasio hace económicamente inviable la utilización masiva de este electrólito.
La sal tetrafluoroborato de plata (AgBF4) debe ser utilizada solo cuando se requiera aumentar el grosor de la película de plata. Esta sal permite obtener superficies mate grisáceas de plata.
A pesar de poder distinguir la calidad del brillo visualmente, fue posible cuantificarlo, utilizando un luxómetro, evitando así la adquisición de un brillómetro, equipo que tiene un uso muy restringido. Estas mediciones permitieron observar que el plateado sobre la pieza de cobre niquelado mejora sustancialmente el brillo del plateado resultante, y que con el electrólito yodado se obtienen las superficies más especulares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.