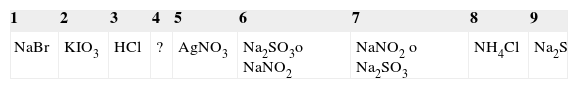El problema de los 9 frascos es un trabajo de laboratorio clásico en cursos básicos de química general e inorgánica. Además de presentársele al alumno como un enigmático rompecabezas, le permite la aplicación de habilidades del pensamiento, ya que en su resolución involucra varios conceptos que se estudian en un curso de estas características, como reacciones ácido-base, producto de solubilidad, hidrólisis de sales, reacciones redox y efecto del pH sobre estas, entre otros, lo que contribuye a la integración de conocimientos adquiridos y experiencias realizadas.
Tanto el programa como la guía para el docente y el alumno se encuentran disponibles, sin cargo, para los lectores interesados.
The 9 bottle problem is a classical lab job in high school and college chemistry.
In solving this chemical “crossword” puzzle, students will be forced to integrate the knowledge acquired on a great variety of items such as solubility and colors of common inorganic precipitates, the possible evolution of gases, acid-base properties of salts, formation of metal-ion complexes, acid-base reactions, and oxidation-reduction reactions, including the influence of pH on them.
A free copy of the program and the teacher guide, in Spanish, are available from the authors upon request.
El problema de los 9 frascos es un trabajo de laboratorio clásico utilizado en muchas escuelas y universidades desde su publicación, hace más de 70 años (MacWood y col., 1940). Durante este lapso se ha utilizado como un trabajo práctico que permite que el alumno utilice las herramientas del pensamiento lógico e integre un amplio conjunto de conocimientos adquiridos en las primeras etapas de sus estudios de licenciatura.
Desde su primera aparición se publicaron diversas variantes, cambiando los reactivos, el número de frascos y otros elementos, pero siempre con un enfoque de enigmático rompecabezas para despertar el interés del alumno (Furlong y col., 2009; Olander, 1996; Ryan y Strothkamp, 1993; Ifft y Roberts, 1975; Zuehlke, 1966). Además de la motivación anterior, al alumno se le presentan varios desafíos, a saber: 1) observación crítica; 2) recolección y organización de datos; 3) enunciado de hipótesis; 4) diseño experimental para corroboración de hipótesis; 5) extracción de conclusiones, y 6) comunicación adecuada con pares y docentes. Este procedimiento se encuadra en un formato de investigación guiada/abierta que en el aprendizaje de la química ha demostrado ser más eficiente que los formatos tradicionales de comprobación (Pavelich y Abraham, 1979). El alumno, con la orientación del docente, construye su propio conocimiento. Algunos de estos procesos fueron enumerados por Murray (2012). Todas las modificaciones al trabajo original reportadas en la literatura están destinadas a actividades en laboratorio, por lo que, según nuestro conocimiento, esta es la primera propuesta de actividad simulada en computadora.
En el marco de nuestro proyecto de elaboración de simulaciones de actividades prácticas complementarias a las actividades de laboratorio (Baggio, 2009), hemos desarrollado la simulación del problema de los 9 frascos siguiendo los lineamientos del trabajo original (MacWood y col., 1940).
El potencial de las simulaciones radica en la posibilidad de realizar un número de determinaciones elevado en tiempos breves, por lo que el alumno ejercita sus habilidades para la resolución de situaciones problemáticas. Estas permiten, además, fundamentalmente, salvar todos los riesgos personales y ambientales, como así también el posible faltante de material y/o reactivos, quizás muy costosos para algunas instituciones, cambiando prácticas tradicionales por otras que se encuadran dentro de los que se conoce como “química verde”.
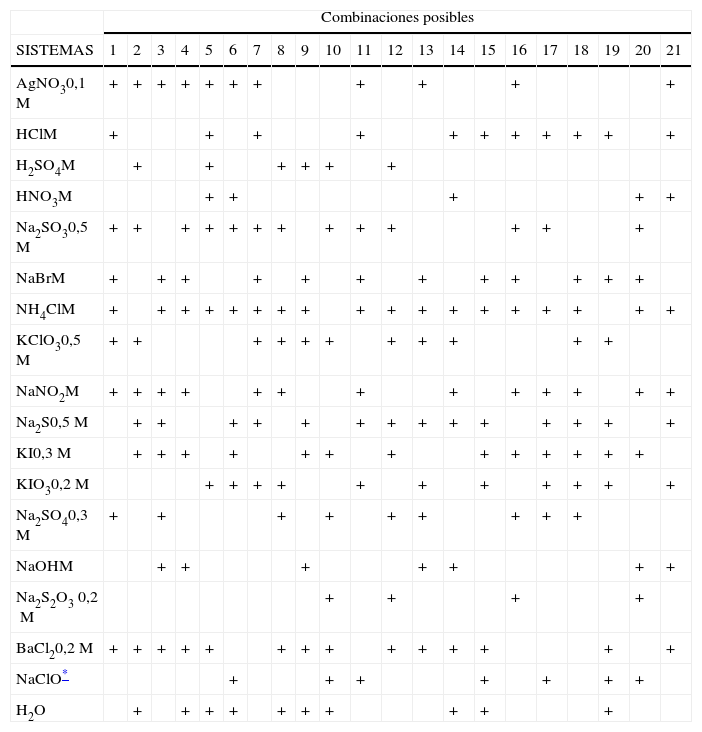
Para el desarrollo del problema se dispone de 18 frascos que contienen 17 disoluciones acuosas y agua. Con esos 18 frascos se arman 21 combinaciones1 de 9 frascos cada una (tabla 1), siguiendo los criterios que se enumeran en el apartado “Metodología”. Al alumno se le asigna una determinada combinación y se le dice cuáles son los sistemas contenidos en cada uno de los 9 frascos (disoluciones y quizás agua), pero estos no están identificados. A través de experiencias como las que se describen en el apartado “Desarrollo”, el alumno debe decir qué sistema contiene cada uno de los 9 frascos.
Las 21 combinaciones de 9 frascos para el trabajo simulado
| Combinaciones posibles | |||||||||||||||||||||
| SISTEMAS | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| AgNO30,1M | + | + | + | + | + | + | + | + | + | + | + | ||||||||||
| HClM | + | + | + | + | + | + | + | + | + | + | + | ||||||||||
| H2SO4M | + | + | + | + | + | + | |||||||||||||||
| HNO3M | + | + | + | + | + | ||||||||||||||||
| Na2SO30,5M | + | + | + | + | + | + | + | + | + | + | + | + | + | ||||||||
| NaBrM | + | + | + | + | + | + | + | + | + | + | + | + | |||||||||
| NH4ClM | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |||
| KClO30,5M | + | + | + | + | + | + | + | + | + | + | + | ||||||||||
| NaNO2M | + | + | + | + | + | + | + | + | + | + | + | + | + | ||||||||
| Na2S0,5M | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |||||||
| KI0,3M | + | + | + | + | + | + | + | + | + | + | + | + | + | ||||||||
| KIO30,2M | + | + | + | + | + | + | + | + | + | + | + | ||||||||||
| Na2SO40,3M | + | + | + | + | + | + | + | + | + | ||||||||||||
| NaOHM | + | + | + | + | + | + | + | ||||||||||||||
| Na2S2O3 0,2M | + | + | + | + | |||||||||||||||||
| BaCl20,2M | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |||||||
| NaClO* | + | + | + | + | + | + | + | ||||||||||||||
| H2O | + | + | + | + | + | + | + | + | + | + | |||||||||||
La elección de los sistemas en el trabajo original se realizó, según los autores, de manera que fueran incoloros a la vez que en el conjunto hubiese: a) compuestos con aniones comunes; b) sales que se hidrolizan; c) agentes oxidantes y reductores, y d) agentes precipitantes. Con esta elección de compuestos se ejercita e integra un gran número de conceptos de la química general, además de lo que significa el aprendizaje de los aspectos descriptivos de la química inorgánica. Así, el alumno debe basarse en sus conocimientos de equilibrios de solubilidad, reacciones ácido-base, hidrólisis de sales, reacciones redox, efecto del pH sobre estas y otros conceptos que contribuyen a la integración en un curso de química general e inorgánica. Por ello, se presenta como muy adecuado para un trabajo de cierre del curso.
Invariablemente, la realización en laboratorio tanto de la propuesta original como de las diferentes alternativas, implica el uso de metales pesados y medios ácidos y básicos fuertes. En muchos casos, los residuos se eliminan directamente a través de los drenajes comunes, sin la necesaria atención a los aspectos de la contaminación ambiental (Olander, 1996) y seguridad personal. Debido a las regulaciones más severas para descartar residuos, muchos docentes se han visto desalentados de continuar con este tipo de experimentación al no disponer de los recursos adecuados para el cumplimiento de las normas de seguridad e higiene vigentes. La utilización de únicamente compuestos relativamente inocuos reduce de forma considerable los riesgos, pero a la vez reduce el potencial académico de la experiencia.
DesarrolloEn el trabajo de laboratorio el alumno conoce cuáles son los 9 sistemas que ha recibido pero no sabe en qué frasco está cada uno. A la vez, dispone de los 9 sistemas rotulados para realizar experiencias extras que lo ayuden a extraer conclusiones en el trabajo con su combinación de frascos. Mezclando sistemáticamente los sistemas por pares y registrando de forma ordenada sus observaciones, el alumno podrá comenzar a resolver su problema. En algunos casos, en que los resultados son negativos o no son suficientes para el propósito de la experiencia, en las etapas finales es necesario agregar un tercer sistema a alguna de las mezclas ya realizadas. Esto ocurre en particular cuando se ha identificado algún ácido o el hidróxido de sodio y existe la posibilidad de que se produzcan reacciones redox sensibles al pH.
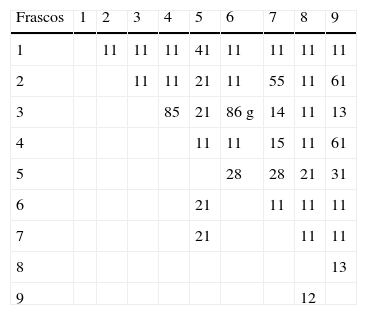
Para registrar los resultados en la etapa exploratoria, es conveniente disponer de una matriz como la que se muestra en la tabla 2; en este caso ejemplificada para la combinación número 9. La convención para mezclar los sistemas es agregar primero el de las correspondientes “fila” y luego el de la “columna”.
Los elementos de matriz (i,j) y (j,i) representan la mezcla de los mismos sistemas, pero agregados en diferente orden. Esto debe ser así porque en algunos casos la inversión del orden de agregado produce reacciones diferentes.
En las simulaciones, en un primer paso, se mezclan volúmenes iguales de cada disolución, agregando el segundo reactivo sobre el primero gota a gota. En un segundo paso, se agrega el exceso del segundo reactivo, en previsión de una posible reacción posterior, en un volumen igual al agregado en el paso 1.
Antes del desarrollo de la simulación, en el laboratorio se verificó que todas las mezclas de dos sistemas dieran los resultados esperados, como por ejemplo la formación de precipitado, la aparición de color, el desprendimiento de gases, la producción de un olor característico (NH3, H2S, SO2, halógenos [Cl2, Br2, I2], vapores nitrosos [NO, NO2, N2O4]) o la liberación de energía en forma de calor. También se repitieron las mezclas invirtiendo el orden de agregado de los reactivos. Es importante añadir siempre los reactivos a aproximadamente la misma velocidad (así lo hace el programa de simulación), para que los productos sean los mismos en cualquier etapa del trabajo, ya que para algunas reacciones los resultados son diferentes si la velocidad cambia. Esto se hace visible en el caso de la reacción entre el ion plata y el ion tiosulfato. En efecto, cuando en un tubo que contiene 15 gotas de disolución de AgNO3 se agregan, gota a gota, 15 gotas de disolución de Na2S2O3, se produce un precipitado blanco que luego vira al amarillo y finalmente a un marrón muy oscuro, quedando la disolución de color pardo. Un agregado de exceso de tiosulfato de sodio no produce cambios significativos en el sistema. En cambio, si a la misma cantidad de solución de nitrato de plata se le agrega rápidamente un exceso de Na2S2O3, la mezcla permanece incolora por la formación del complejo Ag(S2O3)23− antes de que se descomponga el tiosulfato de plata. En el material para el docente se incluye una planilla que resume los resultados experimentales obtenidos.
SimulaciónEl programa de simulación elige al azar entre las 21 combinaciones propuestas y luego, también al azar, una de las posibles distribuciones de los 9 frascos dentro de la combinación seleccionada. Esto hace que puedan generarse 21×9!=7.620.480 situaciones diferentes (el símbolo 9! representa la operación 1×2×3×…×8×9).
Como es posible que el alumno no conozca los resultados de todas las reacciones que se pueden producir combinando los sistemas de 2 en 2, el programa ofrece, como en el trabajo de laboratorio, la posibilidad de experimentar previamente con las disoluciones rotuladas. De esta manera se adquiere la información necesaria para proceder en la etapa de resolución del problema propiamente dicho.
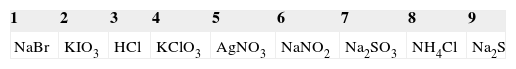
En la figura 1, tomando como ejemplo el caso de la combinación 7, se muestran los botones con el rótulo de los compuestos involucrados. En cada botón aparece el número de orden, del 1 al 9, número que no tiene ninguna relación con los que identifican las disoluciones en la tabla 1.
En la figura 2, se presenta el ejemplo de la selección de la disolución 8 (Na2S) en primer lugar y la 2 (HCl) en segundo lugar.
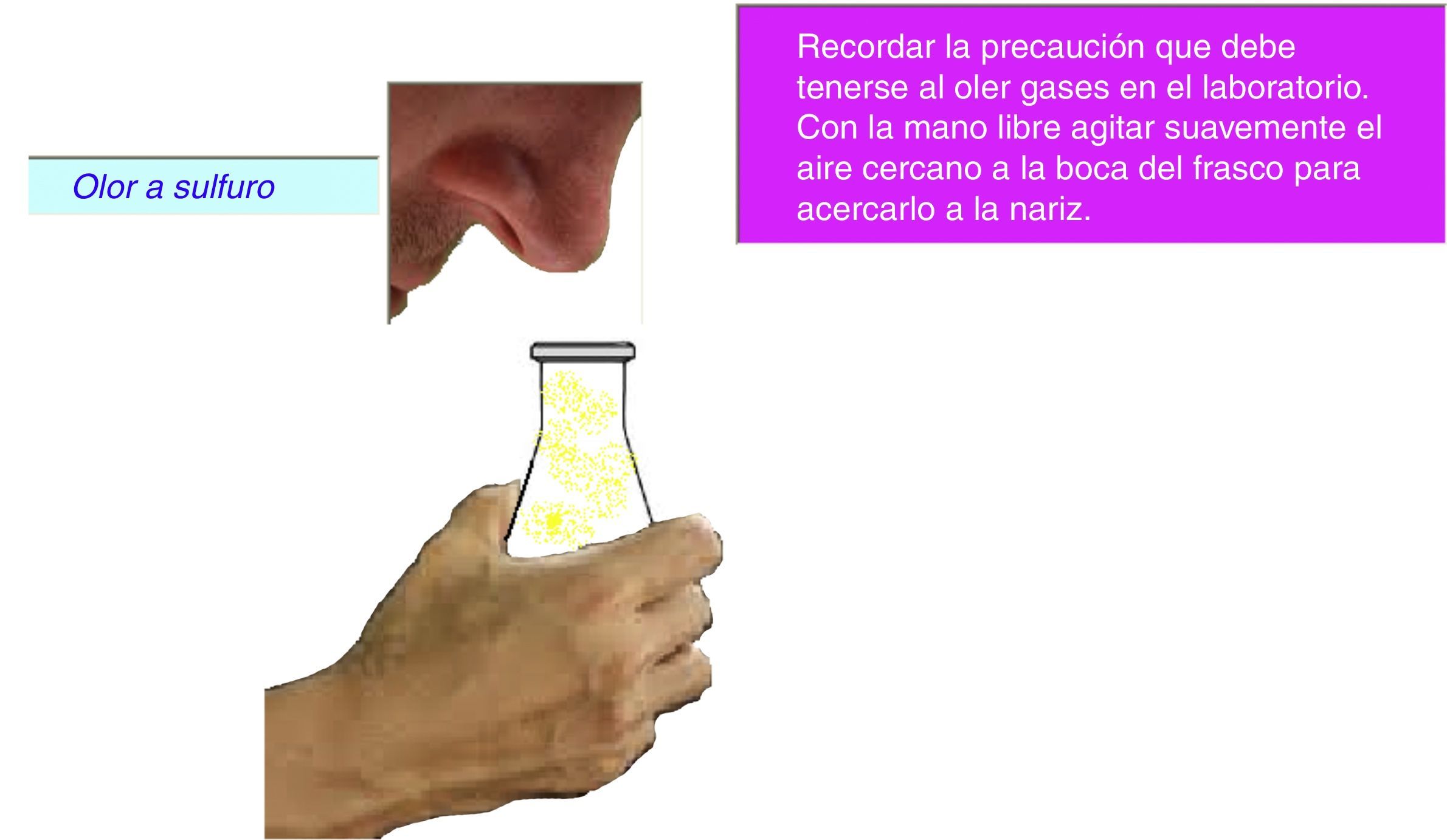
Al pulsar “Agregar 2” se descarga gota a gota el contenido del gotero y luego se habilita el botón “Agregar más 2” y, al pulsarlo, se agrega un exceso de HCl. Se observan algunas burbujas en la disolución resultante y cuando se pulsa el botón “Olor - Cambio térmico”, la detección del olor característico del H2S se pone de manifiesto a través de un cartel (fig. 3), ya que no podemos simular la detección de un olor con la computadora.
En este caso, el tenue punteado amarillo claro en la parte superior del frasco representa el gas que se libera. En otro cartel, se alerta al alumno de que, cuando realiza estos experimentos en el laboratorio, no debe colocar la nariz directamente sobre la salida del recipiente sino mover el gas con su mano libre en dirección a su nariz.
Si se selecciona el frasco 1, se está colocando AgNO3 en el Erlenmeyer, mientras que seleccionando el frasco 4 habrá NaBr en el gotero. La mezcla de las disoluciones produce el precipitado de AgBr (amarillo), que luego de decantar presenta el aspecto que se muestra en la figura 4. En todos los casos la propiedad “incoloro” se representa por el color celeste (como el líquido contenido en el gotero; fig. 4), ya que es necesario diferenciarlo del blanco del monitor. Como se ve en la misma figura, este color es distinto al del sobrenadante del Erlenmeyer.
Las imágenes que muestra el programa deben considerarse como “fotografías instantáneas” distribuidas en el tiempo, mientras el sistema evoluciona. Algunos ejemplos: 1) cuando un sólido está precipitando observamos 3 o 4 imágenes que lo muestran mientras se compacta en el fondo del frasco; 2) cuando se desprenden gases, estos aparecen como un punteado estático de color amarillo claro si se trata de gases incoloros o muy ligeramente coloreados y de color marrón cuando se trata de vapores nitrosos.
Realizando todas las combinaciones posibles, de 2 en 2, se puede completar un cuadro como el que se presenta en la Tabla 2. Si bien el alumno puede registrar la información de la manera que le resulte más cómoda, sugerimos utilizar la siguiente clave de 2 caracteres, o 3 en caso de liberarse un gas, que es la que usa internamente el programa:
Primera ubicación (precipitado y/o color): 1: nada, 2: precipitado blanco, 3: precipitado marrón-negro, 4: precipitado amarillo, sobrenadante blanco lechoso, 5: color violeta, 6: blanco lechoso, 7: color pardo rojizo, 8: color amarillo claro, 9: precipitado pardo lechoso, –1: precipitado blanco → amarillo → marrón negro, –2: precipitado negro → blanco, –3 precipitado blanco → amarillo, –4: ppdo. blanco → amarillo → marrón negro (sólo en exceso de reactivo 2), –5: precipitado blanco (solo en exceso de reactivo 2), –7: humos blancos (gris en imagen), depósito blanco en paredes, –9: precipitado amarillo (con sobrenadante más claro que en 4).
Segunda ubicación (gases y/u olor; redisolución; cambio de temperatura): 1: nada, 2: olor a NH3, 3: olor a H2S, 4: olor a SO2, 5: olor a halógeno, 6: olor a vapores nitrosos, 8: se redisuelve, 9: liberación de energía en forma de calor.
Tercera ubicación: la letra “g” al final del código numérico indica liberación de gases.
En el caso de la precipitación anterior, de AgBr, el código es 41. Para una redox que libera Br2, el código es 75, mientras que la reacción entre el Na2S y el H2SO4 se representa por el código 63g. La reacción entre el AgNO3 y el Na2SO3 tendrá dos códigos diferentes, dependiendo del orden de agregado: 28 si se mezclan en el orden aquí enumerado y 21 si primero se agrega el sulfito.
Es importante que el alumno observe el aspecto del sobrenadante cuando se produce una precipitación, ya que puede ser determinante en el momento de diferenciar reacciones cuando los colores de los precipitados son parecidos, como en el caso del AgBr y el AgI. En la precipitación del AgBr el sobrenadante queda ligeramente blancuzco mientras que en la precipitación del AgI es blanco lechoso. Esto se puede apreciar en la figura 5, donde se muestran los resultados de las reacciones realizadas en el laboratorio. Tubos 1 y 3, AgBr; tubos 2 y 4, AgI. En 1 y 3 se agregó el anión sobre el catión y en 2 y 4, a la inversa.
En la tabla 3 se muestran los resultados de las reacciones que se producen mezclando de 2 en 2 las disoluciones de la combinación 7, cuya distribución en los frascos no conocemos, ya que se han generado al azar por el programa en una de sus corridas.
El triángulo superior se completa cuando seleccionamos un reactivo en la fila (primer reactivo), le agregamos el de la columna (segundo reactivo) y luego exceso de este último. En el triángulo inferior se registran las mezclas invirtiendo el orden de agregado de los reactivos y solo figuran los 3 casos en los cuales los resultados son diferentes a los de la respectiva celda del triángulo superior.
Se puede llegar a la resolución del problema por diferentes caminos de razonamiento e inferencias. Aquí se expone un ejemplo.
Ya que el ion plata produce precipitados con varios de los aniones presentes, trataremos de identificar primero el frasco en que se encuentra.
Ingresando a las reacciones del frasco 5 por la columna y por la fila del mismo, se observa que, con diferentes órdenes de agregado, forma precipitado con 7 de los reactivos (frascos 1, 2, 3, 6, 7, 8, 9), lo que sugiere que se trata de la disolución de AgNO3. Los colores de los precipitados y algunas características de las reacciones permiten sospechar que el frasco 1 contiene NaBr, y el 6 y el 7 Na2SO3 o NaNO2 (los precipitados se redisuelven en exceso del segundo reactivo, pero cuando la mezcla se hace en orden inverso el precipitado se produce recién cuando se hace el agregado de exceso de ion plata) y el 9 contiene Na2S. Las disoluciones 2, 3 y 8 dan precipitados blancos y, de acuerdo con los reactivos presentes, entre ellos deberían contener los iones cloruro y yodato.
El sulfuro de sodio (frasco 9) libera H2S con 3 y con 8. Los únicos que pueden producir esta reacción son el HCl y el NH4Cl (en exceso), ya que este ultimo, en su hidrólisis, produce un medio ácido. La combinación 8-9 produce un resultado distinto en exceso que el 9 (medio ligeramente alcalino por la hidrólisis del sulfuro), y permite detectar un ligero olor amoniacal, enmascarado en parte por el olor característico del sulfuro. Esto casi nos confirma que el 3 es HCl y el 8 es NH4Cl. Quedaría para asignar al 2 el yodato de potasio por el precipitado blanco que se forma al reaccionar con el nitrato de plata. Hasta ahora tenemos:
Falta asignar los contenidos de los frascos 4, 6 y 7, y las sustancias aún no identificadas son KClO3, Na2SO3 y NaNO2. Los últimos 2 se diferencian por su reacción con el 3. En efecto, la liberación de vapores nitrosos en la reacción de los sistemas 3 (HCl) y 6 indica la presencia del ion nitrito (nitrito de sodio) en este último, y la liberación de SO2 gaseoso en la reacción de los sistemas 3 y 7 identifica a este como la disolución de sulfito de sodio. La asignación de la disolución de clorato de potasio al frasco 4 se hace por descarte, pero se confirma por la reacción con el 3, que libera cloro por un proceso redox.
Finalmente el problema resuelto es:
Cuando el alumno supone que ha resuelto el problema, introduce el número de frasco donde considera que se encuentra cada sistema en los casilleros que se muestran en la figura 6. En este caso, y completando de arriba abajo, los números son: 5, 3, 7, 1, 8, 4, 6, 9, 2.
El programa responde si los resultados son correctos o no. En caso de que haya algún error, se puede volver atrás para rectificar los resultados correspondientes.
En la última pantalla que muestra el programa, donde se debe dar la respuesta al problema, existe un comando llamado “Docente”, que funciona con una clave y puede ser utilizado por el profesor. A través de este puede obtenerse la respuesta al problema planteado en caso de que se considere necesario.
A fin de lograr un mejor aprovechamiento de la actividad, es conveniente solicitar al alumno que escriba una ecuación química balanceada para cada una de las reacciones que se producen, así como su justificación, mediante información tabulada, como potenciales normales de reducción, solubilidades y producto de solubilidad, fuerza de ácidos, constantes de hidrólisis y cualquier otro dato que pueda resultar de utilidad.
Una versión simplificada del programa se presentó a docentes y alumnos avanzados de profesorado en 3 cursos recientes dictados por uno de los autores (Baggio, 2014), y recibió una acogida favorable por parte de los participantes. El programa aún no se ha utilizado por los autores con alumnos de grado.
ConclusionesSe presenta un programa de simulación en computadora del clásico de laboratorio “El problema de los 9 frascos”, que permite a los docentes interesados realizar una actividad relevante para los alumnos de los cursos básicos de química, ya que en el proceso de resolución estos deben utilizar al máximo sus habilidades intelectuales.
Por los conceptos involucrados, este progarma es muy adecuado para realizar una integración de los conocimientos adquiridos en un curso básico de química general e inorgánica. Las simulaciones son un buen complemento de las actividades de laboratorio y, en ciertos casos, las reemplazan con ventajas, cuando la actividad práctica genera residuos no siempre fácilmente descartables y/o cuando no se dispone de los materiales o reactivos necesarios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
En el trabajo original se citan 22 combinaciones de frascos, pero las combinaciones 11 y 19 son iguales, por lo que en este trabajo eliminamos la última y numeramos las combinaciones 20, 21 y 22 como 19, 20 y 21 respectivamente.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.