On a practical point of view, more important than the speed of chemical reactions — traditionally studied in chemical kinetics — is the speed of the processes that includes, besides the chemical reaction, other conditions as the rate of diffusion of reactants to the reaction site. In this work, we explore the simple process of burning a candle in two different environments, and we obtain the kinetics of it. We also assess the influence of the size of the candle on the speed equation. The investigative character helps the understanding of the fundamentals of chemical kinetics and the factors that affect chemical reactions
Desde el punto de vista práctico, de mayor importancia que la velocidad de las reacciones químicas —estudiadas tradicionalmente por la cinética química— es la velocidad de otros procesos más allá de la reacción química en sí, como lo es la difusión de los reactivos hacia el sitio de reacción. En este trabajo exploramos el proceso simple de quema de una vela en dos ambientes distintos y obtenemos la cinética del mismo. También se evalúa la influencia del tamaño de la vela sobre la ecuación de velocidad. El carácter de la investigación auxilia en la comprensión de los fundamentos de la cinética y de los factores que afectan la rapidez de las reacciones químicas.
Do ponto de vista prático, mais importante que a velocidade das reações químicas, tradicionalmente estudadas na cinética química, é a velocidade dos processos que incluem além da reação química outras condições como a velocidade de difusão dos reagentes até o locus de reação. Neste trabalho, exploramos o processo simples de queima de uma vela em dois ambientes distintos e levantamos a cinética do mesmo. Também se avaliou a influência do tamanho da vela sobre a equação de velocidade. O caráter investigativo auxilia a compreensão dos fundamentos da cinética química e dos fatores que afetam as reações químicas.
A química estrutura-se como um conhecimento que se estabelece mediante relações complexas e dinâmicas envolvendo um tripé bastante específico, em seus três eixos constitutivos fundamentais: as transformações químicas, os materiais e suas propriedades, e os modelos. Esses objetos do ensino de química podem ser ensinados buscando o entrelaçamento entre conteúdos abordados e atividades experimentais, facilitando assim a aprendizagem do aluno (Orientações Curriculares para o Ensino Médio, 2006). Várias ideias surgem a cada dia de como se trabalhar de forma dinâmica os conteúdos abordados na sala de aula.
Fatareli e colaboradores (2010) mostram a importância de se trabalhar em grupo, relatando uma estratégia didática aplicada em uma aula de cinética química, baseada nos preceitos da aprendizagem cooperativa, em especial no método Jigsaw, para assim verificar as contribuições para o melhor entendimento dos conceitos e a aceitação por parte dos alunos. Uma característica dessa aprendizagem é a sua natureza social, pois os estudantes interagem e compartilham suas ideias, melhorando sua compreensão individual e mútua, com a oportunidade de ensinar e aprender uns com os outros, conduzindo e explicando os experimentos para os colegas, numa atmosfera de companheirismo, descontração e interação. A experimentação no Ensino de Química aliada aos conteúdos abordados, desperta o interesse dos alunos em seus diversos níveis de escolaridade, devido ao seu caráter motivador (Giordan,1999; Ferreira, Hartwig e Oliveira, 2010).
O ensino de química muitas vezes se resume a cálculos matemáticos, fórmulas e nomenclaturas. A ausência da prática aliada à teoria, além de tornar tímida a participação do aluno no processo de aprendizagem, dificulta a conexão de saberes. As reações de combustão, embora presentes na nossa vida, são pouco compreendidas em seus aspectos químicos (Andersson, 1983). Dentre algumas das dificuldades de compreensão desse fenômeno, destaca-se o não reconhecimento do oxigênio como um dos reagentes e o entendimento equivocado da combustão como uma característica intrínseca de uma substância, não como uma reação entre um combustível e um comburente (Galiazzi, et al., 2005). A contextualização é mediador entre teoria e prática no ensino de química, por exemplo, Lima e colaboradores (2000) sugerem alternativas dinâmicas para a construção do conceito de cinética química, através do experimento sobre conservação de alimentos que associados aos conhecimentos prévios dos alunos, visam estabelecer uma relação entre o experimento e o conceito.
A realização de experimentos ajuda aproximar a química vista na sala de aula do cotidiano do aluno, tornado assim as aulas mais atrativas e interativas. As atividades experimentais são capazes de proporcionar um melhor conhecimento ao aluno (SBQ, 2010). Busca-se cada vez mais um ensino contextualizado, familiarizando os conhecimentos do dia a dia do aluno com o que é visto na escola em sala de aula. O saber popular pode ser analisado à luz do conhecimento científico durante aulas de química. A ligação entre ciência e saberes populares é efetiva no que se refere ao processo de ensino-aprendizagem (Leal e Moita Neto, 2013).
No presente trabalho exploramos os fundamentos da cinética química através de um sistema que faz parte do cotidiano de nossos alunos, despertando-os para os condicionantes dos resultados pela aplicação de modelos matemáticos a descrição destes processos químicos e avaliando assim a suas consequências, estimulando o caráter investigativo próprio do saber químico. A queima da vela é um processo químico constantemente revisitado pelo grande potencial didático (contexto, cotidiano, interdisciplinaridade) que têm de auxiliar na compreensão dos diversos aspectos envolvidos (Swain, 1999; Krnel e Glazar, 2001; MacNeil e Volaric, 2003; Schmidkunz, 2004; Galiazzi, et al., 2005; Xiong, et al., 2011; Liu, 2012).
MetodologiaNa realização deste experimento as velas utilizadas para análise são da marca Luz da Vida de nº 1 (11 g; r = 2cm) e nº 3 (17 g; r = 2cm). Com a ajuda de uma régua plástica escolar de 20cm, a altura das velas foram medidas. Nesta medida não foi considerada a parte superior da vela (formato cônico). Em seguida com a ajuda de um cronômetro a cada 2 minutos durante a queima, a altura da vela foi monitorada, até o tempo de uma hora. O processo de combustão da vela foi executado em um ambiente fechado (a. f.), em um laboratório do departamento de Química da UFPI (temperatura ambiente = 25 °C; umidade = 52 %), e em um ambiente aberto (a. a.), em um espaço ao ar livre também na UFPI (temperatura ambiente = 30 °C; umidade = 65 %).
Os fatores que influenciam na combustão, podem ser verificados através dos resultados obtidos, além dos conceitos de cinética química, como: velocidade de reação e fatores que influenciam em uma reação química.
Os experimentos foram realizados numa turma de 20 alunos divididos em 4 equipes. Cada equipe realizou um experimento em ambiente aberto e outro no ambiente fechado. Os resultados encontrados foram comparados posteriormente, através do Teste t, por 2 alunos do próprio curso que colaboraram na co-autoria deste trabalho. A aferição da compreensão teórico-prático foi feita através dos relatórios entregues por cada equipe.
Resultados e discussãoUma breve explicação do experimento aos alunos envolvidos, curso de Cinética Química (Graduação em Licenciatura Plena em Química), foi feita em sala de aula durante a exposição do assunto métodos de cálculos de velocidade de reação.
Para que as substâncias possam reagir é necessário que haja condições ambientais favoráveis. Três elementos concorrem para a combustão da vela: ignição (acender a vela), combustível (própria vela: parafina) e comburente (oxigênio do ar).
Em todo o processo que envolve uma transformação química subjazem dois outros mecanismos que determinam a sua cinética. A cinética química em si, que corresponde as reações químicas que se processam e o mecanismo difusivo dos reagentes que devem se encontrar para que ocorra a reação.
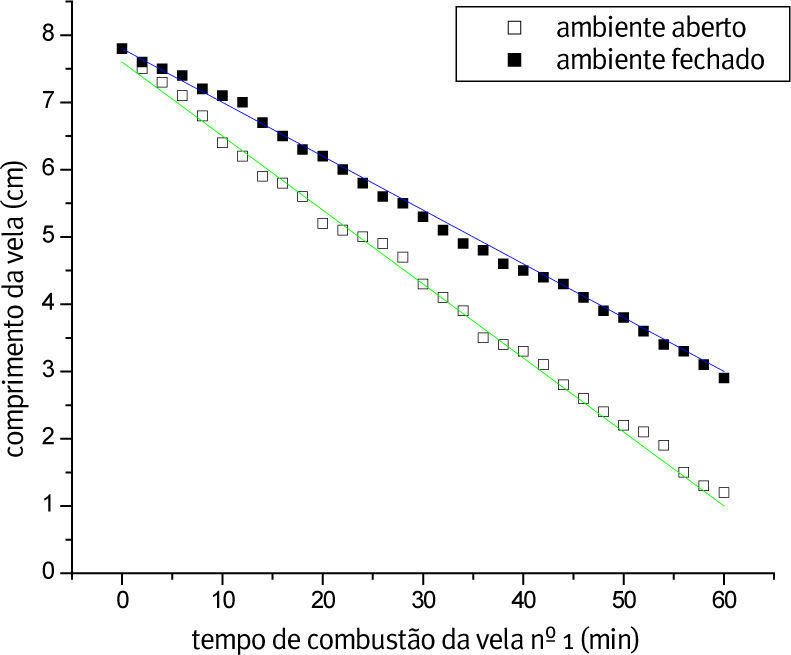
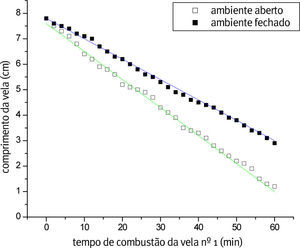
A Figura 1 mostra o gráfico da combustão da vela nº 1, na qual apresenta o tempo de consumo em ambiente aberto e fechado, e a regressão linear para ambos os ambientes. Pode-se observar uma variação na velocidade, pois em ambiente aberto há uma remoção facilitada dos produtos de reação (CO2 e H2O) da proximidade da vela repondo-se facilmente o oxigênio consumido.
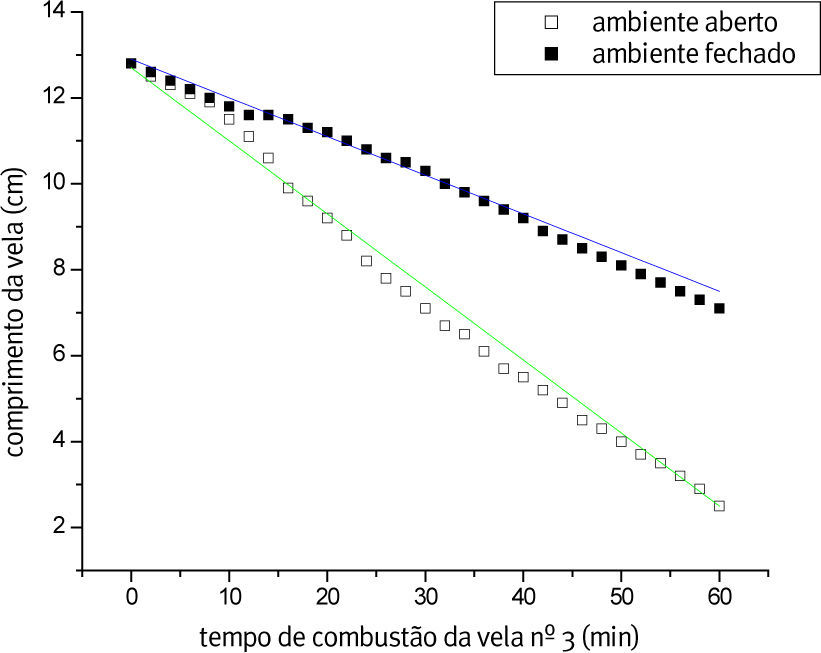
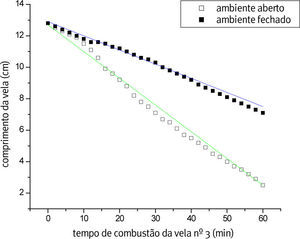
A Figura 2 apresenta o gráfico que representa o processo de combustão em ambiente aberto e fechado, e a regressão linear de ambos os ambientes, para a vela nº 3. As velocidades confirmam a facilidade maior do oxigênio circular a vela em ambiente aberto influenciando a velocidade da queima das velas de diferentes tamanhos.
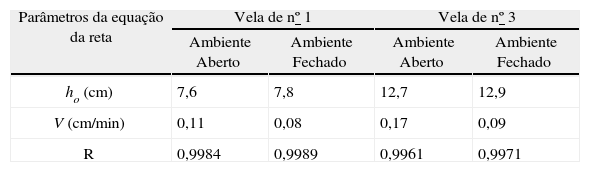
A Tabela 1 mostra os dados obtidos através do ajuste linear em ambiente aberto (a. a.) e fechado (a. f.). Lembrando que a regressão linear é representada pela equação da reta (y = a + b·x), sendo substituído no presente trabalho pelas variáveis (h = h0 + v·t), onde h é altura, h0é a altura inicial, v é a velocidade média da reação e t é o tempo. No nosso caso, a velocidade do processo está sendo acompanhada pela taxa de decréscimo da vela com o tempo.
Parâmetros obtidos da regressão linear para as velas (nº 1 e nº 3) em ambiente aberto (a. a.) e fechado (a. f.)
| Parâmetros da equação da reta | Vela de nº 1 | Vela de nº 3 | ||
| Ambiente Aberto | Ambiente Fechado | Ambiente Aberto | Ambiente Fechado | |
| ho (cm) | 7,6 | 7,8 | 12,7 | 12,9 |
| V (cm/min) | 0,11 | 0,08 | 0,17 | 0,09 |
| R | 0,9984 | 0,9989 | 0,9961 | 0,9971 |
Em ambiente sem circulação de ar a difusão do reagente oxigênio até a vela retardou a reação, diminuindo a velocidade do processo. Sendo assim, os dados obtidos (Tabela 1), mostra que a velocidade de queima para ambas as velas (nº 1 e 3) é maior em ambiente aberto.
Em ambas as velas, quando a queima ocorre em ambiente fechado o acesso de oxigênio a vela (velocidade de difusão) é o fator limitante da velocidade do processo isto explica os valores próximos de velocidade de queima (0,08 e 0,09cm/min).
Os ambientes abertos promovem maior velocidade do processo que os ambientes fechados. Na comparação entre os ambientes abertos a maior velocidade ocorre no sistema com mais parafina disponível (vela nº 3).
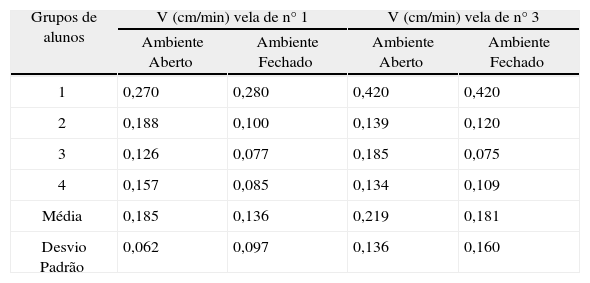
Os relatórios das diversas equipes (resultados compilados na Tabela 2) mostraram qualidade adequada nos dados colhidos e boa compreensão teórica do processo cinético envolvido.
Parâmetros obtidos, por grupos de alunos, da regressão linear para as velas (nº 1 e nº 3) em ambiente aberto (a. a.) e fechado (a. f.)
| Grupos de alunos | V (cm/min) vela de n° 1 | V (cm/min) vela de n° 3 | ||
| Ambiente Aberto | Ambiente Fechado | Ambiente Aberto | Ambiente Fechado | |
| 1 | 0,270 | 0,280 | 0,420 | 0,420 |
| 2 | 0,188 | 0,100 | 0,139 | 0,120 |
| 3 | 0,126 | 0,077 | 0,185 | 0,075 |
| 4 | 0,157 | 0,085 | 0,134 | 0,109 |
| Média | 0,185 | 0,136 | 0,219 | 0,181 |
| Desvio Padrão | 0,062 | 0,097 | 0,136 | 0,160 |
Os valores encontrados pelos co-autores não diferiram significativamente no nível de confiança de 95% dos resultados encontrados pelos diversos grupos para cada um dos ambientes/vela testados. Os altos valores do coeficiente de variação (razão entre o desvio padrão e a média) refletem apenas a inexperiência dos alunos na condução rigorosa dos experimentos.
ConclusãoOs quatro processos químicos estudados foram bem ajustados pelo modelo linear. Nos sistemas fechados, o oxigênio foi o fator limitante da cinética de ambos os processos. Em sistemas abertos, a velocidade foi maior no sistema com mais parafina. Na vela de maior dimensão a velocidade em sistema aberto (0,17cm/min) é cerca de duas vezes maior que no sistema fechado (0,09cm/min).