A series of activities for the teaching of the ionic bond were elaborated based on two theoretical frameworks: modelling-based-teaching and the electrostatic model. In the activities, we tried to establish a relationship between the mechanism through which an ionic bond is formed with energetic issues concerning with the formation of the ionic lattice. In this paper, we present relevant aspects of the teaching strategy and comments about how the discussion of such aspects favoured students’ learning about the ionic bonding. We also discuss recommendations about the teaching of chemical bonding at secondary and university levels.
Se elaboró toda una secuencia de actividades para la enseñanza del enlace iónico con base en dos marcos teóricos: enseñanza con base en modelos y el modelo electrostático. En las actividades tratamos de establecer una relación entre los mecanismos a través de los cuales se forma un enlace iónico con los aspectos energéticos concernientes con la formación de la malla iónica. En este artículo presentamos los aspectos relevantes de la estrategia de enseñanza y comentamos acerca de cómo la discusión de esos aspectos favoreció al aprendizaje del enlace iónico en los estudiantes. También damos recomendaciones sobre la enseñanza del enlace químico en los niveles secundario y universitario.
Algumas pesquisas (por exemplo, Coll and Treagust, 2003; Nahum, et al., 2007) advertem que a forma pela qual o assunto ligação química tem sido abordado no ensino médio tem sido ineficaz quanto aos propósitos educacionais atuais para o ensino de ciências recomendados, por exemplo, por Hodson (1992) e Millar e Osborne (1998).
A discussão insatisfatória dos modelos para ligação química está relacionada, principalmente, a ausência de justificativas para explicar a estabilidade de compostos químicos através das variações energéticas (Mortimer, Mol and Paes, 1994).
Especificamente no caso da ligação iônica, pesquisas (por exemplo, Mortimer et al., 1994; Taber, 2000) têm verificado que os professores geralmente associam a combinação de átomos levando à formação de substâncias à regra do octeto, ao invés de relacionar com o abaixamento de energia potencial do sistema. Nessa visão, a configuração eletrônica dos átomos e os oito elétrons no último nível são fatores determinantes na formação da ligação iônica, que é apresentada como conseqüência de um átomo (metal) doar elétrons para o outro átomo (ametal). Dessa forma, o modelo de ligação iônica fica restrito à idéia de transferência de elétrons (Coll and Treagust, 2003), ou seja, os estudantes passam a ter a noção de que ocorre apenas uma ligação nos compostos iônicos: entre o par de átomos entre os quais ocorreu doação e recepção de elétrons.
O ensino através desse modelo resulta em os estudantes pensarem em pares de íons como moléculas de substância iônica, como constatado por Taber (1994), que identificou o desenvolvimento de um modelo híbrido — no qual características da ligação covalente e interações intermoleculares foram aplicadas à ligação iônica — por estudantes que haviam estudado ligação química. Por isso, esses estudantes não foram capazes de elaborar explicações coerentes para as propriedades dos compostos iônicos.
Para que os alunos possam compreender as estruturas de compostos iônicos e as propriedades de substâncias dessa natureza, um modelo curricular que seja coerente com o modelo científico (eletrostático) deve ser discutido no ensino médio. Entretanto, tem-se observado que quando um modelo curricular baseado no modelo eletrostático é apresentado no ensino de ligação iônica, não são realizadas interpretações das propriedades dos compostos iônicos a partir desse modelo. Em geral, não é realizada a transposição do nível macroscópico para o sub-microscópico através da exploração das propriedades dos compostos para evidenciar elementos específicos do modelo, e nem do nível sub-microscópico para o macroscópico — situações que poderiam levar os alunos a atribuir sentido ao estudo de ligação química.
Modelagem no ensino de ciênciasAtividades voltadas para construção, reformulação e validação de modelos — processo conhecido como modelagem — podem ser uma boa opção na tentativa de atender às exigências contemporâneas para o ensino de ciências, explicitadas, por exemplo, no documento da AAAS (1990). Isso porque elas levam em consideração as idéias prévias dos indivíduos (Clement, 2000), o caráter limitado dos modelos (Morrison and Morgan, 1999) e apresentam caráter investigativo, possibilitando aos alunos o desenvolvimento de várias habilidades de pesquisa (Wellington, 1998). Além disso, vários pesquisadores (por exemplo, Justi and Gilbert, 2002a; Nersessian, 1999) apontam a modelagem como sendo uma das principais práticas do processo de pesquisa científica. Assim, aprender através da modelagem pode contribuir para que os alunos aprendam sobre como o conhecimento científico é produzido — aspecto coerente com um ensino de ciências mais autêntico, isto é, que propicia ao aluno uma visão mais ampla da ciência (Gilbert, 2004).
Entretanto, o campo de estudos envolvendo atividades de modelagem ainda é recente. São encontrados poucos trabalhos na literatura que objetivam a construção do conhecimento científico através de situações em que os alunos são solicitados a construir e reformular modelos visando o entendimento de algum conteúdo específico (por exemplo, Barab, et al., 2000; Maia and Justi, in print; Raghavan and Glaser, 1995). Em todos esses trabalhos os resultados evidenciaram que o ensino por modelagem proporcionou aos alunos um aprendizado significativo dos conteúdos relacionados e uma melhor compreensão sobre modelos.
Os fatos de existirem poucas pesquisas em contextos reais de sala de aula envolvendo modelagem e de esse tipo de ensino proporcionar um aprendizado de ciências mais autêntico acarretam a necessidade do desenvolvimento de mais pesquisas sobre o assunto de forma a contribuir para a melhoria do ensino de ciências.
Questão de pesquisaLevando em consideração os principais problemas do ensino de ligação química, as pesquisas que relatam as principais concepções alternativas dos alunos sobre o assunto, bem como o fato de uma discussão qualitativa do modelo eletrostático ser acessível à compreensão dos alunos do ensino médio, julgamos ser pertinente repensar o ensino de ligação iônica como comumente tem sido abordado nas escolas.
Nesse sentido, optamos pela construção de uma estratégia de ensino para o tema ligação iônica visando a compreensão de aspectos qualitativos do modelo eletrostático por parte dos alunos. A opção por fundamentar o ensino desse tema em modelagem justifica-se pelo fato de ele requerer dos alunos grande capacidade de abstração e visualização, o que pode ser potencializado pelas construções e testes dos modelos, que, por sua vez, podem auxiliar os alunos na explicação das propriedades dos compostos iônicos, devido a simulações mentais do que ocorre com as substâncias iônicas quando são submetidas a diferentes condições (fornecimento de energia, aplicação de força, aplicação de campo elétrico).
Dessa forma, nesse artigo abordaremos a seguinte questão de pesquisa: Como discutir o modelo eletrostático em um ensino fundamentado em modelagem de forma a favorecer o aprendizado significativo de ligação iônica?
Pressupostos teóricosO ensino por modelagemJusti e Gilbert (2002a) desenvolveram uma estrutura esquemática, intitulada Modelo de Modelagem (Figura 1), que apresenta o relacionamento das etapas mais relevantes na elaboração e validação de um modelo.2 Esse diagrama não é a única possibilidade para se conduzir um processo de modelagem, mas é uma proposta bastante coerente, pois foi desenvolvida a partir do estudo de como cientistas elaboram modelos. Suas etapas não seguem, necessariamente, uma seqüência linear, e, como demonstrando no esquema através das setas duplas, tampouco unidirecional.
De acordo com Justi (2006), segundo a proposta expressa nesse diagrama, todo processo de modelagem é empreendido a partir de um propósito, ou seja, inicialmente é necessário definir os objetivos para os quais o modelo será construído. Os propósitos podem ser, por exemplo, a descrição de relações de causa e efeito de um fenômeno ou a previsão do comportamento de um sistema.
Posteriormente, a pessoa envolvida no processo deve ter alguma experiência com o fenômeno a ser modelado (através de observações iniciais diretas ou indiretas, qualitativas ou quantitativas, do alvo modelado ou aquisição de informações já disponíveis — tanto em sua própria estrutura cognitiva quanto em fontes externas, por exemplo, dados relevantes encontrados em um artigo ou livro). Paralelamente, ocorre a seleção da fonte, ou seja, de sistemas com as quais parece possível estabelecer uma analogia ou recursos matemáticos adequados para a situação em questão, ou ainda, de um modelo base para a proposição de outro modelo (chamados no diagrama de ‘origem’ do modelo). Da interação entre esses dois elementos — obtenção e organização de experiências relevantes e seleção de uma origem adequada — a criatividade, o raciocínio crítico e diferentes habilidades mobilizadas pelo indivíduo conduzem à elaboração de um modelo mental inicial. É importante destacar que este é um processo cíclico, como representado pelas setas duplas que unem os quatro elementos iniciais do diagrama. Isto significa que elementos diferentes podem exercer influência nos outros. Portanto, devido à interatividade entre os elementos ocorrer de forma idiossincrática, não é possível descrever completamente a etapa inicial apresentada no diagrama.
Tendo produzido um modelo mental dessa maneira, a próxima decisão a ser tomada é relativa ao modo de representação no qual ele será expresso. Este também é um processo não linear, uma vez que, ao expressar um modelo, o indivíduo que o produziu pode modificá-lo.
Após o modelo ter sido expresso, o próximo passo é testá-lo. Essa etapa de testes pode acontecer através de experimentos mentais3 ou de experimentos empíricos. Nessa etapa podem ocorrer os dois tipos de teste ou apenas um tipo. A escolha dependerá do tema do modelo, dos recursos materiais e dos conhecimentos prévios dos indivíduos.4 Portanto, apenas a partir da seleção de um sistema e da definição de objetivos para construção de modelos é que poderão ser definidos os tipos e quantidades de testes a serem efetuados. Caso as previsões elaboradas a partir do modelo inicial não sejam compatíveis com os resultados obtidos nos testes, torna-se necessário modificar o modelo, voltando ao ciclo, ou rejeitar o modelo, o que conduz a um retorno à etapa inicial do processo. Por outro lado, se o modelo expresso for bem sucedido na fase de testes, ele satisfaz os propósitos estabelecidos inicialmente. Após a obtenção desse modelo bem sucedido, ele deve ser apresentado para outras pessoas que reconhecerão (ou não) sua validade. Essa etapa é muito importante para que sejam levantadas as limitações do modelo, bem como a sua extensão e validade.
A potencialidade do modelo eletrostático para compreensão da ligação iônicaNessa seção apresentaremos uma descrição mais detalhada do modelo eletrostático de forma a subsidiar professores ou futuros professores de química com conhecimentos pertinentes sobre esse tema. Consideramos que esse tratamento é necessário a partir de recomendações da literatura, por exemplo, Taber (1994; 2000). Nas investigações desse autor, verificouse a existência de concepções alternativas comuns entre alunos e professores de química sobre ligação iônica. Isso foi atribuído ao fato de esses professores utilizarem a idéia do octeto como modelo curricular. De acordo com Taber, isso pode ser conseqüência da não discussão do modelo eletrostático na formação desses professores. Como conseqüência, eles fazem uso do modelo que trazem de referência das etapas de escolarização anteriores ou presentes em livros didáticos — que são a principal fonte de consulta dos professores — e, em grande parte, apresentam a ligação iônica com base no modelo do octeto.
O modelo para ligação iônica que será apresentado a seguir teve a contribuição de diversos pesquisadores, como Born-Haber, Haber, Madelung e Fajans (Pauling, 1948).
Um retículo cristalino pode ser imaginado como sendo um arranjo espacial, no qual os pontos são ocupados por íons. Esse arranjo se repete periodicamente, em três dimensões. A energia cristalina ou reticular pode ser calculada através de duas maneiras: teórica ou experimentalmente.
O modo teórico implica o cálculo das energias de todas as interações presentes entre as partículas do sólido, sejam atrações ou repulsões. Para efetuar esse cálculo tomando como base um modelo puramente eletrostático, é necessário considerar que (i) no retículo cristalino, os cátions e ânions estejam localizados em um arranjo geométrico fixo e (ii) os íons apresentem simetria perfeita, podendo ser considerados como cargas puntiformes, de forma que seja possível usar adequadamente a expressão da Lei de Coulomb.
A equação 1, que segue a Lei de Coulomb, permite fazer esse cálculo para um par de íons A e B:
A equação 1 é a expressão para o cálculo da energia potencial coulombiana de um par de íons, em que ZA e ZB (expressos como múltiplos da carga e) são as cargas dos íons separados por uma distância AB e ε0 é a constante de permissividade do vácuo.
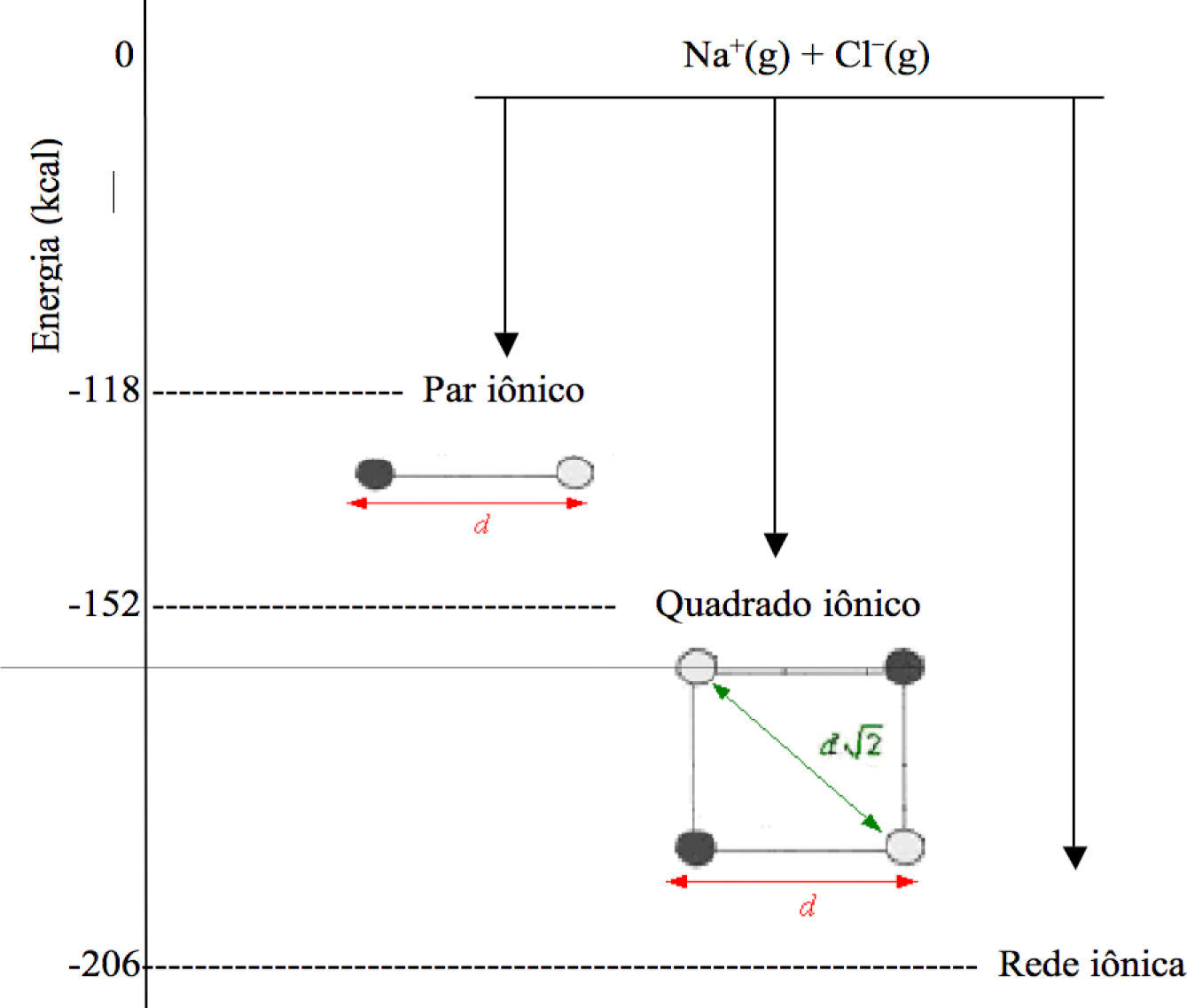
A energia potencial de um cristal iônico do tipo MA, como NaCl, pode ser obtida através da soma de todos os termos VAB de todos os pares de íons do cristal. Para a realização desse cálculo considere o esquema apresentado na figura 2.
É possível efetuar o cálculo para o par iônico, tomando-se como d a distância entre os núcleos dos íons (comprimento da ligação):
Se o mesmo cálculo for efetuado para o quadrado iônico, levando-se em consideração todas as possibilidades existentes, temos que:
Porém, ao invés de ser formado o quadrado iônico, formase um retículo tridimensional de íons, como pode ser visto na figura 3. Analisando esta figura, é possível perceber que cada cátion Na+ é rodeado por seis ânions Cl–, e vice-versa, separados por uma distância d. Há ainda 12 cátions a um distância d2, 8 ânions a d3, 6 cátions a d4, entre outras possibilidades que podem ser encontradas através de uma análise trigonométrica do arranjo do NaCl.
A expressão para energia potencial (V) para toda a estrutura consiste da soma de cada VAB, levando-se em consideração todas as atrações e repulsões possíveis, analogamente ao efetuado anteriormente para o quadrado iônico.
A soma contida nos parênteses é conhecida como constante de Madelung (A), portanto, para o NaCl, tem-se que:
A constante de Madelung já foi calculada para várias substâncias iônicas. No quadro 1 são apresentados alguns valores para essa constante.
Essa constante se relaciona a todas as contribuições, em termos de atrações e repulsões, existentes entre íons em um determinado composto iônico. Ela foi calculada levando-se em consideração as distâncias de um átomo a seus vizinhos em uma célula unitária de um cristal (analogamente ao evidenciado na figura 3). Essa constante é de considerável importância no estudo da física do estado sólido devido ao fato de ela indicar aspectos da estrutura cristalina do material. No quadro 2 são apresentados exemplos de compostos iônicos que apresentam valores próximos para constante de Madelung em relação às substâncias indicadas no quadro 1. Esses exemplos evidenciam que valores próximos dessa constante remetem a número de coordenação e forma de empacotamento típicos, o que está diretamente relacionado a valores das propriedades físicas (temperatura, dureza) e de energia de rede também similares.
Estrutura cristalina, tipo de empacotamento e número de coordenação para algumas substâncias iônicas.
| Estrutura Cristalina | Número de coordenação | Tipo de empacotamento | Exemplos |
|---|---|---|---|
| Cloreto de sódio | 6:6 | Cúbico de face centrada | LiCl, KBr, RbI, CaO, TiO, FeO, NiO |
| Cloreto de césio | 8:8 | Cúbico de corpo centrado | CaS, CsCN, CuZn, TlSb |
| Fluorita | 8:4 | Cúbico de face centrada | UO2, BaCl2, HgF2, PbO2 |
| Wurzita | 4:4 | Cúbico de face centrada | ZnO, BeO, ZnS, MnS, AgI, SiC, NH4F |
| Rutilo | 6:3 | Cúbico de corpo centrado | SnO2, WO2, MgF2, NiF2 |
A equação 4 apresenta a limitação de ter considerado as cargas como sendo puntiformes (o que possibilitou a utilização da Lei de Coulomb). Nesse sentido, o cálculo efetuado a partir dessa equação seria uma aproximação para a energia de ligação dos íons no cristal. Tratamentos mais rigorosos levam em consideração o fato de os íons não serem esferas rígidas, mas deformáveis (Pauling, 1948). Para refinamento do cálculo é introduzida mais uma parcela na equação de V, que se relaciona com a energia de repulsão proveniente da superposição das densidades eletrônicas dos íons vizinhos (Cotton and Wilkinson, 1988). De forma simplificada,
em que: A = constante de Madelung, d = distância entre as cargas, B = constante e dn está relacionado a distância d que pode variar em função da deformação dos íons. A primeira parcela da equação 5 se refere às forças atrativas, do tipo coulombiana. A segunda parcela se refere às forças repulsivas. Isso é uma forma matemática de garantir que se está considerando que os íons não são cargas puntiformes, ou seja, que eles não podem se aproximar indefinidamente uns dos outros, mesmo quando constituem um par cátion-ânion.Como V é função de d, é possível derivar
Na situação de equilíbrio é possível igualar
Resolvendo a equação5 para B→B = d0n-1AZ2nV pode, então, ser expresso como
A equação 6 leva em consideraçao o fato de os íons não serem esferas simétricas. Essa limitação se relaciona também ao fato de a ligação iônica poder apresentar um certo caráter covalente.
De acordo com Pauling (1948), não se pode negligenciar a polarização que cada átomo exerce no campo elétrico do outro. A distribuição de carga simétrica e esférica (modelo puramente eletrostático) é, na realidade, distorcida. O íon Na+ produz um forte campo elétrico que polariza o Cl−, provocando uma distorção do íon esfericamente simétrico, o que resulta em os elétrons do Cl− serem puxados em direção ao Na+ (Mahan and Myers, 1993). A distorção do Cl− na presença de carga positiva (Na+) leva a um abaixamento de energia.
Correções ao modelo puramente eletrostático levam em consideração que (i) a energia de atração tem uma pequena contribuição covalente, o que acarreta na polarização dos íons e que (ii) há existência de energia vibracional na temperatura de 0K (energia do ponto zero6). Com base nessas considerações, torna-se possível obter uma expressão que leva a uma aproximação muito grande do valor de energia medido experimentalmente na formação de 1 mol de NaCl:7
No quadro 3 são fornecidos os valores teóricos para cada tipo de energia que integra a expressão de U, o valor teórico da energia de rede e uma comparação desse valor com o experimental.
Como evidenciado pelo quadro 3, o valor calculado teoricamente é muito próximo do experimental, apresentando erro de cerca de 1%. Se for levado em consideração o modelo puramente eletrostático para o NaCl, o valor encontrado também será muito próximo do experimental, pois, como pode ser visto no quadro 3, as outras contribuições são mínimas quando comparadas à coulombiana. Isso evidencia que o modelo eletrostático é satisfatório para explicar o mecanismo da ligação iônica, enfocando as variações energéticas.
A maneira experimental de se calcular a energia do retículo cristalino se baseia na utilização do ciclo termodinâmico de Born-Haber. A idéia básica é a da formação do NaCl(s) a partir dos átomos de Na(g) e Cl(g), provenientes das substâncias simples Na(s) e Cl2(g). Como são conhecidos os valores de cada variação de entalpia (ΔH) para cada etapa do processo (energia de atomização, energia de sublimação, afinidade eletrônica, energia de ionização), torna-se possível calcular o H do retículo com base no valor experimental da energia liberada no processo. Na figura 4 são mostradas as equações representativas para cada etapa do processo e no quadro 4 são fornecidos os valores de ΔH (kJ/mol) para cada etapa.
ΔH (kJ/mol) para cada etapa do processo de formação do NaCl (Dasent, 1970, p. 71).
| Etapa | Equação representativa |
|---|---|
| 1. Energia de sublimação | Na(s) → Na(g) ΔHSubl= +108kJ |
| 2. Energia de ionização | Na(g) → Na+(g) + e− ΔHion= 496kJ |
| 3. Energia de dissociação | ½ Cl2(g) → Cl(g) ½ ΔHdiss= 121K |
| 4. Afinidade eletrônica | Cl(g) + e− → Cl−(g) ΔHae= 348kJ |
| 5. Formação do retículo | Na+(g) + Cl−(g) → NaCl(s) ΔHretículo= x |
| Processo global | Na(s) + ½ Cl2(g) → NaCl(s) ΔHexperimental= –411 kJ |
Efetuando-se os cálculos:
No quadro 5 são apresentados os valores de ΔH(kJ/mol) obtidos teoricamente e através do método de Born-Haber para alguns compostos iônicos.
ΔH(kJ/mol) obtido teoricamente e através do método de Born-Haber para alguns compostos iônicos (Dasent, 1970, p. 80).
| Composto | Ucoulombiano | Urepulsão | Upolarização | Uponto-zero | ΔH(298K) calculado | ΔH(298K) Born-Haber |
|---|---|---|---|---|---|---|
| NaCl | –863 | +114 | –25 | +8 | –776 | –788 |
| CsI | –619 | +90 | –54 | +3 | –592 | –602 |
| AgI | –808 | +138 | –128 | +3 | –802 | –891 |
| CuBr | –925 | +114 | –64 | +4 | –882 | –977 |
Analisando o quadro 5, é possível concluir que o método de Born-Haber é satisfatório para cálculo das energias de rede dos compostos iônicos de metais alcalinos. Porém, para AgI e CuBr as discrepâncias entre os valores teóricos e experimentais foram maiores. Esse erro pode ser explicado pela significativa contribuição covalente na ligação entre os átomos desses compostos.
Considerando o que foi exposto a respeito do modelo eletrostático, é possível afirmar que ele é um modelo satisfatório para a compreensão da ligação iônica, uma vez que satisfaz os três princípios básicos enfatizados por McWenny (1979) para explicar determinado tipo de ligação química: o mecanismo da ligação, a estequiometria e o número de ligações e a estrutura da substância.
Apesar de considerarmos a importância de professores de química entenderem claramente a formação da ligação iônica, ressaltamos que não é nosso intuito — e nem recomendamos para os professores ou futuros professores de química — utilizar o modelo eletrostático no ensino médio com o nível de detalhamento apresentado nessa seção, principalmente, devido aos cálculos complexos. Em compensação, consideremos relevante utilizar as propriedades energia de ionização e afinidade eletrônica para subsidiar o estudo do modelo eletrostático no ensino médio, pois acreditamos que elas potencializam o entendimento da formação de cátions e ânions — em detrimento ao ensino tradicional do tema — no qual isso é apenas assimilado pelos alunos, sem real entendimento do que ocorre quimicamente. Consideramos primordial, portanto, utilizar aspectos energéticos para subsidiar o estudo de ligação iônica a partir do modelo eletrostático, como o ciclo termodinâmico de Born-Haber, que potencializa o entendimento do processo pelo qual a ligação ocorre. Por fim, ressaltamos a necessidade de se utilizar representações 2D e 3D de redes iônicas e, assim, desenvolver uma compreensão qualitativa da Lei de Coulomb aplicada a diferentes tipos de estruturas cristalinas.
A estratégia de ensinoO diagrama Modelo de Modelagem foi utilizado como suporte teórico tanto na elaboração das atividades a serem realizadas pelos alunos quanto na definição das ações do professor durante o processo de ensino. Portanto, o grande desafio dessa proposta foi a transposição das etapas necessárias à modelagem presentes no processo científico para o processo de ensino. O principal objetivo das atividades de ensino é favorecer a ocorrência de situações em que os alunos vivenciem cada uma das etapas do diagrama.
Anteriormente a discussão das atividades a serem apresentadas, julgamos pertinente que o professor discuta com os alunos sobre modelos (natureza, funções e usos na ciência) e sobre modelagem (como sendo uma das principais práticas do processo de investigação científica). Em termos de conhecimentos químicos prévios, julgamos pertinente que já se tenha discutido com os alunos sobre: modelo de partículas; modelos atômicos, principalmente, o modelo de Bohr e as propriedades periódicas; Lei de Coulomb; reações químicas e quantidade de matéria. Entretanto, caso os alunos ainda não tenham estudado reações químicas e quantidade de matéria é possível utilizar a estratégia de ensino a partir de simplificações na Atividade 3 (que apresenta reações químicas)8 e nas Atividades 4 e 7, em que a unidade mol aparece. Nesses casos, o professor pode introduzir tal unidade de forma simples, dizendo que é uma unidade de contagem para átomos, moléculas, íons, elétrons etc. utilizadas pelos químicos. Ele pode fazer isso através do uso de analogias.9
Em todas as atividades os alunos devem trabalhar em grupos, porque o incentivo entre os pares pode favorecer a criatividade, a análise crítica e o florescimento de idéias, bem como a discussão para a proposição dos modelos e seus testes.
Atividade 1: Fatores energéticos envolvidos na formação de substânciasO principal objetivo ao elaborar essa Atividade foi disponibilizar aos alunos elementos que os auxiliem a compreender que o estabelecimento de ligação química ocorre com abaixamento de energia. Acreditamos que as idéias discutidas nessa Atividade, somadas aos conhecimentos anteriores adquiridos nas aulas de química (tais como, modelo atômico de Bohr, energia de ionização, afinidade eletrônica etc.), poderiam contribuir para que os alunos desenvolvessem ou resgatassem alguns dos pré-requisitos necessários para construção de modelos sobre ligação iônica. Portanto, essa Atividade se relaciona à etapa de ter experiências com o ‘alvo’ no diagrama Modelo de Modelagem.
A Atividade 1 consta de dois experimentos: queima de magnésio (parte A) e “garrafa mágica” (parte B), que foram selecionados em virtude de apresentarem evidências empíricas que podem encorajar os alunos na solução de um problema. Após a observação dos fenômenos, os estudantes devem responder algumas questões que exigem relacionamento entre os níveis fenomenológico e sub-microscópico de modo a explicar como fatores energéticos influenciam na formação de substâncias. Para isso é importante que o professor dirija o pensamento dos alunos para aspectos relevantes dos fenômenos na tentativa de superar explicações baseadas no senso comum, como por exemplo, relacionar estabilidade a não alterações visuais de uma substância.
Na Parte A, o magnésio combina-se com o oxigênio presente no ar atmosférico quando uma determinada quantidade de energia é fornecida ao sistema, através do aquecimento, transformando-se em óxido de magnésio. Durante essa queima, ocorre liberação de uma luz muito intensa. Ao se aquecer o óxido de magnésio não são percebidas alterações visuais que poderiam ser interpretadas como indicativas da formação de uma nova substância.
Com base nas evidências experimentais e nos conhecimentos anteriores, os alunos devem explicar algumas questões que têm como intuito principal levá-los a perceber que (i) o óxido de magnésio não sofre alteração naquelas condições por ser mais estável do que o sistema inicial (Mg e O2), e (ii) um sistema mais estável é aquele que apresenta menor conteúdo energético comparativamente ao sistema inicial naquelas condições.10
Na parte B, os alunos devem agitar a “garrafa mágica”11 (inicialmente solução incolor) de modo a perceber as modificações no sistema ao se fornecer energia ao mesmo (solução azulada). Nesse caso, quando o sistema é agitado, ocorre a oxidação em meio alcalino da dextrose, fazendo com que o sistema fique azul.
Com base nas evidências experimentais e nas idéias prévias, os alunos devem explicar algumas questões que objetivam levá-los a perceber que (i) o conteúdo energético dos reagentes e produtos contidos no sistema não é tão diferente e, por isso, a reação é reversível e (ii) a reação do experimento da parte A não é reversível porque o MgO é bem menos energético do que o sistema inicial (Mg e O2). Não é esperado que os alunos descrevam quimicamente o processo através das reações que ocorrem, porque não é o objetivo principal desse experimento nessa Atividade. Entretanto, caso o professor ache pertinente, recomendamos a apresentação das transformações químicas12 aos alunos durante a socialização das respostas.
Ao final da discussão dos experimentos, é prevista a discussão do gráfico de energia potencial em função da distância internuclear com o objetivo de levar os alunos a compreender que, no estabelecimento de ligação química, ocorre equilíbrio entre as forças atrativas e repulsivas, o que é acompanhado por liberação de energia.
Atividade 2: Formação de íons e as propriedades periódicasDe acordo com o diagrama Modelo de Modelagem, para que um modelo seja construído, é necessário esclarecer quais são os objetivos para os quais isto ocorre. No processo de ensino, quem explicita quais são os objetivos é o professor. A partir dessa Atividade, os alunos já devem estar cientes de que vão propor modelos para explicar a formação do cloreto de sódio a partir das substâncias Na(s) e Cl2(g). Portanto, inicialmente, eles devem explicar como são formados cátions e ânions e propor quais os íons mais estáveis formados a partir de Na(g) e Cl(g).
Esperamos que os alunos utilizem seus conhecimentos anteriores juntamente com os elementos fornecidos pela Atividade: dados de 1ª energia de ionização e afinidade eletrônica para os vinte elementos químicos de menor número atômico e valores energéticos envolvidos nos processos Na(s) → Na(g) e ½ Cl2(g) → Cl(g) (ter experiência com o ‘alvo’) para explicar como e quais íons são formados. A intenção é que os estudantes relacionem a formação de íons com explicações mais coerentes com o modelo científico – força coulombiana e cálculos termodinâmicos – ao invés de simplesmente utilizarem regras, como a do octeto, explicação muito comum entre os alunos que estudam esse tema de maneira tradicional (Taber, 1994, 1997).
O professor deve investigar se os alunos realmente apresentam os conhecimentos prévios necessários para avaliar os dados fornecidos na Atividade e, caso necessário, deve retomar a discussão dos mesmos. Porém, ele deve tomar o cuidado de não responder as solicitações feitas aos alunos, ou seja, deve ter bom senso em fornecer subsídios aos alunos, mas deixar que eles estabeleçam as relações necessárias. Na apresentação das respostas para a turma, o professor deve checar se todos compreenderam o problema e aprimorar as explicações, caso necessário.
Atividade 3: Pensar em como os íons estão ligados formando o cloreto de sódioNessa Atividade, os alunos devem propor um modelo que explique como os íons Na+ e Cl− interagem levando à formação do cloreto de sódio. Inicialmente, solicita-se aos alunos que criem um modelo sub-microscópico para o sistema sal de cozinha dissolvido em água e que o expressem através de um desenho. Depois, solicita-se que eles representem como esse sistema ficaria após a evaporação de toda a água. A opção por este sistema foi feita por seus íons constituintes serem simples e familiares aos alunos e por considerarmos que seria mais fácil para eles construírem um modelo para o cloreto de sódio para representar fenômenos cotidianos.
Para que os alunos expressem o modelo consensual do grupo, é necessário que o professor disponibilize alguns materiais como: lápis de cor, massinha de modelar, bolinhas de isopor de diferentes tamanhos e palitos. Essa parte da Atividade se relaciona com o diagrama Modelo de Modelagem no que se refere a expressar o modelo mental em algum modo de representação. Durante esse processo, pode ocorrer um ciclo de alterações entre o modelo mental e o expresso, até um ponto que eles estejam adequados um em relação ao outro. Daí a importância de disponibilizar diferentes materiais, de forma a permitir uma melhor adequação na transposição.
Esperamos que os alunos utilizem seus conhecimentos prévios, tais como força coulombiana na proposição do modelo. Além de construírem os modelos, os alunos devem explicálos (o que esperamos que façam em termos das idéias de interação, energia e estabilidade) e justificar o material escolhido para a confecção dos mesmos.
Considerando a literatura (Taber, 1994), nessa etapa, é esperado que os alunos construam modelos do tipo um único íon positivo atraindo um único íon negativo (‘NaCl molécula’). É importante que o professor conheça o que a literatura prevê em termos de concepções alternativas que os alunos podem apresentar a fim de subsidiar a proposição de questões que estimulem a proposição do modelo e a construção do conhecimento ao invés de apenas utilizar um conhecimento já pronto — as chamadas generative questions (Vosniadou, 2002) — que podem colaborar para que os estudantes percebam incoerências em seus modelos.
Sempre que um modelo for elaborado, ele deve ser socializado para toda a turma. Julgamos ser de extrema importância que cada grupo exponha seu modelo para toda a classe porque, dessa forma, o professor e os alunos de outros grupos podem discutir sobre o significado atribuído a cada representação utilizada, observando a coerência das representações. Esse pode ser um momento rico, no qual cada grupo tem possibilidades de contribuir de maneiras distintas na discussão do assunto. Também pensamos que a disponibilização de vários materiais e recursos para a expressão do modelo concreto pode resultar na proposição de modelos distintos, o que pode ajudar os alunos a entender que não existe uma única forma de representação correta ou estabelecida por uma conven-ção. 13 O professor não deve julgar os modelos como corretos ou incorretos, mas se limitar a fazer questionamentos que levem os estudantes a perceber as incoerências dos seus modelos ou que os conduza a testar e reestruturar as inconsistências percebidas, reformulando ou rejeitando seus modelos. Alunos de outros grupos também podem fazer questionamentos dessa natureza de forma a ajudar seus colegas na reestruturação de suas idéias. Para tal, deve ser estabelecido um ambiente de respeito mútuo às idéias dos indivíduos.
Atividade 4: Teste 1 – Explicar a elevada temperatura de fusão do NaClO diagrama Modelo de Modelagem aponta a fase de teste dos modelos como uma etapa essencial do processo de modelagem. Por esse motivo, o professor deve deixar claro para os alunos a necessidade de testar os modelos elaborados na Atividade 3, de forma a explicar uma propriedade da substância. Caso o modelo não seja satisfatório, ele deve ser reformulado. Nesse caso, o teste ocorre através da condução de experimentos mentais.
A escolha desse teste se deveu ao fato de a temperatura de fusão ser uma importante propriedade física das substâncias iônicas e de o conhecimento gerado a partir do teste poder ajudar os alunos a compreender a importância de se estudar ligações químicas para entender o comportamento dos materiais.
Caso os alunos construam modelos ‘NaCl molécula’, eles não serão capazes de explicar a temperatura de fusão (808°C) do cloreto de sódio. Nesse caso, o professor deve auxiliá-los propondo questões que os ajudem a perceber incoerências no modelo. Isso pode acarretar em os estudantes rejeitarem modelos moleculares de forma consciente.
Os grupos devem comunicar para toda a classe o resultado de seus testes dos modelos. Isso deve ser feito de forma a comparar o processo de modelagem vivido por eles com os que ocorrem na própria ciência, evidenciando aos alunos que a ciência não é construída apenas por acertos.
Atividade 5: Teste 2 – Explicar dados energéticos envolvidos na formação do NaClEssa Atividade foi elaborada visando a reformulação de modelos ‘NaCl molécula’ e, ainda, a confirmação da validade de modelos não moleculares (várias atrações, possibilidade de rede), caso os alunos já tenham modificado seus modelos na atividade anterior. A necessidade de um novo teste visando favorecer a transição de modelos ‘NaCl molécula’ para ‘NaCl em rede’ foi prevista na elaboração de estratégia de ensino levando em consideração (i) os pressupostos teóricos do diagrama Modelo de Modelagem, no qual mais de um teste pode ser necessário para verificar a adequação de um modelo, e (ii) que indivíduos podem pensar de maneira diferente, isto é, que o teste anterior pode não ter resultado na modificação dos modelos de todos os alunos.
Nesse caso, a Atividade 5 disponibiliza os seguintes dados: “O processo de formação de pares de partículas de cloreto de sódio a partir de um mol de íons Na+ e Cl− libera uma quantidade de energia igual a 104,5 kcal/mol de cloreto de sódio formado. Entretanto, quando a substância cloreto de sódio é formada, obtêm-se experimentalmente que a quantidade de energia liberada é de 206 kcal/mol”. Espera-se que os conhecimentos prévios disponibilizados pela Atividade 1 – abaixamento de energia e formação de substâncias mais estáveis (ter experiência com o ‘alvo’) sejam utilizados pelos alunos na análise desses dados empíricos e que através da condução de experimentos mentais eles rejeitem modelos ‘NaCl molécula’ e proponham modelos ‘NaCl em rede’, ou seja, esperamos que os alunos percebam que a atração entre os íons não se dá na forma de pares de NaCl, e sim que existem várias atrações, formando uma rede.
A denominação ‘rede’ não deve ser mencionada aos alunos durante a exposição dos dados. É importante enfatizar que não há expectativa de eles chegarem exatamente ao modelo científico, uma vez que não receberão dados para isso,14 mas eles podem ser capazes de perceber a necessidade da existência de uma estrutura mais complexa de íons do que aquela resultante da atração unitária entre eles.
Para expressar os modelos mentais, o professor deve fornecer vários materiais aos alunos (como na Atividade 3). Durante a socialização dos modelos de cada grupo para a turma, a escolha do material utilizado na confecção do mesmo deve ser justificada e a coerência das representações adotadas deve ser verificada. Nessas discussões, alguns alunos que podem não ter pensado na possibilidade da existência de uma rede terão nova oportunidade para refletir sobre seus modelos e discutir sobre qual o modelo mais provável para o NaCl com toda turma. O professor também pode estabelecer um paralelo entre a produção do conhecimento científico, na qual ocorre comunicação do modelo à comunidade científica, com processo vivido em sala de aula, no qual os estudantes têm o importante papel de contribuir na confirmação, reformulação ou rejeição de um dos modelos dos colegas.
Atividade 6: Teste 3 – Explicar propriedades físicas de compostos iônicosApós a reformulação dos modelos para o cloreto de sódio a partir dos dados empíricos da Atividade 5, pensamos que seria importante testar os modelos elaborados pelos alunos. Para isso, na Atividade 6, deve-se solicitar aos alunos que utilizem seus modelos atuais para explicar a elevada temperatura de fusão do cloreto de sódio e o fato de cristais iônicos serem duros, quebradiços e apresentarem planos de clivagem. Caso ainda exista algum aluno que não tenha conseguido pensar numa organização mais complexa de íons, esta seria uma nova oportunidade para ele refletir sobre o modelo para o cloreto de sódio.
Atividade 7: Calcular a energia de rede do cloreto de sódioDe forma a recapitular o processo de ensino vivenciado pelos alunos, na Atividade 7 são fornecidos dados termodinâmicos envolvidos na formação do NaCl(s) a partir de Na(s) e Cl2(g) (semelhante aos da figura 4) sendo solicitado aos alunos o cálculo do valor energético envolvido na formação do cloreto de sódio e a interpretação do mesmo.
Atividade 8: Propor um modelo consensual e discutir abrangências e limitações de um modelo.O fechamento do processo de ensino por modelagem deve culminar com a proposição de um modelo consensual para o cloreto de sódio na turma. O professor deve conduzir a discussão de modo a favorecer a elaboração desse modelo, ajudando os alunos a perceber as possíveis limitações de seus modelos. Mas é importante que ele enfatize que, independente disso, os modelos deles eram instrumentos poderosos para prever e explicar várias características dos compostos iônicos. Isso está relacionado à etapa de considerar abrangências e limitações de um modelo no diagrama Modelo de Modelagem. Desta forma, os objetivos iniciais serão atingidos, ou seja, alguns aspectos relevantes sobre o modelo do cloreto de sódio terão sido propostos pelos alunos e discutidos sem que os alunos tenham que aceitar um único modelo imposto pelo professor.
A seguir, o professor deve apresentar o modelo cúbico (o que pode ser feito através de várias formas de representação: bidimensional (bolas e varetas e compacto) e tridimensional), mas enfatizar que os alunos não receberam dados para saber ao certo o tipo de estrutura cristalina e que, mesmo assim, seus modelos tinham um grande poder explicativo (uma vez que apresentavam a importante característica de representar uma rede). Agindo dessa maneira, o professor valoriza todo o processo de ensino. Isto contribui para que os alunos percebam que eles mesmos são capazes de pensar em vários aspectos sem que esses lhes sejam apresentados prontos.
Finalmente, considerando a importância de ampliar o conhecimento dos alunos sobre substâncias iônicas, o professor deve apresentar outros exemplos de compostos iônicos com distintas estruturas cristalinas.
ConclusõesNo ensino por modelagem, é essencial que alguns aspectos sejam levados em consideração de forma a favorecer a aprendizagem dos alunos, como constatado a partir de aplicações da estratégia de ensino relatada a situações regulares de ensino (para mais detalhes ver Parte II desse artigo). Os primeiros são de natureza metodológica:
- •
interações dos alunos nos grupos e socializações de idéias entre os diferentes grupos, por permitirem a negociação de idéias e o compartilhamento de hipóteses, dúvidas, informações e soluções (Maia and Justi, in print).
- •
papel moderador do professor, fundamental para a construção de conhecimento dos grupos. Isso porque os fatos de o professor ouvir as idéias dos alunos e de favorecer a reflexão dos mesmos sobre essas idéias podem contribuir para ajudar os alunos a buscar novas informações, a refletir sobre os modelos (limitações, reformulações, significado das representações), a utilizar idéias prévias em momentos adequados, a expressar claramente idéias expressas inicialmente de forma confusa, a interpretar as evidências empíricas a partir dessas idéias prévias e a negociar idéias entre os colegas (Justi, 2006).
Outros aspectos se relacionam a elementos presentes no diagrama Modelo de Modelagem:
- •
Evidências experimentais, importantes por motivar os alunos na resolução de problemas, por fundamentar a geração de novos conhecimentos e por influenciar na proposição e reformulação de modelos devido à condução de experimentos mentais (Maia and Justi, in print; Mendonça and Justi, 2007).
- •
Idéias prévias, essenciais para a construção e reformulação dos modelos Expressão dos modelos concretos, o que pode favorecer a visualização e facilitar o entendimento e a comunicação dos alunos (Ferreira, Queiroz, Mendonça and Justi, 2007; Justi and Mendonça, 2007).
- •
Testes dos modelos, essenciais por (in)validar os modelos propostos (Maia and Justi, in print; Mendonça and Justi, 2007).
Por fim, destaca-se a necessidade de o professor ter conhecimentos sobre as concepções alternativas, o modelo eletrostático e modelagem para que as atividades sejam conduzidas de forma coerente com os referenciais teóricos Portanto, defendemos a necessidade da discussão dos aspectos energéticos envolvidos no estabelecimento de ligação química, das propriedades de compostos químicos e suas diferentes estruturas através das atividades de modelagem aqui apresentadas, visando favorecer o aprendizado significativo dos alunos em diferentes aspectos: compreensão do mecanismo da ligação (proposição de modelos explicativos e causais), explicação de propriedades (testar um modelo para prever e explicar comportamentos), desenvolvimento da capacidade de visualização (diferentes tipos de modelos e discussão dos códigos de representação adotados) e capacidade de transitar entre os níveis de representação da química (utilizar modelos para explicar observações macroscópicas em termos sub-microscópicos, utilizar modelos para entender representações simbólicas, por exemplo, a equação que expressa a Lei de Coulomb, através de modelos concretos que demonstram diferentes distâncias entre cargas).
Entretanto, salientamos que esse tipo de ensino demanda mais tempo em comparação ao ensino tradicional. Isso porque os estudantes precisam de tempo para discutir com seus pares, propor modelos, socializá-los para a turma e verificar a validade dos mesmos. Todavia, não acreditamos que este seja um impedimento para professores efetivamente comprometidos com a aprendizagem de seus alunos.
Implicações para o ensinoPara que estratégias de ensino semelhantes às apresentadas nesse artigo possam ocorrer no ensino médio é necessário, na formação inicial de professores de química, a ocorrência de (i) um estudo mais aprofundado sobre os modelos para ligação química como, por exemplo, os aspectos apresentados no item “A potencialidade do modelo eletrostático para compreensão da ligação iônica”, e (ii) discussões sobre modelos e modelagem.
Isso porque (i) um dos pré-requisitos fundamentais para a discussão adequada dos conteúdos é o domínio, por parte dos professores, dos saberes disciplinares de sua área de conhecimento e dos saberes pedagógicos (Tardif, 2005); (ii) muitos professores apresentam visão limitada de modelos na ciência, não os aplicam de forma adequada em sala de aula e desconhecem atividades de modelagem no ensino (Justi and Gilbert, 2002b) e (iii) muitas das concepções alternativas apresentadas por alunos do ensino médio são compartilhadas por professores de química (Taber, 2000). Isso indica que uma abordagem mais ampla de ligação química no ensino superior tem sido negligenciada. Portanto, torna-se necessário que professores do ensino superior dediquem atenção especial à discussão (i) dos modelos científicos para os tipos de ligação química em uma abordagem que seja proveitosa para os futuros professores de química do ensino médio, por exemplo, trabalhando de forma interdisciplinar com as disciplinas específicas de formação dos saberes pedagógicos; e (ii) da natureza do conhecimento científico, enfatizando modelos como um de seus principais produtos e modelagem como essencial no processo de construção do conhecimento científico.
Agradecemos ao professor Luiz Otávio Fagundes do Amaral do Departamento de Química da Universidade Federal de Minas Gerais pelas sugestões bibliográficas e pelas discussões sobre ligação química e ao CNPq pelo apoio financeiro na realização desse trabalho.
No Brasil, o ensino médio é o nível que precede o nível universitário. Ele ocorre em três anos e é geralmente cursado por alunos de 15-17 anos.
Representação de uma idéia, objeto, evento, processo ou fenômeno para um dado sistema, que apresenta uma finalidade específica (Gilbert, Boulter & Elmer, 2000).
Condução de um experimento na mente através da integração de conhecimento intuitivo, pensamento lógico, imaginações construtivas, esquemáticas e testes de hipóteses (Reiner & Gilbert, 2004).
Os testes mentais são realizados quando é impossível ou inviável, por falta de recursos materiais, a realização de testes empíricos. Os experimentos empíricos estão associados aos mentais, ou seja, torna-se necessário “rodar na mente” o experimento de forma a possibilitar uma explicação para os comportamentos observados empiricamente, ou, ainda, realizar o experimento mental anteriormente ao experimento empírico visando uma melhor execução prática, por exemplo, para minimizar os gastos de materiais (Justi, 2006).
A equação foi resolvida para B (constante introduzida na equação 2, que se relaciona ao termo repulsivo) em função das demais variáveis porque é possível determiná-las experimentalmente.
A 0K a energia vibracional é diferente de zero porque as partículas retêm ½ da energia vibracional quântica (hν°). A energia do ponto-zero é ½ hν°, em que h é a constante de Planck e ν° é a freqüência vibracional fundamental.
Para a dedução das equações de forma mais detalhada para cada tipo de energia envolvida na expressão de U, ver Dasent, 1970, p. 74-84.
O intuito principal é discutir sobre abaixamento de energia e estabilidade. Portanto, o entendimento das equações representativas dos processos discutidos nessa Atividade não é essencial para a compreensão desse aspecto.
Como sugestões, o professor poderia, por exemplo, relacionar as unidades dúzia ou cento com mol. Ou relacionar o espaço ocupado por mesma quantidade de bolinhas de isopor de diferentes diâmetros em garrafas plásticas.
O professor deve tomar cuidado ao discutir esse assunto de forma a evitar que os alunos possam desenvolver a idéia alternativa de que só reações exotérmicas são espontâneas. Por isso, deve enfatizar que na formação de ligações é que ocorre liberação de energia, mas que a liberação de energia pode ser menor do que a absorção gasta no processo.
Em um balão de fundo chato de 500 mL, colocar aproximadamente 250 mL da solução obtida dissolvendo-se, em um litro de água, 20 g de hidróxido de sódio, 20 g de dextrose (glicose) e 2 mL de solução a 1% de azul de metileno. O balão deve ser bem tampado de forma que possa ser agitado intensamente. Para que as mudanças de cor ocorram rapidamente, é imprescindível que esta solução tenha sido recentemente preparada.
Em meio alcalino, a glicose é lentamente oxidada pelo oxigênio dissolvido em solução, formando ácido glicólico, conforme a equação CH2OH-CHOH-CHOH-CHOH-CHOH-CHO + ½ O2 → CH2OH-CHOH-CHOH- CHOH- CHOH-COOH. Na presença de hidróxido de sódio, o ácido é convertido em gliconato de sódio. O azul de metileno catalisa a reação porque atua como um agente de transferência de oxigênio. Ao oxidar a glicose, o azul de metileno reduz-se a leuco-metileno, tornando-se incolor. O leuco-metileno se re-oxida rapidamente enquanto houver oxigênio no sistema e a solução volta a se tornar azul.
A menos que exista uma justificativa coerente para que se utilize uma convenção específica na representação.
Os alunos podem já ter observado que cristais de cloreto de sódio tem formato cúbico e, a partir disso, se aproximar bastante do modelo científico para o NaCl.