The aim of the work in hand is to come to conclusions as to why students relate boiling points of substances, such as halogens, with their atomic properties. The fact that this mistake has been observed in many evaluations brought about the implementation of a specific test to find out whether the students know that the boiling point is a macroscopic property of an elemental substance as in this case and not an atomic property.
As the energy associated with a physical change is generally much lower than the one related to chemical bond breaking, the test also included a question aimed at finding out if students are able to differentiate between physical and chemical properties. It is thought that this could be helpful for them to relate boiling points to strength of intermolecular forces, and therefore overcome one of the most common alternative conceptions associated with this subject.
Finally, in view of the different interpretations of the word “chlorine”, used on an equal basis for the atom, the molecule and the elemental substance, the test provided a way to detect whether students that have already studied the subject of chemical bonds, are able to relate experimental data, state of matter and atomicity of chlorine; that is, that they can relate submicroscopic and macroscopic states.
The analysis of the obtained results allows the identification of difficulties the students are faced with in this subject and the interpretation of possible causes.
El objetivo del presente trabajo es indagar si los alumnos del primer curso universitario de Química de la Universidad de Buenos Aires han adquirido la base conceptual que les permita transitar del nivel de análisis submicroscópico (Johnstone, 1997) al nivel de las propiedades macroscópicas de las sustancias. Dado que en el curso además de temas de Química General se incluyen conceptos básicos de Química Orgánica, el análisis de las propiedades físicas resulta de fundamental importancia a los efectos de integrar estas últimas con conceptos tales como estructura molecular y grupos funcionales, con el objetivo de lograr aprendizaje significativo de las distintas familias de compuestos orgánicos (Torres et al., 2005).
Se había observado en algunas respuestas a exámenes que los niveles de análisis de entidades de complejidad creciente a veces se confundían, dado que un grupo de alumnos analizaba el punto de ebullición utilizando propiedades atómicas como energía de ionización, error que surgía cuando no se les indicaba en forma explícita la fórmula molecular de la sustancia.
Los ítems del instrumento presentado en este trabajo fueron diseñados con el objetivo de poder responder a las siguientes preguntas:
Los estudiantes ¿han adquirido el conocimiento que les permita:
- –
reconocer el punto de ebullición como una propiedad macroscópica de la sustancia y no como una propiedad de sus átomos?
- –
diferenciar una propiedad física de una propiedad química?
- –
relacionar el comportamiento de las entidades del nivel submicroscópico con las propiedades del nivel macroscópico?
- –
deducir el estado de agregación a temperatura ambiente de una sustancia a partir del dato de su punto de ebullición?
- –
distinguir en una sustancia simple el átomo de la molécula, cuando en un dado contexto se menciona sólo el nombre de dicha sustancia?
De acuerdo con la investigación en enseñanza de las ciencias, los estudiantes llegan a las clases de ciencias naturales con muchas ideas preconcebidas sobre el comportamiento del mundo natural, derivadas de su experiencia física y social, que los llevan a hacer predicciones que no coinciden con las teorías y explicaciones científicas (Campanario y Otero, 2000). Además, cuando los estudiantes asimilan nueva información en sus estructuras de conocimiento, pueden obtenerse algunos resultados no esperados de la instrucción (Talanquer, 2006a).
Al analizar las respuestas de los estudiantes se consideraron en este trabajo algunas de las dificultades que conlleva la adquisición del conocimiento científico tales como el nivel de abstracción requerido en la construcción de representaciones mentales para términos que designan entidades que no pueden percibirse, como átomos, moléculas y/o conceptos como uniones entre partículas; la falta de dominio de la sintaxis particular que se utiliza en los enunciados científicos (Lemke, 1997) y la polisemia de los términos utilizados en las definiciones y explicaciones cuyo significado, en el contexto de la disciplina, es diferente al que se le da en la vida cotidiana. Algunos de los supuestos empíricos que subyacen a las concepciones alternativas más comunes, como el de continuidad de las propiedades de la materia (Talanquer, 2006a; Trinidad-Velasco y Garritz, 2003), se aplican a los resultados de este trabajo.
También se tuvo en cuenta la dificultad en adquirir la habilidad para sortear la distancia conceptual existente entre la estructura del átomo y la de la molécula, así como entre la estructura molecular y las propiedades físicas de las sustancias. En ambos casos se requiere comprender que entidades con niveles de organización de complejidad creciente presentan propiedades de diferente naturaleza (Luisi, 2002). Cuando las propiedades de un nivel de organización superior son distintas de las del nivel anterior, y no siempre fácilmente predecibles a partir de estas últimas, pueden considerarse como emergentes (Talanquer, 2006b). Las propiedades de la molécula, como su polaridad, surgen de la particular organización de los átomos que la forman y las propiedades de la sustancia, como el punto de ebullición, emergen de la organización de las partículas que la forman. A esta dificultad en la asignación de las propiedades que corresponden a cada nivel de complejidad se suma la confusión que se produce, en el caso de las sustancias simples covalentes, al usar el mismo término para designar la sustancia simple, el elemento, la molécula y el átomo.
Se analizaron además probables formas de pensamiento que podrían sustentar algunas de las respuestas desde el punto de vista de su posible adquisición como resultado de las instancias de enseñanza. Desde este punto de vista, reconocer y caracterizar las ideas y los esquemas de razonamiento de los estudiantes puede resultar útil para construir estrategias dirigidas a que los mismos puedan avanzar en la construcción del conocimiento de la ciencia.
MetodologíaPara responder a los interrogantes planteados a partir de las respuestas erróneas de los alumnos se diseñó un test (Apéndice) de tipo combinado abierto/cerrado, que consta de dos ítems. El primero remite al nivel de comprensión del concepto de propiedad y el segundo es de aplicación de los conocimientos a un sistema particular. Se proponen opciones y se solicita la justificación de las afirmaciones elegidas.
Las opciones (a), (b) y (c) del ítem 1–a se plantearon con el propósito de averiguar si los estudiantes saben que el punto de ebullición es una propiedad macroscópica de la sustancia. Es aquí cuando surge la dificultad en distinguir las propiedades emergentes de cada nivel de organización. Las opciones (d) y (e) del ítem 1–a se propusieron para determinar si los alumnos pueden diferenciar una propiedad física de una química, considerando que esta conceptualización (Riboldi et al., 2004) les permitiría distinguir entre un cambio de estado de agregación y la ruptura de un enlace químico.
El ítem 2 se planteó, por un lado, para investigar si los estudiantes reconocen la atomicidad de la molécula de cloro, uno de los ejemplos utilizados en clase en la explicación del enlace covalente, y por otro lado, para establecer si pueden relacionar el dato experimental del punto de ebullición de dicha sustancia con el estado de agregación a temperatura ambiente, sin que se indique explícitamente la fórmula molecular (Cl2), lo cual, considerando las opciones planteadas, no parecía necesario en el contexto del ítem. Por lo tanto, este ítem está dirigido a comprobar si los alumnos relacionan el comportamiento de las entidades del nivel submicroscópico con las propiedades del nivel macroscópico.
El test fue administrado al finalizar el dictado de la asignatura, a una muestra representativa de 158 alumnos pertenecientes a diferentes turnos horarios, antes de que los mismos rindieran su última evaluación.
Se analizaron las opciones elegidas por los alumnos para cada ítem, y se elaboraron las conclusiones validadas por las justificaciones dadas por los estudiantes.
Las justificaciones fueron analizadas individualmente por los autores, consensuando entre ellos la clasificación realizada. Este proceso o triangulación ínter evaluadores condujo a una categorización de dificultades, algunas de las cuales han sido mencionadas en la bibliografía (Talanquer, 2006a; Furió y Furió, 2000). Además de la triangulación mencionada, se realizaron cruces entre los dos ítems del test dando lugar a una triangulación entre niveles, el conceptual y el de aplicación.
Resultados y discusiónAnálisis del ítem 1En la tabla 1 se indican los resultados obtenidos en el ítem 1–a expresados como porcentajes sobre el total de alumnos que responden.
Se observa que el porcentaje de respuestas correctas es mucho mayor en el ítem 1–a (c) (72%), opción que corresponde a un gran conjunto de moléculas, que en el ítem (b) (27%), que se refiere a una sola molécula. Se determinó además que el 45% del total de alumnos eligieron simultáneamente las respuestas (b) y (c), lo que corresponde a la idea de que el PE es una propiedad de una molécula y también de un gran conjunto de moléculas. Se podría entonces adjudicar el alto porcentaje de opciones incorrectas al empeño que se pone en el curso en la predicción de la magnitud relativa del punto de ebullición, a partir del conocimiento de las características de las partículas que forman la sustancia. La metodología de trabajo propuesta en el curso consiste en plantear la estructura de Lewis a partir de la fórmula de la sustancia para, teniendo en cuenta la polaridad de los enlaces y la geometría molecular, determinar la polaridad de la molécula y el tipo de fuerzas que se establecen entre las moléculas de la sustancia en estado líquido o sólido (Torres et al., 2005). Como consecuencia del enfoque del tema es posible que, al preguntar si el PE es propiedad de una molécula o de un conjunto de moléculas, algunos alumnos interpretaran que la pregunta estaba dirigida a indagar en la naturaleza de la molécula, que sí influye en el PE, y no en la idea de una única molécula. Estas conclusiones se basan en algunas explicaciones dadas por los estudiantes (ejemplo de justificaciones que corresponden a la dificultad B de la tabla 2).
Categorización de dificultades.
| Dificultades en la adquisición del conocimiento científico | Causas específicas de respuestas erróneas | Ejemplos de justificaciones |
|---|---|---|
| A) El nivel de abstracción requerido para las representaciones mentales de entidades que no pueden percibirse. | i) La concepción alternativa más habitual que se relaciona con la ruptura del enlace entre átomos. | i) “El PE es una propiedad de una molécula debido a que hay que entregar energía para vencer enlaces entre átomos.” |
| ii) Idea preconcebida de la continuidad de las propiedades de la materia. | ii) “La molécula es la mínima expresión de las características físicas y químicas de una sustancia.” | |
| B) En el proceso de asimilación de la nueva información pueden obtenerse resultados no esperados de la instrucción. | El énfasis que se pone durante el proceso de enseñanza en que el punto de ebullición de una sustancia depende de la naturaleza de la molécula. | “El PE es propiedad de una molécula porque dependiendo de su masa molecular relativa, su polaridad, sus fuerzas intermoleculares, etc., su punto de ebullición varía.” |
| C) La falta de dominio de la sintaxis particular que se utiliza en los enunciados científicos. | Un error en la interpretación del enunciado, es decir, “una” molécula podría haber sido entendido como “la” molécula, en vez de “una única” molécula. | “El PE de una molécula se puede determinar conociendo las fuerzas intermoleculares en ellas presentes.” |
| “El PE es una propiedad física de una molécula porque tiene que ver con la polaridad en una molécula.” | ||
| D) La polisemia de los términos científicos con diferente significado en la vida cotidiana o con diferentes acepciones en la disciplina. | La polisemia del término cloro. El mismo nombre para átomo, molécula y sustancia simple y cloro comercial (en nuestro país se le llama cloro a la solución que se utiliza para purificar el agua de las piscinas). | “En la tabla periódica aparece el PE de cada átomo.” |
| “A temperatura ambiente el cloro estará líquido.” | ||
| E) La falta de competencias en el campo de las matemáticas. | Errores en la habilidad para trabajar con números negativos. | “Si está líquido a – 34,7 a temperatura ambiente es sólido.” |
| F) Aplicación de heurísticos en la resolución de problemas. | i) Falta de delimitación de los campos disciplinares. | “El PE es una propiedad química porque es ésta la que estudia el estado de la materia.” |
| ii) Disponibilidad de los conceptos (Recencia y frecuencia). | “En química consideramos todo el tiempo al PE.” |
También habría que considerar la posibilidad de adjudicar la elección de la opción incorrecta (b) a una interpretación diferente de su significado y a la falta de contextualización de la misma dentro del ítem. Es decir, “una” molécula podría haber sido entendido como “la” molécula, en lugar de “una única” molécula a pesar de ofrecerse como otra opción “gran conjunto de moléculas”. (Ejemplo de justificaciones que corresponden a la dificultad C de la tabla 2).
Cabe destacar que sólo un 24% de los alumnos eligieron simultáneamente las opciones correctas en los ítems a), b) y (c) que corresponden al número y tipo de partículas.
Con respecto a los resultados obtenidos en la afirmación sobre tipo de propiedad, ítems (d) y (e), el 24% de los alumnos respondieron ambas opciones correctamente. Sólo el 10% respondió correctamente todo el ítem 1.
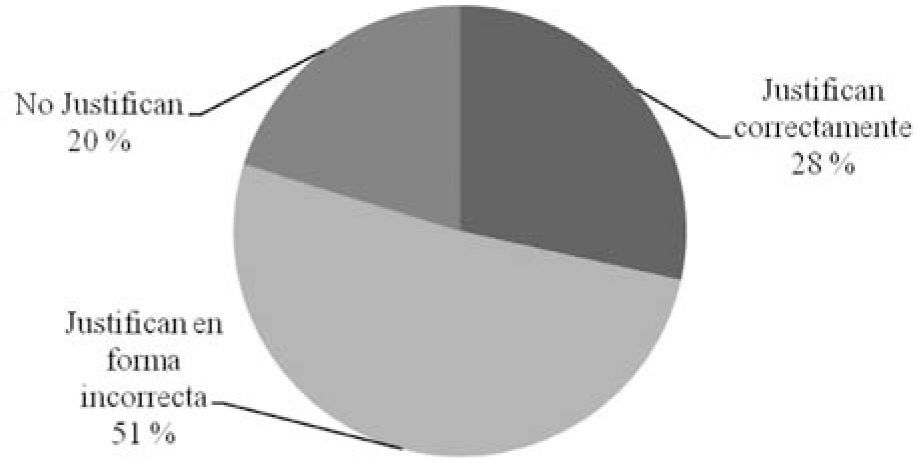
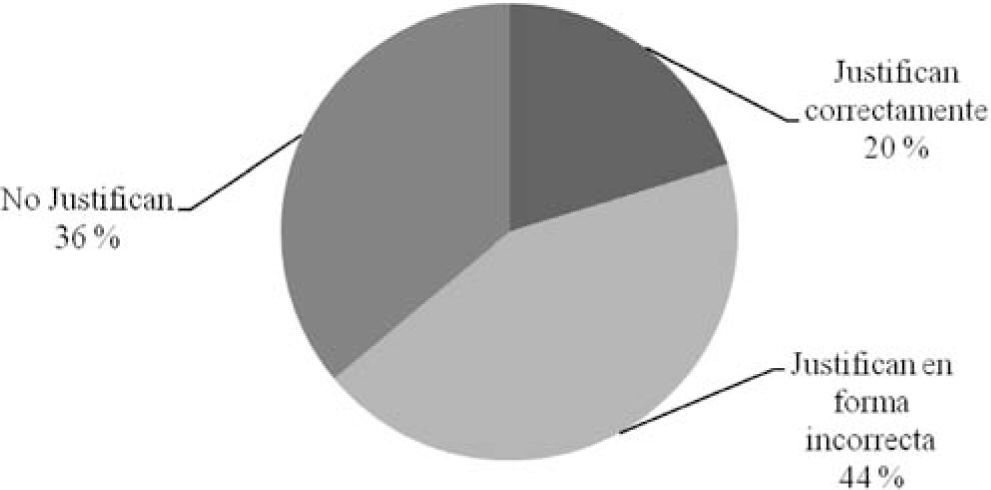
Si tenemos en cuenta las justificaciones escritas por los alumnos, se observa que en los ítems referidos al tipo de partículas, en los que hubo un mayor porcentaje de elecciones correctas que en los ítems sobre tipo de propiedad, también es mayor el porcentaje de estudiantes que justificaron su elección. El 79% de los alumnos justificaron su elección en los ítems (a), (b) y (c) que refieren al tipo de partículas (gráfico 1) pero sólo el 28% lo hizo correctamente, mientras que el porcentaje de estudiantes que justificaron la elección de las opciones (d) y (e) sólo alcanzó el 64% (gráfico 2).
Se adjudica la menor cantidad de justificaciones a las opciones sobre cambio físico y cambio químico, con respecto a las opciones sobre tipo de partículas, al hecho que la distinción entre cambio físico y químico forma parte del currículum de química de la escuela media y no se insiste sobre este tema en el curso universitario, donde sólo se menciona en unidades didácticas como sistemas materiales o reacciones químicas. Las justificaciones a las opciones referidas a los temas que forman parte de los contenidos tratados en forma intensiva durante el curso suelen ser mucho más completas que las que corresponden a los temas vistos en la escuela media.
Por otro lado, se observó en las explicaciones que justificaron la elección de las opciones (d) o (e) que los estudiantes mayoritariamente relacionaron el tipo de propiedad con la asignatura en que estudiaron el fenómeno. (Ejemplo de justificaciones que corresponden a la dificultad F de la tabla 2).
Análisis del ítem 2En el gráfico 3 se muestran los resultados obtenidos en el ítem 2 del test (Apéndice) expresados como porcentajes sobre el total de alumnos que responden.
Se observa que el 28% de los alumnos eligieron la opción (a) correspondiente al cloro gaseoso formado por moléculas monoatómicas. Este porcentaje considerable podría deberse a que estos estudiantes interpretaron que el círculo representa a la molécula, tal como suele aparecer en la bibliografía al referirse a los estados de agregación de la materia, a pesar de que en el mismo ítem, en la opción (b), se sugiere la atomicidad de la molécula. También puede pensarse que algunos estudiantes eligieron dicha opción porque suponen que al pasar al estado gaseoso se rompe el enlace entre los átomos de la molécula, lo que se sustenta en el ejemplo (i) de la dificultad A de la tabla 2. En trabajos de investigación de distintos autores se observa que los estudiantes de química de nivel introductorio utilizan en sus explicaciones el concepto de enlace covalente con más frecuencia que el de fuerzas intermoleculares (De Posada, 1999) y que muchos estudiantes suponen que la formación de una unión entre átomos del mismo elemento es un proceso físico (Riboldi et al., 2004).
El 14% de los alumnos no reconocieron el esquema correspondiente al estado de agregación gaseoso evidenciando la dificultad en la utilización de representaciones que corresponden al nivel de pensamiento submicroscópico (Johnstone, 2000) o bien, en la interpretación de las temperaturas negativas (ejemplos de justificaciones de las dificultades D y E de la tabla 2).
El análisis de las justificaciones del ítem 2 indica que el 58% de los alumnos (gráfico 4) justificaron correctamente su elección refiriéndose al estado gaseoso del cloro y a las moléculas diatómicas.
Análisis conjunto de los ítems 1 y 2Además de las causas de error comentadas en el análisis del ítem 2, relacionadas con el estado de agregación de cloro, una cuestión que puede contribuir a la confusión de los alumnos es que, en la tabla periódica, figuran los puntos de ebullición de las sustancias elementales (ejemplos de justificaciones de la dificultad D de la tabla 2). Esto produce la asignación de una propiedad a un nivel de organización con el que no se corresponde. Se pone de manifiesto la polisemia del término cloro que dentro de la disciplina refiere tanto al átomo como a la molécula, a la sustancia y al elemento y que además en el lenguaje cotidiano refiere a un producto comercial desinfectante. El problema de la polisemia de los términos científicos se evidenció en las respuestas a ambos ítems, razón por la cual se buscó indagar si los alumnos que respondieron que el PE es propiedad de un átomo eligieron, consistentemente, la representación icónica de gas monoatómico.
Al analizar conjuntamente las respuestas de los alumnos a algunas opciones de los ítems 1 y 2 (tabla 3) se verificó que del 14% de los alumnos que eligieron en 1–a (a) la opción que afirma que el punto de ebullición es una propiedad del átomo, el 23% consideró que el cloro es una sustancia gaseosa de moléculas monoatómicas y el 55% que es una sustancia gaseosa formada por moléculas diatómicas.
En la tabla se muestran los porcentajes que resultaron de los cruces de las opciones (a), (b) y (c) del ítem 1–a con las opciones (a) y (b) del ítem 2-a.
Los valores resaltados corresponden al porcentaje de respuestas correctas a los incisos (a), (b) y (c) del ítem l–a.
| Ítem 1 Ítem 2-a | 1a | 1b | 1c | |||
| Sí | No | Sí | No | Sí | No | |
| 14% | 68% | 62% | 27% | 72% | 10% | |
| a) Monoatómico (g) | 23% | 27% | 28% | 30% | 24% | 56% |
| b) Diatómico (g) | 55% | 59% | 55% | 51% | 58% | 38% |
Con respecto al tema de la consistencia de las respuestas a los ítems 1 y 2, se observa en la tabla 3 que, con excepción del reducido grupo de estudiantes (10%) que eligió la opción incorrecta en 1–a (c), en la mayoría de los casos los porcentajes obtenidos son similares entre sí, cercanos a los porcentajes globales (gráfico 3); es decir, los alumnos respondieron a cada ítem en forma independiente, como si los mismos no estuviesen vinculados.
Se analizaron las justificaciones de los ítems 1–b y 2-b de manera conjunta. De este análisis surgió la tabla 2, en la cual se expone la categorización de las dificultades que conlleva la adquisición del conocimiento científico, las probables causas de las respuestas erróneas y algunas de las justificaciones dadas por los estudiantes.
De las causas específicas de respuestas erróneas, las más frecuentes fueron: falta de habilidad para trabajar con temperaturas menores que cero (Dificultad E de la tabla 2); relación del PE con la energía de enlace intramolecular (Dificultad Ai de la tabla 2); interpretación errónea de la consigna del ítem 1-a (b), “una molécula”, al considerar que se refiere a la naturaleza de la molécula (Dificultad B de la tabla 2); falta de conceptualización que se expresó mediante justificaciones armadas con términos científicos recientemente conocidos —recencia— o usadas un gran número de veces —frecuencia— (Oliva Martínez, 1996, y Pozo et al., 1991) (Dificultad Fii de la tabla 2). Le siguieron en frecuencia: la falta de delimitación de los campos disciplinares (Dificultad Fi en la tabla 2); la interpretación equivocada del enunciado (Dificultad C de la tabla 2); y las debidas a la polisemia del término cloro (Dificultad D de la tabla 2).
No se encontraron justificaciones en las que se relacione en forma explícita el PE con la energía de ionización.
ConclusionesLos estudiantes demostraron su dificultad en adquirir la habilidad para sortear las distancias conceptuales existentes entre la estructura del átomo y la de la molécula, como así también entre la estructura molecular, nivel submicroscópico, y las propiedades físicas de las sustancias, nivel macroscópico. Se evidencia la necesidad de resaltar la definición de propiedad, teniendo en cuenta a qué tipo de sistemas pueden aplicarse mediciones, y de enfatizar a qué nivel de organización corresponde cada propiedad, especificando si la propiedad considerada corresponde al átomo o a la molécula o a la sustancia, ya que de cada nivel de organización emergen propiedades de diferente naturaleza. Desde este punto de vista, también sería útil especificar cómo pueden obtenerse los valores de las propiedades más comunes y qué tamaño de muestra se necesita para ello.
Para mejorar la articulación del nivel submicroscópico y el macroscópico se propone enfatizar el concepto de cambio físico y cambio químico, y recalcar la diferencia entre fuerzas intra e intermoleculares, ya que de su intensidad dependen dos propiedades que no se relacionan entre sí: la energía de enlace y el punto de ebullición. Este conocimiento podría ayudar a evitar una de las concepciones más habituales en el tema de fuerzas intermoleculares que se refiere a la relación del punto de ebullición con la energía necesaria para producir la ruptura de enlaces entre los átomos de la molécula en lugar de la involucrada en la separación de moléculas. Para profundizar el conocimiento de las causas de las dificultades que encuentran los estudiantes al acceder al primer curso de química de nivel universitario se prevé aplicar este tipo de análisis a estudiantes de escuela media.
Con respecto a la visión integrada de las opciones elegidas y justificaciones, hay en los estudiantes una tendencia a no vincular los problemas planteados. La falta de coherencia entre las respuestas a los dos ítems se puede considerar como una evidencia de aprendizaje no significativo. Las metodologías que consisten en establecer relaciones y contextualizar son necesarias para construir conocimiento científico y su ausencia indica una dificultad para analizar el propio aprendizaje a través de la metacognición, evidenciando la utilización de procesos heurísticos rápidos y con economía de recursos para la elaboración de respuestas.
Estos resultados podrán ser utilizados en el diseño de estrategias de enseñanza destinadas a una población distinta a la que respondió al instrumento pero creemos, y así lo indican también otros estudios de didáctica de la química, que los obstáculos epistemológicos y las nociones alternativas que dificultan la adquisición del conocimiento científico son comunes a muchos de los estudiantes que ingresan a la universidad. Será importante tener en cuenta aquellas dificultades que tienen su origen en la manera en que son dictadas las clases para promover el análisis del discurso y de la simbología utilizados por los docentes.
El presente trabajo está inserto en el proyecto de la Universidad de Buenos Aires: “Estudio de los obstáculos que dificultan el aprendizaje significativo de la química en un primer curso universitario” (UBACYT-U005).
1–a. Completar la tabla marcando con una x la opción elegida para cada ítem. El punto de ebullición es una propiedad:
1–b. Explica la elección de tus respuestas:
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2–a. El punto de ebullición del cloro es –34,7°C. Marca con una x cuál de los siguientes diagramas representa al cloro a temperatura ambiente:
2–b. Explica el porqué de tu elección:
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------