Para su enseñanza, se reconstruye la historia de la química alrededor de 5 momentos revolucionarios, presentándose aquí únicamente el cuarto de ellos. Incorporando los instrumentos que contribuyeron a su establecimiento y las subdisciplinas derivadas, además de los conceptos desarrollados, las revoluciones químicas se caracterizan en términos de la noción kuhniana de «ejemplar» y no de «paradigma». Se reconoce, más allá de un dogma, la forma en que se consolidan diferentes entidades «ocultas o escondidas» muy importantes en la enseñanza de la química, como los átomos, las moléculas, los electrones o en este caso el espín. Asimismo, se traza el paso de las sustancias a las especies químicas.
With educational purposes, a new chronology is introduced to address the history of chemistry around five revolutionary moments, analysing in this article only the fourth of them. Each revolution is considered in terms of the Kuhnian notion of ‘exemplar’ rather than ‘paradigm’. This approach enables the incorporation into the revolutionary process of the instruments that contributed to their establishment, as well as the concepts that were developed and the derived subdisciplines. It is recognized, beyond a dogma, the way in which several ‘hidden entities’ very important in the teaching of chemistry —such as atoms, molecules, electrons or, in this case, spin— are consolidated. It also traces the passage of the substances to the chemical species.
El conocimiento científico (es) principalmente … un producto humano, construido con recursos materiales y culturales localmente situados, en lugar de ser simplemente la revelación de un orden preestablecido en la naturaleza.
J. Golinski
A pesar de los avances en la enseñanza de la química en los últimos años, en general cuando la enseñamos, se sigue presentando únicamente el contenido científico, por lo que la interpretación de la enseñanza de las ciencias como «dogma» o como «retórica de conclusiones» propuesta hace muchos años por Schwab (1962) permanece1. Si las habilidades de pensamiento científico no se abordan ni en los cursos, ni en los laboratorios, ni en los libros de texto, no podemos asumir que nuestros estudiantes estén siendo preparados para realizar actividades de naturaleza científica (Chamizo e Izquierdo, 2007).
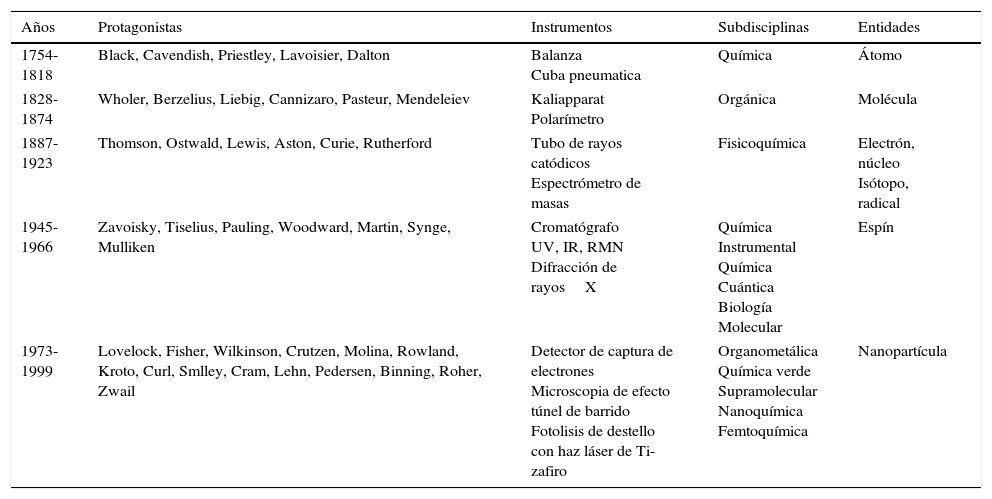
El propósito principal de este trabajo es continuar con el proyecto de mostrar cómo los profesores de química, utilizando la historia de la química, podrían enseñar química2. Lo anterior significa integrar algo más que una gran cantidad de nombres y fechas. Representa un difícil equilibrio entre la anecdótica simplificación excesiva, de muchos libros de texto, contra la profunda profesionalidad del historiador. Busca reconocer la forma en que se consolidan diferentes entidades importantes en la enseñanza de la química, como los átomos, las moléculas, los electrones o en este caso el espín. Por lo tanto, siguiendo la propuesta inicial de Jensen (1998a) se reconstruye la historia de la química alrededor de 5 momentos revolucionarios (tabla 1) (Chamizo, 2011; Chamizo, 2015). Estos momentos se consideran en términos de la noción kuhniana de «ejemplar»3 y no de «paradigma» (Kuhn, 1971). Así, además de discutir únicamente conceptos, con esta aproximación se reconoce la incorporación de instrumentos (Holmes y Levere, 2000) y la aparición de subdisciplinas (Kuhn, 1992) en el proceso revolucionario, lo que proporciona una representación más adecuada de tales periodos de desarrollo y consolidación (Chamizo, 2014b). La aproximación aquí presentada concuerda además con la idea de Chang (2011) de que las épocas históricas están marcadas por objetos epistémicos (entidades que identificamos como partes constitutivas de la realidad), así como por personas, instituciones o modelos.
Las 5 revoluciones de la química
| Años | Protagonistas | Instrumentos | Subdisciplinas | Entidades |
|---|---|---|---|---|
| 1754-1818 | Black, Cavendish, Priestley, Lavoisier, Dalton | Balanza Cuba pneumatica | Química | Átomo |
| 1828-1874 | Wholer, Berzelius, Liebig, Cannizaro, Pasteur, Mendeleiev | Kaliapparat Polarímetro | Orgánica | Molécula |
| 1887-1923 | Thomson, Ostwald, Lewis, Aston, Curie, Rutherford | Tubo de rayos catódicos Espectrómetro de masas | Fisicoquímica | Electrón, núcleo Isótopo, radical |
| 1945-1966 | Zavoisky, Tiselius, Pauling, Woodward, Martin, Synge, Mulliken | Cromatógrafo UV, IR, RMN Difracción de rayosX | Química Instrumental Química Cuántica Biología Molecular | Espín |
| 1973-1999 | Lovelock, Fisher, Wilkinson, Crutzen, Molina, Rowland, Kroto, Curl, Smlley, Cram, Lehn, Pedersen, Binning, Roher, Zwail | Detector de captura de electrones Microscopia de efecto túnel de barrido Fotolisis de destello con haz láser de Ti-zafiro | Organometálica Química verde Supramolecular Nanoquímica Femtoquímica | Nanopartícula |
La historia es lo que contamos hoy, con la información que tenemos de ayer.
C. Husbands
Algunos autores coinciden en reconocer un cambio fundamental en este periodo asignándole diferentes nombres como «revolución instrumental» (Morris, 2002) o «el nacimiento de la química moderna» (Klein, 2012), pero de acuerdo con la cronología aquí desarrollada se identifica como la cuarta revolución química.
Esta revolución se caracteriza fundamentalmente por la incorporación de nuevos instrumentos en las prácticas químicas al finalizar la Segunda Guerra Mundial, cuando el soviético Zavoisky publica el primer artículo donde se explica la resonancia paramagnética electrónica (tabla 2). Ese mismo año el presidente de la National Science Foundation de los Estados Unidos, Vaneevar Bush, da a conocer el informe «Ciencia. La frontera infinita», en el que solicita de manera abierta que el gobierno federal financie la investigación de las ciencias en las universidades norteamericanas y apoye además a las empresas que habían provisto de materiales y equipamiento al ejército. Así, al integrarse nuevos instrumentos en los laboratorios químicos, estos cambiaron más que en los anteriores 300 años. Entre estos instrumentos cabe destacar: los espectrómetros de ultravioleta, visible e infrarrojo; los de cristalografía de rayosX y de electroforesis; los espectroscopios de masas (particularmente a partir de 1956) y, al poco tiempo, los más importantes de todos, los de resonancia magnética nuclear (RMN). Por otra parte, los cromatógrafos, e inclusive el rotavapor, ocuparon un lugar en las mesas de los laboratorios. Se crearon nuevas industrias de equipamiento siguiendo la lógica militar de la estandarización de las partes, lo que facilitó su consumo. Apareció una nueva subdisciplina, la química instrumental (Morris, 2002).
Principales acontecimientos de la cuarta revolución química
| Año | Tecnoquímicos | Políticos y culturales |
|---|---|---|
| 1945 | El presidente de la National Science Foundation de los Estados Unidos, V. Bush, publica el informe «Ciencia. La frontera infinita», en el que solicita de manera abierta que el gobierno federal financie la investigación de las ciencias en las universidades norteamericanas. Desde ese momento la adquisición de nuevos instrumentos creció considerablemente. Ese mismo año el soviético E.K. Zavoisky publica el primer artículo donde se explica la resonancia paramagnética electrónica | Termina la Segunda Guerra Mundial con la ocupación de Berlín por el ejército soviético y la rendición incondicional de Japón después de sufrir, en Hiroshima y Nagasaki, ataques norteamericanos con bombas atómicas |
| 1947 | L. Leloir funda en Buenos Aires el Instituto de Investigaciones Bioquímicas Fundación Campomar, donde llevó a cabo la investigación sobre azúcares por la cual le otorgaron el Premio Nobel de Química años después | Inicia la Guerra Fría |
| 1948 | El sueco A.W.K. Tiselius obtiene el Premio Nobel de Química por sus investigaciones en electroforesis y análisis por adsorción, especialmente en el descubrimiento de la complejidad de las proteínas del suero sanguíneo | India declara su independencia (1947) |
| 1951 | Se publica en la revista Life el artículo «Cortisone from giant yam» en donde se da a conocer mundialmente la investigación realizada en la compañía mexicana Syntex sobre la cortisona. Pocos años después junto con la UNAM esta compañía desarrolla la pastilla anticonceptiva | Inicia la Guerra de Corea (1950-53) |
| 1952 | Los ingleses A.J. Martin y R.L.M. Synge obtienen el Premio Nobel de Química por la invención de la cromatografía de partición, mientras que el suizo F. Bloch y el norteamericano E.M. Purcell recibieron el Premio Nobel de Física por su desarrollo de la resonancia magnética nuclear. Ese año la contaminación atmosférica en Londres provocó la muerte de al menos 8,000 personas | La URSS lanza el Sputnik, el primer satélite artificial en 1957, y 4 años después al primer astronauta |
| 1953 | El alemán H. Staudinger recibe el Premio Nobel de Química por sus investigaciones en química macromolecular | En 1962 Rachel Carson publica La primavera silenciosa, considerado por muchos como uno de los libros más importante de no ficción del sigloXX. |
| 1954 | El norteamericano L. Pauling recibe el Premio Nobel de Química por sus investigaciones sobre el enlace químico y su aplicación en la elucidación de la estructura de sustancias complejas. Uno de los fundadores de la biología molecular ha sido reconocido entre los 20 científicos más importantes en toda la historia de las ciencias | El impacto de las sustancias químicas en el ambiente es innegable. Ese mismo año L. Pauling obtiene el Premio Nobel de la Paz y F.H.C. Crick, J.D. Watson y M. Wilkins el de Medicina por la elucidación de la estructura del ADN Crisis de los misiles soviéticos en Cuba |
| 1956 | En el Reino Unido se promulga la Clean Air Act que establece el control de combustibles utilizados para calentar los hogares en las ciudades para reducir la contaminación atmosférica | En 1964 el Premio Nobel de la Paz es otorgado a M. L. King, China hace explotar su primera bomba atómica e inicia la Guerra de Vietnam |
| 1961 | El norteamericano J.W. Linnett publica un artículo en JACS donde rehace el modelo del octeto de Lewis considerando el espín | En 1965 F. Jacob, A. Lwoff y J. Monod obtienen el Premio Nobel de Fisiología por sus estudios en el control genético de la síntesis de enzimas |
| 1962 | El norteamericano N. Bartlett sintetiza los primeros compuestos con gases nobles. El suizo M.F. Perutz y el inglés J.C. Kendrew obtienen el Premio Nobel de Química por sus estudios en la estructura de las proteínas globulares | Los filósofos Heidegger, Sartre, Foucault y Kuhn marcan nuevas preocupaciones filosóficas, mientras que los escritores latinoamericanos García Márquez, Cortázar, Fuentes, Borges, Carpentier, y Asturias irrumpen en la literatura universal acompañados por los directores |
| 1963 | Se otorga el Premio Nobel de Química al suizo K. Ziegler y al italiano G. Natta por sus investigaciones en polímeros. Se inicia el Quantum Chemistry Exchange Program (QCPE), donde se comparten los primeros programas para calcular teóricamente algunas propiedades de las sustancias. Durante los siguientes dos años el austriaco W. Kohn construye la teoría de funcionales de la densidad con la que es posible calcular sustancias complejas. El norteamericano R.G. Pearson publica en el JACS su artículo sobre el modelo de ácidos y bases duros y blandos, el treceavo más citado en los 125 años de esa revista | Fellini, Bergman, Buñuel, Kubrick, Kurosawa y Herzog, quienes caracterizan lo que se conoce como cine de autor. El mundo ya es una aldea global |
| 1964 | El Premio Nobel de Química se le otorga a la británica D. C. Hodgkin por la determinación estructural de diversas sustancias bioquímicas utilizando difracción de rayosX, mientras el suizo R.R. Ernst mejora notablemente la resolución de la resonancia magnética nuclear, investigación con la que también será galardonado años después | |
| 1965 | El norteamericano R. Woodward recibe el Premio Nobel por sus extraordinarios méritos en el arte de la síntesis orgánica. El Chemical Abstracts Service introduce el CASRegistryNumber (CASRN), un sistema computarizado para identificar cualquier sustancia sin requerir de su nombre y desde entonces la mayor base de datos sobre la identidad de las mismas | |
| 1966 | El norteamericano R. Mulliken recibe el Premio Nobel de Química por su trabajo fundamental sobre el enlace químico y la estructura electrónica de las moléculas empleando el método de orbitales moleculares |
En este periodo también se empezaron a fabricar de manera masiva las computadoras y con ellas los programas que permitieron hacer «cálculos químicos», desde la incorporación del método teórico-computacional conocido como Extended-Hu¿ckel, hasta el desarrollo del método de funcionales de la densidad4. Todo lo anterior hizo que los químicos empezaran a pensar la estructura de la materia en términos de la mecánica cuántica, que por entonces abanderaba de manera admirable Pauling5 y que terminaría consolidando Mulliken6. Quedó claro que la química cuántica no era una aplicación de la mecánica cuántica a la química, sino una nueva subdisciplina de esta última (Garritz, 2014).
La biología molecular surgió al final de la Segunda Guerra Mundial por la integración de diversas disciplinas para contestar una pregunta que constituyó un problema, ¿cómo la información genética se transfiere de un organismo a otro? La pregunta fue formulada originalmente por lo que se denominó el grupo de los fagos7 e integró a lo largo de los años siguientes a biólogos (Watson), físicos (Delbrük), químicos (Tiselius y Pauling) y cristalógrafos (Perutz). Por su parte, Astbury (1961), en un artículo en la prestigiosa revista Nature, caracteriza esta subdisciplina como: … no tanto una técnica como un enfoque, un enfoque desde el punto de vista de las ciencias básicas con la idea principal de buscar bajo las manifestaciones a gran escala, de la biología clásica, su correspondiente plan molecular. Considera la forma de las moléculas biológicas […] y es predominantemente tridimensional y estructural, lo que no significa, sin embargo, que sea simplemente un refinamiento de la morfología, sino que debe al mismo tiempo investigar la génesis y la función.
El aislamiento y estudio estructural de las proteínas, los instrumentos secuenciadores de aminoácidos, las estructuras del ADN y la hemoglobina son solo algunos de los resultados de la investigación en esta subdisciplina… de varias disciplinas.
La química sintética aprovechó la llegada de los nuevos instrumentos y se empeñó en la preparación de nuevas sustancias más complicadas, muchas de gran importancia biológica y medicinal. Se sintetizaron, entre otras sustancias, la morfina, el colesterol, la cortisona, la estricnina, la penicilina, diversos tranquilizantes y, en México, la pastilla anticonceptiva. El estadounidense Woodward se proclamó el campeón de la síntesis química. La síntesis total de la vitaminaB12 es un hito en la historia de la química. Con 9 átomos de carbono asimétricos, empezó en 1960 y requirió la participación de más de 100 químicos provenientes de 19 países trabajando en dos laboratorios simultáneamente para concluir en 1972 cuando Woodward hizo el anuncio, en Nueva Delhi, en una conferencia de la International Union of Pure and Applied Chemistry (IUPAC). Por su parte, en la química inorgánica Bartlett sintetiza contra todas las expectativas los primeros compuestos con gases nobles. A lo anterior hay que añadir la manera en la que las macromoléculas comerciales cambiaron la forma literalmente de «constituir» el mundo. La posguerra marca el inicio de la era de los plásticos. La aplicación de la termodinámica y la cinética química al estudio sistemático de estos materiales fue tarea abordada por diferentes grupos de investigación, entre los cuales destaca el dirigido en Alemania por Staudinger. Las palabras plástico y flexible se volvieron comunes e identificaron socialmente una actitud valiosa, aunque también caracterizaron, la primera de ellas, a la naciente sociedad de consumo mundial.
Hacia el final de la cuarta revolución el Chemical Abstracts Service introduce el CASRegistryNumber (CASRN), un sistema computarizado para identificar cualquier sustancia sin requerir de su nombre y, desde entonces, la mayor base de datos sobre la identidad de las mismas8. A los químicos les queda claro que una sustancia química es lo que es, independientemente de su origen, pero han sido incapaces de contrarrestar la veneración popular con resabios de nobleza, por identificar las genealogías materiales, lo cual impide superar la dicotomía de natural vs. sintético. Y peor aún la de asociar moralmente: «natural-bueno» vs. «sintético-malo».
De las sustancias a las especiesLa objetividad instrumental no es simplemente una cuestión de exactitud y verdad. En el nivel más básico… implica la reducción del papel del juicio humano y está inextricablemente ligada a la reducción de los costes laborales del análisis mediante la depuración del papel del analista y el «blackboxing» del instrumento que realiza el análisis.
D. Baird
Es necesario precisar sobre el concepto de sustancia y esa es una de las aportaciones de esta revolución. La pureza depende de la posibilidad técnica de identificar impurezas. Diferentes técnicas indican diferentes niveles de pureza. Por ello, generalmente cuando se indica la pureza se menciona la técnica de análisis a través de la cual se ha reconocido. Los avances experimentales van redefiniendo la pureza y con ello el propio conocimiento químico. No hay sustancias puras, lo que hay es un modelo de sustancia pura (Sánchez y Valcárcel, 2003; Fernández-González, 2013; Chamizo, 2014a). Como lo dijo el filósofo de la química Gaston Bachelard (1976): Pero si verdaderamente se pueden aislar especies materiales, será necesario especificarlas dentro de una cierta pureza material, así como se especifica a los objetos geométricos dentro de una determinada pureza formal. Y así como no se tienen en cuenta algunos accidentes contingentes para juzgar acerca de la forma de los objetos, no se debe anegar a las especies materiales en una diversidad superabundante.
Así, a lo que accedemos comúnmente es a una sustancia contaminada (con una diversidad superabundante) que enfrentamos con un modelo de sustancia pura. Por ejemplo, en el Gold Book de la IUPAC se define a un isotopólogo como «aquella entidad molecular que difiere en su composición isotópica». Así, para la aparentemente pura y simple sustancia9 agua (en un frasco, pero sin sales, ni gases disueltos en ella) se tienen: agua ligera H2O; agua semipesada, es decir, con un átomo de deuterio HDO; agua pesada D2O10; agua superpesada, con dos átomos de tritio T2O. Solo para indicar algunas propiedades físicas de algunas de estas sustancias a 25°C y una atmósfera de presión la densidad del agua es de 0.997g/ml, mientras que la del agua pesada es de 1.104g/ml; el punto de ebullición de la primera es de 100°C, mientras que el de la segunda es de 101.4°C. Como también el oxígeno tiene tres isótopos (16O, 17O y 18O), se puede tener H218O, o HT18O. Es decir, cuando superficialmente un libro de texto indica que agua es H2O es eso, una simplificación, una vez que lo que se ha encontrado son 11 de los posibles 18 isotopólogos del agua, es decir, 11 sustancias diferentes. Además, habría que considerar todos los posibles iones derivados de la disociación de esos 11 isotopólogos (Weisberg, 2006). Así, aceptando inicialmente su singular pureza resulta que el agua no es una sustancia, sino muchas. Es una mezcla homogénea de sustancias.
Hay que recordar que hasta la cuarta revolución el análisis químico de nuevas sustancias consideraba las siguientes 5 etapas:
- •
Descripción detallada de la preparación de los reactivos, incluyendo sus métodos de purificación.
- •
Resultados de su composición, es decir, el análisis elemental y ocasionalmente la masa molecular.
- •
Características físicas, color, forma de los cristales, etc., así como sus temperaturas de ebullición y/o fusión.
- •
Solubilidad en diversos disolventes.
- •
Ejemplos de reactividad química, es decir, reacciones específicas.
Como bien saben los químicos dedicados a la síntesis, las propiedades reconocidas a través de estas 5 etapas no siempre bastaban para caracterizar inequívocamente a las nuevas sustancias, más allá del tiempo que se requería para hacerlo. Las nuevas técnicas espectroscópicas no solo redujeron el tiempo de caracterización, sino que poco a poco fueron dando lugar a una identificación «absoluta» de cada sustancia contra la caracterización relacional utilizada hasta entonces y explícita en las dos últimas etapas (Schummer, 2002). Al final de la cuarta revolución muchos de los artículos que informaban la síntesis de nuevas sustancias lo hacían empleando, además de algunas de las propiedades reconocidas en las 5 etapas previamente indicadas: la espectroscopia de ultravioleta-visible; la espectroscopia de infrarrojo, la resonancia magnética nuclear de 1H y la espectrometría de masas. Esta identificación «absoluta» de las sustancias, que muchos interpretan como equivalente a su estructura molecular (las estructuras moleculares, por ejemplo, carecen de temperaturas de ebullición o de fusión) no tiene precedente. Más aún, la cantidad de sustancia necesaria para hacer la identificación ha disminuido a nivel microscópico, además de que se pueden caracterizar sustancias mezcladas. Por primera vez en la historia de la química ya no es necesario tener sustancias puras para su identificación. Por ello, con el advenimiento de más y mejores técnicas analíticas, se va construyendo la pureza que, de alguna manera, pudiera ser un artefacto, es decir, un producto generado por la manipulación experta de cierto material. Su realidad no reside en su existencia «inmediata», sino en la manera en la que es hecha y conocida.
Con la incorporación de nuevos instrumentos en las prácticas químicas durante la cuarta revolución química el acercamiento espacio-temporal a las sustancias permitió reconocer la complejidad que ese nombre por sí solo abarcaba. La permanencia de la composición elemental de una sustancia sujeta a repetidas operaciones para eliminar sus posibles contaminantes, el criterio operativo que los químicos utilizan para distinguir las sustancias de las mezclas, ya no necesariamente reflejaba el mundo que los químicos abordaban. No podía mantenerse ya la vieja concepción de una sustancia que por definición se encontraba fuera del tiempo. Así poco a poco se fue abandonando el estrecho concepto de sustancia química por el más amplio de especie química.
La definición de la IUPAC para especie química indica que: Son átomos, moléculas, fragmentos moleculares, iones, etc., involucrados en un proceso químico o de medición. Generalmente las especies químicas son un conjunto de entidades moleculares químicas idénticas que pueden explorar el mismo conjunto de niveles de energía moleculares en la escala de tiempo del experimento… La redacción de la definición pretende abarcar casos, como el grafito, el cloruro de sodio o un óxido superficial, donde la unidad básica unidad estructural no puede ser capaz de tener existencia aislada, así como aquellos casos donde sí.
No es un cambio menor. Al ir sustituyendo el concepto de sustancia como aquello que se encuentra en un frasco, se está imponiendo al mundo material que nos rodea, de igual manera que con la pureza, los resultados de nuestros experimentos y la capacidad de nuestros instrumentos (Grasselli, 1992). Al pasar de las sustancias a las especies químicas el campo de estudio de la química crece y se complica considerablemente. Los mecanismos de reacción que tanto éxito tenían en la química orgánica y que descomponían una reacción en una serie de reacciones sucesivas considerando la existencia de varios intermediarios pudieron y fueron estudiados. Muchos de esos intermediarios, como los radicales, no eran otra cosa que especies químicas. Varios de los instrumentos más importantes para su estudio son los que tienen que ver con el espín, la entidad de esta revolución.
El espín, junto con la masa y la carga, es una de las propiedades intrínsecas de las partículas subatómicas, pero a diferencia de estas no tiene un análogo macroscópico. Decir que corresponde al giro de las partículas (electrón, protón o neutrón) en una u otra dirección es una simplificación didáctica. Propuesto para explicar «curiosidades» espectroscópicas a finales de los años veinte (Chamizo y Garritz, 2014), la aceptación del espín electrónico por la comunidad de los físicos tomó los años que vieron nacer a la mecánica cuántica relativista. En química, el espín contrario de dos electrones es lo que permite explicar el enlace químico de acuerdo con el modelo del enlace covalente11. Un radical tiene un electrón desapareado y por ello es una especie muy reactiva ya que rápidamente se enlaza con otra para aparearlo… De alguna manera el estudio de los electrones apareados, lo que sucede en la mayoría de las sustancias, ayuda a gestar la química cuántica. Los protones y los neutrones también tienen espín que se manifiesta en el estado basal de núcleos cuando se tiene en número impar de estas partículas en el núcleo atómico. En 1945 se establecen las bases de la técnica instrumental de resonancia paramagnética electrónica, con la cual se detecta el espín del electrón, y pocos años después las de la resonancia magnética nuclear, que hacen lo propio con el espín del protio, uno de los isótopos del hidrógeno. A partir de la cuarta revolución química el espín se incorpora en la práctica cotidiana de la comunidad química, como lo demuestran la modificación del modelo del octeto (Linnett, 1961; Jensen, 2017), la incorporación de los radicales (con espín) en el modelo de ácidos y bases duros y blandos (Pearson, 1963) o las investigaciones en química sintética (Woodward, 1972).
El paso de la sustancia a la especie fue acompañado de otro no menos importante que tuvo que ver con precisar cuál es la entidad fundamental de la sustancia: el átomo o la molécula. Durante muchos años la mayoría de la comunidad química asumió que era el átomo. Sin embargo, a principios de la cuarta revolución el anterior acuerdo fue cambiando hacia el reconocimiento de la molécula como un conjunto de núcleos y electrones con espín.
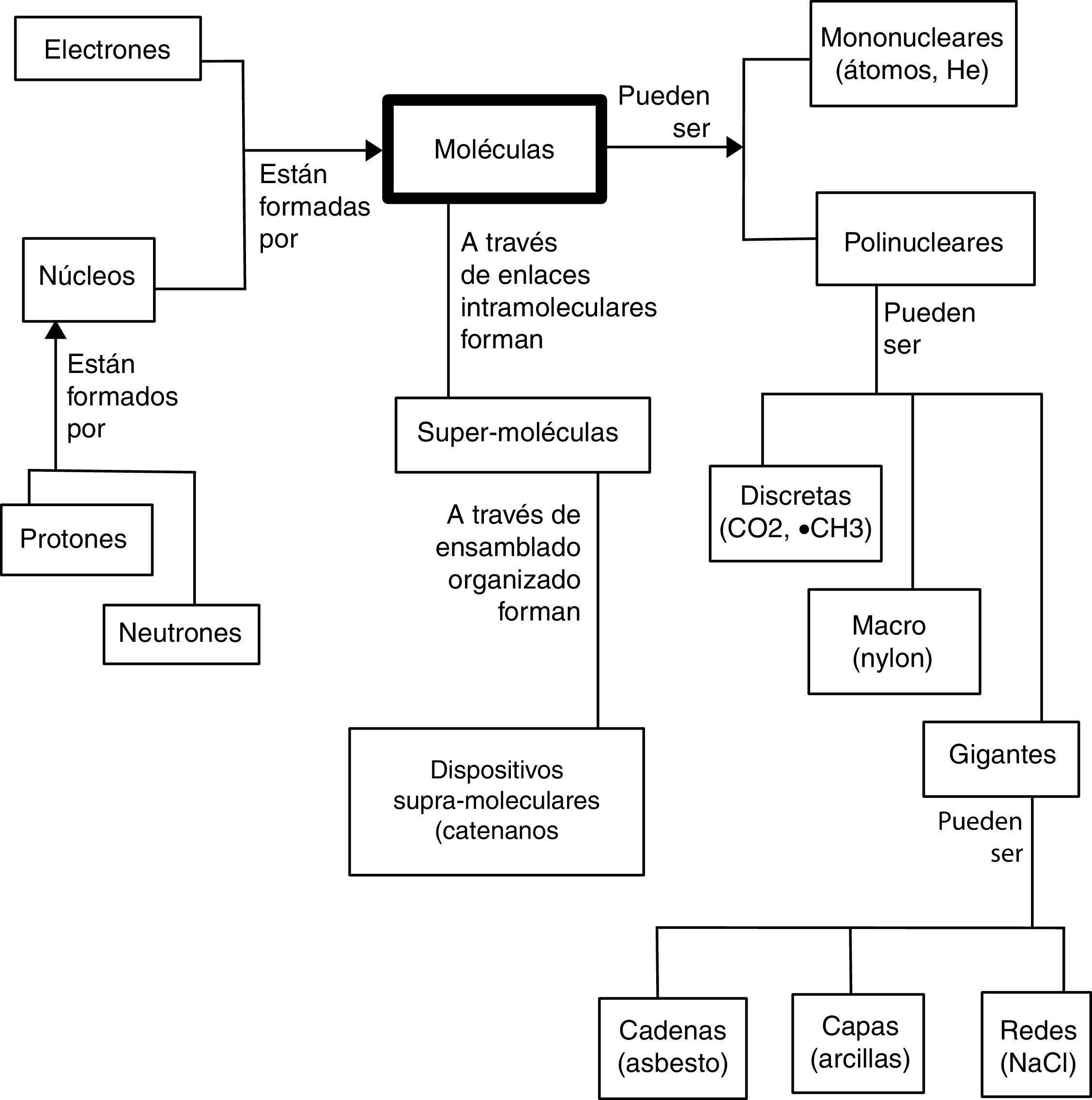
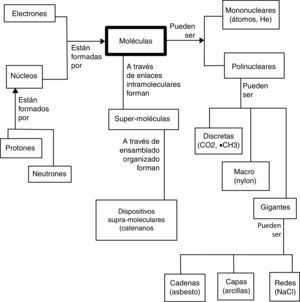
L. Pauling impulsó la idea de que los átomos conforman las moléculas en su extraordinario libro The nature of the chemical bond and the structure of molecules and crystals publicado al inicio de la Segunda Guerra Mundial y en el que introduce la explicación de muchas de las propiedades de las sustancias químicas empleando la mecánica cuántica. La naturaleza cuántica de los átomos (como es interpretada por los físicos) permite entender la estructura de las moléculas que conforman, y de la estructura molecular se derivan las propiedades de las sustancias (Pauling es uno de los varios fundadores de la biología molecular). Sin embargo, a partir de la cuarta revolución y resultado del trabajo de Mulliken esta idea fue cambiando. A partir de la mecánica cuántica ya se había descrito que un orbital atómico es una función de onda monoelectrónica que considera la atracción del electrón por el núcleo e integra de manera promediada la repulsión de los otros electrones. Para Mulliken un orbital molecular se define de la misma manera, salvo que en lugar de considerar un núcleo se toman varios de ellos. La molécula está conformada por átomos, los que a su vez lo están por núcleos y electrones12. Las propiedades moleculares explican a su vez las características de las sustancias. La molécula aparece como la entidad fundamental de las sustancias o especies químicas (Jensen, 1998b), como puede verse en la figura 1 en la que se adelanta una de las aportaciones de la quinta revolución: la química supramolecular.
ConclusionesLa cuarta revolución química se caracteriza por cambios significativos en el énfasis de la investigación y la práctica científica, así como en la estructura de las organizaciones académicas y profesionales. La química se desdobla. Ya no solo es inorgánica, orgánica o fisicoquímica, sino también, con la incorporación de nuevos instrumentos, profundamente analítica. Como lo indicó Schummer (2002, p. 19), se pasa de las sustancias a las especies: El impacto más importante de los métodos espectroscópicos fue que finalmente hizo que los químicos se decidieran a favor de las especies moleculares. Una vez establecidos como medios independientes en la determinación de estructuras, se utilizaron también métodos espectroscópicos para caracterizar especies cuasi-moleculares para las que no existe una sustancia química correspondiente ni un enfoque clásico para la elucidación de la estructura química, como estados conformacionales, estados intermedios en solución, complejos de van der Waals, o fragmentos moleculares en espectroscopia de masas.
Como una disciplina madura, la química empieza a traspasar fronteras y a partir de este momento la biología ocupa un lugar preponderante en sus intereses, muchos en el campo de la biología molecular, una nueva subdisciplina. Por otro lado, la irrupción de las computadoras y de la espectroscopia, con su multitud de instrumentos, obligó a los químicos a aprender el lenguaje de la mecánica cuántica, lo que dio lugar a otra subdisciplina: la química cuántica. Los libros de texto en todo el mundo, bajo la concepción lógico-positivista de la ciencia, cada vez se hicieron más fisicoquímicos, buscando los «principios» de la química en la física y abandonando la enorme cantidad de conocimiento empírico que se había acumulado durante siglos. A pesar de que el espín era conocido antes, es en este periodo que encuentra un lugar importante en la química, entre otras razones por su incorporación en instrumentos de análisis (resonancia paramagnética electrónica y resonancia magnética nuclear) y su capacidad para explicar el enlace químico. Como se demuestra consultando los libros de química general surgidos a partir de esa revolución, la enseñanza de la química quedó colonizada, asumiendo que a partir de los principios fisicoquímicos se tendría que entender y hacer química.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los dos árbitros anónimos que con sus valiosos comentarios permitieron mejorar la claridad de lo aquí dicho.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.
Por ejemplo, en la mayoría de los textos para la enseñanza de química se«introduce», apresurada y apretadamente, la entidad «átomo» sin apenas pruebas de su existencia, entidad que tomó más de un siglo (todo el XIX y principios del XX) para ser aceptada por la comunidad científica, contra la idea de algunos galardonados con el Premio Nobel (Chalmers, 2009).
Hay muchas dificultades en la enseñanza de la historia de la química, Höttecke y Celestino-Silva (2011) han discutido 4 de ellas: habilidades didácticas de los maestros; sus creencias así como su conocimiento epistemológico; el marco institucional y la naturaleza de los libros de texto disponibles. Se han publicado artículos sobre 4 de las 5 revoluciones (Chamizo, 2011; Chamizo, 2014b; Chamizo, 2015; Chamizo, 2017), con el presente documento concluye, en lo fundamental, la primera etapa de este proyecto que consiste en precisar los periodos, los instrumentos, las subdisciplinas y las entidades asociadas.
El término «ejemplar» indica una colección histórica de problemas específica, en la cual se considera el uso de instrumentos, resueltos por la comunidad y que se encuentra generalmente en su literatura profesional, especialmente en sus libros de texto. Es más estrecho que el de «paradigma» y evita algunas de las ambigüedades que este último adquirió a lo largo de los años.
Y que se empezó a utilizar de manera importante a partir de la quinta revolución química hasta nuestros días.
Quien con J. C. Slater desarrollaría el modelo de los orbitales atómicos o de unión valencia.
El que con F. Hund desarrollaría el modelo de orbitales moleculares.
Constituido por M. Delbrük, A.D. Hershey y S.E. Luria, quienes obtendrían el Premio Nobel de Fisiología en 1969 por sus investigaciones sobre los virus bacteriófagos (Mullins, 1972).
A la fecha con más de 123 millones de sustancias registradas que incluyen: elementos; compuestos orgánicos, inorgánicos y organometálicos; metales y aleaciones; minerales; isótopos; partículas nucleares; proteínas y ácidos nucleicos; polímeros y materiales no estructurables.
Según la IUPAC una sustancia es: materia de composición constante caracterizada por las entidades (moléculas, unidades fórmula, átomos) que la componen. Las propiedades físicas como la densidad, el índice de refracción, la conductividad eléctrica, el punto de fusión, etc., caracterizan la sustancia química.
Su CASRN es 7789-20-0, mientras que el del H2O es 7732-18-5. También bajo este criterio son sustancias diferentes.
El efecto mutuo entre las partículas, en este caso los electrones, se reconoce a través del concepto de correlación electrónica. Hay dos tipos de correlación electrónica independientes entre sí: la correlación de carga y la correlación del espín. El espín no modifica la interacción electrostática entre cargas, ni reduce su repulsión, sin embargo, en el «estado basal» no degenerado, de átomos o moléculas, estos tienen menor energía cuando sus espines están apareados.
En su conferencia de recepción del Premio Nobel Mulliken indicó: «Hay, sin embargo, otra manera de describir las moléculas, usualmente llamado método de enlace de valencia… En este método, se piensa que cada molécula está compuesta de átomos, y la estructura electrónica se describe usando los orbitales atómicos de estos átomos. Este enfoque, que yo prefiero llamar el método del orbital atómico, es una alternativa válida al método de orbitales moleculares, que en su forma más general considera cada molécula como una unidad autosuficiente y no como un mero agregado de átomos. Al principio el método de los orbitales atómicos apeló a los químicos porque era mucho más fácil de encajar con las formas habituales de pensar. Sin embargo, se ha hecho cada vez más evidente que el método de orbitales moleculares es más útil para una comprensión detallada de la estructura electrónica de las moléculas…».
Sobre este asunto y también por razones educativas es importante el artículo de Harré y Llored (2013) sobre el estudio mereológico de las moléculas, es decir, la relación entre las partes y el todo.