S. aureus provokes high rates of morbidity and mortality into the hospitals, because of the poor health conditions of patients, failure to comply with the prevention guidelines, and the multidrug resistance strains. In this sense many patients acquire surgical wound infections, bacteremia or pneumonia, which further exacerbate their pathological condition and complicate their eventual cure, depending on the gravity of the initial illness. By the other hand physicians, chemists and nurses are obliged to make additional efforts taking an active part in prevention, detection and control of the infectious outbreaks whose etiological agents are the most difficult to eradicate because they are resistant to nearly all antibiotics. The present work deals with the problem of the main nosocomial infections caused by S. aureus.
Staphylococcus aureus es una bacteria considerada como oportunista, debido a que ocasiona enfermedades al humano, principalmente cuando éste atraviesa lapsos de vulnerabilidad asociados a circunstancias anómalas que disminuyen la competencia de su sistema inmunológico. Bajo tales condiciones, el microorganismo es capaz de provocar afecciones en casi cualquier región anatómica, lo cual refleja su amplio bagaje en cuanto a genes de virulencia que lo habilitan para establecerse, reproducirse, sobrevivir y diseminarse en diversas clases de tejidos (Massey, 2006).
Ciertamente, S. aureus es una causa común de piodermitis, intoxicaciones alimentarias y toda una gran variedad de afecciones entre la población general; no obstante, el “blanco” preferido de esta especie se ubica predominantemente dentro de los hospitales, en donde entra en contacto con numerosos pacientes debilitados, ya sea debido a que éstos padecen de enfermedades graves, traumatismos o quemaduras serios u otras lesiones, incluyendo las provocadas por alguna cirugía, o bien, porque han sido sometidos a tratamientos que abaten la inmunidad celular o a la implantación inadecuada de dispositivos médicos, tales como prótesis, catéteres u otros materiales plásticos (Harbarth, 2008; Hugonnet, 2004; Raad, 2007).
Por lo tanto, es precisamente dentro de las instituciones de salud, en donde resulta notablemente mayor la proporción de individuos que adquieren infecciones por estafilococos u otros agentes microbianos, aun cuando en aquellas se concentran el personal especializado (médicos, químicos de laboratorio, enfermeros, etc.) y los equipamientos diagnósticos y terapéuticos más avanzados (Rayner, 2005; Schramm, 2006).
Cabe agregar que esta irónica situación se ve agravada drásticamente por el hecho de que, en el ambiente nosocomial, residen los microorganismos más resistentes a los antibióticos, aspecto trascendental que suele complicar el éxito de los regímenes terapéuticos, lo que se traduce en considerables índices de mortalidad y en permanencias hasta cuatro veces más prolongadas de los pacientes —con los altos costos que ello implica (Schramm, 2006).
En tal contexto, cada hospital está obligado a instalar comités interdisciplinarios de vigilancia encargados de establecer programas efectivos, para evitar o disminuir la ocurrencia de enfermedades infecciosas que puedan afectar a los internos y al propio personal de la institución; las estrategias seleccionadas deben dar lugar a acciones concretas susceptibles de supervisión, abarcando desde las más sencillas (por ejemplo, el adecuado lavado de las manos y la utilización de gel desinfectante cada vez que se tenga contacto con un paciente y antes de atender a otro), hasta las destinadas a detectar y controlar con atingencia los brotes que llegaran a surgir (Jarvis, 2001; Wassenberg, 2010).
El presente trabajo aborda las temáticas generales más relevantes asociadas a las infecciones intrahospitalarias ocasionadas por Staphylococcus aureus, uno de los tres principales patógenos nosocomiales, haciendo especial énfasis en las causas que sustentan su elevada incidencia y las características de las tres entidades clínicas que se presentan con mayor frecuencia entre los pacientes afectados.
iS. aureus y las infecciones nosocomialesEl término “infecciones intrahospitalarias” se refiere específicamente a aquellos padecimientos ocasionados por microorganismos o agentes virales que se adquieren dentro de las instalaciones nosocomiales y cuya sintomatología aparece, por lo tanto, a partir de las 48 horas posteriores a la admisión del enfermo, en las unidades de cuidados intensivos u otras áreas de atención, e inclusive, independientemente de que la permanencia haya resultado prolongada o sólo se haya tratado de una consulta externa (Jarvis, 2001).
Esta clase de enfermedades representa todo una problemática para las instituciones de salud, ya que su afectación abarca a una importante proporción de internos, e inclusive, llega a ocasionar la muerte de quienes resultan más vulnerables, implicando sobre todo a pacientes inmunodeficientes que padecen cáncer, SIDA, diabetes, quemaduras u otros trastornos debilitantes (alteraciones cardiovasculares o granulocíticas), así como a los enfermos sometidos a regímenes terapéuticos que abaten la inmunidad celular (tales como las basados en corticoesteroides) y a quienes se les han instalado sondas, catéteres venosos o urinarios, tubos endotraqueales, prótesis valvulares o articulares, etc. (Laupland, 2008).
En este delicado contexto, Staphylococcus aureus destaca como uno de los tres principales agentes causales de infecciones intrahospitalarias a nivel mundial: las cepas implicadas, conocidas ampliamente como HA-MRSA (del inglés healthcare-acquired methicillin-resistant Staphylococcus aureus), agravan las condiciones de millones de internos cada año, afectando a todo el espectro de edades y en cualquier pabellón de los nosocomios.1 En tal sentido, es particularmente importante subrayar que su transmisión y diseminación ocurren predominantemente a través del personal del propio hospital y que, en consecuencia, a las HA-MRSA no sólo se les detecta en las diversas áreas sino, paralelamente, en otros centros de salud con los que se comparte a la plantilla de médicos, paramédicos, enfermeros u otros colaboradores del sistema de salud (Pofahl, 2011; Muthukrishnan, 2011; Jones, 2007).
A tal respecto, el personal hospitalario puede contener HA-MRSA en las manos, batas, guantes, corbatas o, inclusive, en su mucosa nasal (como portadores sanos), lo que contribuye a que el microorganismo sea transmitido a los pacientes y a que, consecuentemente, ocurran brotes de neumonía, bacteremia y/o algunos otros padecimientos. Por tal motivo, cuando dicha cepa es detectada en las vías respiratorias altas de algún integrante del equipo de salud o de los propios enfermos, se aplican localmente antibióticos tales como la mupirocina.2 Por obvio, esta importante medida requiere de la periódica realización de cultivos a todo el equipo humano que interacciona con los internos, para que el laboratorio pueda detectar oportunamente a quienes fungen como portadores (Pofahl, 2011; Muthukrishnan, 2011; Jones, 2007; Albrich, 2008).
iiMultirresistencia bacteriana, una amenaza crecienteEn el complejo desafío que suponen las altas tasas de morbilidad y mortalidad de las infecciones intrahospitalarias, un factor determinante es el que combina, dentro de los nosocomios, el intercambio de material genético y el surgimiento espontáneo de mutantes entre los diversos agentes causales, con la progresiva selección de las cepas multirresistentes, la cual avanza inexorablemente conforme las clonas susceptibles pre-existentes van desapareciendo del ambiente al entrar en contacto con los numerosos internos que reciben tratamientos antimicrobianos3 (Rayner, 2005; Arias, 2009).
El primer reporte de resistencia a penicilina en S. aureus se publicó sólo cerca de un año después de iniciada la aplicación de este antimicrobiano para tratar infecciones en humanos. A partir de ese entonces, los estafilococos han seguido adquiriendo resistencia a una mayor cantidad de agentes terapéuticos, complicando cada vez más la curación de los pacientes afectados (Arias, 2009; Wassenberg, 2010).
El paso previo a la inquietante etapa en que se encuentra actualmente la lucha contra los padecimientos nosocomiales ocasionados por S. aureus consistió en la aparición de las cepas HA-MRSA. Éstas, como muchas otras bacterias, producen altas concentraciones de β-lactamasas, enzimas que inactivan a la mayor parte de los antibióticos clasificados como β-lactámicos, tales como las penicilinas y cefalosporinas; sin embargo, también resultan resistentes a oxacilina, meticilina y cloxacilina, antibióticos clasificados como penicilinas no degradables por β-lactamasas, lo que se basa en su capacidad para producir una diferente proteína de unión a penicilina (PBP), denominada PBP2a, la cual no pierde su función catalítica4 en presencia de los mencionados antimicrobianos, ya que ninguno de ellos la reconoce como su “blanco” de acción. La síntesis de la PBP2a se encuentra codificada en el gen mecA y cataliza la reacción de transpeptidación que sustenta la rigidez de la pared celular, aun en presencia de los β-lactámicos comunes o de los no degradables por β-lactamasas, ya que ninguno de ellos la reconoce como su receptor natural (Nakatomi, 1998; Schramm, 2006; Simor, 2010).
El gen mecA y otros que regulan la expresión de este último residen en un elemento genético móvil, denominado cassette estafilocóccico mec (SCCmec), el cual también contiene una secuencia de inserción unida al gen mec y abarca a diversos genes que codifican para una recombinasa que cataliza la inserción y escisión del mencionado elemento móvil a partir del cromosoma bacteriano (Nakatomi, 1998; Simor, 2010).
De acuerdo con lo anterior, la sola aparición de las HA-MRSA ha venido representando un factor particularmente negativo para establecer regímenes terapéuticos efectivos destinados a los internos afectados. No obstante, el reciente panorama intranosocomial luce cada vez más complicado, debido a la existencia de cepas que también han adquirido resistencia a la vancomicina, glucopéptido que había venido significándose como “la última esperanza” para tratar infecciones intrahospitalarias ocasionadas por HA-MRSA u otros agentes causales multirresistentes (Chakraborty, 2011; Wassenberg, 2010; Schramm, 2006; Loomba, 2010).
Si bien desde 1997 se habían detectado cepas de S. aureus que mostraban cierta tolerancia (clasificada como resistencia intermedia) a la vancomicina, fundamentada en el atípico engrosamiento de su pared celular, la resistencia estafilocóccica más efectiva (o resistencia total) a la vancomicina surgió mediante la conjugación de un plásmido, en el contexto de algunas infecciones mixtas ocasionadas conjuntamente por Enterococcus faecalis y HA-MRSA. Como es sabido, los enterococos elaboran las enzimas Van ABHX que sustituyen, en la pared celular, al dipéptido D Alanina-D Alanina, “blanco” de la vancomicina, por la terminación D Alanina-D Lactato, sin afectar la estabilidad bacteriana; además, cuentan con una maquinaria biológica que promueve eficazmente la recombinación genética, tanto dentro de su propio género como con otras bacterias Gram positivas, gracias a los relevantes papeles de sus feromonas y de una proteína conocida como sustancia de agregación (AS), codificadas ambas en el plásmido pAD1 enterocóccico (Chakraborty, 2011; Wassenberg, 2010; Loomba, 2010).
Ante tal panorama, hoy en día, cuando se detectan infecciones intrahospitalarias ocasionadas por cepas resistentes a vancomicina, las limitadas opciones incluyen, de acuerdo con la condición y padecimientos de cada enfermo, la utilización de nuevos antibióticos; entre ellos, figura una droga sintética conocida como Linezolid, la cual corresponde a una oxazolidinona que inhibe la síntesis proteica microbiana, impidiendo que la subunidad ribosomal 50S se incorpore al complejo de iniciación. Asimismo, en ocasiones se aplica exitosamente la combinación de dos estreptograminas (Sinercid), quinupristina y dalfopristina cíclicos, que también impiden la síntesis de proteínas al agente causal, aunque su acción se ejerce sobre el dominio de la peptidil-transferasa de la subunidad ribosomal 50S; una de las propiedades interesantes de estos últimos compuestos consiste en que las moléculas de ambos grupos actúan en forma sinérgica, originando una efectiva acción bactericida y reduciendo la probabilidad de que sobrevivan las variantes resistentes que pudieran surgir hacia uno u otro componentes (Rayner, 2005; Arias, 2009; Schramm, 2006).
Otras alternativas incluyen el desarrollo de nuevos antimicrobianos,5 el estudio de la posibilidad de incrementar la concentración de los antibióticos conocidos y el establecimiento de terapias múltiples consistentes en administrar simultáneamente dos, tres o más fármacos a los enfermos. Estas últimas opciones representan la posibilidad de mayores efectos colaterales, aunque también una alta probabilidad de rebasar la capacidad de los microorganismos para neutralizar la acción de los antimicrobianos (Rayner, 2005; Arias, 2009).
iiiPatogenia asociada a las infecciones intrahospitalarias por S. aureusAl margen de que S. aureus llega a colonizar la piel del 9 a 24% de los individuos sanos, su importante transmisibilidad entre la comunidad tiene que ver más con el hecho de que alrededor del 30% de los adultos es portador nasal y/o nasofaríngeo de esta especie. Lógicamente, las cifras anteriores llegan a parecer hasta exageradas, sobre todo cuando se toma conocimiento de que el microorganismo puede ocasionar diversas patologías al humano, incluidas la furunculosis, impétigo, bacteremia, neumonía, endocarditis, meningitis, artritis purulenta y osteomielitis, y de que, adicionalmente, produce exotoxinas muy agresivas, responsables de frecuentes intoxicaciones alimentarias y de cuadros graves poco comunes, tales como el síndrome del shock tóxico (SST) y el síndrome estafilocóccico de la piel escaldada (SEPE) (Girou, 2003; Chakraborty, 2011; Becker, 2003; Sepkowitz, 2009; de Kraker, 2011).
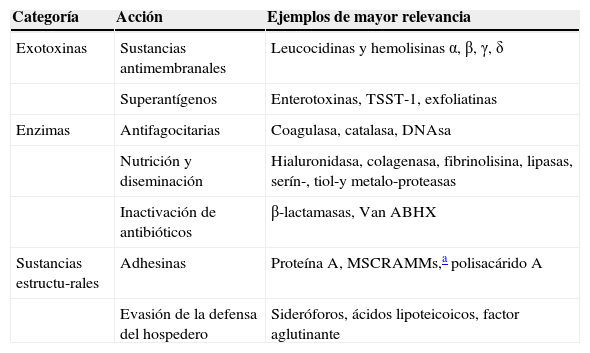
A tal respecto, es preciso subrayar que las cepas HA-MRSA producen numerosos factores de virulencia (consultar la tabla 1), aunque sólo manifiestan su patogenicidad cuando las condiciones tisulares y las relativas a la defensa del individuo resultan propicias para su establecimiento y multiplicación (Gordon, 2008).
Principales factores de patogenicidad detectados en HA-MRSA (Wilson, 2011).
| Categoría | Acción | Ejemplos de mayor relevancia |
|---|---|---|
| Exotoxinas | Sustancias antimembranales | Leucocidinas y hemolisinas α, β, γ, δ |
| Superantígenos | Enterotoxinas, TSST-1, exfoliatinas | |
| Enzimas | Antifagocitarias | Coagulasa, catalasa, DNAsa |
| Nutrición y diseminación | Hialuronidasa, colagenasa, fibrinolisina, lipasas, serín-, tiol-y metalo-proteasas | |
| Inactivación de antibióticos | β-lactamasas, Van ABHX | |
| Sustancias estructu-rales | Adhesinas | Proteína A, MSCRAMMs,a polisacárido A |
| Evasión de la defensa del hospedero | Sideróforos, ácidos lipoteicoicos, factor aglutinante |
Ciertamente, una vez que ha iniciado un cuadro estafilocóccico, la evolución del proceso infeccioso es incierta, debido a la influencia de numerosas toxinas, enzimas y componentes estructurales de la bacteria, así como de ciertos elementos predisponentes comunes en quienes se encuentran internados en los nosocomios; a saber, las erosiones, heridas traumáticas, incisiones quirúrgicas, quemaduras, dermatosis de diversos orígenes, la inadecuada instalación de dispositivos plásticos (catéteres en vías urinarias, sondas intravenosas, suturas o prótesis valvulares cardíacas), cualquier disfunción que tolere el crecimiento y la supervivencia del invasor y, desde luego, los padecimientos debilitantes (diabetes, alcoholismo, disfunción coronaria, tumores malignos, uremia, SIDA, leucemia, etc.) y las deficiencias inmunológicas (Girou, 2003; Chakraborty, 2011; Becker, 2003; Sepkowitz, 2009; de Kraker, 2011; Raad, 2007).
Es importante agregar que muchos de los genes asociados a la virulencia de S. aureus son regulados por un efectivo sistema de quorum-sensing,6 que coordina su comportamiento durante la colonización de los tejidos humanos y la aplicación de estrategias para su sobrevivencia; por ejemplo, cuando las células estafilocóccicas están en un periodo de crecimiento temprano, producen predominantemente sus adhesinas pero, una vez que la población bacteriana entra en su fase exponencial de desarrollo, predomina claramente la síntesis de exoenzimas (Becker, 2003; Gordon, 2008).
Así mismo, la abundancia de material mucopurulento que caracteriza a las infecciones de heridas por esta especie sólo resulta comprensible cuando se conoce que la comunidad microbiana invasora actúa de manera concertada. Esta conducta cumple con el paradigma del proceso de patogénesis bacteriana, que establece un progreso cercano al máximo de colonización y persistencia por parte del invasor, como una necesidad previa (más que una supuesta oportunidad) para que éste proceda a diseminarse (Chakraborty, 2011; Becker, 2003; Gordon, 2008).
ivLas tres infecciones intrahospitalarias más comunes por HA-MRSASi bien las cepas HA-MRSA ocasionan una gran variedad de infecciones intrahospitalarias, entre las que se incluyen a la endocarditis invasiva, la osteomielitis y la artritis purulenta, las entidades clínicas que destacan por su mayor frecuencia son la bacteremia, la neumonía y la colonización de heridas de cualquier origen. Adicionalmente, las bacteremias adquiridas en las unidades de cuidados intensivos tienen una mortalidad de casi 15% e incrementan en más de 20 días la permanencia de los enfermos, con los altos costos que ello supone; por su parte, los MRSA son los principales causantes de infecciones de heridas, ya que ocasionan alrededor del 30% del total de casos, pero también son los más comunes agentes etiológicos de neumonía (su incidencia rebasa el 25%). Adicionalmente, provocan el 10% de las bacteremias7 nosocomiales, cifra que sólo llega a ser superada por otras especies de estafilococos, Enterococcus sp y Candida albicans; cabe subrayar que cuando la bacteremia es primaria8S. aureus también resulta la especie con más aislamientos en el laboratorioc (Harbarth, 2008; Lambert, 2011; Girou, 2003; Chakraborty, 2011).
BacteremiaLa invasión del torrente circulatorio representa un evento casi exclusivo del ambiente intrahospitalario y suele aparecer como consecuencia de cualquier infección estafilocóccica localizada en la piel y las mucosas del tracto respiratorio, aunque también actúa como un factor desencadenante la instalación de cuerpos extraños, tales como las prótesis intravasculares y las sondas o catéteres intravenosos que permanecen por tres días o más, así como los que se introducen en la arteria femoral (Harbarth, 2008; Laupland, 2008; Lambert, 2011; Raad, 2007; Raad, 2004).
Lógicamente, los dispositivos plásticos que llegan a contaminarse durante su inserción también suelen dar lugar a bacteremias cuya detección ocurre en tiempos variables; en cualquier caso, es conveniente retirarlos de inmediato para dar inicio al tratamiento, ya que S. aureus suele formar biopelículas sobre dichos materiales, lo que impide que los antibióticos puedan alcanzar las capas más profundas para detener eficazmente el crecimiento bacteriano (Girou, 2003; Raad, 2004; Raad, 2007).
Los signos y síntomas de la bacteremia incluyen fiebre, escalofríos y toxicidad sistémica, aunque la patología se puede agravar cuando da lugar a endocarditis; es común que ésta se manifieste en forma aguda, destruyendo una o más válvulas cardíacas, lo que se traduce en altas tasas de mortalidad de 40 al 80%, dependiendo del problema médico subyacente, así como de la edad y condición del paciente y, desde luego, de la resistencia de la cepa a los antimicrobianos seleccionados para tratar el padecimiento (Schramm, 2006; Simor, 2010; Raad, 2004; Raad, 2007).
Dada la gravedad de la bacteremia, el diagnóstico se realiza generalmente con base en la sintomatología, aunque también deben realizarse hemocultivos seriados, previa recolección de la sangre del individuo mediante venopunción o a partir de los catéteres intravasculares instalados con anterioridad, a fin de afinar o cambiar el régimen terapéutico inicial (Raad, 2004).
NeumoníaSe estima que la neumonía estafilocóccica se observa más a menudo en niños con fibrosis quística o sarampión, en pacientes debilitados o que padecen influenza y en individuos hospitalizados tratados con antimicrobianos, esteroides y químicos anticancerosos o inmunodepresores (Harbarth, 2008; Girou, 2003; Arias, 2009).
Los principales factores de riesgo son las cirugías recientes, las intervenciones quirúrgicas abdominales y toráxicas, las enfermedades pulmonares obstructivas, las terapias con ventiladores mecánicos,9 las edades avanzadas y la aplicación de fármacos inmunodepresores. Su periodo de incubación fluctúa entre 1 y 7 días, según la concentración de IgA secretoria, la cantidad de inmunoglobulinas y la participación de los PMNs y los macrófagos pulmonares, alveolares y pleurales; sus signos clínicos más relevantes incluyen fiebre, anorexia, vómito, mal estado general y síndrome de insuficiencia respiratoria (disnea, polipnea, aleteo nasal y cianosis), así como accesos tusígenos de características variables (Girou, 2003; Rayner, 2005).
Las complicaciones más frecuentes de la neumonía abarcan insuficiencia cardíaca, septicemia, abscesos pulmonares, obstrucción neumónica con atelectesia y enfisema, ruptura alveolar y desequilibrio hidroelectrolítico. Durante las etapas tempranas de la enfermedad, los pacientes presentan dolor en el pecho, fiebre, aliento muy corto y signos de infusiones pleurales; por lo regular, el diagnóstico requiere de la toraxocentesis y la terapia casi siempre obliga a la intubación pectoral o a la intervención quirúrgica. El tratamiento con antibióticos suele basarse en la administración de penicilinas resistentes a las β-lactamasas, tales como la nafcilina, o bien, de vancomicina, en ambos casos durante varias semanas (Girou, 2003; Rayner, 2005; Arias, 2009; Loomba, 2010; Gordon, 2008).
Infecciones de heridas postquirúrgicasS. aureus es la causa más común de infecciones intrahospitalarias que se localizan en las heridas asociadas a las cirugías, las cuales suelen aparecer más frecuentemente entre los 7 y 10 días posteriores a la intervención, aunque la literatura acepta como rango general el de 2 a 30 días. Lógicamente, en la menor o mayor extensión de ese lapso influyen factores tales como la administración profiláctica de antimicrobianos, las dosis y duración del régimen terapéutico, los procedimientos quirúrgicos, el grado de contaminación microbiológica en el quirófano, el tiempo de la cirugía y la condición intrínseca del paciente (Lambert, 2011; Wassenberg, 2010; Schramm, 2006).
Las medidas de contención para enfermos con infecciones por HA-MRSA incluyen precauciones comunes que incluyen el adecuado lavado de las manos después de tocar fluidos corporales, herramientas potencialmente contaminadas o fomites asociados al enfermo, usar guantes nuevos y bata limpia, etc. Sin embargo, cuando el laboratorio detecta que la herida o absceso de un paciente contiene al microorganismo, es conveniente el aislamiento del individuo, en algún cuarto privado, a fin de que ello funcione como un claro mensaje para el personal médico y sus colaboradores, en el sentido de extremar las precauciones para impedir la diseminación del invasor hacia otros internos (Harbarth, 2008; Albrich, 2008; de Kraker, 2011).
Comentarios finalesDentro de los nosocomios, el papel del químico (QFB, QBP, QB, etc.) resulta de la mayor trascendencia en cuanto a la detección de brotes epidémicos y, posteriormente, en la evaluación de las medidas aplicadas para controlarlos, lo que implica un cuidadoso monitoreo de la calidad de los especímenes recibidos para análisis; por tal motivo, su participación es fundamental en el diseño y la difusión de los lineamientos asociados a la correcta selección y recolección de las muestras clínicas a analizarse.
Así mismo, la realización de pruebas de susceptibilidad a los antibióticos (antibiogramas), debe tomar en cuenta la emergencia de mayor resistencia entre las cepas intrahospitalarias, lo que obliga a incorporar una mayor cantidad de antimicrobianos, para elegir a los más activos, respetando siempre los lineamientos metodológicos del CLSI (Clinical and Laboratory Standards Institute).
Finalmente, cabe señalar que si bien las cepas MRSA son típicas del ambiente intrahospitalario, estos microorganismos ya empiezan a ocasionar problemas entre la comunidad extranosocomial, lo que refleja una desafortunada extensión de la problemática abordada hacia la población general. Hoy en día, no es raro que estas cepas causen neumonías necrosantes y contagiosas afecciones de la piel en niños de guarderías y escuelas, así como bacteremias entre los drogadictos; de hecho, también se han detectado portadores nasales de MRSA en numerosos individuos sanos.
Tal es el enorme riesgo de las cepas MRSA, que el CDC (Center for Diseases Control and Prevention) de EUA las tiene señaladas, junto con la influenza A H1N1, la tuberculosis, el cáncer ocupacional, el West Nile Virus, la influenza aviar y el síndrome respiratorio agudo severo (SARS), entre otras, como amenazas en el campo profesional, en su página informativa Workplace Safety & Health Topics.
La mupirocina resulta muy tóxica para uso oral o parenteral, pero es muy efectiva y no provoca mayores reacciones colaterales cuando se emplea tópicamente.
Las bacterias susceptibles desaparecen de los hospitales conforme entran en contacto con los pacientes que reciben antibióticos, lo que supone un balance a favor de las resistentes, e inclusive, una mayor frecuencia de recombinación genética entre éstas, que conduce a la adquisición de multiresistencia.
Las PBPs catalizan importantes reacciones de transpeptidación y transglicosidación que aportan la rigidez de la pared celular bacteriana.
El desarrollo de nuevos antibióticos representa una opción cuyos resultados suelen obtenerse en periodos más prolongados de lo deseado (12-15 años hasta su comercialización).
El término quorum-sensing se refiere al conjunto de los mecanismos que hacen posible un comportamiento general sincrónico, como comunidad, por parte de la bacteria (en este caso invasora). Dichos mecanismos dependen de ciertas densidades celulares alcanzadas por la microcolonia, indispensables para coordinar la síntesis de adhesinas, biopelículas, toxinas y otros factores de virulencia.
El término “bacteremia” significa invasión del torrente circulatorio por bacterias que logran reproducirse en la sangre.
La expresión “bacteremia primaria” se emplea para diferenciar los casos en que no se ha aislado al microorganismo con anterioridad, a partir de otras muestras clínicas del paciente. Análogamente, se habla de “bacteremia secundaria” para denotar la previa detección del agente causal en otras muestras de regiones anatómicas diferentes.