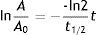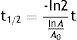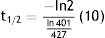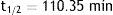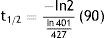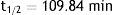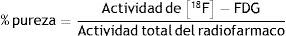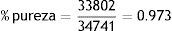La radioactividad es más conocida por sus efectos nocivos, por el estallido de las bombas atómicas en la Segunda Guerra Mundial, pero también tiene funciones beneficiosas para el cuidado de la salud, ya que sirve tanto para el diagnóstico temprano de enfermedades como para su tratamiento. En este trabajo se presenta, desde una perspectiva de educación química, los conceptos fundamentales de la tomografía por emisión de positrones (PET). Asimismo, se explica el proceso de producción de radiofármacos para PET, en particular 18F. También, se discuten diversos tipos de radiofármacos utilizados para diagnóstico de enfermedades oncológicas, neurológicas y cardíacas. El uso y aplicaciones clínicas de este método de imagen es ya una realidad en México desde el año 2005. Se espera que estudiantes y profesores del área de ciencias químico-biológicas logren una mejor comprensión y un panorama de los alcances y aplicaciones que puede tener esta técnica.
The radioactivity is more known for adverse effects by the explosion of atomic bombs in World War II, but also has features beneficial to health care since it serves for the early diagnosis of diseases to your treatment. This paper presents, from a perspective of chemical education, the fundamental concepts of the Emission of Positron Tomography (PET). Also explains the process of production of radiopharmaceuticals for PET, in particular 18F. Also, different types of radiopharmaceuticals used for diagnosis of oncological, neurological and cardiac diseases are discussed. The use and clinical applications of this method of Imaging is already a reality in Mexico since 2005. It is expected students and teachers of the area chemical biological sciences achieve a better understanding and an overview of the scope and applications that this technique can have.
Los científicos han trabajado constantemente en el desarrollo de diferentes aplicaciones de la radioactividad desde su descubrimiento, uno de los campos con importantes logros es el de la medicina.
Esto es muy significativo, considerando el temor generalizado que se le tiene a este controvertido fenómeno, ya que lo más conocido por la gente fuera del mundo científico son los efectos causados por el estallido de las bombas atómicas durante la segunda guerra mundial (Guibertau and Mettler, 2012), Desde una perspectiva de educación química hay que explicar que la radiactividad, en cantidades pequeñas y perfectamente controladas, sirve tanto para el diagnóstico temprano de enfermedades como para su tratamiento.
La medicina nuclear es la disciplina dedicada a este tipo de aplicaciones de la radiactividad, en las que destaca en forma importante el área de diagnóstico, tema sobre el cual enfocaremos nuestra atención. De manera simplificada, se puede decir que para el diagnóstico se realizan dos tipos de estudios: in vivo e in vitro (Lezama, 1997). Los estudios in vivo consisten en administrar al paciente, generalmente por vía intravenosa, una pequeña cantidad de una sustancia radiactiva, conocida como radiofármaco, y seguir su trayectoria por medio de un equipo externo de detección de la radiación.
Numerosos radiofármacos exigen, antes de su dispensación y posterior administración al paciente, someterlos a un proceso previo de preparación (preparación extemporánea). La responsabilidad de esta preparación extemporánea, así como el buen uso de los medicamentos radiofármacos, es competencia exclusiva del químico especialista en Radioquímica o Radiofarmacia, y en la preparación de radiofármacos para la Tomografía por Emisión de Positrones (PET), medicamentos marcados con radionúclidos emisores de positrones producidos en ciclotrones. Las sustancias radiactivas empleadas como radiofármacos contienen en su estructura un radionúclido y su forma química define su comportamiento en el organismo. Los radionúclidos utilizados en los radiofármacos deben reunir determinadas características. Su vida media física y biológica debe ser corta, o relativamente corta, para que pueda detectarse en el organismo sin ocasionar una irradiación excesiva. Otras características importantes son sus propiedades fisicoquímicas, las cuales deben ser adecuadas para poder preparar el radiofármaco en la forma farmacéutica requerida, y estar disponible en el sitio de su aplicación (Carrió y González, 2003).
El objetivo de esta comunicación es explicar y transmitir conceptos fundamentales de la Tomografía por Emisión de Positrones aplicada al diagnóstico de enfermedades para lograr una mayor comprensión y análisis de los alcances y aplicaciones que puede tener esta técnica. La PET es utilizada para la obtención de imágenes en medicina nuclear molecular para el diagnóstico de enfermedades. El principio del tomógrafo por emisión de positrones consiste en la detección de elementos radiactivos que emiten positrones para posteriormente reconstruir imágenes bidimensionales y tridimensionales de la distribución de dicha radiación dentro del cuerpo humano mediante algoritmos matemáticos (Thie, 2012). Los elementos radiactivos provienen del paciente al cual le inyectaron previamente cierta molécula «marcada» con un radionúclido (radiofármaco) (Lezama y Espejel, 1982).
La preocupación por la detección en etapas tempranas de las enfermedades y el correcto diagnóstico de las mismas, induce los avances de la tecnología en equipos de aplicaciones médicas, una de las tecnologías más recientes es la llamada tomografía por emisión de positrones, mejor conocida como PET. Esta es una nueva modalidad en la medicina nuclear que basa su funcionamiento en la naturaleza de los positrones.
Los radiofármacos son medicamentos a los cuales se les ha pegado un radioisótopo dentro de su estructura y que, por su forma farmacéutica, cantidad y calidad de radiación, puede ser administrado en pacientes con fines de diagnóstico y/o terapéuticos (Ferro, 2000). Los radiofármacos constan de una molécula específica unida a un átomo radiactivo, la molécula específica determina la ruta metabólica y el elemento radiactivo permite la detección externa de la biodistribución del radiofármaco dentro del organismo.
La medicina nuclear diagnóstica se basa en el uso de los radiofármacos, donde un isótopo radiactivo se incorpora a una molécula orgánica o inorgánica que se dirige selectivamente a un órgano de interés o que se incorpora a un proceso metabólico o fisiológico del organismo. Dado que el isótopo es un emisor gamma o de positrones, se pueden obtener por medio de sistemas de detección llamados gammacámaras (la gammacámara es un dispositivo de captura de imágenes, la imagen realizada se llama gammagrafía, este proceso aporta información morfológica y funcional del órgano o tejido en concreto) se utiliza en medicina nuclear y equipos de PET, externamente imágenes in vivo del funcionamiento de los diversos órganos o sistemas, las cuales se procesan en sistemas de cómputo y se imprimen en placas radiográficas o fotográficas. Estas imágenes pueden ser analizadas y correlacionadas con experiencias clínicas. Lo más importante de los radiofármacos para diagnóstico es que pueden obtenerse estudios «dinámicos» lo que no puede lograrse con el ultrasonido o la tomografía convencional (Bicher, Wehrl, Judenhofer, 2008).
Producción de radiofármacos para tomografía por emisión de positronesLos radiofármacos PET son considerados medicamentos y como tales su fabricación debe realizarse en una zona limpia para minimizar los riesgos de contaminación microbiana, de partículas y de pirógenos (Oyama, Akino, Kanamaru, 2003).
Se considera que la PET es actualmente la única técnica que permite obtener imágenes capaces de proporcionar información cuantitativa sobre procesos bioquímicos y fisiológicos. Debido a que las mediciones fisiológicas se requieren para la obtención de una imagen única, se emplean radioisótopos de vida media muy corta para marcar las moléculas trazadoras. La producción de los radioisótopos de ciclotrón y su marcado se efectúan in situ.
En México, la utilización de los equipos PET se inició con la apertura de la Unidad PET-Ciclotrón de la Universidad Nacional Autónoma de México en 2002. Actualmente en México se cuenta con 13 equipos PET.
Los radioisótopos más empleados son el 18F (vida media de 110min), el 11C (20min), el 13N (10min) y el 15O (2min).
La producción de los radionúclidos se lleva a cabo dentro de un acelerador de partículas llamado ciclotrón.
La ventaja de tener un ciclotrón dentro de las instalaciones del hospital, es el poder disponer de radiofármacos con vida media corta (110 min aproximadamente) para la realización de los diferentes estudios, ya que se pueden utilizar y ser administrados a los pacientes inmediatamente después de ser sintetizados en el laboratorio.
Los radionúclidos producidos en los ciclotrones no tienen la forma química y farmacéutica adecuada para ser utilizados como trazadores biológicos por lo que deben ser incorporados a moléculas más complejas, lo cual se lleva a cabo en un laboratorio de radiofarmacia. El radiofármaco obtenido debe ser sometido a estrictos ensayos de control antes de ser administrado al paciente, por lo que la unidad debe contar con un laboratorio de control de calidad (Christian y Wahl, 2003).
Producción 18FEn el caso de la producción de [18F], las partículas que se aceleran son iones de hidrógeno (fig. 1a y b). La ecuación que define dicha reacción es la siguiente:
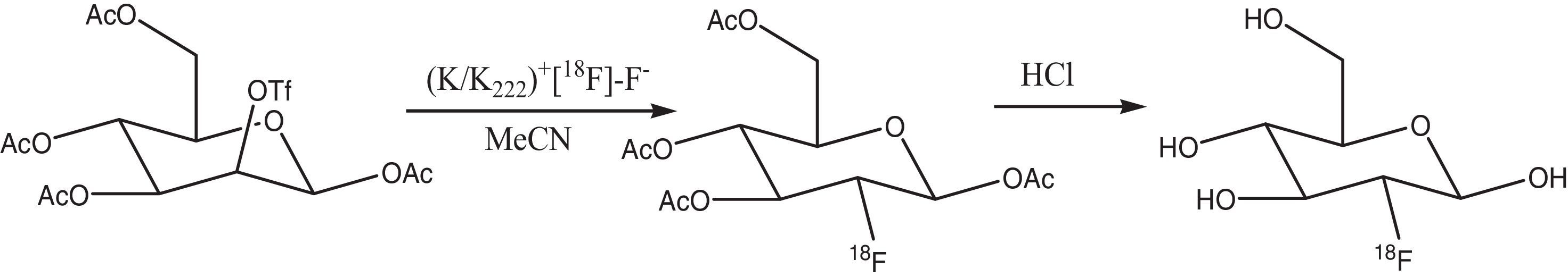
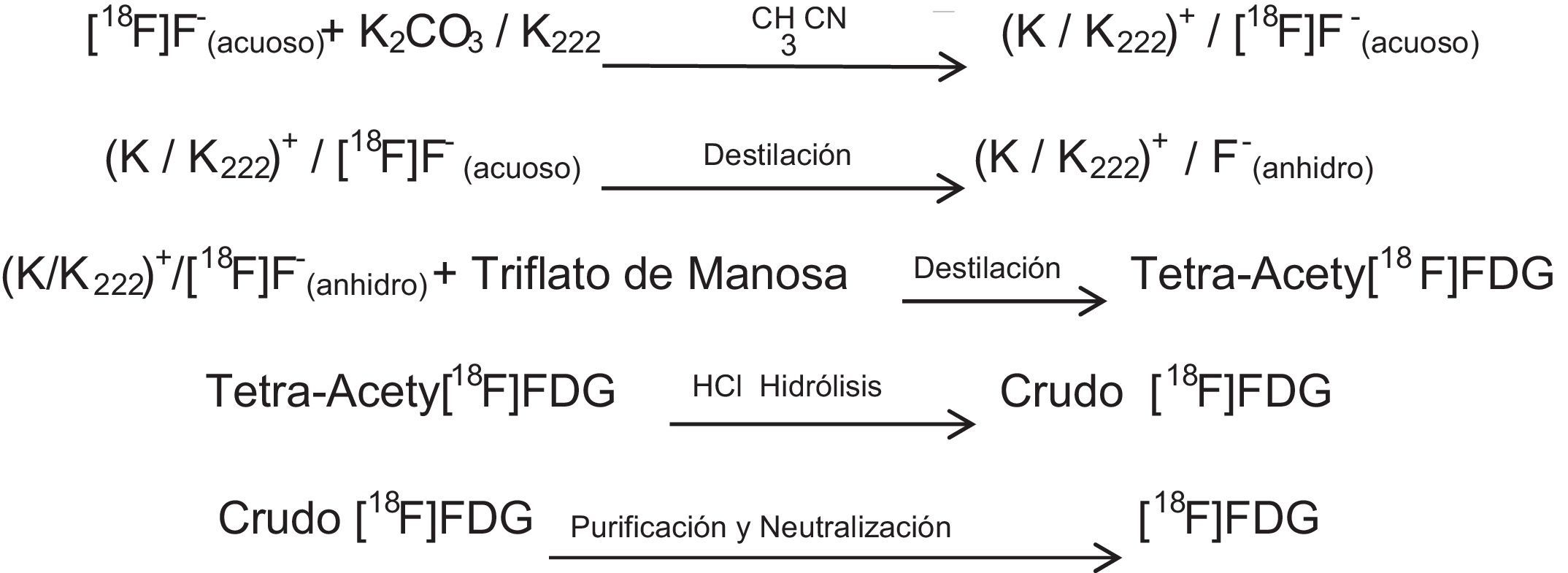
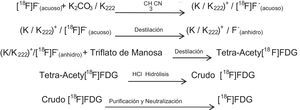
Manipulación de 18F (producción de FDG)Una vez producido el radionúclido, este es descargado y atrapado en una resina de intercambio iónico como [18F]-fluoruro. Esta resina está acondicionada en la forma de CO32-(NaHCO3 1.0M), con la cual se captura hasta un 95% del anión [18F]-fluoruro producido; esta actividad es registrada mediante una cámara de ionización activímetro (CRC 15 PET, Capintec Inc.) y con esto se cuantifica la cantidad de [18F]-fluoruro producido por el ciclotrón. Posteriormente el [18F]-fluoruro, que se encuentra en la resina es extraído empleando una disolución de K2CO3. Como el K18F no es soluble en disolventes orgánicos, se utiliza un aminopoliéter llamado K222 (4,7,13,16,21,24-hexaoxa-1,10-diazobiciclo (8.8.8) hexacosano) como catalizador de transferencia. De la cantidad capturada de [18F]-fluoruro por la resina, se logra transferir aproximadamente un 96-98%. La cantidad transferida de [18F]-fluoruro se colecta en un tubo de borosilicato, obteniéndose una solución del complejo K/K222+/[18F]-F-; este complejo fluorado se somete a calentamiento para eliminar la mezcla de disolventes con la cual se prepara el K222 (H2O/MeCN), teniendo así un medio anhidro y permitiendo que el complejo se solubilice en el disolvente de la reacción (MeCN). Se realiza a continuación una evaporación de disolvente, con lo cual se asegura un medio anhidro; a continuación se realiza la reacción con triflato de manosa (1,3,4,6-tetra-O-acetil-trifluorometanosulfonilo-β-D-manopiranosa) disuelta en MeCN, en esta molécula el grupo saliente y por ende el sustituido es el triflato de C2, rompiéndose el enlace C-O y generándose el enlace C-F vía SN2, teniéndose una inversión en la configuración produciéndose 2-[18F]fluoro-2-desoxi-1,3,4,6-tetra-O-acetil-β-D-manopiranosa. Debido a que en el triflato de manosa existen cuatro grupos protectores, se procede a removerlos, razón por la cual se lleva a cabo una hidrólisis ácida con HCl 0.1M; esta mezcla es calentada a 110°C por 8 min, con lo cual los grupos acetilos de la 2-[18F]fluoro-2-desoxi-1,3,4,6-tetra-O-acetil-β-D-manopiranosa se convierten a grupos hidroxilos, generándose así la 2-[18F]flúor-2-desoxi-D-glucosa o simplemente [18F]-FDG.
El esquema de reacción para la producción de [18F]-FDG puede verse en esta página (Esquema 1).
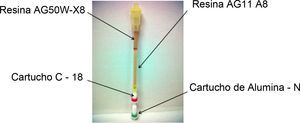
PurificaciónEn la síntesis del radiofármaco no solo se obtiene un producto, sino que se obtienen subproductos, los cuales no son de utilidad clínica (polímero de la [18F]-FDG, compuestos polifluorados, 2-[18F]fluoro-2-desoxi-1,3,4,6-tetra-O-acetil-β-D-manopiranosa, etc.), por esta razón se realiza una purificación por cromatografía en columna (fig. 2), utilizando resinas de intercambio iónico (AG11 A8 y AG50W-X8). La resina AG11 A8 sirve para eliminar (atrapar) los residuos del 4,7,13,16,21,24-hexaoxa-1,10-diazobiciclo (8.8.8) hexacosano y la resina AG50W-X8 se emplea para eliminar aniones carbonato de K2CO3, cloruros y grupos acetato, además se utiliza un cartucho llamado C-18 (Sep®-Pak) con el cual se eliminan azúcares polimerizados y finalmente se utiliza un cartucho de alúmina-N (Waters®) cuya función es remover el ion [18F]-fluoruro que no reaccionó. Finalmente el producto es diluido en agua estéril para inyección, libre de pirógenos grado USP y es transferido a un vial estéril de 30ml donde el [18F]-FDG es esterilizado por microfiltración utilizando un filtro de membrana de 0.22μm; el radiofármaco es colectado para su posterior fraccionamiento y colocado en un contenedor de wolframio para atenuar la radiación emitida por la [18F]-FDG.
Con este método se logra sintetizar el radiofármaco con rendimientos químicos y actividades específicas altas.
Control de calidadLos radiofármacos deben ser sometidos a diferentes controles de calidad que asegure su pureza, seguridad y eficacia (Spielmann, Peterbauer, Schindler, 2005). Además de las pruebas fisicoquímicas clásicas (apariencia física, color, ausencia de partículas extrañas, pH, etc.), esterilidad y ausencia de pirógenos, los radiofármacos deben poseer una adecuada pureza radionúclida y radioquímica (Hartung, Wendel, 1996).
Para la validación del radiofármaco se realiza un control de calidad estricto, dentro de este control de calidad se tienen que realizar diferentes pruebas para que el radiofármaco pueda ser liberado del laboratorio y finalmente sea enviado a los diferentes hospitales de grupo Ángeles que utilizan el [18F]-FDG para estudios diagnóstico de cáncer.
Las pruebas de control de calidad realizadas son:
- a)
Apariencia: la primera prueba es visual. La formulación debe ser clara, incolora y libre de partículas (fig. 3). Para realizar esta prueba se realiza la observación a través de un vidrio emplomado, para evitar la exposición innecesaria al material radiactivo.
- b)
pH: este radiofármaco es administrado por vía intravenosa por lo que la determinación del pH es muy importante (fig. 4). El pH puede estar en un intervalo de 4.5 – 8.0, de tal forma que no ocasione molestias al paciente. Esta prueba se realiza utilizando tiras de papel para pH.
- c)
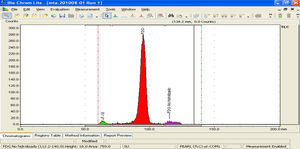
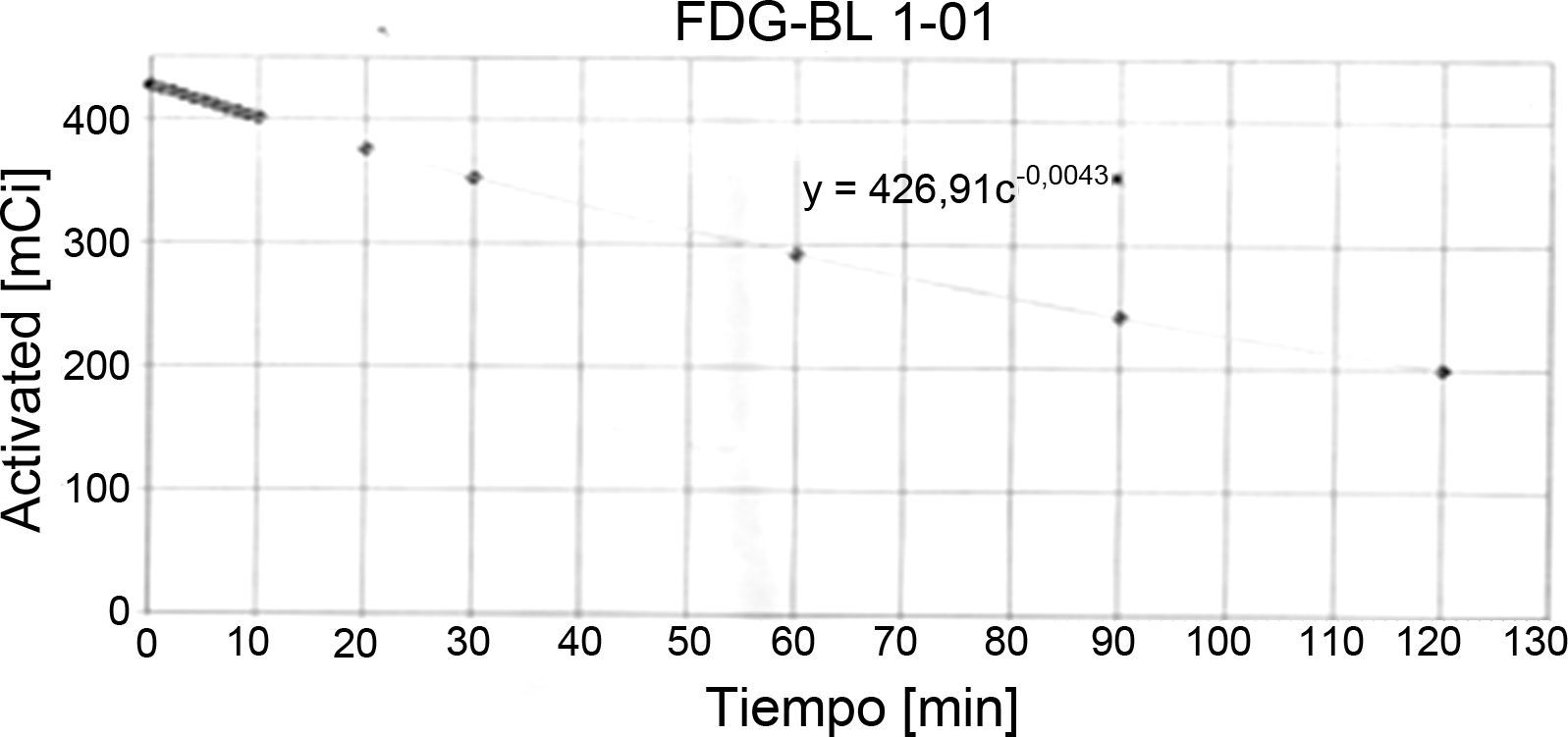
Identidad radionúclida: esta prueba se basa en la determinación de la vida media del radionúclido, haciendo uso de algún sistema de detección (cámara de ionización activímetro, CRC 15PET Capintec Inc.), la cual debe estar comprendida entre 105 - 115 min para 18F, para poder ser aprobada (fig. 5). La vida media del [18F es de 109.7 min.
- d)
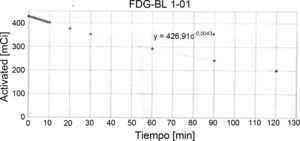
El procedimiento que realizamos en el área de ciclotrón y radiofarmacia para determinar la vida media es el siguiente: el producto final (FDG), que se ha recolectado en un vial de cristal de 30ml (fig. 3), se coloca en el activímetro para determinar la actividad (en mCi) que se tiene en ese momento t=0. Se realiza la medición de la actividad durante 2 h, se toman lecturas cada minuto (los primeros 10 min) seguidas de otras lecturas a los 20, 30, 60, 90 y 120 min respectivamente. Los datos obtenidos se tabulan y por medio de la ecuación de vida media obtenemos la gráfica de la vida media (fig. 6):
Aplicando logaritmo a la ecuación de actividad y vida media.
De la tabla 1, tenemos que para un tiempo de 10 min la lectura fue 401 mCi, sustituyendo en la ecuación anterior.
Para 90 min, la lectura fue 242 mCi sustituyendo obtenemos (fig. 7):
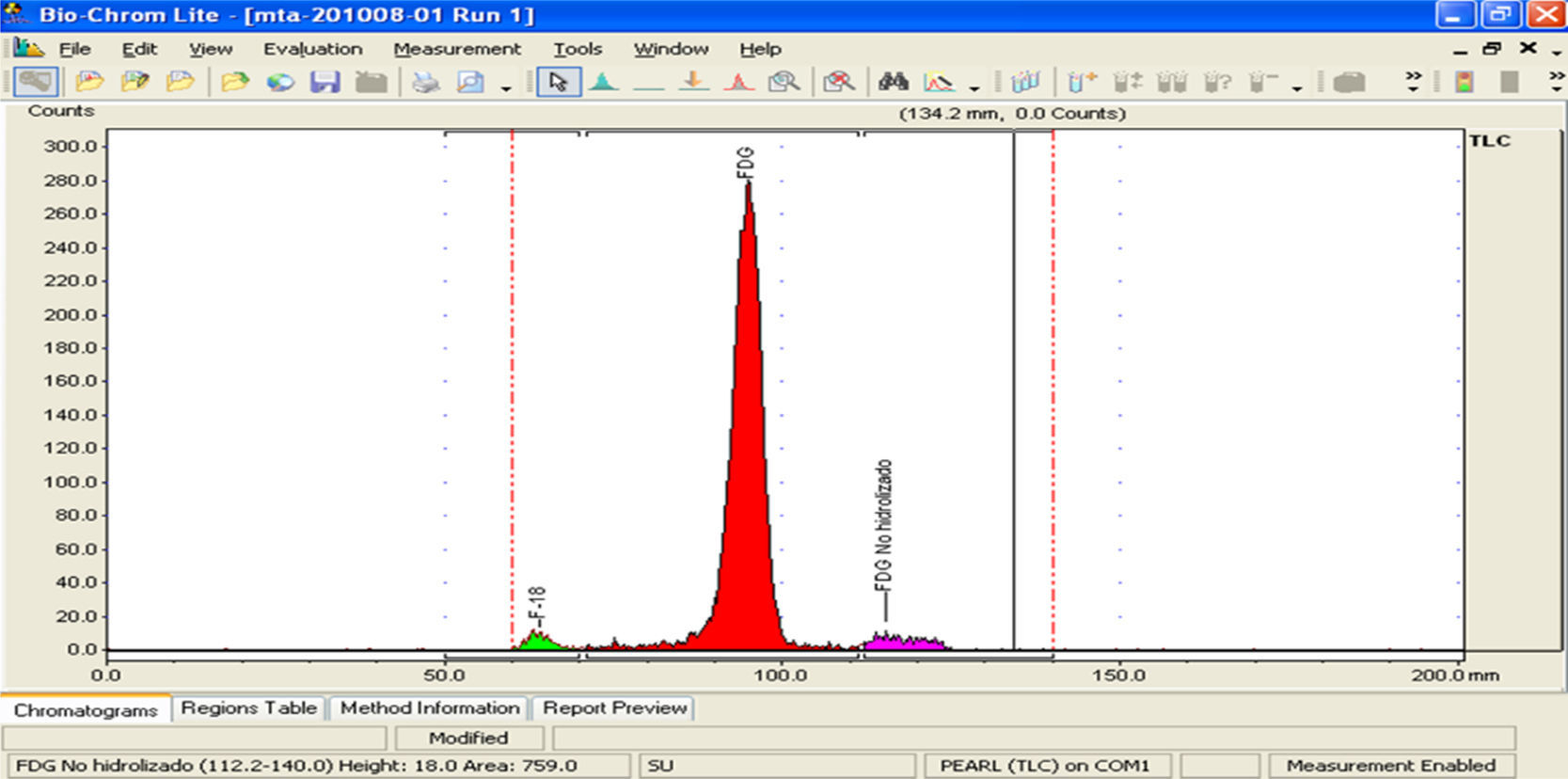
e) Pureza radioquímica: la pureza radioquímica es la fracción de radionúclido presente en la forma química deseada en un radiofármaco. Esta prueba se realiza con una cromatografía en capa fina utilizando una placa de silica gel, para ello se utiliza una fase móvil de una mezcla de disolventes (MeCN/H2O) en una relación 95:5, la cual fue probada para obtener un resultado en el menor tiempo posible. Una vez que se ha realizado la placa cromatográfica se realiza un escaneo de dicha placa con un detector colimado de radiación (BIOSCAN), determinando de esta forma la localización de [18F]-FDG, 18F y del 2-[18F]fluoro-2-desoxi-1,3,4,6-tetra-O-acetil-β-D-manopiranosa. El valor de [18F]-FDG para que la prueba sea aceptada para su distribución debe ser mayor del 90% (FDG>90%), de la radioactividad total.
f) Pureza radionúclida: la pureza radionúclida se define como la relación existente entre la actividad de un determinado radionúclido y la actividad total del compuesto (radiofármaco). Las impurezas radionúclidas esperables son otros radionúclidos vinculados con el método de producción.
Para la realización de esta prueba se utiliza un espectrómetro gamma previamente calibrado, dentro del cual se coloca una pequeña muestra de la [18F]-FDG, obteniéndose así un espectro gamma. Este espectro es analizado para detectar la presencia de la emisión gamma correspondiente al [18F]-FDG a (511KeV), este valor no debe ser menor del 90% de pureza en la muestra.
Por definición, el porcentaje real es determinado de acuerdo a la siguiente relación:
Dónde:
La actividad del [18F]-FDG es obtenida del espectro gamma a 511KeV.
La actividad total del radiofármaco es obtenida del punto más alto del espectro gamma.
Por ejemplo, si a la energía de 511KeV tenemos que la actividad es de 33,802 cuentas (desintegraciones por minuto) y en el punto más alto del espectro gamma tenemos que la actividad total del radiofármaco es de 34,741 cuentas con una energía de 512.9KeV, con la relación anterior obtenemos:
Por lo tanto el porcentaje de pureza radionúclida es 97.3% (figs. 8 y 9).
g) Prueba de pirógenos (endotoxinas bacterianas): para la determinación de endotoxinas se realiza el ensayo de Limulus Amebocyte Lysate, esta es una prueba cualitativa para endotoxinas bacterianas Gram negativas, para ello se realiza un inóculo de la muestra en la solución del Limulus Amebocyte Lysate, posteriormente se incuba este a 37°C durante aproximadamente 60min (fig. 10); la formación de un gel indica la presencia de endotoxinas pues en ausencia de endotoxinas no ocurre formación de gel. La infección de Gram negativas por Limulus polyphemus tiene como consecuencia una coagulación intravascular fatal. Se ha demostrado que esta coagulación es el resultado de la acción de la endotoxina y una proteína gelificante en los amebocitos circulantes en la sangre.
h) Esterilidad: esta prueba se realiza utilizando medios de cultivo aptos para crecimiento de bacterias aerobias y bacterias anaerobias. El medio de cultivo utilizado es caldo tioglicolato.
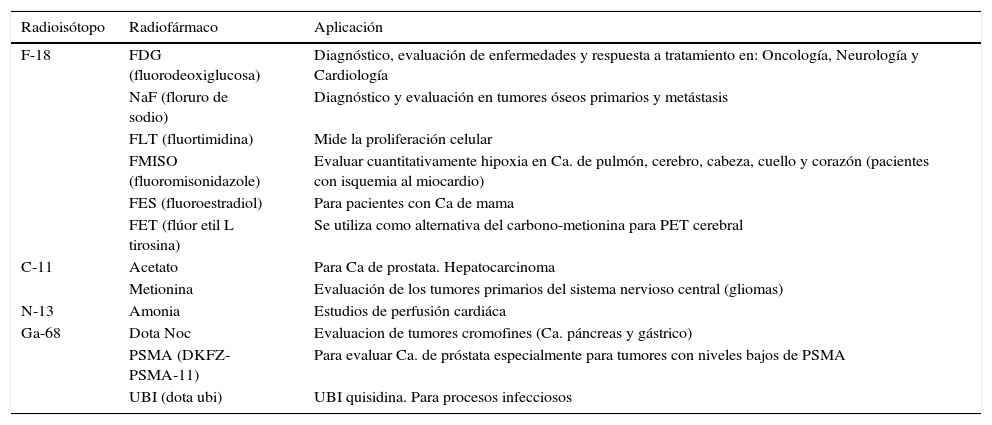
AplicacionesRadiofármacos para diagnóstico: existen alrededor de 117 radiofármacos para diagnóstico aprobados para su uso en humanos (FDA, EE. UU.). El radioisótopo más común es el Tecnecio-99m (99mTc) a partir del cual pueden preparase alrededor de 53 diferentes radiofármacos aprobados, lo que constituye 65% de todos los estudios de medicina nuclear que se practican a nivel mundial y aproximadamente 80% de estos realizados en México.
Los radiofármacos para diagnóstico pueden clasificarse como agentes óseos, hepáticos, hepatobiliares, cerebrales, cardíacos, renales, pulmonares, tiroideos, para el diagnóstico de neoplasias y para la detección de procesos infecciosos ocultos (tabla 2).
Algunos radiofármacos utilizados para diagnóstico y evaluación de enfermedades en diferentes especialidades de la medicina
| Radioisótopo | Radiofármaco | Aplicación |
|---|---|---|
| F-18 | FDG (fluorodeoxiglucosa) | Diagnóstico, evaluación de enfermedades y respuesta a tratamiento en: Oncología, Neurología y Cardiología |
| NaF (floruro de sodio) | Diagnóstico y evaluación en tumores óseos primarios y metástasis | |
| FLT (fluortimidina) | Mide la proliferación celular | |
| FMISO (fluoromisonidazole) | Evaluar cuantitativamente hipoxia en Ca. de pulmón, cerebro, cabeza, cuello y corazón (pacientes con isquemia al miocardio) | |
| FES (fluoroestradiol) | Para pacientes con Ca de mama | |
| FET (flúor etil L tirosina) | Se utiliza como alternativa del carbono-metionina para PET cerebral | |
| C-11 | Acetato | Para Ca de prostata. Hepatocarcinoma |
| Metionina | Evaluación de los tumores primarios del sistema nervioso central (gliomas) | |
| N-13 | Amonia | Estudios de perfusión cardiáca |
| Ga-68 | Dota Noc | Evaluacion de tumores cromofines (Ca. páncreas y gástrico) |
| PSMA (DKFZ-PSMA-11) | Para evaluar Ca. de próstata especialmente para tumores con niveles bajos de PSMA | |
| UBI (dota ubi) | UBI quisidina. Para procesos infecciosos |
Radiofármacos óseos: se han utilizado derivados de fosfatos y fosfonatos como el etilen-hidroxi-difosfonato (99mTc-EHDP) y el metilendifosfonato (99mTc-MDP). Un estudio gammagráfico óseo provee información funcional sobre el incremento de la formación ósea, la ausencia de hueso e incremento o ausencia del flujo sanguíneo. Esta información puede ser útil para el diagnóstico y seguimiento de patologías tales como el hiperparatiroidismo, tumores, malformaciones arteriovenosas y la osteomielitis crónica entre otras.
Radiofármacos hepáticos: se emplean coloides de azufre, fitato o estaño marcados con 99mTc. La imagen gammagráfica hepática pone de manifiesto patologías del hígado por modificaciones de la morfología o por alteraciones en la homogeneidad de la captación del isótopo. Así, los procesos tumorales, el carcinoma primitivo o metastásico del hígado, los procesos quísticos, el quiste hidatídico y el absceso hepático son algunas de las patologías que pueden estudiarse por procedimientos de medicina nuclear.
Radiofármacos hepatobiliares: con estos compuestos se pueden obtener estudios dinámicos del sistema hepatobiliar, para lo cual se usan derivados del ácido fenil-carbamoil-metil-iminodiacético como el 99mTc-DIPA (2,6-diisopropil) y el más reciente 99mTc-Mebrofenin (3-bromo-2,4,6-trimetil). De manera muy general, las patologías de vías biliares detectadas por centelleografía hepatobiliar son: colestasis, estudios de ictericias prolongadas en el recién nacido para confirmar hepatitis o atresia de vías biliares, colecistitis aguda, tamaño y colocación de la vesícula biliar, evaluación de traumatismos abdominales o evaluación postoperatoria del sistema hepatobiliar.
Radiofármacos cerebrales: el 99mTc-DTPA sirve para evaluar traumatismos cerebrales y el 99mTc-HMPAO, derivado de la propilenaminooxima, tanto como el 99mTc-ECD, dímero del etil cisteinato, son capaces de atravesar la barrera hematoencefálica. Por lo que con estos dos últimos compuestos, es posible detectar cambios en el padrón de distribución en varias patologías y trastornos mentales como la demencia senil causada por lesiones vasculares, la enfermedad de Alzheimer, la epilepsia y la migraña. También existe la posibilidad de localizar un infarto agudo cerebral, incluso antes que con la tomografía computarizada.
Radiofármacos cardíacos: los más difundidos son derivados de isonitrilos formando complejos catiónicos liposolubles con el 99mTc y el cloruro de Talio-201. De hecho, en estos estudios se pone de manifiesto la característica única de la obtención de imágenes en la medicina nuclear que es mostrar diferentes funciones de un órgano. En este caso, es posible estudiar 14 funciones cardíacas, incluidos los procesos bioquímicos y metabólicos de sus diferentes estructuras.
Radiofármacos renales: durante muchos años se ha empleado el 131I-ortoyodohipurato de sodio con el que se evalúa la depuración renal mediante estudios cuantitativos renales como el flujo efectivo renal, la función de perfusión diferencial o la orina residual. También puede evaluarse la tasa de filtración glomerular y el reflujo. Desde hace poco se trabaja con los compuestos de oxo-Tecnecio como el 99mTc-MAG3 y el 99mTc-EC (etilcisteinato) muy útiles en la evaluación de trasplantes renales. Para estudios de perfusión renal se prefiere el 99mTc-DMSA.
Radiofármacos pulmonares: se emplean principalmente macroagregados de albúmina (99mTc-MAA) como agentes para evaluar la perfusión pulmonar y el 99mTc-DTPA en forma de aerosol para estudios de ventilación pulmonar. Estos procedimientos son útiles para el estudio de embolias pulmonares, enfermedad pulmonar obstructiva, enfisema pulmonar y asma por citar algunos.
Radiofármacos tiroideos: el radiofármaco de elección para trastornos tiroideos es el yoduro de sodio I-131.
Radiofármacos para diagnóstico de neoplasias: con cada uno de los radiofármacos de diagnóstico es posible visualizar alteraciones que nos permiten sospechar o confirmar la presencia de un cáncer. Sin embargo, existen compuestos más específicos y selectivos para ciertos tipos de cánceres y sus metástasis como es el neuroblastoma y el feocromocitoma, los cuales se detectan con una alta sensibilidad mediante el empleo del radiofármaco 131I-metayodobencilguanidina (131I-MIBG), el cual, a su vez pude ser empleado como un efectivo método de tratamiento para estas neoplasias. Otro de los radiofármacos ampliamente utilizado para la detección de cánceres y procesos inflamatorios es el citrato de galio-67.
Radiofármacos para diagnóstico de procesos infecciosos ocultos: dado que un absceso es una acumulación focal de leucocitos, estos pueden marcarse in vivo con 99mTc-HMPAO y obtener imágenes de la extensión y localización de un absceso o proceso inflamatorio. También puede emplearse gammaglobulina humana marcada con Tc-99m.
Conclusiones- •
La PET, como el mejor representante de las técnicas de imagen molecular, nos permite no solo hacer una evaluación más apropiada de los pacientes, sino realizar un enfoque de terapia personalizada, al ayudar a resolver algunas de las preguntas más frecuentes relacionadas con el cáncer, como: ¿es maligna la lesión?, ¿el cáncer está diseminado?, ¿la terapia que se va a formular es óptima?, ¿está funcionando la terapia administrada? y ¿el tumor está controlado, o en recaída?
- •
Las características únicas de imágenes de PET, que analiza y cuantifica in vivo procesos bioquímicos o fisiológicos, permiten al médico examinar el tejido corporal vivo desde una perspectiva bioquímica o fisiológica más que una estructural o anatómica. El PET ha aumentado nuestro conocimiento de la fisiología y bioquímica tanto en condiciones de normalidad como en los estados de enfermedad.
- •
El PET-FDG está en uso clínico rutinario y su aplicación más frecuente es en oncología, especialmente en el estudio de nódulos pulmonares, después de la demostración favorable del costo-beneficio.
Los autores declaran no tener ningún conflicto de intereses.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.














![Reacción para la preparación del radiofármaco [18F]-FDG. Reacción para la preparación del radiofármaco [18F]-FDG.](https://static.elsevier.es/multimedia/0187893X/0000002700000004/v3_201703180213/S0187893X16300076/v3_201703180213/es/main.assets/thumbnail/sc1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)