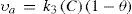Among the most important limitations to carry out chemistry laboratory practices at many primary and secondary schools from some Latin American countries is the scarce availability of lab materials, chemical reagents, and appropriate equipments to make the required measurements. This work shows the use of low cost materials as a successful alternative to observe the adsorption phenomenon of colouring molecules on a solid. For it, an activated carbon with high adsorption capacity, from coconut shell, was prepared, and then the Langmuir equation for physical adsorption phenomena was determined using commercial refreshments as adsorbate.
Los fenómenos de adsorción presentan enorme importancia en el desarrollo de operaciones y procesos en la industria química, en laboratorios y en el campo académico e investigativo. Múltiples aplicaciones de fenómenos de adsorción se hacen evidentes durante procesos de catálisis heterogénea (por ejemplo en reacciones de craqueo de petróleo, de eliminación de contaminantes, como en el caso de los convertidores catalíticos de automóviles —catálisis ambiental— y reacciones de química fina, entre otros), procesos de separación de mezclas (con variadas aplicaciones en cromatografía), tratamiento de residuos en solución acuosa, y procesos de purificación de gases y líquidos (por ejemplo, en procedimientos de purificación de agua y aceites) (Carriazo et al., 2008; Centi y Perathoner, 2008; Fernandes et al., 2005; Tubert y Talanquer, 1997; Rouquerol et al., 1999; Duff et al., 1988). Para muchas de estas aplicaciones se recurre al uso de carbón activado como material adsorbente, debido a sus reconocidas propiedades: área superficial muy grande, microporosidad elevada y económicamente de bajo costo, entre otras (Podkoscielny Nieszporek, 2007; Figuereido et al., 1999).
El término “carbón activado” se refiere a carbones muy porosos producidos a partir de materiales ricos en carbono, mediante diversas formas de activación química o física (Rouquerol et al., 1999). La obtención de carbones activados a partir de material lignocelulósico es ampliamente usada en la industria química debido al bajo costo y a la abundancia de este tipo de materiales en la naturaleza. Además, este tipo de precursores es muy importante porque permite la obtención de carbones activados con porosidad variada dependiendo de las condiciones de preparación, como temperatura y tiempo de activación (Vargas et al., 2008). Para la preparación de carbones activados el material es calcinado (carbonización) y luego sometido al proceso de activación, lo cual conduce a aumentar la porosidad y la capacidad de adsorción del material carbonizado mediante tratamientos de oxidación de los grupos funcionales de la superficie del sólido. Diversos procedimientos de oxidación son empleados para introducir grupos oxigenados en la superficie del carbón, por vía gaseosa (O2, CO2, N2O), o mediante el uso de soluciones acuosas (H2O2, (NH4)2S2O8, HClO4 o HNO3) (Cortés et al., 2008; Rouquerol et al., 1999; Figuereido et al., 1999).
Por otra parte, diversos modelos fenomenológicos han sido desarrollados para interpretar el proceso de adsorción de moléculas (adsorbato) en fase gaseosa o en fase líquida sobre la superficie de un sólido (adsorbente) (Aguilar y Salmones, 2003; Tubert y Talanquer, 1997; Rouquerol et al., 1999; Masel, 1996). Uno de los modelos más sencillos para el estudio de la adsorción de moléculas sobre un sólido microporoso es el de Langmuir, propuesto entre 1915 y 1918 (Masel, 1996). Langmuir desarrolló un modelo simple para predecir la cantidad adsorbida de un gas sobre una superficie en función de la presión del fluido, suponiendo que: el adsorbato forma una monocapa sobre la superficie (se adsorbe una molécula por sitio de adsorción), todos los sitios de adsorción de la superficie son energéticamente equivalentes, las moléculas adsorbidas no tienen movimiento sobre la superficie, y no existen interacciones entre moléculas adsorbidas en sitios vecinos (Tubert y Talanquer, 1997; Masel, 1996).
En el modelo de Langmuir se asume que el sistema establece un equilibrio dinámico entre los procesos de adsorción y desorción del adsorbato (A) (gas, líquido o especies en solución) sobre la superficie sólida (S), formando un complejo adsorbato-adsorbente (AS) con constantes de velocidad Ka y Kd para los procesos de adsorción y desorción, respectivamente:
Bajo estos supuestos, es posible llegar a concluir que la cantidad adsorbida (θ) de un gas, de un líquido o de moléculas en solución, sobre un sólido a temperatura constante, es función de la presión o concentración, y del número de sitios disponibles en la superficie, y establecer la siguiente expresión general para la isoterma (Tubert y Talanquer, 1997; Masel, 1996): θ = kP1 + kP, donde k es la constante de equilibrio del proceso y P es la presión del gas, o concentración del adsorbato en el caso de especies en solución.
Sin embargo, aunque los procesos de adsorción son de extrema importancia y el carbón activado constituye un material adsorbente de enorme interés industrial y académico, es poco frecuente encontrar, en el nivel de educación secundaria, actividades experimentales encaminadas a demostrar las propiedades de adsorción de este material y aún menos frecuente encontrar prácticas de laboratorio referentes a la determinación de las ecuaciones clásicas de los modelos de adsorción. Aun a nivel superior, las prácticas de laboratorio desarrolladas en esta temática son dirigidas hacia la ilustración o aplicación de los diferentes modelos, generalmente con el objeto de determinar el área de un sólido mediante la adsorción de un gas o de un soluto en solución acuosa (determinando la isoterma particular del sistema por ajuste o extensión de la relación general de variables), una visión instrumental de los modelos de adsorción, pero no encaminadas a la demostración experimental (Fernandes et al., 2005; Tubert y Talanquer, 1997; Duff et al., 1988). El objetivo del presente artículo es interpretar el proceso de adsorción sólido-líquido, mediante un modelo fenomenológico, en este caso el modelo de Langmuir, en forma didáctica mediante el empleo de materiales de uso cotidiano y de bajo costo.
Finalmente, dentro de las causas para desconocer los aspectos relacionados con el estudio de los fenómenos de adsorción en el desarrollo de currículos de secundaria, se encuentra el aparentemente “complicado” razonamiento para explicar los fenómenos de adsorción a este nivel y la marcada carencia de recursos logísticos en los colegios o escuelas de muchos países latinoamericanos. Rutinariamente, para el desarrollo de prácticas de adsorción se requieren equipos técnicos especializados, como sortómetros (para la adsorción de gases) y espectrofotómetros (para determinar la concentración de especies químicas en solución acuosa), o en casos sencillos realizar una serie de titulaciones engorrosas. Sin embargo, el uso de recursos domésticos o de bajo costo, permitiría superar grandes obstáculos en la implementación de actividades sobre fenómenos de adsorción en escuelas, colegios y en cursos básicos de química en la universidad. Por ello, y teniendo en cuenta la importancia de las prácticas de laboratorio en los procesos de aprendizaje en química (Hofstein y Mamlok-Naaman, 2007), el presente trabajo busca ilustrar las propiedades que posee un carbón activado preparado a partir de cáscara de coco (un residuo doméstico) en la adsorción de los colorantes contenidos en refrescos de uso común en el hogar. Adicionalmente, y aún más importante, se pretende llegar a la ecuación clásica de Langmuir para adsorción física, mediante los resultados de adsorción-desorción obtenidos empleando columnas de carbón activado de fácil preparación y la elaboración de una escala colorimétrica.
Desarrollo experimentalPreparación del carbón activadoSe colocaron 260 g de cáscara de coco (figura 1-a) en una mufla, a una de temperatura 280 °C, durante 4 horas. Al cabo de este tiempo se recuperaron 114 g, proporcionando un rendimiento de 44% para el proceso de calcinación en estas condiciones (figura 1-b). Luego, el producto carbonizado fue triturado en mortero (también se puede utilizar un molino casero), tamizado en malla N° 60-ASTM (reemplazable por un colador doméstico de huecos muy pequeños) y posteriormente sometido al proceso de activación. Para la activación del carbón se colocaron 50 g del producto tamizado en 400 mL de solución de ácido nítrico (HNO3) aproximadamente 3,5 M, durante 4 horas, a temperatura ambiente, en cabina de extracción y con agitación constante (basado en los procedimientos de Cortés J. et al., 2008 y Figueiredo et al., 1999). Si no se cuenta con una cabina de extracción, el ensayo debe realizarse en un lugar abierto, teniendo cuidado de que las pequeñas cantidades de gases producidas no sean inhaladas por ninguna persona. Luego, el carbón fue retirado de la solución y lavado cinco veces con agua destilada empleando centrífuga (a 5000 revoluciones por minuto, durante tres minutos). Si no se cuenta con centrífuga, se puede utilizar un proceso de filtración o una simple decantación. En este último caso, las operaciones tardarán más tiempo. Finalmente, el carbón fue secado en estufa durante 10 horas a 50°C y luego tres horas a 160 °C. El producto final se muestra en las figuras 1c y 1d.
Elaboración de las columnas y ensayos de adsorciónSe elaboraron 10 columnas de vidrio, de 15 cm de altura y 6 mm de diámetro interno (las columnas también pueden construirse con mangueras plásticas transparentes, todas con igual diámetro). Cada columna se selló en la parte inferior con un tapón-filtro de 0,5 cm de altura, elaborado en lana de vidrio (reemplazable por algodón). El trabajo con lana de vidrio debe realizarse empleando guantes. En la parte inferior externa de cada tubo se colocó cinta transparente para sostener el sello interno de lana de vidrio, teniendo el cuidado de perforar la cinta colocada sobre el sello (entre 6 y 8 huecos con aguja de jeringa) para permitir la salida de líquido en los ensayos de adsorción. Cada tubo se empaca con carbón activado, variando la altura de carbón (0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5; 4,0; 4,5 y 5,0 cm) para el primer ensayo, y con una altura constante (1 cm) para el segundo ensayo de adsorción, teniendo cuidado de hacer un empacado uniforme para todos los tubos: “si se dan seis golpecitos al primero,… seis al segundo,… seis al tercero,… etc.” (figura 2).
Ensayos de adsorciónPara los ensayos de adsorción, primero se desarrolla una fase inicial con el objeto de observar la decoloración de cuatro soluciones de refresco comercial (figura 2a) de colores diferentes, correspondiente a cuatro sabores distintos (uva, fresa, naranja y limón). Se colocan 20 mL de solución de concentración 5 g/L en recipientes transparentes, se agregan 3 g de carbón activado a cada solución, se agita durante 30 minutos, y finalmente, se filtra el contenido de cada recipiente (figura 3). Las soluciones fueron preparadas con agua destilada, pero si no se cuenta con ésta puede emplearse agua purificada para consumo humano. Para efectos de una simple demostración del fenómeno de adsorción en escuelas y colegios, el experimento podría concluirse en esta fase, complementándose con una etapa de discusión sobre la explicación del fenómeno, orientada por el docente.
Por otra parte, se desarrolló una fase complementaria (un poco más avanzada) para llegar a la ecuación de Langmuir. Para esta etapa se preparó previamente una escala colorimétrica a partir de diferentes concentraciones de solución del refresco seleccionado (uva), con el fin de lograr una determinación aproximada (por comparación del color) de la concentración de las soluciones de este refresco después de estar en contacto con el adsorbente (carbón activado). La escala se construyó mediante dilución de una solución inicial de 2 × 104 ppm (equivalente a 2% p/V) de refresco en agua destilada (reemplazable por agua purificada para consumo humano), para obtener las concentraciones siguientes (en ppm): 2 × 104, 1,5 × 104, 1 × 104, 5 × 103, 2 × 103, 1 × 103, 500, 200, 100, 10 y 0 (figura 4). La concentración 0 ppm corresponde a agua sola.
Para verificar la ecuación de Langmuir se efectuaron dos ensayos de adsorción y uno de desorción: el primero, variando la altura de la columna de carbón activado, lo cual corresponde a una variación en la cantidad del adsorbente (y, por tanto, del área superficial disponible para la adsorción), manteniendo constante la concentración del adsorbato (colorante). Para este ensayo, se hicieron pasar (por efecto de gravedad) 1,5 mL de solución 2 × 104 ppm de refresco por el interior de cada columna colocada dentro de un tubo de ensayo de aproximadamente 8 cm de largo (la adición —con jeringa de 2 mL— se hace casi de manera simultánea —rápidamente— en todas las columnas, para que el tiempo de contacto del carbón con la solución, al final del ensayo, sea aproximadamente el mismo. Se esperó que bajara todo el volumen de solución en cada columna y se dejó ésta en contacto con la solución durante 45 minutos, con el objeto de esperar que el sistema alcanzara el equilibrio (figura 5). Después se retiró cada columna y se comparó el color de la solución de cada tubo de ensayo con la escala de colores previamente elaborada, determinando de manera aproximada la concentración remanente.
El segundo ensayo de adsorción se desarrolló variando la concentración de la solución del mismo refresco (es decir variando la cantidad de adsorbato), pero manteniendo constante la altura (o sea la cantidad y, por tanto, el área superficial disponible) de carbón activado. Para ello, se pasaron 10 soluciones (1,5 mL en cada caso) de concentración (ppm) diferente (2 × 104, 1,5 × 104, 1 × 104, 5 × 103, 3 × 103, 2 × 103, 1 × 103, 500, 200, 100) por columnas empacadas con 1 cm carbón activado cada una. El procedimiento de adición fue igual que en el ensayo anterior, y después de 45 minutos se retiraron las columnas de los tubos de ensayo, y se compararon las concentraciones remanentes con la escala colorimétrica para aproximar la concentración en cada caso (figura 6a). Es de anotar que los ensayos de adsorción se realizaron a temperatura ambiente y en tiempos iguales. El ensayo de desorción se realizó empleando las columnas extraídas de los primeros ocho tubos (100 a 104 ppm) del segundo ensayo de adsorción. Para ello, luego del equilibrio, las columnas separadas de cada solución se dejaron secar al aire (verticalmente, 10 minutos); se introdujo cada una en un tubo de ensayo limpio y seco, se adicionan rápidamente, a cada columna, 1,5 mL de agua destilada a 60 °C (para aumentar la desorción del adsorbato), y se dejan durante 45 minutos para que el agua desorba el colorante adsorbido y alcance el equilibrio a temperatura ambiente (figura 6b).
(a) Soluciones de refresco después de la adsorción sobre carbón activado, empleando diferentes concentraciones iniciales de refresco y cantidad de carbón (altura) constante. (b) Soluciones obtenidas del proceso de desorción con 1,5 mL de agua caliente (60 °C) sobre las columnas extraídas en (a) de los ocho tubos de concentración más baja (de 100 a 104 ppm).
La figura 3 muestra la decoloración de las soluciones de refresco como consecuencia de la adsorción de las moléculas colorantes sobre el carbón activado. Esto revela la potente adsortividad del material preparado a partir de cáscara de coco y los excelentes resultados con respecto al proceso de preparación. Además, explica el porqué este material es utilizado exitosamente en procesos de purificación de aguas, entre otros. Alrededor de este resultado, el docente debe dirigir la discusión de sus estudiantes sobre dos aspectos: los procesos químicos involucrados en la preparación del carbón activado (calcinación controlada y activación con ácido nítrico: reacciones de óxido-reducción y estequiometría), y el fenómeno “fisicoquímico” de la adsorción de los colorantes sobre la superficie del carbón activado.
Por otro lado, la tabla 1 y la figura 7 muestran los resultados de la dependencia de la adsorción del refresco (uva) con respecto al área del adsorbente (altura o cantidad de carbón activado), empleando una concentración (C) constante. La figura 7, obtenida a partir de la correlación de los primeros cinco puntos de la tabla 1, revela de manera aproximada una dependencia lineal que pasa por el origen (con un coeficiente de correlación de r = 0,9843), típica de una relación directamente proporcional entre dos variables.
Cantidad de refresco comercial adsorbido sobre las columnas de carbón activado a diferentes alturas, empleando 1,5 mL de solución con concentración constante (2 × 104 ppm; cantidad adicionada = 30 mg).
| Tubo | Altura de carbón (cm) | Concentración remanente, aproximada (ppm) | Cantidad adsorbida (mg) |
|---|---|---|---|
| 1 | 0,5 | 15 000 | 7,5 |
| 2 | 1,0 | 10 000 | 15 |
| 3 | 1,5 | 5 000 | 22,5 |
| 4 | 2,0 | 3 000 | 25,5 |
| 5 | 2,5 | 700 | 29 |
| 6 | 3,0 | 10 | 30 |
| 7 | 3,5 | 0 | total |
| 8 | 4,0 | 0 | total |
| 9 | 4,5 | 0 | total |
| 10 | 5,0 | 0 | total |
Para el análisis siguiente debe tenerse en cuenta que todos los ensayos de adsorción se desarrollaron en tiempos iguales, lo que hace que la velocidad de adsorción (cantidad adsorbida sobre unidad de tiempo: Xa/t) quede definida sólo por la cantidad adsorbida (Xa). Por tanto, la figura 7 es una representación de la velocidad de adsorción en función del área de a carbón activado, y de esta manera puede establecerse que la velocidad de adsorción (υa) es proporcional al área disponible del adsorbente.
Si asumimos que el total (100%) de área es la unidad (1), y que la fracción de área cubierta por moléculas de adsorbato es θ, entonces la fracción de área descubierta (o área disponible) será (1 − θ). De este modo, podemos decir que:
k1 es una constante de proporcionalidad bajo las condiciones del ensayo.Por otra parte, la tabla 2 y la figura 8 muestran los resultados de adsorción del refresco frutiño con respecto a la variación en la concentración de la solución adicionada (C), conservando constante la altura de la columna de carbón activado (1 cm). En la figura 8 se eliminaron los últimos dos puntos de la tabla 2 (a las más altas concentraciones), con el objeto de mejorar la linealidad. Esta figura, revela claramente una dependencia lineal que pasa por el origen (r = 0,9985), típica de una relación directamente proporcional entre dos variables. Por tanto, a partir de la figura 8, y teniendo en cuenta que los ensayos se realizaron en tiempos iguales (de esta manera la velocidad de adsorción queda definida por la cantidad adsorbida, Xa), se puede establecer que la velocidad de adsorción es proporcional a la concentración de solución (C):(υa) es proporcional a C, o sea:
Cantidad de producto comercial adsorbido sobre las columnas de carbón activado con altura constante (1,0 cm), empleando 1,5 mL de solución a diferentes concentraciones.
| Tubo | Concentración adicionada (ppm) | Concentración remanente, aproximada (ppm) | Cantidad adsorbida (mg) |
|---|---|---|---|
| 1 | 100 | 0 | 0,15 |
| 2 | 200 | 10 | 0,28 |
| 3 | 500 | 100 | 0,6 |
| 4 | 1 000 | 100 | 1,3 |
| 5 | 2 000 | 200 | 2,7 |
| 6 | 3 000 | 500 | 3,75 |
| 7 | 5 000 | 300 | 7,05 |
| 8 | 10 000 | 1 500 | 12,75 |
| 9 | 15 000 | 6 000 | 13,5 |
| 10 | 20 000 | 8 000 | 18,0 |
De las ecuaciones 1 y 2 se deduce que:
donde k3 es una constante de proporcionalidad que involucra las constantes k1 y k2.De otro lado, los resultados del ensayo de desorción (cantidades de colorante desorbido) se presentan en la tabla 3 y la figura 9 (r = 0,9916), y muestran una proporcionalidad entre las cantidades desorbidas y adsorbidas (la cantidad adsorbida también es un indicativo de la fracción de área cubierta: θ). Como el tiempo es constante en los experimentos, entonces puede deducirse que la velocidad de desorción (υd) queda definida simplemente por las cantidades desorbidas, y por tanto se puede deducir que:υd es proporcional a θ, o sea que:
donde k4 es una constante de proporcionalidad.Cantidad de refresco comercial desorbido luego de la adsorción previa sobre las columnas de carbón activado con altura constante (1,0 cm). La desorción se hizo con 1,5 mL de agua destilada a 60 °C.
| Tubo | Concentración adicionada (ppm) | Cantidad adsorbida (mg) | Concentración desorbida, aproximada (ppm) | Cantidad desorbida (mg) |
|---|---|---|---|---|
| 1 | 100 | 0,15 | 10 | 0,015 |
| 2 | 200 | 0,28 | 100 | 0,15 |
| 3 | 500 | 0,6 | 200 | 0,3 |
| 4 | 1 000 | 1,35 | 400 | 0,6 |
| 5 | 2 000 | 2,7 | 1 000 | 1,5 |
| 6 | 3 000 | 3,75 | 2 000 | 3 |
| 7 | 5 000 | 7,05 | 4 000 | 6 |
| 8 | 10 000 | 12,75 | 9 000 | 13,5 |
Desorción del refresco comercial en función de la cantidad adsorbida inicial. Los valores graficados corresponden a los obtenidos en la tabla 3.
Finalmente, para un proceso de adsorción en condiciones de equilibrio dinámico, las velocidades de adsorción y de desorción se igualan (υa = υd) y, por tanto, igualando las ecuaciones 3 y 4, y llamando k3k4 = k, se llega a la siguiente expresión:
La ecuación 5 es la ecuación clásica de Langmuir para fenómenos de adsorción física (Aguilar y Salmones, 2003; Tubert y Talanquer, 1997; Masel, 1996).
ConclusionesEl presente trabajo muestra que la utilización de materiales caseros constituye una estrategia excelente para llevar a cabo el desarrollo de actividades prácticas sobre fenómenos de adsorción, acercando al estudiante a situaciones reales, superando obstáculos logísticos y de instrumentación en las escuelas, y evitando el uso de reactivos muchas veces costosos y generadores de contaminación a través de las aguas de vertimiento producidas en las instituciones educativas. Por otra parte, se logró observar el proceso de adsorción de moléculas colorantes y verificar experimentalmente la ecuación clásica de Langmuir, mediante la preparación de carbón activado de cáscara de coco (desecho casero), el empleo de refrescos comerciales y sin recurrir a equipos costosos para realizar las mediciones.