The purpose of this paper is to review the 12 principles of Green Chemistry proposed by Anastas and Warner (1988). While each principle is stated, examples developed in research laboratories and industrial processes and products are described so as to give a broad perspective of the new techniques, methodologies and organic substances that Green Chemistry has developed. The importance of the ecotoxicology and biodegradability of the new products is also commented, so as to have a perspective of the challenges this discipline should face.
La sociedad global actual está íntimamente relacionada con los productos químicos y sus procesos. Debido a estos lazos y porque se conocen bien algunas de las interacciones adversas que muchos de ellos han tenido en el medio ambiente, la química está directamente relacionada con la declaración de Río de 1992 sobre el Medio Ambiente y el Desarrollo, que en el principio 1 proclama que los seres humanos constituyen el centro de las preocupaciones relacionadas con el desarrollo sustentable. Los seres humanos tienen derecho a una vida saludable y productiva en armonía con la naturaleza.
La sustentabilidad de nuestra civilización depende de si podemos suministrar fuentes de energía, alimentos y productos químicos a la creciente población sin comprometer la salud de nuestro planeta a largo plazo. El desarrollo de las herramientas para lograr esos objetivos es un gran reto científico, tecnológico y social.
La industria química, los gobiernos, la academia y las organizaciones no gubernamentales han tomado diferentes medidas para enfrentar el reto de la interfase entre la química y la sustentabilidad. Entre ellas se encuentran la Iniciativa Global para el Cuidado Responsable del Consejo Internacional de Asociaciones Químicas, las conferencias sobre química sustentable de la Organización para la Cooperación y el Desarrollo Económico (OCDE) y diversas leyes y convenios internacionales para la regulación de los productos y procesos químicos.
Uno del los conceptos más atractivos en química para lograr la sustentabilidad es la Química Verde, cuyo objetivo es la utilización de un grupo de principios que reducen o eliminan el uso o generación de sustancias peligrosas en el diseño, manufactura y aplicaciones de productos químicos, lo que en muchos casos implica el rediseño de los productos y procesos utilizados.
Los principios de la Química VerdeLos 12 principios de la Química Verde, originalmente definidos por Anastas y Warner (1988) se han aplicado en el desarrollo de una amplia gama de productos y procesos cuyo objetivo ha sido minimizar los riesgos a la salud y al medio ambiente, reducir la generación de desechos y prevenir la contaminación. A continuación se hará una revisión de estos principios, con algunos ejemplos, adelantos y retos por resolver. En algunos casos se utilizarán síntesis, productos o procesos que han sido ganadores del Programa Presidencial de Premios a los Retos de la Química Verde, que otorga la Agencia de Protección Ambiental de Estados Unidos (US EPA).
1. Prevención
Es preferible evitar la producción de un residuo que reciclarlo, tratarlo o disponer de él una vez que se haya formado.
2. Economía atómica
Los métodos de síntesis deberán diseñarse de manera que se incorporen al máximo los reactivos en el producto final, minimizando la formación de subproductos, lo que favorece también al principio 1.
La economía atómica se refiere a la relación del peso molecular del producto de una reacción o proceso respecto a la suma de los pesos moleculares de todos los reactivos utilizados.
La economía atómica depende de la naturaleza intrínseca de cada reacción. Por ejemplo, una reacción tipo Diels-Alder tiene 100% de economía atómica:
En cambio, la reacción de Wittig tiene una economía más baja:
El uso principal de este parámetro es adaptar la secuencia de reacciones de una síntesis de forma que las transformaciones con baja economía atómica se limiten al mínimo, para evitar la generación de subproductos que deberán separarse, y eventualmente tratarse o disponerse (principio 1).
Por ejemplo, el poli(metacrilato de metilo) se utiliza en la fabricación de resinas y plásticos. La síntesis tradicional del monómero —metacrilato de metilo— usa como reactivos acetona y cianuro de hidrógeno, seguidos por la hidrólisis ácida y la esterificación como se indica a continuación:
La economía atómica es del 75%.
La síntesis verde indicada a continuación tiene una economía atómica de 97.7%:
La preparación aceptable de un compuesto orgánico implica, no sólo una reacción relativamente eficiente, sino también la facilidad de su aislamiento y purificación a partir de la mezcla de reacción. Por ello, se han definido otros parámetros, como los siguientes (Curzons, et al., 2001):
- •
Eficiencia de masa, que toma en cuenta el rendimiento de la reacción:
- •
Intensidad de masa, que también toma en cuenta la masa del disolvente utilizado:
- •
Factor ambiental (factor E), donde el parámetro importante está relacionado con los desechos generados (Sheldon, 2007):
En general, el factor E está relacionado con el tipo de industria, como se indica en la siguiente tabla (tabla 1):
- •
Cociente ambiental, se obtiene al multiplicar el factor E por un factor Q que refleja la naturaleza de los residuos y su impacto ambiental. Por ejemplo, el NaCl tiene un valor Q = 1, mientras que los metales pesados pueden tener un valor de Q = 100-1000. Para asignar el factor Q se toman en cuenta: la ecotoxicidad, la capacidad de afectar la capa de ozono o de causar efecto invernadero, la capacidad de causar la acidificación de suelos o agua, potencial de eutroficación, degradabilidad, etc.
- •
Ecoescala, que evalúa reacciones a escala de laboratorio y cubre un rango amplio de condiciones y técnicas utilizadas en la química orgánica, como el precio de los reactivos, su peligrosidad, el equipo necesario, la temperatura y el tiempo de reacción, las condiciones de aislamiento y purificación del producto (Van Aken, 2006).
- •
Análisis del ciclo de vida (de la cuna a la tumba), metodología que toma en cuenta todas las etapas del ciclo de la vida de un producto químico, así como los impactos ambientales de los productos secundarios, solventes, servicios auxiliares, etc. utilizados durante su vida.
Sus elementos son:
- •
Materias primas.
- •
Formulación, manufactura y procesamiento.
- •
Empaque y distribución.
- •
Uso del producto.
- •
Reuso, reciclado, disposición.
Por ejemplo, para analizar el ciclo de vida de un solvente específico, se debe considerar y cuantificar el uso de recursos no renovables para su producción, su toxicidad, capacidad de degradación biótica o abiótica y otros impactos ambientales debidos a su uso, la emisión de gases contaminantes debidos a su incineración o el uso intensivo de energía, si se destilan para recuperarlos (Anastas y Lankey, 2000; Clark, 2006a; Kümmer, 2007).
Una propuesta interesante más reciente (Augé, 2008) puede aplicarse a reacciones sencillas y secuencias de reacciones e integra algunos de los parámetros anteriores.
3. Uso de metodologías que generen productos con toxicidad reducida
Siempre que sea posible, los métodos de síntesis deberán diseñarse para utilizar y generar sustancias que tengan poca o ninguna toxicidad, tanto para el hombre como para el medio ambiente.
Dos ejemplos de este principio incluyen reacciones que utilizan fosgeno, y que han sido modificadas para utilizar reactivos con poca toxicidad.
• La síntesis de policarbonato, que tradicionalmente se lleva a cabo a partir de bisfenol A con fosgeno; la opción verde incluye difenilcarbonato (figura 1):
• La síntesis tradicional de dimetilcarbonato, que se utiliza como agente alquilante, también utiliza fosgeno:
Se han propuesto las siguientes síntesis verdes:
4. Generar productos eficaces pero no tóxicos
Los productos químicos deberán ser diseñados de manera que mantengan la eficacia a la vez que reduzcan su toxicidad.
El diseño de productos químicos supone un propósito de aplicación con el que se debe evaluar su desempeño. Sin embargo, tan importante como este aspecto es su impacto potencial en la salud humana y en el medio ambiente. Los tres aspectos deben tener la misma importancia en la evaluación, que debe llevar a la elección de un producto, donde los aspectos económico, social y ecológico permiten tomar una decisión sustentable.
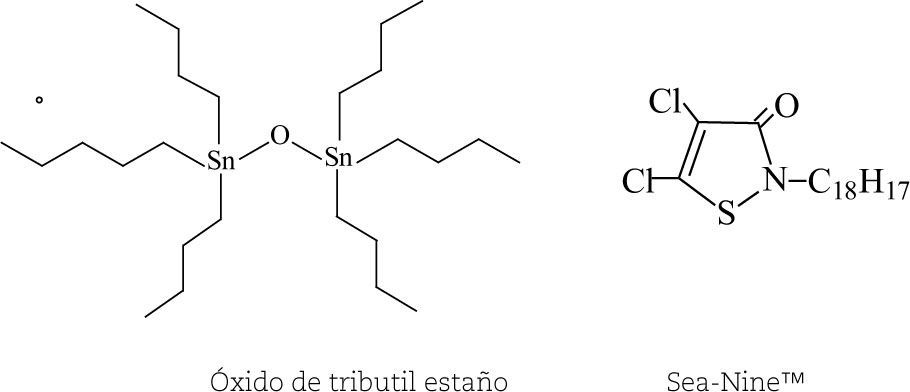
Un ejemplo es el óxido de tributil estaño, un producto antiadherente utilizado en pinturas para evitar la incrustación de organismos en superficies metálicas, por ejemplo, en los barcos. Es un compuesto con vida media en el agua de mar superior a seis meses, su capacidad de bioconcentración (es decir, la capacidad de incrementar progresivamente la cantidad que se acumula en los tejidos de algún organismo vivo sin causarle un daño) es alta (104) y causa toxicidad crónica, por lo que afecta mucho a la fauna marina.
El compuesto que lo ha sustituido es el Sea-Nine™ (4,5-dicloro-2-N-octil-4-isotiazolin-3-ona), que no provoca toxicidad crónica y sufre una rápida biodegradación para generar productos no tóxicos (vida media < 1 h) y su capacidad de bioconcentración es baja (13). Esta sustancia fue desarrollada por Rohm and Haas y fue ganadora del Programa Presidencial de Premios a los Retos de la Química Verde en 1996.
En general, un producto más seguro significa que es menos tóxico. Sin embargo, en el diseño de la funcionalidad de un producto debe incluirse su facilidad y rapidez de degradación ya que los productos químicos no siempre se degradan totalmente hasta CO2, agua y sales inorgánicas. Si la entrada al medio es mayor que su degradación, habrá una cierta cantidad presente y el compuesto será pseudo-persistente. Los productos que resisten la biodegradación permanecen disponibles a la biota para ejercer su acción tóxica, no siempre de forma conocida o predecible. Los compuestos químicos persistentes que se bioacumulan son de mayor preocupación porque los niveles de concentración que se consideran no riesgosos desde el criterio de una toxicidad aguda, pueden resultar en una toxicidad crónica. Por lo tanto, la tratabilidad de los efluentes que contienen los productos y que pueden llegar al medio ambiente puede mejorarse con un diseño molecular responsable.
La biodegradabilidad de un compuesto está en función, no sólo de su estructura, sino también de las condiciones de exposición, es decir, el tipo de condiciones presentes en el medio ambiente, el tipo de tratamiento, las pruebas de laboratorio que la determinan, etc.
Las siguientes características moleculares aumentan la resistencia a la biodegradación: la presencia de halógenos—especialmente el flúor y el cloro si hay tres o más en una molécula pequeña—; la ramificación de cadenas alifáticas; los carbonos cuaternarios; las aminas terciarias; los grupos nitro, nitroso, azo y arilamino; los residuos policíclicos —especialmente si tienen más de tres anillos fusionados—; los residuos heterocíclicos —por ejemplo el anillo imidazol—; los grupos éter —excepto los etoxilatos.
Por otro lado, las características estructurales que aumentan la biodegradabilidad son los grupos lábiles a la hidrólisis enzimática, en especial los ésteres y las amidas, los átomos de oxígeno presentes en alcoholes, aldehídos, ácidos carboxílicos y algunas cetonas, pero no los éteres, las cadenas alquilo lineales y los grupos fenilo.
En el área de la ecotoxicología se han hecho generalizaciones para reducir la toxicidad acuática. En muchos casos, los cambios de estructura química o propiedades que reducen la toxicidad también reducen la biodegradabilidad: el aumento en el peso molecular, el aumento de impedimento estérico en el sitio activo, incluir grupos voluminosos o grupos hidrofílicos, como grupos sulfonato o ácido carboxílico. Así, las aminas primarias son ecotóxicas, pero se degradan con facilidad en suelo o agua. Es posible reducir la toxicidad modificando la estructura sin aumentar la persistencia en el medio ambiente. Entonces un producto verde no sólo es menos tóxico, sino también más biodegradable (Boethling et al., 2007).
Desde el punto de vista del análisis del ciclo de vida de los productos, es interesante el siguiente caso referido a los pesticidas, que ejemplifica la complejidad que puede tener el diseño de compuestos benignos.
Entre los primeros insecticidas exitosos se encuentran el dicloro difenil tricloroetano (DDT) y otros compuestos orgánicos halogenados, como los clordanos (aldrin y dieldrin) que resultaron muy persistentes. Por ello se desarrollaron fosfoésteres orgánicos como el paratión. La siguiente generación de pesticidas fueron los piretroides, mucho menos tóxicos y además fotosensibles, lo que favorece su degradación abiótica. Los ejemplos más recientes son los espinosoides (SpinosadTM) y las acilureas (HexoflumuronTM), que tienen un perfil más adecuado desde el punto de vista ambiental y toxicológico.
El HexoflumuronTM desarrollado por Dow y ganador de un premio EPA en 2000, es un agente de control de termitas, diseñado para sustituir al Clorpirifos pues es menos tóxico y sólo se debe aplicar cuando se detecta la actividad de estos organismos. Sin embargo, como se muestra en la figura 3, uno de sus metabolitos es persistente: los átomos de cloro en el anillo aromático, de flúor en la cadena alifática y la amina aromática del metabolito (b), nos dan una mayor toxicidad crónica en peces (valor crónico o CV) en medio acuático que el metabolito principal del compuesto no verde que sustituye (Boethling et al., 2007).
5. Reducir el uso de sustancias auxiliares
Se evitará, en lo posible, el uso de sustancias que no sean imprescindibles (solventes, reactivos para llevar a cabo separaciones, etc.) y en el caso de que se utilicen, que sean lo más inocuos posible.
Los disolventes son importantes como medio de reacción y en los procesos de purificación. Muchos de ellos presentan riesgos a la salud humana y al medio ambiente, en especial por su volatilidad. Por ello, una de las áreas más importantes de la química verde es la eliminación o reemplazo por disolventes no peligrosos que tengan un impacto ambiental limitado. Entre los disolventes tradicionales que cumplen con estas características se encuentran los siguientes: acetona, etanol, metanol, isopropanol, hexano, ácido acético y acetato de etilo (Doxsee y Hutchison, 2005). Sin embargo, se ha desarrollado reacciones que se llevan a cabo sin disolventes, y también disolventes alternativos como los siguientes:
- •
agua
- •
líquidos iónicos
- •
sistemas bifásicos basados en compuestos fluorados
- •
fluidos supercríticos, como el CO2
- •
disolventes biodegradables
- •
bio-solventes
Reacciones en solución acuosa
A pesar de su evidente bajo impacto ambiental, el agua no se ha utilizado con frecuencia en la síntesis orgánica ya que muchos reactivos no son solubles en ella. Sin embargo, hay muchas propuestas para su utilización, como las siguientes
Líquidos iónicos
Los líquidos iónicos (ILs) son sales cuyo punto de fusión es bajo, por lo que son líquidos a temperatura ambiente. Se diseñan con cationes orgánicos grandes, como anillos imidazolio y piridinio, con cadenas N,N´-alquilo que modifican la hidrofobicidad de la molécula. Los aniones comunes son hexafluorofosfato (PF6–), tetrafluoroborato (BF4–), cloruro (Cl–), nitrato (NO3–) y bromuro (Br–), entre otros. Algunos ejemplos son los siguientes (figura 4):
Sus propiedades, tales como su buena solubilidad (para un rango amplio de compuestos orgánicos, inorgánicos y organometálicos y también gases), estabilidad térmica, no volatilidad y no inflamabilidad en condiciones de operación diversas, los hace versátiles y son sustitutos adecuados a los solventes orgánicos comunes. Los líquidos iónicos utilizados como medio de reacción son más selectivos, permiten rendimientos de reacción más altos y pueden reusarse, lo que permite clasificarlos como solventes verdes. Variando los cationes y aniones de su estructura, se pueden diseñar ILs con las características de solvatación adecuadas para procesos específicos, incluyendo electrolitos en baterías, catálisis por metales de transición, solventes en extracciones líquido-líquido y muchos tipos de reacciones orgánicas e inorgánicas, desde hidrogenaciones catalíticas e hidroformilaciones, hasta reacciones Friedel-Crafts y Diles-Alder.
Conforme se hace la transición de curiosidades académicas a productos comerciales, su impacto ambiental es un tema que se está estudiando ya que la afirmación de que los ILs son verdes ha resultado controvertida. Aunque no presentan riesgo a la calidad del aire, su impacto en agua y suelo sí es una preocupación mientras no se tengan datos de su ecotoxicidad y capacidad de biodegradación (Ranke et al., 2007).
Los ILs más comunes, como [bmim][BF4] y [bmim][PF6], muestran una biodegradabilidad mínima. Sin embargo, se ha confirmado que la presencia de un enlace éster en la cadena alquilo aumenta la biodegradabilidad, igual que el anión alquil sulfato, en especial el octilo. La degradación observada es consistente con el ataque a la parte de la molécula que proviene de un alcohol, además de que el ión octilsulfato es muy biodegradable. El anillo imidazol es resistente al ataque biológico debido a la sustitución de ambos átomos de nitrógeno del anillo (Morrissey et al., 2009; Ardan et al., 2009).
Docherty y Kulpa (2005) y Ranke et al. (2007) han obtenido datos sobre la degradación biótica y abiótica, la bioacumulación y la actividad biológica, y concluyen que la variabilidad en las estructuras no permite aún una conclusión respecto a su toxicidad y ecotoxicidad. Sin embargo, se sabe que la toxicidad aumenta con la longitud de la cadena alquilo unida a los ILs basados en anillos imidazolio y piridinio, lo que se puede explicarse por su carácter lipofílico creciente y su posibilidad de provocar la disrupción de la membrana celular (necrosis polar).
Sistemas bifásicos basados en compuestos fluorados o fluorosos
El término solvente fluoroso es análogo al término acuoso, y enfatiza el hecho de que una de las fases de un sistema bifásico es más abundante en fluorocarbonos que la otra. Un sistema fluoroso consiste de una fase fluorosa conteniendo un reactivo o catalizador fluoroso y una segunda fase donde se encuentra el producto y que puede ser cualquier solvente orgánico o inorgánico con limitada solubilidad en la fase fluorosa (Hobbs y Thomas, 2007).
Los reactivos y catalizadores pueden hacerse solubles en una fase fluorosa agregando cadenas alquilo lineales o ramificadas perfluoradas con un número de carbonos alto. Una reacción bifásica fluorosa puede proceder en la fase fluorosa o en la interfase, dependiendo de la solubilidad de las sustancias en la fase fluorosa. Una de las características interesantes de estos sistemas es que su miscibilidad en solventes orgánicos es dependiente de la temperatura. Así, en una mezcla que contiene una fase orgánica y otra fluorosa, la reacción catalítica homogénea se lleva a cabo a alta temperatura y la separación bifásica del catalizador y el producto se lleva a cabo a baja temperatura. Esta metodología ha demostrado tener un buen potencial para convertirse en una plataforma tecnológica para aplicaciones de Química Verde. Se han utilizado para la síntesis de moléculas pequeñas en gran escala, separación de biomoléculas, preparación de nanomateriales, catálisis enzimática, etc.
A continuación se muestran reacciones de hidroformilación (11) (Curran, 2000) y transesterificación (12) utilizando esta metodología:
Los solventes fluorosos tienen propiedades toxicológicas discutibles, aun cuando se han desarrollado perfluorocarbonos cíclicos como sustitutos de sangre pues no son tóxicos, tienen alta estabilidad y capacidad de disolver oxígeno y dióxido de carbono. Sin embargo, muchos son persistentes y a los de bajo punto de ebullición se les ha responsabilizado por la destrucción de la capa de ozono y el calentamiento global.
Para enfrentar estas críticas, se ha reducido significativamente la cantidad de flúor en las moléculas con el desarrollo conocido como “química fluorosa ligera” en donde las cadenas agregadas como marcadores son C8F17 o C6F13. La extracción fluorosa en fase sólida utilizando sílica gel modificada con cadenas C8F17 es una forma de separar compuestos fluorosos ligeros. Estas adaptaciones eliminan el uso de solventes fluorosos en el medio de reacción y en los pasos de separación, y se llevan a cabo en solventes comunes (Zhang, 2009).
6. Disminuir el consumo energético
Los requerimientos energéticos serán catalogados por su impacto medioambiental y económico, reduciéndose todo lo posible.
El desarrollo de métodos que cumplan con este principio ha llevado al desarrollo de metodologías que permiten el calentamiento del medio de reacción en muy poco tiempo a través del uso de microondas, infrarrojo y ultrasonido. Por ejemplo, la reacción de Suzuki (13) (Kabalka et al., 2000) requiere sólo dos minutos con radiación microondas y es también una reacción sin solvente:
La reacción de Mannich (14) (Bruckmann et al., 2008) se lleva a cabo con irradiación ultrasonido en 1 h. Si se utilizan las condiciones comunes, la reacción requiere 24 horas.
7. Utilización de materias primas renovables
Las materias primas han de ser preferiblemente renovables en vez de agotables, siempre que sean técnica y económicamente viables.
Conversión de la biomasa
El uso de biomasa como fuente de energía es un área de gran desarrollo actualmente, en especial para la obtención de combustibles para la transportación. El etanol se ha utilizado por algún tiempo mezclado con combustibles convencionales (Petrus y Noordermeer, 2006). Sin embargo, al considerar el contenido de energía de los diferentes productos presentes en la biomasa, los terpenos encabezan la lista, seguidos de los aceites vegetales, la lignina y los azúcares. Ya que la producción de terpenos es muy baja para alcanzar los requerimientos de los biocombustibles, no es sorprendente que la mayor atención se ha enfocado en los aceites vegetales, a partir de los cuales se ha desarrollado la síntesis y uso del biodiésel. También esta materia prima tiene sus limitaciones, por lo que el desarrollo de la producción a gran escala se encuentra en la lignocelulosa. Si la lignocelulosa se utiliza como materia prima para generar biocombustibles, los azúcares, terpenos aceites vegetales, más valiosos pueden emplearse para la síntesis productos de mayor valor agregado.
La transformación de la plataforma petroquímica actual por una plataforma biotecnológica basada en el aprovechamiento de la biomasa puede estar enfocada a reemplazar los productos directamente derivados del petróleo o a utilizar los grupos funcionales de los componentes de la biomasa para desarrollar productos nuevos con mejores propiedades y nuevas aplicaciones.
La naturaleza produce la mayor parte de las 170 × 109 toneladas de biomasa cada año por el proceso de fotosíntesis, 75% de las cuales pueden asignarse a carbohidratos. Los humanos sólo aprovechamos el 3-4% como alimento o para procesos no alimenticios. Dos tipos de azúcares están presentes en la biomasa: las hexosas, entre las cuales la glucosa es la más abundante, y las pentosas, en especial la xilosa. Hay dos maneras de transformar los azúcares a bioproductos: los proceso químicos y los fermentativos (Clark et al., 2006b; Corma et al., 2007; Gallezot, 2007).
La fermentación de la glucosa produce varios compuestos que pueden utilizarse como materia prima de productos químicos útiles en la industria, como los ácidos láctico, succínico, itacónico, glutámico y 3-hidroxipropiónico. Sólo como ejemplo, a continuación se muestran algunos derivados útiles del ácido láctico (figura 5):
En cuanto a las transformaciones químicas, los monosacáridos pueden deshidratarse, reducirse u oxidarse para generar productos útiles, por ejemplo:
En cuanto a los triglicéridos, las transformaciones posibles son muy variadas. La hidrólisis genera ácidos grasos, a partir de los cuales se produce el biodiésel por transesterificación, pero también dioles y ácidos dicarboxílicos utilizados como estabilizadores y plastificadores, entre otros. Por otro lado, el glicerol, es el compuesto base de una gran cantidad de productos, entre otros (Behr et al., 2008):
A partir de estos productos se pueden obtener solventes, polímeros, resinas, aditivos, etc.
8. Evitar la derivatización innecesaria
Se evitará en lo posible la formación de derivados (grupos de bloqueo, de protección/desprotección, modificación temporal de procesos físicos/químicos).
Un ejemplo es la siguiente reacción, que evita la formación del cloruro de ácido como intermediario para la síntesis de la amida:
La siguiente reacción es una modificación de la reacción de Grignard, que no requiere la protección del alcohol:
9. Potenciación de la catálisis
Se emplearán catalizadores (lo más selectivos), reutilizables en lo posible, en lugar de reactivos estequiométricos.
Entre los catalizadores más útiles empleados por la química verde se encuentran las enzimas, que: a) tienen una muy alta selectividad, lo que reduce los desechos generados; b) pueden actuar en compuestos específicos aunque estén en una mezcla, lo que reduce el requerimientos de separaciones cromatográficas o de otro tipo, y c) requieren condiciones suaves de reacción en comparación con métodos sintéticos tradicionales, lo que también disminuye los requerimientos energéticos. El área de la biocatálisis en medios no acuosos se ha extendido mucho, por ejemplo, utilizando líquidos iónicos, CO2 supercrítico y solventes fluorosos. Entre las enzimas más versátiles utilizadas para la síntesis orgánica se encuentran la α-quimotripsina y lipasas para reacciones de transesterificación (20) (Nara et al., 2002) y resolución de modificaciones racémicas, y las lacasas para reacciones redox (19) (Riva, 2006).
Como ejemplo de otro tipo de catalizadores se encuentra el activador de H2O2, el Fe-TAML, que permite la oxidación de contaminantes recalcitrantes en medio acuoso para obtener una variedad de sustratos aceptables desde el punto de vista ambiental. Se ha demostrado su utilidad en compuestos persistentes, como pesticidas y compuestos farmacéuticos que tienen la característica de ser bioactivos y por ello tóxicos para los microorganismos y potenciales disruptores endócrinos en los humanos, otros mamíferos, peces y anfibios (Khetan y Collins, 2007; Shappell et al., 2008).
El Fe-TAML tiene la siguiente estructura, que resultó de un diseño desarrollado a partir del grupo heme de oxidoreductasas (Collins y Walter, 2006) (figura 7):
10. Generar productos biodegradables
Los productos químicos se diseñarán de tal manera que al finalizar su función no persistan en el medio ambiente sino que se transformen en productos de degradación inocuos.
Una aplicación de este principio es el desarrollo de polímeros biodegradables que están diseñados para sustituir a los plásticos tradicionales, que son persistentes en el medio ambiente. Se sintetizan a partir de biomoléculas abundantes en la naturaleza, unidas por enlaces que pueden ser hidrolizados por los sistemas enzimáticos de los microorganismos presentes en el suelo.
El ácido poliláctico y el poliaspártico son ejemplos de este tipo de plásticos y se muestran a continuación:
La síntesis del ácido poliláctico a partir de ácido láctico directamente y con un catalizador de estaño, permite un mejor control del peso molecular y mereció el premio de la EPA para la compañía Cargill Dow LLC (ahora NatureWorks LLC) en 2002. Se utiliza para fibras y materiales de empaque.
En cuanto al ácido poliaspártico, puede sustituir al poliacrilato y usarse como dispersante, antiincrustante o superabsorbente. Fue desarrollado por la empresa Donlar Corporation, por la que recibió el premio EPA en 1996.
11. Desarrollar metodologías analíticas para la monitorización en tiempo real
Las metodologías analíticas serán desarrolladas para permitir el monitoreo y control en tiempo real de los procesos, previo a la formación de productos secundarios.
La meta de la Química Analítica para la Química Verde es utilizar procedimientos analíticos que generen desechos menos peligrosos y que sean benignos al medio ambiente sin afectar la generación de resultados con rapidez, eficiencia y eficacia. Esto puede lograrse desarrollando nuevos métodos analíticos o modificando los viejos para incorporar procedimientos que permitan lograr las metas.
Un ejemplo son los detectores de “huellas dactilares” de iones (ion footprint detector), que no requiere extraer la sustancias de una mezcla por su análisis; es decir, no es necesario evitar las interferencias, lo que reduce en un 90% el disolvente para la cromatografía GC/MS y 50% para el análisis LC/MS.
12. Minimizar el potencial de accidentes químicos
Se elegirán las sustancias empleadas en los procesos químicos de forma que se minimice el riesgo de accidentes químicos, incluidas las emanaciones, explosiones e incendios.
Para atender este principio, se pueden utilizar sólidos en vez de líquidos o sustancias de baja presión de vapor en lugar de líquidos volátiles o gases que están asociados con la mayoría de los accidentes químicos.
ConclusiónLa Química Verde presenta una nueva filosofía y establece estándares altos para llevar a cabo la investigación y producción de sustancias y procesos químicos, maximizando sus beneficios y minimizando los efectos secundarios que pueden ser dañinos al ser humano y al medio ambiente. A pesar de los éxitos alcanzados durante los últimos 15 años, la disciplina está en sus inicios y aún quedan muchos retos que deben enfrentarse en laboratorios de investigación y desarrollo de institutos, universidades e industrias, por lo que los químicos deben poner en juego sus conocimientos y creatividad.
En cuanto al aspecto docente, es interesante la propuesta del Dr. Cann (1999) de llevar a la clase de Química Orgánica o Química Ambiental las propuestas ganadoras del Programa Presidencial de Premios a los Retos de la Química Verde a través de seminarios o proyectos, ya que constituyen ejemplos de síntesis química y procesos industriales en la frontera del conocimiento actual (http://www.epa.gov/greenchemistry/pubs/pgcc/past.html).