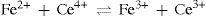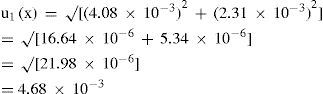A potentiometric Ultramicrotitration (titration of 0.2 mL) of ammoniacal ferrous sulfate with three different oxidants (potassium dichromate, potassium permanganate and ceric sulfate) was compared to the conventional potentiometric titration of the above reagent. This article compares the Ultramicrotitration against the conventional one, uses less than 2% of the reagents, consequently decreasing costs and waste in similar proportions. The optimization of resources, expenses and waste motivates an “ecological conscience” in both instructors and students that may also positively impact current industry standards.
Los problemas de contaminación ambiental siempre han existido, y hasta hace poco tiempo era una moda hablar de sus posibles soluciones, con las cuales, uno como individuo de la sociedad planetaria, quedaba bien. Actualmente el problema ha alcanzado tal magnitud que se hace necesario estructurar soluciones (Baeza et al., 2004; Berry, 2000; Butcher et al., 1985). Es claro que todas las actividades humanas generan contaminación (desde las actividades mínimas vitales como respirar y alimentarnos hasta el trabajo de los grandes desarrollos industriales). Es ahora cuando nos estamos haciendo más conscientes de que absolutamente todas nuestras actividades tienen un costo y que inevitablemente lo tendremos que pagar. La factura ya está hecha, y quien tenga conciencia tratará de pagarla de inmediato o al menos no aumentar su costo. De no hacerlo la naturaleza misma lo cobrará con enfermedades en uno mismo o en nuestros descendientes.
Pero ¿cómo pagar? El eslogan “la educación es la solución” ofrece la respuesta: educar en la conciencia ecológica ya no es tarea tan difícil, porque el destino nos está alcanzando, todo individuo consciente de esta problemática puede ver los efectos del cambio climático debido a la depredación que estamos cometiendo con los ecosistemas, la falta de agua y a la vez grandes volúmenes de aguas contaminadas, el aumento global de temperatura y el consiguiente aumento del nivel del mar por la destrucción de los glaciares polares, la furia de los tsunamis, tornados y huracanes, que en la actualidad son noticias diarias, tal y como si estuviésemos viviendo un apocalipsis bíblico. Siendo la educación la mejor posible solución, a los docentes nos corresponde colaborar educando con el ejemplo. En las carreras profesionales del área de química un componente fundamental en el proceso de aprendizaje es el trabajo experimental del laboratorio (Díaz Ricart, 2002) como el lugar fundamental para generar preguntas y respuestas (Rincón Arce y Pérez Saavedra, 2003). Es en este lugar donde mostramos las verdades actuales de los fenómenos químicos de manera experimental e inconscientemente estamos enseñando a contaminar, porque como mencionamos anteriormente, toda actividad humana tiene un costo; por lo mismo, enseñar tiene un costo, y enseñar en el laboratorio tiene un costo mayor (Ibáñez, 2000; Mayo, 1986; Mono, 2000) por la intrínseca necesidad de experimentar y, con esto, utilizar reactivos químicos, y por lo tanto generar residuos que finalmente se arrojan al caño para terminar en nuestros ríos, tierras de cultivo (Rayén Quiroga, 2001), acumularse en nuestros alimentos y finalmente llegar a nuestros mares. Afortunadamente la preocupación por la sustentabilidad y la no-contaminación en esta área de conocimiento ya tiene un camino andado (Szafran et al., 1991; Torres y Castrellón, 2000; Trejo Alba-rran, 2006) para dar soluciones.
La Química es una ciencia axiológica que con los antecedentes ya mencionados nos permite intentar con nuestros estudiantes minimizar los costos de nuestras facturas, por enseñar y aprender; es decir, no generar deshechos e incrementar aprendizaje. Para nuestro caso en particular (Química Analítica), el ultramicroanálisis es la solución, la enseñanza por medio de ultramicrovaloraciones potenciométricas, sin perder información, y creando conciencia con el ejemplo en nuestros estudiantes, podemos comenzar a minimizar la “Huella Ecológica”.2 En 2003 (Rincón Arce y Pérez Saavedra, 2003) comenzamos un proceso en el ámbito de grupo piloto para disminuir costos y desechos en nuestros laboratorios; actualmente ya no es trabajo de grupo piloto sino un paradigma formal en nuestros laboratorios. Pero dadas las actuales circunstancias, rediseñamos las metodologías propuestas para reintentar romper el paradigma creado y volver a minimizar reactivos utilizados y ya no generar desechos (considerando que la mejor manera de recuperar desechos es no generándolos).
En las tablas 1 a 3 se muestra la disminución en volumen de reactivos utilizados de acuerdo con el modelo propuesto, así como la disminución de los costos para el caso de la valoración de sulfato ferroso amoniacal con dicromato de potasio.
Reactivo por valorar (sulfato ferroso amoniacal FeSO4(NH4)2SO4 .6H2O, peso equivalente 392.14 g; una solución 0.1 N tendrá 0.039 214 g/mL).
Reactivo valorante (dicromato de potasio K2Cr2O7, peso equivalente 49.03 g; una solución 0.1 N tendrá 0.004 903 g/mL).
| Modelo | Volumen usado (mL) | Repeticiones por equipo | Total de equipos | Vol. total usado (mL) | Gramos totales | Costo2 (dólares) |
|---|---|---|---|---|---|---|
| Convencional | 20 | 3 | 280 | 16 800 | 82.3704 | 37.06 |
| 2003 | 3 | 3 | 280 | 2 520 | 12.3555 | 5.56 |
| 2008 | 0.3 | 3 | 280 | 252 | 1.2355 | 0.556 |
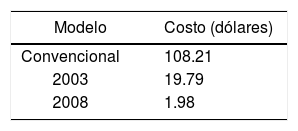
Del modelo convencional de trabajo al modelo de 2003 disminuimos en más de una quinta parte los reactivos utilizados por práctica, y del modelo del 2003 al ahora propuesto disminuimos 10 veces los reactivos utilizados por práctica.
Del modelo convencional de trabajo al modelo ahora propuesto pasamos de utilizar 25.200 litros (108.21 dólares) de reactivo por práctica a 0.420 litros (1.98 dólares) de reactivo por práctica (el costo por contaminar no está considerado, porque en realidad es incalculable). Por último, el volumen final de 0.420 L se coloca en una charola de vidrio o plástico para cristalización, se expone al sol, el líquido (agua) se evapora y se recupera la sal formada, con lo cual ni líquido ni reactivo se desechan.
Objetivos- 1.
Establecer una nueva técnica de cuantificación experimental en metodologías convencionales mediante sistemas de medición adecuados a ultramicrovaloraciones (volúmenes por valorar de 0.2 mL) para instrumentarlas a nivel laboratorio.
- 2.
Contribuir a la disminución de la contaminación ambiental, provocado por el uso de reactivos químicos en la actividad experimental, sin perder información.
- 3.
Modificar el trabajo experimental en docencia, mediante el uso de ultramicrovaloraciones, para provocar un cambio de actitud en el estudiante y el docente respecto a la contaminación ambiental.
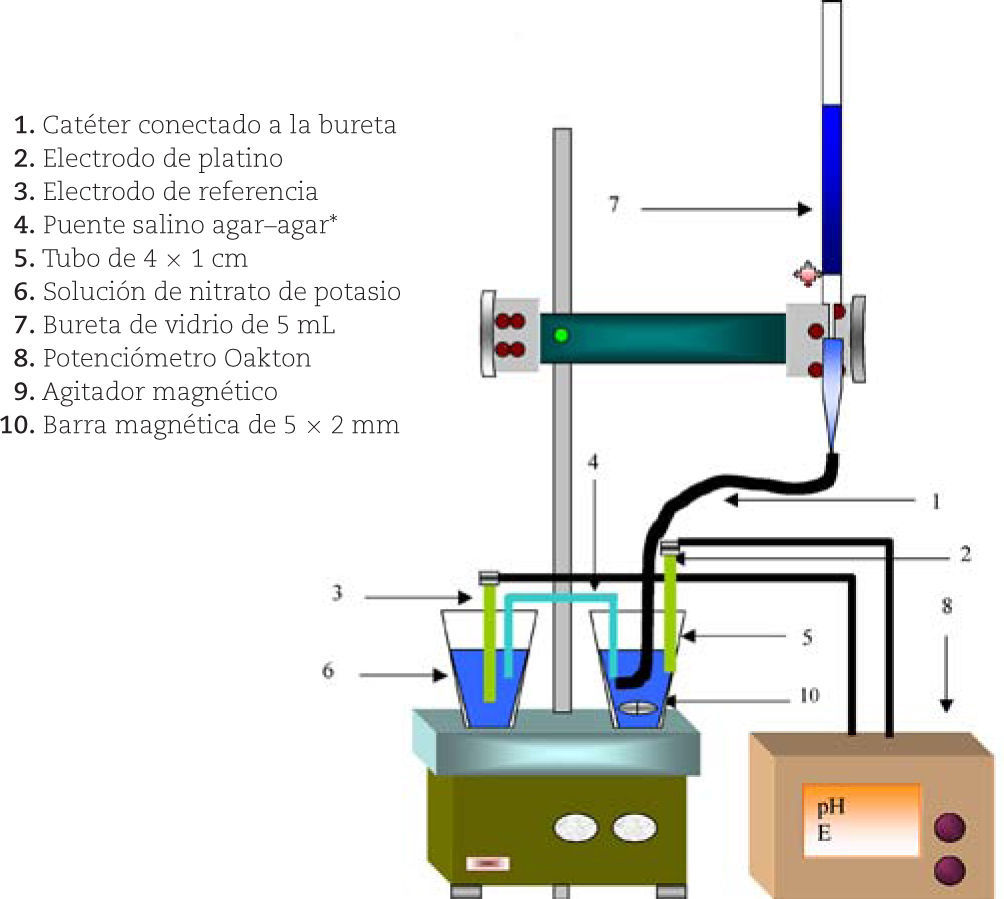
Los reactivos utilizados fueron grado analítico, estandarizados de acuerdo con Orozco (1975). Como electrodo indicador se usó un alambre de platino calibre 24, como electrodo de referencia un electrodo de calomel marca Corning y un potenciómetro marca Oakton modelo RS 232. Con una micropipeta marca Trannsferpette se tomaron 30 alícuotas de 0.2 mL y con una pipeta volumétrica 30 alícuotas de 5 mL de sulfato ferroso amoniacal preparado en H2SO4 al 5%,3 se titularon con dicromato de potasio, que fue utilizado como estándar primario (agregando 0.4903 g de sal pura de dicromato de potasio, en 100 mL de agua destilada para obtener una concentración de 0.1 N; Orozco, 1975). El esquema del equipo experimental utilizado se presenta en la figura 1; el aforo de la bureta (con capacidad de 5 mL clase A con una graduación mínima de 0.01 mL y una tolerancia de ± 0.01 mL, Harris, 1991) no se hizo de la manera convencional, se conectó la bureta a un catéter para inyección de insulina —Accu-Chek, Ultraflex, Infusion Set, 60 cm ref. 04631374001 Roche—, el aforo es hasta la punta de salida del catéter que se sumerge dentro del seno de la solución. (En experimento previo se comprobó que no existiera difusión de la solución valorante a través del catéter, ver anexo 1). Para las valoraciones de volúmenes de 5 mL se utilizó una bureta de 10 mL clase A, con una graduación mínima de 0.1 mL y una tolerancia de ± 0.01 mL (Harris, 1991); las valoraciones se realizaron de manera convencional.
Equipo experimental.
* El electrodo de referencia convencional tiene un diámetro mayor (1.3 cm) que el recipiente contenedor de la solución por valorar (1 cm). Esto hace necesario separarlo en un segundo recipiente que contiene nitrato de potasio 0.1 M; el circuito se cierra con un puente de agar-agar, que se preparó poniendo a ebullir 25 mL de nitrato de potasio 0.1 M en un vaso precipitado de 100 mL, y agregando 0.25 g de agar-agar. Luego un tubo en U se llena con la solución antes que ésta se enfríe; al solidificar el agar-agar se utiliza el tubo como puente salino.
Los datos obtenidos se procesaron matemáticamente usando un programa de hoja electrónica (Excel); con dicho programa se obtuvieron las gráficas correspondientes de potencial (mV) contra volumen agregado de valorante. Asimismo, se procesó la información para obtener los datos y las gráficas correspondientes a la primera derivada del potencial contra el volumen ajustado, lo cual permitió determinar analíticamente el volumen de punto de equivalencia para cada valoración de sulfato cérico. Este mismo procedimiento se siguió para la valoración de sulfato ferroso amoniacal con permanganato de potasio y dicromato de potasio. Las reacciones efectuadas se presentan en el anexo 2).
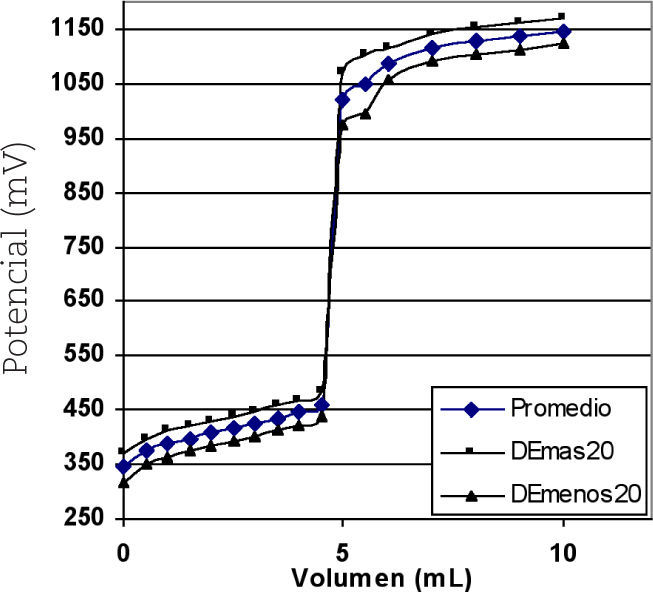
ResultadosEn las figuras 2, 4 y 6 se muestran cada una de las gráficas experimentales promedio obtenidas de 30 valoraciones de 0.2 mL de sulfato ferroso amoniacal (0.099 N) con dicromato de potasio (0.1 N), permanganato de potasio (0.099 N) y sulfato cérico (0.101 N), respectivamente. En las figuras 3, 5 y 7 se muestran cada una de las gráficas experimentales promedio obtenidas de las 30 valoraciones de 5 mL de sulfato ferroso amoniacal; en todas las gráficas se incluye el intervalo de la desviación estándar para cada volumen agregado incrementada en un factor de 20, con el fin de obtener una apreciación visual sencilla.
En las figuras 8 y 9 se muestra la determinación del punto de equivalencia por el método de la primera derivada para la valoración de 0.2 mL y 5 mL de sulfato cérico. En la tabla 4 se presentan los volúmenes de punto de equivalencia obtenidos para las valoraciones de sulfato ferroso amoniacal para cada agente oxidante. En las tablas 5 y 6 se presentan los resultados de los miligramos recuperados de las valoraciones de 0.2 mL y 5 mL de sulfato ferroso amoniacal con cada sistema oxidante, contra los miligramos esperados y su error porcentual.
Resultados de los volúmenes del punto de equivalencia (VPE) de las valoraciones de 0.2 mL de sulfato ferroso amoniacal 0.099 N con cada sistema oxidante.
| Valoración | 0.2 mL | 5.0 mL |
|---|---|---|
| Dicromato de potasio 0.1 N | 0.185±4.08×10–4 | 4.75±4.08×10–3 |
| Permanganato de potasio 0.099 N | 0.195±4.08×10–4 | 4.75±4.08×10–3 |
| Sulfato cérico 0.101 N | 0.195±4.08×10–4 | 4.75±4.08×10–3 |
Resultados de los miligramos recuperados de las valoraciones de 0.2 mL de sulfato ferroso amoniacal 0.099 N con cada sistema oxidante contra los miligramos esperados y su error porcentual.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
|---|---|---|---|---|---|---|---|---|---|
| Valoración | Volumen obtenido (mL) | Normalidad experimental obtenida N1V1=N2V2 | Volumen valorado (mL) | Milimoles experimentales obtenidas (1×2) | Milimoles teóricas (0.1×0.2) | Peso molecular | mg esperados (4×5) | mg obtenidos (3×5) | Error porcentual |
| Dicromato de potasio 0.1 N | 0.186±4.08×10–4 | 0.0928±0.026 | 0.2±4.08×10–4 | 0.0186±0.026 | 0.02 | 392.14 | 7.84 | 7.28±0.026 | 7.14 |
| Permanganato de potasio 0.099 N | 0.195±4.08×10–4 | 0.096±0.026 | 0.2±4.08×10–4 | 0.0193±0.026 | 0.0198 | 392.14 | 7.76 | 7.57±0.026 | 2.47 |
| Sulfato cérico 0.101 N | 0.195±4.08×10–4 | 0.0985±0.026 | 0.2±4.08×10–4 | 0.0197±0.026 | 0.0202 | 392.14 | 7.92 | 7.72±0.026 | 2.52 |
| Promedio | 4.04 | ||||||||
Resultados de los miligramos recuperados de las valoraciones de 5 mL de sulfato ferroso amoniacal 0.099 N con cada sistema oxidante contra los miligramos esperados y su error porcentual.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
|---|---|---|---|---|---|---|---|---|---|
| Valoración | Volumen obtenido (mL) | Normalidad experimental obtenida N1V1=N2V2 | Volumen valorado (mL) | Milimoles experimentales obtenidas (1×2) | Milimoles teóricas | Peso molecular | mg esperados (4×5) | mg obtenidos (3×5) | Error porcentual |
| Dicromato de potasio 0.1 N | 4.75±4.08×10–3 | 0.095±0.0027 | 5.0±4.08×10–3 | 0.475±0.0027 | 0.5 | 392.14 | 196.07 | 186.26±0.0027 | 5 |
| Permanganato de potasio 0.099 N | 4.75±4.08×10–3 | 0.094±0.0027 | 5.0±4.08×10–3 | 0.47±0.0027 | 0.495 | 392.14 | 194.1 | 184.3±0.0027 | 5.05 |
| Sulfato cérico 0.101 N | 4.75±4.08×10–3 | 0.096±0.0027 | 5.0±4.08×10–3 | 0.479±0.0027 | 0.505 | 392.14 | 198.0 | 187.83±0.0027 | 5.13 |
| Promedio | 5.06 | ||||||||
Se estableció la metodología experimental para llevar a cabo ultramicrovaloraciones potenciometricas (0.2 mL de reactivo por valorar) de sulfato ferroso amoniacal con tres diferentes sistemas oxidantes que pueden ser instrumentadas con mucho éxito en los laboratorios de escuelas que imparten carreras relacionadas con el área química (con poca experiencia se puede manejar con éxito la instrumentación propuesta) pudiendo comprobarse que con este método prácticamente no hay productos de desecho y se minimiza el uso de reactivos, con lo que se aumenta la seguridad en su manejo, además de disminuirse los costos de experimentación.
En relación a los resultados experimentales de las valoraciones, en las tablas 5 y 6 se puede observar que los errores porcentuales promedio para las valoraciones de 0.2 mL y 5 mL son 4.04 y 5.06 respectivamente, aunque los volúmenes de punto de equivalencia en la ultramicrovaloración tienen una incertidumbre 10 veces mayor que en la titulación convencional (0.026 respecto a 0.0027, respectivamente). Esta alta incertidumbre en la ultramicrovaloración se puede disminuir de dos maneras: una utilizando una bureta más precisa y exacta que la de 5 mL (por ejemplo utilizando la Eppendorf® Repeater® Plus Pipettor que permite agregar volúmenes de 1 a 20 μL, como una bureta convencional, con una exactitud del ± 1 al ± 2.5%) o bien, utilizar la bureta de 5 mL valorando 2 mL en vez de 0.2 mL, pero disminuyendo 10 veces la concentración (en vez de valorar soluciones 0.1 M usar 0.01 M), con lo cual no se incrementan costos.
Finalmente se puede concluir que el uso de microcantidades, además de proveer un gran avance en la manipulación segura de sustancias peligrosas y las ventajas antes mencionadas, también nos lleva a crear una conciencia ambiental en todos los que intervienen en el proceso: cuando el docente y el estudiante obtienen resultados lo suficientemente confiables con una instrumentación diferente a la convencional, que permite ahorrar recursos y no contaminar, difícilmente vuelven a utilizar instrumentaciones que generan desperdicios y les motiva una conciencia de posibilidad de cambio en metodologías tradicionales. Con esta metodología, nuestras escuelas siempre escasas de recursos tienen alternativas para formar futuros profesionistas en el área de química sin fuertes inversiones. Finalmente, se puede comentar que el trabajo presentado puede ser un buen ejemplo de reactividad redox para los cursos iniciales de química analítica.
El presente trabajo fue apoyado mediante el proyecto papime con clave pe205509. Los autores agradecen al Dr. Gustavo Marcial Delgado, de la Universidad Nacional Autónoma de Nicaragua, León (UNAN-León), y a la Dra. Mª de los Ángeles Álvarez Fernández del DOCINADE, por su valiosa asesoría.
Para asegurar que no exista difusión de la sustancia valorante al seno de la solución por valorar, ya que el catéter se sumerge en ella, se realizó el siguiente experimento: se preparó rojo de metilo al 0.1% y pH = 4.0 (ácido acético/acetato de sodio 0.1 M, solución A), obteniéndose un color rojo en agua. Para elegir una concentración adecuada y elaborar un espectro del indicador se hicieron diluciones de 1/10 y se midieron las absorbancias correspondientes, obteniéndose los resultados mostrados en la tabla 1. Se corrió un espectro de absorción (espectrofotómetro Thermo Spectronic Modelo Genesys 20), de la dilución de 0.01% (solución B) obteniéndose un máximo de absorbancia entre 500 y 550 nm (meseta). La bureta de 5 mL que se utiliza para añadir el valorante se afora con la solución B, hasta la punta del catéter; éste se sumerge en una celda de espectrofotómetro que conteniene la solución A (cuya absorbancia a 500 nm es de 0.0, por utilizarse como solución blanco). Se midieron las absorbancias por triplicado de la celda a los 20 minutos y 24 horas. Los resultados obtenidos se muestran en la tabla 2.
Como se puede observar en la tabla 2, a las 24 horas de contacto del catéter con la solución la absorbancia es 0.003, valor que cae dentro de la incertidumbre de lectura del equipo (exactitud fotométrica 0.003 A, Manual del Operador Genesys™ 20 Spectrophotometer).
La solución decinormal de dicromato de potasio se prepara pesando 0.4903 g de la sal pura, disolviendo y aforando a 100 mL (Orozco, 1975, p. 372).
3.9 g de sulfato ferroso amoniacal se disuelven en agua que contiene 5% de H2SO4 y sé afora a 100 mL (Orozco, 1975, p. 374). De esta solución se toman cinco alícuotas de 2 mL y se titulan con la solución de dicromato de potasio 0.1 N, usando como indicador ferricianuro de potasio. La concentración experimental obtenida fue de 0.099 N.
N1V1 = N2V2
N2 = 0.1 (dicromato de potasio)
V2 = 1.98 mL (dicromato de potasio)V1 = 2 mL (sulfato ferroso amoniacal)N1 = sulfato ferroso amoniacal (por calcular)N1 = (N2V2) / V1 = (0.1×1.98) / 2 = 0.099
0.32 g de permanganato de potasio se aforaron a 100 mL (Orozco, 1975, p. 308). Para su estandarización se tomaron cinco alícuotas de 2 mL de sulfato ferroso amoniacal de concentración 0.099, y se titularon con permanganato de potasio. No fue necesario el uso de indicador ya que el permanganato actúa como tal. La concentración experimental obtenida fue 0.099 N.
La reacción química es:
N1V1 = N2V2
N2 = 0.099 (sulfato ferroso amoniacal)
V2 = 2 mL (sulfato ferroso amoniacal)
V1 = 2 mL (permanganato de potasio)
N1 = permanganato de potasio (por calcular)
N1 = (N2V2) / V1 = (0.099×2) / 2 = 0.099
6.32 g de sulfato doble de cerio amoniacal (IV) se disuelven en agua que contiene 6% de H2SO4 y se aforan a 100 mL (Orozco, 1975, pp. 37 y 382-384). Para su estandarización, se toman cinco alícuotas de 2 mL de sulfato ferroso amoniacal de concentración 0.099 y se titularon con sulfato doble de cerio amoniacal (IV) utilizando como indicador el ferroin. La concentración experimental obtenida fue 0.101 N.
N1V1 = N2V2
N2 = 0.099 (sulfato ferroso amoniacal)
V2 = 2 mL (sulfato ferroso amoniacal)
V1 = 2.04 mL (sulfato cérico amoniacal)
N1 = sulfato cérico amoniacal (por calcular)
N1 = (N2V2) / V1 = (0.099×2.04) / 2 = 0.101
La tolerancia reportada por el fabricante para la micropipeta digital Transferpette® de 100 a 1000 μL es de 0.001 mL (Manual de Operación Brand).
Considerando una distribución triangular [10–3/√6] = [10–3/2.45] = 4.08×10–4 mL.
Considerando que la temperatura del laboratorio tiene una variación de ± 4 °C (el coeficiente de expansión del volumen del agua es de 2.1×10–4), al utilizar una distribución rectangular resulta una incertidumbre estándar de:
[(0.195×4×2.1×10–4)/√3] = [1.64×10–4/1.73] = 9.48×10–5
Combinando estas contribuciones se obtiene la incertidumbre estándar:
La incertidumbre estándar relativa será:
[u1(x)/x] = (4.19×10–4)/(0.195) = 2.15×10–3
La incertidumbre reportada por el fabricante para la bureta de 5 mL ± 0.01 mL.
Considerando una distribución triangular 10–2/√6 = 10–2/2.45 = 4.08×10–3 mL.
Considerando que la temperatura del laboratorio tiene una variación de ± 4 ° C (el coeficiente de expansión del volumen del agua es de 2.1×10–4) utilizando una distribución rectangular resulta una incertidumbre estándar de:
[(5×4×2.1×10–4)/√3] = (4.2×10–3)/1.73] = 2.43×10–3
Combinando estas contribuciones se obtiene:
La incertidumbre estándar relativa será:
[u1(x)/x] = (4.75×10–3)/(0.2) = 2.37×10–2
El método de validación muestra una repetibilidad para la determinación del 0.1%; este valor puede ser utilizado directamente para el calculo de las incertidumbres estándar, combinadas.
Incertidumbre estándar u(x) = 0.001
Cáculo de las incertidumbres combinadas
La incertidumbre extendida U(xFeII) se calcula multiplicando las incertidumbres estándares combinadas por un factor de cobertura de 2:
U[xFeII] = 0.026×2 = 0.052
La tolerancia reportada para la pipeta volumétrica de 5 mL clase A es de 0.01 mL (Harris, 1991)
Considerando una distribución triangular [10–2/√6] = [10–2/2.45] = 4.08×10–3 mL.
Considerando que la temperatura del laboratorio tiene una variación de ± 4 °C (el coeficiente de expansión del volumen del agua es de 2.1×10–4), al utilizar una distribución rectangular resulta una incertidumbre estándar de:
[(4.75×4×2.1×10–4)/√3] = [39.9×10–4/1.73] = 2.31×10–3
Combinando estas contribuciones se obtiene la incertidumbre estándar:
La incertidumbre estándar relativa será:
[u1(x)/x] = (4.68×10–3)/ (4.75) = 9.86×10–4
La incertidumbre reportada por el fabricante para la bureta de 5 mL ± 0.01 mL.
Considerando una distribución triangular 10–2/√6 = 10–2/2.45 = 4.08 10–3 mL.
Considerando que la temperatura del laboratorio tiene una variación de ± 4 °C (el coeficiente de expansión del volumen del agua es de 2.1×10–4), al utilizar una distribución rectangular resulta una incertidumbre estándar de:
[(5×4×2.1×10–4)/√3] = (4.2×10–3)/1.73] = 2.43×10–3
Combinando estas contribuciones se obtiene:
La incertidumbre estándar relativa será
[u1(x)/x] = (4.75×10–3)/(4.75) = 10–3
El método de validación muestra una repetibilidad para la determinación del 0.1%; este valor puede ser utilizado directamente para él calculo de las incertidumbres estándar, combinadas.
Incertidumbre estándar u(x) = 0.001
Cálculo de las incertidumbres combinadas
La incertidumbre extendida U(X FeII) se calcula multiplicando las incertidumbres estándares combinadas por un factor de cobertura de 2
U(x FeII) = 0.00133×2 = 0.0027
La huella ecológica se define como el uso de espacio ambiental (nacional, regional o per capita) necesario para producir los niveles de vida que existen en determinados asentamientos humanos, en relación a las capacidades de carga de los ecosistemas relevantes.
Colectados los residuos de H2SO4 al 5 % se diluyen con agua de la llave con relación de 1:100. Una vez diluidos se neutralizan con NaOH al 10% en peso, hasta alcanzar un pH entre 5 y 7, con lo que están listos para verter en la alcantarilla (Manejo de residuos, 2009).