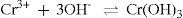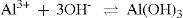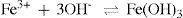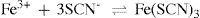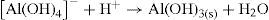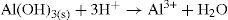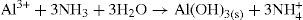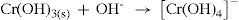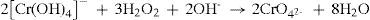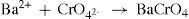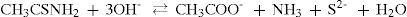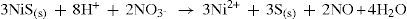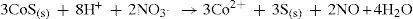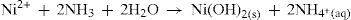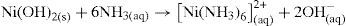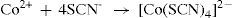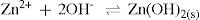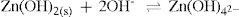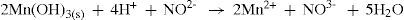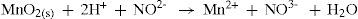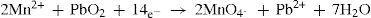This article presents a support material to help students of the Chemistry course in the understanding of chemical concepts involved in the identification and separation of cations made in practice classes in the Qualitative Analytical Chemistry subject. The material was elaborated in the perspective of contributing to the student's learning, by dialoguing and discussing with them in these classes during a semester.
Este artículo presenta material de apoyo para auxiliar a los estudiantes del curso de química en la comprensión de los conceptos químicos involucrados en la identificación y separación de los cationes realizados en las clases de laboratorio de Química Analítica Cualitativa. El material fue elaborado con el propósito de contribuir al aprendizaje estudiantil, mediante el diálogo y la discusión con ellos en las clases de un semestre completo.
Investigações sugerem que o ensino da Química deveria centrar-se nos estudos sobre as substâncias e os materiais (a constituição, as propriedades e as transformações). Melhor dizendo: a partir desse estudo, espera-se que os estudantes possam compreender, interpretar e analisar algumas das características do mundo que o rodeia (Silva, Núñez, 2008).
Na década de 1960, o processo de ensino e aprendizagem centrava-se em conhecer os elementos, os compostos químicos e suas transformações, e descrever sua obtenção e aplicações. Já na década seguinte a discussão dirige-se aos aspectos conceituais da Química com ênfase nos princípios químicos. Entre eles, a estrutura atômica e molecular, a termoquímica e o equilíbrio químico. Na década de 1980 e 1990, encontramos muitas discussões sobre as concepções alternativas, a partir das quais se começa a perceber que os estudantes possuíam representações próprias para o fenômeno químico. É nesse aspecto que entra a expressão dificuldade de aprendizagem, a qual tem sido usada nas pesquisas de ensino de Ciências como forma de descrever uma situação em que o estudante não tem sucesso na aprendizagem de um conteúdo.
No ensino de Química, as dificuldades de aprendizagem dos conceitos e habilidades manifestam-se nas variadas concepções alternativas dos estudantes e nos erros na solução de situações problema e de exercícios. Um aspecto interessante para o qual as investigações vêm sinalizando é que as dificuldades de aprendizagem são similares em diferentes países, culturas, condições sociais e econômicas (Pozo, Goméz-Crespo, 1998).
Segundo Kempa (1991), as dificuldades de aprendizagem, de modo geral, estão vinculadas à natureza das idéias prévias (concepções alternativas) ou à pouca aquisição para estabelecer conexões significativas com os conceitos que se deseja ensinar; às relações entre a demanda ou complexidade de uma tarefa a ser aprendida e a capacidade do estudante para organizar e processar a informação; à competência lingüística; à pouca coerência entre o estilo de aprendizagem do estudante e o estilo de ensino do professor.
Suarez Yánez (1995) agrega à discussão de Kempa (1991) o critério da internalidade (origem interna) ou externalidade (origem externa) da dificuldade de aprendizagem. Dentre as de origem interna, encontram-se o estilo da aprendizagem, a capacidade do estudante para organizar e processar informação, a competência linguística. Com relação às de origem externa, podemos citar a natureza do objeto de estudo, a demanda das tarefas e o estilo de ensino.
Tal discussão é corroborada por Jiménez Aleixandre (2007) sinalizando que as dificuldades de aprendizagem estão relacionadas: à matéria, sob o ponto de vista macroscópico e microscópico; à linguagem química, sejam fórmulas, equações químicas, modelos, etc.; às características das reações químicas, tais como calor de reação, equilíbrio químico e velocidade (rapidez) das reações químicas; aos tipos de reações químicas (ácido-base e redox) e aos processos eletroquímicos.
Ao procurar a transposição didática (Lopes, 1999), observa-se a importância de se procurar caracterizar as propriedades dos materiais a partir da análise experimental de identificação macroscópica e sua respectiva explicação microscópica. Particularmente no ensino superior são utilizadas, de modo geral, ferramentas como atividades experimentais que propiciem não apenas a relação micro-macro, mas também que possa promover o desenvolvimento de habilidades específicas da profissão do químico. Nestes experimentos a observação dos fenômenos se dá no nível macroscópico e, a partir deste, procura-se explicar microscopicamente.
Em uma investigação realizada por Dantas et al. (2008) sobre a marcha analítica da aula experimental em livros de ensino superior, os autores observaram que estes materiais, em geral, iniciam com breve desenvolvimento histórico e não associam aspectos teóricos com a atividade experimental. Este argumento subsidia a intencionalidade deste trabalho considerando a necessidade de materiais de apoio que auxiliem os estudantes do ensino superior na construção do conhecimento químico minimizando as dificuldades de aprendizagem.
O que pretendemos neste artigo é olhar para tais questões no ensino superior na disciplina de química analítica e discutir as etapas de identificação de cátions com o objetivo de auxiliar no entendimento dos conceitos envolvidos no processo de identificação. Para tanto, procuramos conhecer qual a sequencia mais apresentada em livros didáticos do ensino superior. A partir desta identificação inicial, foi elaborado um texto de apoio para abordar estes conceitos na disciplina.
O que sinalizam os livros didáticos do ensino superior: o comportamento de hidróxidos e sulfetos em solução aquosaNa disciplina de química analítica qualitativa os íons Alumínio (III), Ferro (III), Crômio (III), Níquel (II), Cobalto (II), Manganês (II) e Zinco (II), constituem o que se denomina de grupo III. Alguns livros didáticos muito utilizados nesta disciplina (Baccan, 1995; Vogel, 1981) registram como agentes precipitantes para este grupo, os hidróxidos e os sulfetos. Com exceção do alumínio, os cátions deste grupo têm uma característica bastante peculiar, pertencem a primeira fila dos metais de transição e, por isto, têm forte tendência de formar complexos.
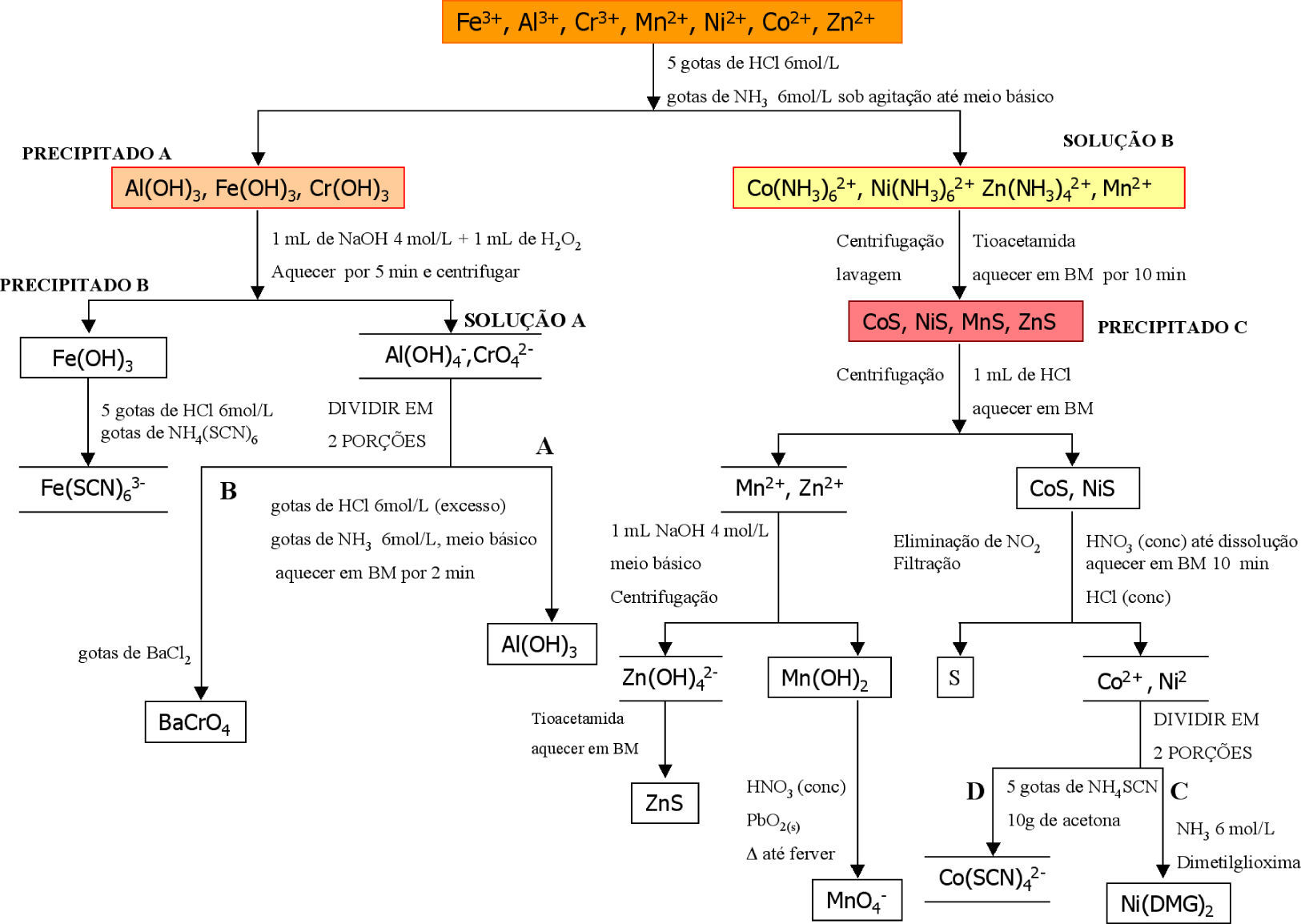
De modo geral, no contexto brasileiro, nas aulas de Química Analítica Qualitativa, os estudantes recebem uma amostra desconhecida, sólida ou líquida, para realizar o processo de separação e identificação dos íons presentes. Na primeira etapa de separação, os íons dos elementos Alumínio (III), Ferro (III) e Crômio (III) formam hidróxidos muito pouco solúveis em solução alcalina. A solução sobrenadante é constituída pelos complexos de Níquel (II), Cobalto (II), Manganês (II) e Zinco (II). De maneira geral, o procedimento realizado é semelhante ao que é mostrado na Figura 1.
Esquema de separação da mistura de cátions do grupo III (Baccan, 1995).
Nota-se que neste esquema, a partir de uma amostra contendo uma mistura de cátions do grupo III, é necessário adicionar ácido clorídrico concentrado e amônia para dar condições favoráveis para ocorrer a precipitação desejada. Isto significa que avaliar o meio reacional é muito importante para se compreender as condições em que determinadas reações químicas ocorrem. Afinal, que condições são estas? Por exemplo, se fosse adicionado somente ácido clorídrico o que aconteceria? E se fosse adicionado somente a base amônia, ocorreria precipitação de algum dos íons presentes na amostra?
Considerando a adição de ácido clorídrico, que é um ácido forte, haveria em solução quantidade suficiente de íons cloreto para interagir com os íons metálicos presentes e favorecer a formação de cloretos de ferro, crômio, alumínio, manganês, níquel, cobalto e zinco. No entanto, estes cloretos são solúveis. A partir desta sequência, não seria possível separar estes íons entre si, pois estariam todos juntos em solução. Baseado nesta constatação, o meio ácido não favorece a separação dos cátions presentes nesta amostra.
Seguindo o mesmo raciocínio, consideramos a adição de uma base, amônia. Em solução a mesma apresenta o seguinte equilíbrio:
A adição desta base na solução, em concentração adequada, fornece quantidade suficiente de íons hidroxila para interagir com os íons metálicos presentes e favorecer a formação de hidróxidos de todos os cátions presentes que irão precipitar. Portanto, não seria possível separar os íons entre si, pois permaneceria uma amostra sólida. A adição somente de amônia, como fonte de base, não favorece a separação dos cátions presentes na amostra inicial.
Com base nas considerações acima, geralmente é realizada a adição conjunta de ácido clorídrico e amônia, formando um tampão para ajustar o pH do meio (cujo valor deve estar por volta de 9,3). A formação deste tampão favorece a precipitação dos hidróxidos de alumínio, crômio e ferro. Isto indica que o íon hidroxila está presente em quantidade suficiente para exceder os valores dos produtos de solubilidade destes sais e precipitá-los como hidróxidos, separando-os dos demais íons que permaneceram na solução sobrenadante formando complexos. Para os íons que formaram complexos de níquel (II), cobalto (II), manganês (II) e zinco (II), o excesso de amônia no meio tamponado excede o valor do produto de solubilidade dos hidróxidos destes cátions até dissolvê-los para formarem os complexos amínicos destes mesmos cátions.
Esta comprovação é interessante porque nos leva a questionar por que os íons alumínio, ferro e crômio também não formariam complexos? Se continuar a adicionar base a este meio, também haverá formação de complexos de alumínio, crômio e ferro. No entanto, evita-se este procedimento porque o objetivo é separá-los entre si. Evitando a formação de todos os complexos juntos porque a separação entre eles não seria possível. Portanto, de acordo com este método, mantémse o pH do tampão num valor tal que precipite os hidróxidos de Al3+, Cr3+ e Fe3+ e os demais íons formem complexos.
Voltando à Figura 1, analisaremos a formação do precipitado A. Na solução que contém o tampão, os cátions alumínio (III), ferro (III) e crômio (III) ao interagir com o ânion hidroxila comportam-se como ácidos e bases de Lewis. Sendo o ácido de Lewis um receptor de pares eletrônicos e a base de Lewis, um doador de pares eletrônicos. Assim, os cátions metálicos comportam-se como ácidos e o ânion hidroxila, como base, conforme mostra as reações abaixo:
Um método de classificação de ácido e base conhecido como Conceito Ácido e Base Duro e Mole (Pearson, 1997; Miessler & Tarr, 2004), pode ser usado para fazer uma discussão sobre o comportamento dos íons que formam estes hidróxidos. De acordo com este método, o ácido de Lewis é receptor de elétrons e a base de Lewis, o doador. Átomos receptores ou duros possuem geralmente carga alta positiva e pequeno tamanho, sem elétrons desemparelhados na camada de valência e são pouco polarizáveis. Ácidos moles têm átomos receptores de baixa carga positiva e tamanho grande, e geralmente têm pares de elétrons desemparelhados na camada de valência e são muito polarizáveis. Uma base dura tem uma nuvem eletrônica difícil de deformar quimicamente. Elétrons foram unidos firmemente para que a perda de um elétron fosse difícil, enquanto uma base mole é facilmente deformada e até mesmo oxidada (Canham & Overton, 2003). Analisando os equilíbrios acima e de acordo com esta classificação, os cátions Al3+, Fe3+ e Cr3+ são considerados ácidos duros e o ânion OH–, uma base dura. Como estamos considerando nesta discussão que as interações entre os íons são predominantemente eletrostáticas, as interações duro-duro nestas condições são bastante favoráveis. Se compararmos com outra base dura, como por exemplo, o cloreto (Cl–), podemos verificar que a interação dos cátions com este ânion não é forte o suficiente para que ocorra a precipitação. Ocorre que o cloreto possui raio (181 pm) maior que o íon hidróxido (140 pm), o que caracteriza este último como sendo uma base mais dura que o cloreto, favorecendo sobremaneira a precipitação como hidróxido e não cloreto. A etapa seguinte é então separar os íons presentes no precipitado A.
Para separar os hidróxidos que constituem o precipitado A, adiciona-se hidróxido de sódio concentrado (porque o excesso de base dissolve parte do precipitado, complexando o íon alumínio e o íon crômio, separando-os do sólido que permaneceu precipitado). Em seguida, adiciona-se também peróxido de hidrogênio (necessário na identificação do íon cromato) e aquece-se a mistura. Com isto, tem-se, portanto, uma solução e o precipitado B. O mesmo apresenta uma coloração marrom avermelhada bem característica do hidróxido de ferro (III), como mostra a equação:
Para confirmar a presença de Fe3+, adiciona-se a este sólido ácido clorídrico, para baixar o pH e dissolver o precipitado. Em seguida, acrescenta-se tiocianato de amônio, formando o complexo vermelho de tiocianato de ferro, conforme a equação:
Para formar este complexo, o íon tiocianato, SCN–, pode ligar-se através do átomo de nitrogênio, que atua como uma base intermediária interagindo com o íon Fe3+, um ácido duro. Um ácido ou base com característica intermediária significa que, dependendo da natureza do cátion, ele pode se comportar como mole ou duro. A coloração vermelha apresentada é característica para ferro (III), por isto, o identifica. Assim, tem-se no precipitado B, a presença confirmada do ferro trivalente.
Na solução A temos o íon cromato e o complexo de alumínio. Esta solução é dividida em duas porções A e B, e os íons serão identificados individualmente.
Na porção A, é adicionado ácido clorídrico concentrado para neutralizar o excesso de hidróxido de sódio no meio reacional e dissolver o complexo de alumínio, convertendo-o a hidróxido insolúvel de alumínio, como mostra o equilíbrio 7. Este então é dissolvido em excesso de ácido clorídrico (equilíbrio 8). A adição de amônia reprecipita hidróxido de alumínio de aspecto branco gelatinoso, como mostra o equilíbrio 9. É importante registrar que em meio ácido, não apresenta o mesmo aspecto. Por este motivo, a identificação é realizada em meio básico.
Neste ponto, surge uma pergunta: Se esta reação se processa em meio básico, por que será que é necessário utilizar ácido clorídrico e amônia para precipitar hidróxido de alumínio? Por que não se utiliza somente uma base como hidróxido de sódio, que já está presente no meio? Em excesso de hidróxido de sódio a precipitação de hidróxido de alumínio não ocorre devido à formação de um íon complexo solúvel. Por este motivo, adiciona-se o ácido para reduzir a concentração de íon hidroxila e posteriormente adiciona-se amônia para ocorrer a precipitação do hidróxido de alumínio. Assim, o íon alumínio está identificado.
A porção B, cujo meio está básico por causa da adição de hidróxido de sódio (equilíbrio 10) foi tratada com H2O2, um forte agente oxidante. Os íons tetrahidroxocromato (III) são oxidados a íon cromato (equilíbrio 11). Após acidificar a solução com ácido acético e adicionar solução de cloreto de bário, forma-se um precipitado amarelo de cromato de bário, como mostra o equilíbrio 12.
Pelo exposto acima, o íon crômio também já foi confirmado e o entendimento da identificação entre os três íons, Al3+, Cr3+ e Fe3+, parece estar bem esclarecida.
A discussão agora se concentra na solução contendo complexos amínicos com os íons Ni2+, Co2+, Zn2+ e Mn2+. Estes íons formaram os complexos de [Zn(NH3)4]2+ (tetraminozincato), [Ni(NH3)6]2+, (hexaminoniquelato), [Co(NH3)6]2+ (hexaminocobaltato) e o íon Mn2+. A quantidade de NH3 não é suficiente para complexar o íon Mn2+.
A formação de complexos é característica para os íons de metais de transição que constituem este grupo. Eles podem formar um grande número de compostos porque os metais exibem muitos estados de oxidação e a capacidade para formar complexos com uma ampla variedade de ligantes. Os compostos formados são coloridos e as cores geralmente resultam de transições eletrônicas com os orbitais d parcialmente preenchidos nestas espécies (Shriver, 2003).
Em metais complexos o íon metálico funciona como um ácido de Lewis em direção a uma série de íons ou moléculas que são bases de Lewis. Estas bases de Lewis possuem um ou mais pares isolados de elétrons, e quando ligados ao íon metálico são chamados ligantes, doando um ou mais pares de elétrons para o ácido de Lewis do metal. Nos complexos formados neste grupo, a amônia, uma base dura, atua como ligante e forma complexos com metais ácidos intermediários, como Co2+, Ni2+ e Zn2+.
Voltando à Figura 1, vamos analisar a separação destes complexos entre si. Quando é adicionado a esta mistura uma solução de tioacetamida, CH3CSNH2, e aquece-se por 10 minutos aproximadamente, o complexo se desfaz e observa-se a formação do precipitado C, constituído por sulfetos. Analisando novamente o meio reacional, verifica-se que NH3 está em excesso e a concentração dos íons metálicos deve ser muito pequena. O que pode ocorrer se, a uma solução que contenha o íon complexo, for adicionado um reagente, o qual, sob condições adequadas, iria formar um precipitado com o íon central?
Será feita então uma análise bem minuciosa, tanto dos átomos de metais de transição quanto dos complexos que são formados a partir dos mesmos.
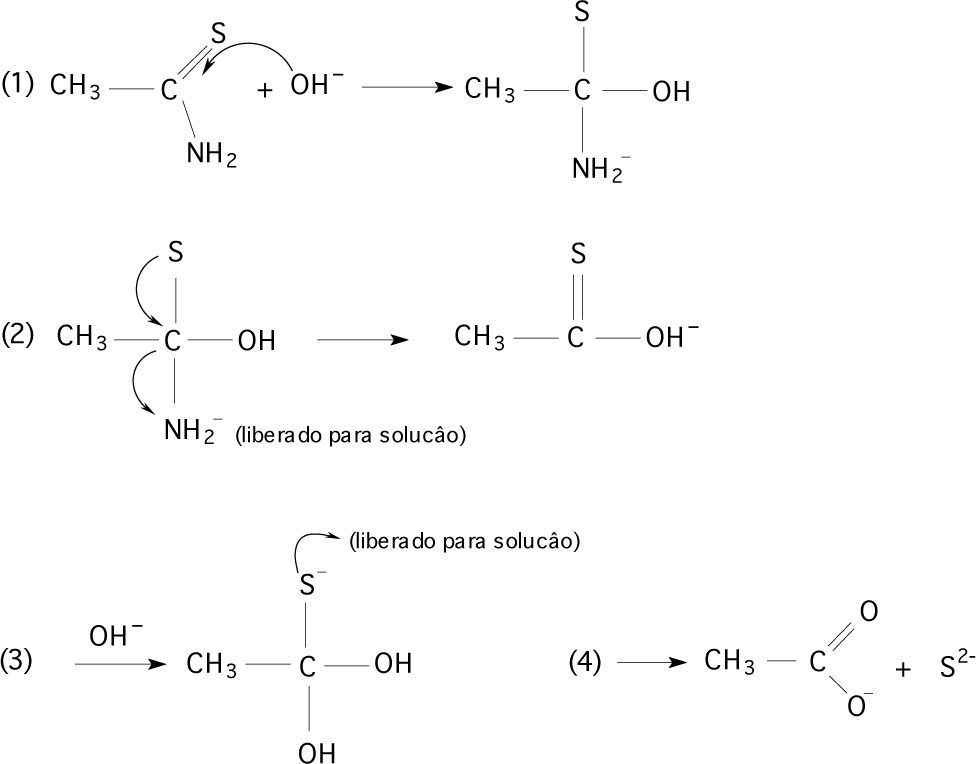
Para exemplificar, temos o complexo amínico de cobalto, [Co(NH3)6]2+. Estamos enfatizando o que acontece com os íons Co2+ e as moléculas de amônia quando é adicionado tiocetamida neste meio alcalino. Não devemos esquecer que os íons e as moléculas que interagiam inicialmente com os íons cobalto, permanecem todos em solução. Portanto, estão presentes: Co2+, Cl–, NH3, OH– e H2O. Nestas reações, o íon cloreto é utilizado para manter o pH do meio estável. Com a adição de tioacetamida como fonte de base, temos outros íons em solução: os íons sulfeto e acetato, como mostra a reação:
Mas como se estabelece este equilíbrio? Como podem ocorrer interações entre todos os íons presentes? Como deve reagir após a adição de tioacetamida? Por que é favorável a formação do precipitado? A seguir, é mostrado um mecanismo simplificado provável para esta reação, como mostra à Figura 2.
Assim, temos além das moléculas de água e amônia, os íons sulfeto e os íons acetato. Para formar então um precipitado, é necessário que haja uma interação forte entre o íon sulfeto que foi adicionado à solução e o íon metálico que está em solução na forma de complexo.
Estendendo um pouco mais esta discussão, lembramos que o nosso exemplo é o complexo de cobalto (II). Imaginamos então que uma vez formado o complexo, como ele deveria se recombinar para formar outra espécie, tal como CoS? Não se deve esquecer que, a idéia inicial de precipitar estes complexos é para ser útil no processo de identificação, portanto, fazse necessário provocar uma precipitação para iniciar o processo de separação dos cátions presentes.
Experimentalmente é o que ocorre. Como em solução o equilíbrio é dinâmico, todos os íons presentes interagem entre si para formarem ou não novas espécies. Por uma série de fatores, que vamos discutir, formam-se sulfetos muito pouco solúveis em água. A resposta pode estar na natureza dos cátions, em particular, cobalto (II), níquel (II) e zinco (II). Os complexos amínicos destes cátions são considerados lábeis, ou seja, complexos que sofrem um rápido equilíbrio (Shriver, 2003).
Para exemplificar, usaremos o complexo de cobalto. Numa reação característica deste complexo, o [Co(NH3)6]2+, o equilíbrio é estabelecido em torno de 10–6 s–1. Como se deve imaginar, é um tempo extremamente pequeno. Isto significa que o equilíbrio se estabelece de maneira muito rápida tanto no sentido da formação dos sulfetos quanto na direção dos complexos.
Analisando novamente os íons que estão presentes, pergunta-se: por que os íons OH– não interagem com os íons cobalto para precipitar como hidróxidos? Ocorre que nas condições do meio, que tem NH3 em excesso, os hidróxidos se dissociam mantendo o íon Co2+ em solução, na forma de complexos amínicos de cobalto. No entanto, como já vimos, na presença do íon sulfeto (uma base de Lewis), atua como um ligante e interage com o íon cobalto (II), um ácido de Lewis, e forma um precipitado.
Deve-se ressaltar que para formar o precipitado o produto das concentrações dos íons em solução tem que exceder o valor do produto de solubilidade dos mesmos. Os sulfetos formados neste grupo possuem valores de produtos de solubilidade pequenos (3 × 10–26 para CoS, 1,4 × 10–24 para NiS, 1,4 × 10–15 para MnS e 1 × 10–23 para ZnS), portanto, favorece a formação destes sulfetos na presença da concentração de sulfeto que é adicionado. A próxima etapa é separá-los.
Adicionando ácido clorídrico e aquecendo a mistura, parte desta mistura dos complexos permanece em solução e outra parte forma o precipitado C. Quais íons estão formando este precipitado? Os íons níquel e cobalto. Enquanto que, em solução, encontram-se os íons zinco em manganês.
Para separar e identificá-los, é adicionado ácido nítrico para dissolver o precipitado, como mostra os equilíbrios 14 e 15.
Após serem dissolvidos, a solução é aquecida para remover óxidos de nitrogênio e o enxofre livre em solução está presente em quantidades não mensuráveis. Tem-se, portanto, íons Ni2+ e Co2+ na solução sobrenadante. Neste ponto, a solução é dividida em duas porções, C e D. Na porção C, adiciona-se amônia.
Como a concentração de amônia é suficientemente alta, o hidróxido formado no equilíbrio 16 reage com mais amônia para formar o íon complexo [Ni(NH3)6]2+, como mostra o equilíbrio 17.
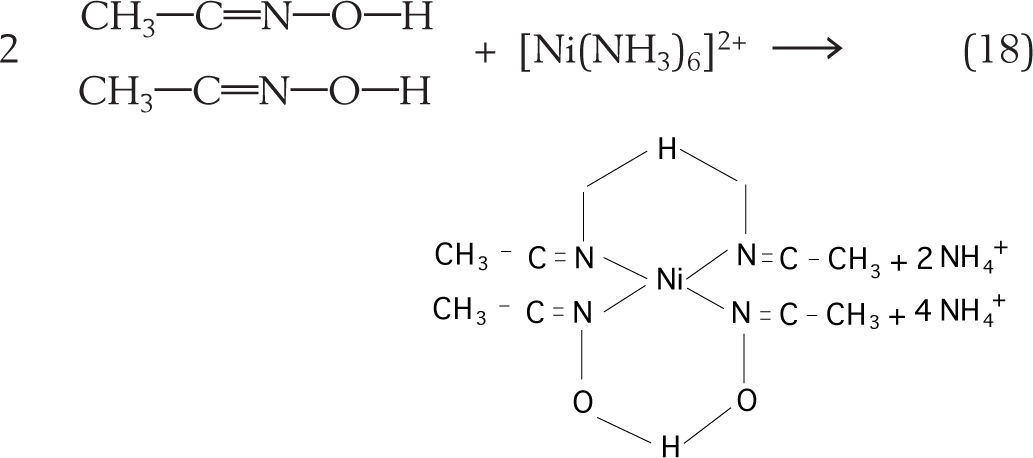
Para confirmar a presença do níquel neste complexo, é necessário então adicionar uma espécie química capaz de interagir com este complexo para torná-lo insolúvel. Tradicionalmente é adicionado um composto orgânico, a dimetilglioxima que reage com íons níquel em amônia aquosa e precipita um complexo insolúvel vermelho, conforme mostra a equação 18.
Na porção D, é realizado o teste confirmatório para o íon cobalto. Assim como para o íon níquel, após a dissolução à quente, óxidos de nitrogênio são removidos e o enxofre livre em solução, está em quantidades não significativas. Tem-se, portanto, o íon Co2+ livre para se coordenar ao ligante –SCN através do átomo de enxofre (O íon Co2+ é um ácido intermediário em relação ao Fe3+, ele é mais mole, portanto, se coordena pelo enxofre e não pelo nitrogênio!), de acordo com o equilíbrio 19:
O tiocianato de cobalto de cor azul, indica a presença do íon cobalto(II).
Vamos então a discussão dos íons precipitados na presença de sulfetos que são solúveis em ácido clorídrico, Zn2+ e Mn2+. Adiciona-se hidróxido de sódio a esta solução. Quando uma base é adicionada à solução ligeiramente ácida de Zn2+ e Mn2+, ocorre as seguintes reações, representadas nos equilíbrios 20 e 21:
Forma-se um precipitado de hidróxido de zinco (equilíbrio 20) e com um ligeiro excesso de OH–, uma base dura, dissolve o hidróxido de zinco e favorece a formação do hidroxicomplexo Zn(OH)4 2– (tetrahidroxizincato), como mostra o equilíbrio 21. A adição de tioacetamida, rica em íons S2–, uma base mole, polarizável, interage com o ácido Zn2+, presente na solução, formando um precipitado branco de sulfeto de zinco. Com isto, o íon zinco pode ser identificado.
Dos quatro sulfetos presentes inicialmente no precipitado de níquel, cobalto, zinco e manganês, nos resta agora discutir como se forma o sulfeto de manganês. Como MnS é o mais solúvel dos sulfetos estudados neste grupo, apresentando um Kps na ordem de 1,4 × 10–15, é necessário provocar sua precipitação no meio para podermos identificá-lo. Para tanto, é adicionado a esta solução hidróxido de sódio concentrado, como fonte de OH–, um base dura, e forma-se um precipitado branco de Mn(OH)2, pouco solúvel em água. Em solução ácida, o íon nitrito reduz Mn3+ a Mn2+, conforme equilíbrio 22.
Nesta situação temos novamente o íon Mn2+ em solução, só que desta vez em meio ácido. É adicionado então óxido de chumbo, como mostra o equilíbrio 24, para oxidar Mn2+ a MnO4. Como o íon chumbo é solúvel à altas temperaturas, ele se dissolve durante o aquecimento e não interfere na identificação do íon manganês(II).
ConsideracoesComo sinalizamos no inicio deste artigo, materiais de apoio compõem a tríade das relações dialógicas na sala de aula (professor-texto-estudante). Neste sentido, entendemos que a discussão apresentada pode contribuir no processo de aprendizagem, mas não é o único.
Esperamos que uma discussão intermediada pelo professor aponte nesta sequência de reações a relação entre o nível microscópico e o macroscópico estabelecendo a completa separação e identificação de todos os hidróxidos e sulfetos metálicos presentes no grupo III.