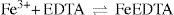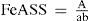This work proposes an alternative didactic experiment in order to determine the stability of the complexes that are involved in a spectrophotometric titration of Fe(III) ions with EDTA and 5-sulfosalicylic acid as indicator using a hybrid system in batchwise and in continuous flux, in which a conventional aquarium pump as a propulsion system is employed. The obtained results using this system are according to the literature. However, the use of the aquarium pump in this hybrid system has shown to be really efficient, useful and easy to be used by undergraduate students, and it can be used in any laboratory.
Este trabajo propone un experimento didáctico alternativo para determinar la estabilidad de los complejos involucrados en la titulación espectrofotométrica de iones Fe(III) con EDTA y con ácido sulfosalicílico como indicador, utilizando un sistema híbrido entre uno batch y otro de flujo continuo, en el que se emplea una bomba de acuario como sistema de propulsión. Los resultados obtenidos con este sistema están de acuerdo con los de la literatura y este sistema híbrido con la bomba de acuario ha mostrado su eficiencia, utilidad y facilidad para su uso por los estudiantes de licenciatura. Pueden ser empleados en cualquier laboratorio.
A titulação complexométrica baseia-se na reação de quelantes com íons metálicos formando um complexo estável, sendo normalmente empregada para determinação de metais, utilizando um indicador metalocrômico, para a detecção do ponto final, o qual é normalmente visualizado pela mudança de cor promovida pela interação do indicador com o metal em análise. Medidas espectrofotométricas ou fotométricas podem ser utilizadas na detecção do ponto final de titulações complexométricas, no entanto, é necessária variação de cor do indicador ou das espécies envolvidas no ponto final (Cortes et al., 2007). Com o auxílio da espectrofotometria, torna-se possível conduzir um estudo da estabilidade de complexos (expressa pelo valor da constante de equilíbrio da reação, denominada constante de formação ou de estabilidade) (Skoog et al., 2002).
O quelante EDTA é amplamente utilizado para determinações de vários metais em amostras ambientais e biológicas, e também para remoção dos mesmos em processos de tratamento de resíduos químicos. Esta vasta aplicabilidade torna o EDTA relevante quando reações complexométricas são abordadas de forma técnico-científica na química do cotidiano.
O ácido 5-sulfosalicílico (ASS) forma com os íons de Fe(III) um complexo intensamente colorido, com máximo de absorção em 500 nm (Ogawa e Tobe, 1966; Pozdnyakov et al., 2006). Este complexo é empregado como indicador metalocrômico na titulação espectrofotométrica de Fe(III) com solução padronizada de EDTA em pH 2, pois o complexo FeEDTA é cerca de 1010 vezes mais estável que o complexo FeASS.
Via de regra, experimentos didáticos de titulações espectrofotométricas envolvendo complexometria são realizados de forma tradicional, ou seja, sem envolver sistemas de automatização. Em geral, observa-se um restrito número de trabalhos abordando sistemas automatizados com enfoque didático (Reis, 1996; Nóbrega et al., 1996; Rocha et al., 2000; Coelho et al., 2006).
Normalmente a automatização de sistemas de análise faz uso de Análise por Injeção em Fluxo (FIA), na qual o custo de uma bomba peristáltica aliado ao longo processo de otimização destes sistemas tornam o seu emprego em experimentos didáticos nas disciplinas de Química Analítica pouco viável.
Como alternativa para reduzir o custo de análises por injeção de fluxo o emprego de outros sistemas propulsores para FIA são citados na literatura. Grudpan e colaboradores (1993) propuseram um sistema composto por uma bomba de aquário combinada com uma válvula injetora, o qual foi empregado em titulações ácido-base e em determinações de sódio, potássio e cálcio por fotometria de chama. Matos (2001) e Silva (2005) e seus colaboradores propuseram o emprego de mini-compressores de ar do tipo bomba de diafragma como sistema alternativo de propulsão para FIA em determinações amperométricas e potenciométricas respectivamente. A partir destes estudos, surge a idéia de aliar um sistema propulsor simples e de baixo custo a experimentos didáticos de titulação espectrofotométrica.
Propõe-se então a montagem de um sistema híbrido entre sistemas em batelada e em fluxo contínuo, no qual a bomba de aquário é utilizada para homogeneização e transporte do meio reacional até a cela espectrofotométrica, para ser empregado em estudos de estabilidade de complexos. O resultado é uma prática alternativa para a disciplina de Química Instrumental do Curso de Licenciatura em Química, abordando a determinação de Fe(III) por meio de titulação espectrofotométrica com EDTA na presença do indicador metalocrômico ASS, obtendo-se o valor experimental da constante de dissociação do complexo FeASS.
Parte experimentalConstrução do sistema de fluxoO sistema foi montado da seguinte forma: um espectrofotômetro (Varian Cary 50 UV-VIS) serviu como detector; cubeta com 1 cm de diâmetro (tubo de ensaio de 5 mL que acompanha o equipamento) e uma tampa de silicone com dois capilares de polietileno funcionou como cela de fluxo; uma bureta (25 mL) foi utilizada para adição do titulante e uma bomba de aquário convencional (Sarlo 140; Vazão: 80/160 L/h e Pressão: 0,5 mca), como sistema de propulsão dos fluidos, dispensando o emprego de bomba peristáltica.
Preparo e padronização de soluçõesUma solução de Fe(III) 5,00 × 10–3 mol L–1 foi preparada a partir de nitrato férrico nono-hidratado (Merck) em solução de ácido nítrico 1,00 × 10–2 mol L–1, a solução de ácido 5-sulfosalicílico di-hidratado (Merck) 5,00 × 10–3 mol L–1 foi utilizada como indicador e a solução de EDTA 1,00 × 10–2 mol L–1 foi utilizada como solução titulante após ter sido padronizada com óxido de zinco (II) (Leite, 2000).
Medidas espectrofotométricasOs espectros de absorção molecular dos agentes complexantes (EDTA e ASS) e dos complexos (FeASS e FeEDTA) foram obtidos no intervalo de 400 a 600 nm. O comprimento de onda referente ao valor máximo de absorbância, no qual a titulação espectrofotométrica da solução de Fe(III) e FeASS com EDTA deve ser efetuada, foi identificado.
Obtenção da curva analíticaPara obtenção da curva analítica do complexo FeASS, foram preparadas soluções padrão no intervalo de concentração de 0,30 × 10–4 a 3,30 × 10–4 mol L–1, para verificação da lei de Lambert-Beer e determinação do valor experimental da absortividade molar.
Determinação da estequiometria do complexo FeEDTAA determinação da estequiometria do complexo FeEDTA formado foi conduzida utilizando o método da razão molar introduzido por Yoe e Jones (1944) e posteriormente proposto como método espectrofotométrico para determinação de complexos em solução (Meyer e Ayres, 1957).
Titulação espectrofotométricaUtilizando o sistema híbrido de análise desenvolvido, 22 mL da solução de Fe(III) com ASS na proporção de 10:1 (v/v) foi titulada com solução de EDTA (1,00 × 10–2 mol L–1) em pH 2,00 (não foi utilizada solução tampão). As concentrações das soluções reagentes foram calculadas de tal forma que o volume final do meio reacional respeitasse o maior volume do aparato plástico acima da bomba (cerca de 30 mL). Alíquotas de 0,50 mL de EDTA foram adicionadas ao sistema reacional, sendo que após cada adição de EDTA os valores de absorbância foram registrados em intervalos de 30 segundos (t-teste, n = 15) até que as medidas fossem estatisticamente iguais.
Resultados e discussãoO sistema híbrido de análise desenvolvido, utilizando uma bomba de aquário como sistema propulsor, é mostrado na figura 1. O aparato de plástico que acompanha a bomba foi utilizado como recipiente para o meio reacional, simplificando a proposta. Desta forma, o próprio sistema de funcionamento cíclico da bomba é responsável pela homogeneização da solução a cada adição de alíquota do titulante.
Por se tratar de um experimento didático de titulação espectrofotométrica, é fundamental que o estudante saiba verificar se a proposta experimental é exeqüível e em que condições experimentais deve-se trabalhar. Portanto, inicialmente foi feito um estudo para determinar o comprimento de onda no máximo de absorção do complexo FeASS. O espectro de absorção molecular foi obtido no intervalo de 400 a 600 nm e um máximo de absorção observado em 500 nm (figura 2), sendo este comprimento de onda escolhido para as medidas espectrofotométricas subseqüentes. Como o sistema reacional é composto por várias espécies, entre reagentes e complexos (ASS, EDTA, e FeEDTA), observaram-se também as características espectrais de cada espécie isoladamente no intervalo de 400 a 600 nm (figura 2).
Como o complexo monitorado espectrofotometricamente é o FeASS, obteve-se primeiramente uma curva analítica (figura 3), na qual a lei de Lambert-Beer é obedecida no intervalo de concentração de 0,30 × 10–4 a 3,30 × 10–4 mol L–1 (y = 0,175x – 0,006; R = 0,999). Paralelamente, por meio da lei de Lambert-Beer, determinou-se o valor da absortividade molar do complexo FeASS (ε = 1752 L cm–1 mol–1), o qual é próximo dos valores encontrados na literatura (Ogawa e Tobe, 1966; Pozdnyakov et al., 2006).
A titulação espectrofotométrica do Fe(III) com EDTA foi conduzida em 500 nm, com intervalo de tempo de 30 segundos (tempo reacional necessário), definido em testes preliminares, entre as adições de alíquotas da solução de EDTA. Durante a titulação não houve variação significativa do pH. A cubeta (tubo de ensaio de vidro) não deve ser removida do sistema montado durante a titulação espectrofotométrica, pois foram observadas variações significantes nas medidas de absorbância quando foi removida entre as seqüências de adições de solução de EDTA. Portanto, supõe-se que a irregularidade das paredes da cubeta de vidro empregada interfira nas medidas de absorbância do complexo FeASS.
Determinou-se, por meio da curva de titulação espectrofotométrica do Fe(III) com EDTA (figura 4), a concentração de íons Fe(III) na solução (5,10 × 10–3 mol L–1) com erro relativo de 2,8%, mostrando assim a eficiência do sistema proposto. É importante ressaltar que os valores das medidas de absorbância foram corrigidos em relação às distorções provocadas pela diluição da solução ao longo da titulação espectrofotométrica.
A razão molar de um íon Fe(III) para uma molécula de EDTA, foi obtida por meio do método da razão molar introduzido por Yoe e Jones (figura 5). Este método consiste em medir a absorbância de uma série de soluções contendo uma quantidade variável de um dos componentes e uma quantidade constante do outro (Ewing, 1972). Ao invés de tomar alíquotas da solução titulada após cada adição de titulante para medir a absorbância, foi empregado o sistema híbrido proposto, o qual agilizou a análise e evitou erros de manipulação. A razão molar do complexo FeEDTA obtida está de acordo com os dados da literatura (Harris, 2008).
Por meio dos dados obtidos, calculou-se a constante de dissociação do complexo FeASS, considerando a parte da curva de titulação (figura 4), na qual a reação predominante é representada pela reação 1.
A reação 1 é a soma das reações químicas de formação do complexo FeEDTA (reação 2) com a de dissociação do complexo FeASS (reação 3). As constantes de equilíbrio para as reações químicas (reações 1 e 2) são dadas pelas equações 1 e 2, respectivamente. A constante de equilíbrio para a reação 1 (equação 3) é obtida por meio do produto das equações 1 e 2.
Para o calculo da constante de dissociação do complexo FeASS, foram feitas algumas considerações:
- 1)
A condição de equilíbrio pode ser identificada na figura 4, quando 10,20 mL da solução de EDTA foram gastos na titulação espectrofotométria. Neste ponto o valor da absorbância do complexo FeASS foi de 0,45. A concentração do complexo FeASS pode ser calculada pela equação da lei de Lambert-Beer (equação 4), onde b = 1,00 cm e ε = 1752 L cm–1 mol–1. Desta forma determinou-se a concentração do complexo FeASS (2,57 × 10–4 mol L–1).
- 2)
A concentração do ASS (5,37 × 10–5 mol L–1) no equilíbrio foi calculada por meio da Equação 5.
onde mol ASSe, mol ASSi e mol FeASS representam, respectivamente, o número de mol no equilíbrio, adicionado inicialmente e do complexo, também no equilíbrio.
- 3)
Admitindo que todo o EDTA adicionado está complexado, calculou-se a concentração do complexo FeEDTA (3,17 × 10–3 mol L–1). Utilizando a equação 1 e a constante de formação condicional do FeEDTA em pH 2,00 (Kf = 3,25 × 1011) (Harris, 2001), calculou-se a concentração de EDTA (9,90 × 10–8 mol L–1) livre no ponto de equivalência.
Mediante estas considerações calculou-se o valor do produto entre as constantes de dissociação Kd do complexo FeASS e de formação Kf do complexo FeEDTA (equação 3). Conhecido o valor deste produto (6,70 × 103) e da constante de formação do complexo FeEDTA, obteve-se o valor experimental de 1,60 × 10–8 (temperatura ambiente) para a constante de dissociação do complexo FeASS. Sabendo-se que Kf = 1/Kd, chega-se ao valor de 6,15 × 107 para a constante de formação do complexo FeASS. Valor este semelhante ao encontrado por McBryde et al. (1970).
ConclusãoO uso de uma bomba de aquário convencional para análise utilizando o sistema híbrido proposto em um laboratório de ensino mostrou-se muito eficiente e prático, uma vez que possibilitou a determinação da constante de formação do complexo FeASS, com resultados equivalentes aos encontrados na literatura. Com este sistema foi possível explorar, em ambiente prático de ensino-aprendizagem, os princípios da titulação espectrofotométrica, assim como os conceitos referentes à formação de complexos e deslocamento de equilíbrio.
AgradecimentoOs autores agradecem o apoio financeiro da Universidade Católica de Brasília (UCB).