El cateterismo de senos petrosos inferiores (CSPI) está indicado en el diagnóstico de síndrome de Cushing (SC) hormona adrenocorticotropa (ACTH) dependiente, especialmente cuando los resultados del resto de las pruebas diagnósticas son discordantes.
ObjetivoDescribir los pacientes a quienes se les realizó esta prueba invasiva funcional en un hospital de tercer nivel.
MétodosEstudio observacional sobre una cohorte retrospectiva de pacientes con SC ACTH-dependiente y CSPI entre los años 2004 y 2019. Se determinaron sus características epidemiológicas, hormonales, radiológicas y funcionales, evaluándose su capacidad diagnóstica y puntos de corte óptimos para diferenciar entre enfermedad de Cushing (EC) y síndrome de Cushing ectópico (SCE).
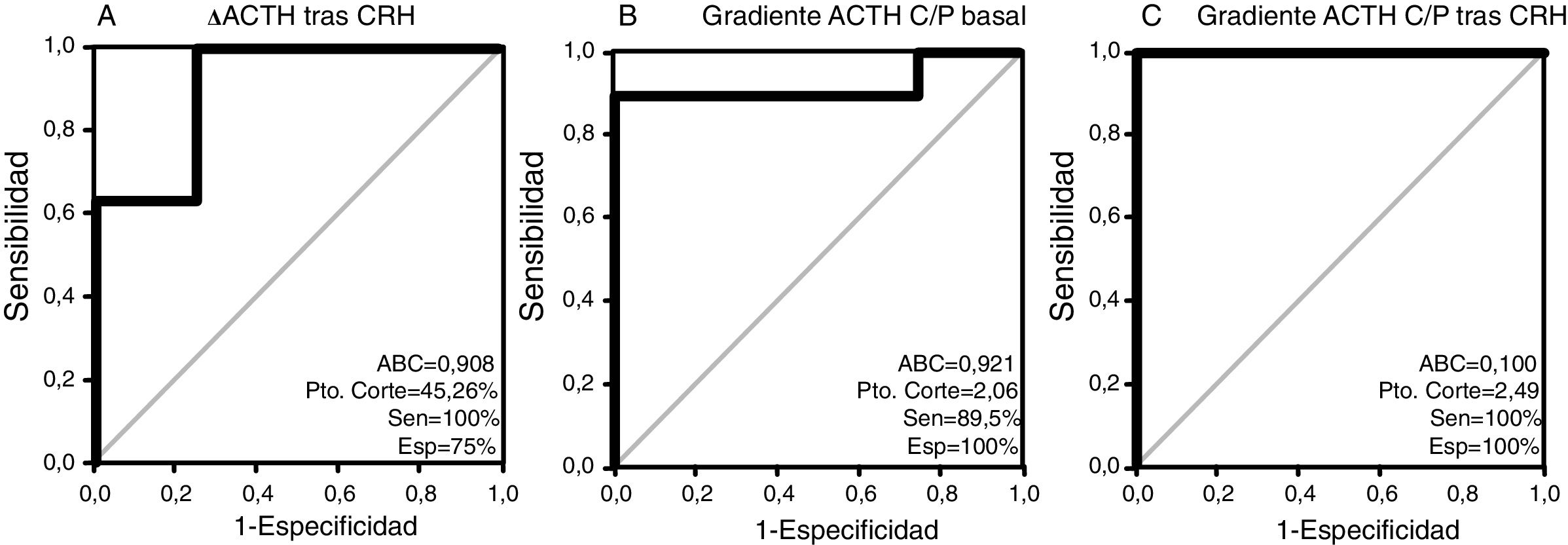
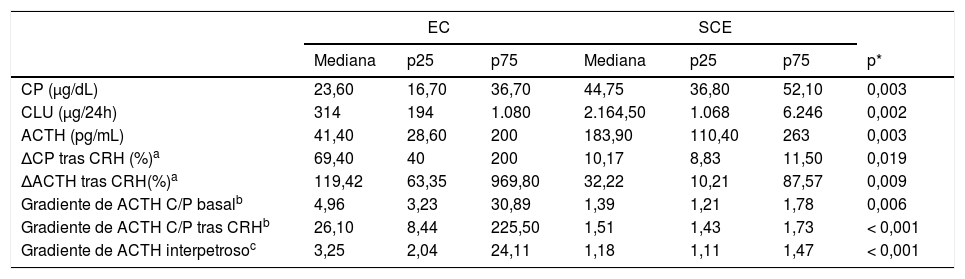
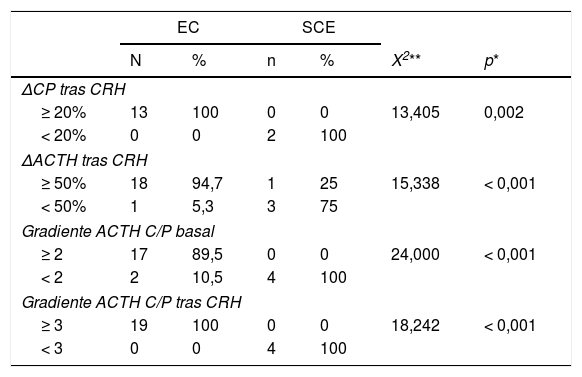
ResultadosFueron evaluados 23 pacientes de los cuales 65,2% fueron mujeres y la edad promedio fue 42 (36-62) años. Se evidenció una secreción de ACTH de origen hipofisario en el 82,6% de los pacientes y de origen ectópico en el 17,4%. Los niveles de cortisol plasmático, cortisol libre urinario y ACTH fueron más elevados en pacientes con SCE. Respecto al CSPI, el gradiente ACTH central/periférico (C/P) basal detectó el 89,5% de pacientes con EC y tras estimulación con de la hormona liberadora de corticotropina (CRH) el 100%, siendo los puntos de corte óptimos para el diagnóstico de EC 2,06 basal y 2,49 tras estimulación con CRH.
ConclusionesEl CSPI con estimulación de CRH es una prueba con alta precisión diagnóstica para clasificar de manera correcta a los pacientes con EC y SCE. Los puntos de corte de los gradientes pueden ser distintos a los valores clásicos, por lo que recomendamos que cada centro los evalúe.
Inferior petrosal sinus sampling (IPSS) is indicated in the diagnosis of adrenocorticotropic hormone (ACTH)-dependent Cushing's syndrome (CS), especially when the results of the initial diagnostic tests are discordant.
ObjectiveTo describe the patients who underwent this invasive functional test in a tertiary hospital.
MethodsThis was an observational study of a retrospective cohort of patients with ACTH-dependent CS and IPSS between 2004 and 2019. We determined their epidemiological, hormonal, radiological and functional characteristics, and evaluated their diagnostic capacity and optimal cut-off points to differentiate between Cushing's disease (CD) and ectopic Cushing's syndrome (ECS).
Results23 patients were evaluated, of which 65.2% were women with the average age of 42 (36-62) years. ACTH secretion of pituitary origin was evident in 82.6% of the patients and of ectopic origin in 17.4%. Plasma cortisol, urinary free cortisol, and ACTH levels were higher in patients with ECS. Regarding IPSS, the baseline central/peripheral ACTH gradient detected 89.5% of patients with CD and after stimulation with CRH, 100%. The optimal cut-off points in the diagnosis of CD were 2.06 at baseline and 2.49 after CRH stimulation.
ConclusiónIPSS with CRH stimulation is a test with a high diagnostic accuracy for correctly classifying patients with CD and ECS. The cut-off points of the gradients may be different from the classic ones. Therefore, we recommend that each center perform its own evaluation.
El síndrome de Cushing (SC) comprende el conjunto de signos y síntomas debidos a la exposición crónica a concentraciones altas de glucocorticoides. Se trata de un trastorno potencialmente letal por las comorbilidades que ocasiona: hipertensión arterial, diabetes mellitus, coagulopatía, enfermedades cardiovasculares, infecciones y fracturas, entre otras. De este modo, un retraso en el diagnóstico puede incrementar sustancialmente la tasa de mortalidad1.
El SC puede desarrollarse de forma dependiente o independiente de la hormona adrenocorticotrópica (ACTH). Las formas ACTH-dependientes suponen alrededor del 80-85% de los casos y se caracterizan por una producción excesiva de ACTH, generalmente procedente de un adenoma hipofisario (enfermedad de Cushing [EC]) o más raramente de un tumor extrahipofisario (síndrome de Cushing ectópico [SCE])2. Diferenciar entre ambas causas puede ser complejo, especialmente cuando los resultados analíticos o pruebas funcionales son discordantes o no se evidencian lesiones en la resonancia magnética hipofisaria (RMh)3,4. En estas situaciones es necesario realizar un test funcional invasivo. Desde 1970, se ha usado el cateterismo de senos petrosos inferiores (CSPI) y actualmente es considerado el gold standard para determinar si la secreción de ACTH es central o ectópica, así como su lateralización en caso de EC5,6. Con la finalidad de incrementar la sensibilidad diagnóstica del procedimiento, se suele realizar con estimulación con hormona liberadora de corticotropina (CRH)7.
El objetivo primario de este estudio es evaluar la precisión diagnóstica que nos proporcionan el test de estímulo con CRH y el CSPI, y construir curvas de característica operativa del receptor (COR) para comparar si los puntos de corte establecidos en estudios previos respecto al gradiente ACTH central/periférico (C/P) se asemejan a los encontrados en la experiencia de nuestro centro. Como objetivos secundarios, analizamos los diferentes parámetros epidemiológicos, hormonales y funcionales encontrados en los pacientes de nuestro centro con SC ACTH-dependiente y CSPI realizado, profundizando además en las diferencias clínicas entre pacientes con EC y con SCE.
Material y métodosDiseño del estudio y selección de la muestraSe realizó un estudio observacional sobre una cohorte retrospectiva de pacientes diagnosticados de SC ACTH-dependiente entre los años 2004 y 2019, en el Servicio de Endocrinología y Nutrición del Hospital General Universitario Gregorio Marañón, a los que se les realizó un cateterismo de senos petrosos inferiores.
Abordaje diagnóstico del síndrome de CushingEl diagnóstico inicial de SC fue realizado mediante la determinación, en al menos dos ocasiones, de cortisol libre en orina (CLU) de 24 horas, test de supresión con 1 mg de dexametasona nocturno y/o cortisol salival a las 23 horas2. Se descartaron aquellos pacientes con estados de pseudoCushing.
Respecto al diagnóstico etiológico de SC, se realizó determinación de ACTH y se consideraron orientativos de SC ACTH-dependiente (hipofisario o ectópico) aquellos casos con valores > 15 pg/mL. En cuanto al test de estimulación con CRH, se consideró orientativo de EC ante un aumento de ACTH > 50% o de cortisol plasmático > 20% sobre el valor basal8. También se efectuó una RMh en todos los pacientes.
Se realizó un CSPI a todos los pacientes fundamentalmente por pruebas de imagen o funcionales dudosas. Se excluyó del análisis estadístico aquellos que no tuviesen los estudios anteriormente mencionados o bien resultasen casos de SC ACTH-independiente.
El procedimiento se llevó a cabo en el Servicio de Radiología en presencia de un equipo experimentado formado por dos neurorradiólogos intervencionistas, un anestesista, un endocrinólogo y un profesional de enfermería. Se utilizó la misma técnica de CSPI en todos los pacientes. La prueba consistía en canalizar ambas venas antecubitales (una de ellas para extracción de sangre y la otra para inyección del estímulo) así como cateterizar las dos venas femorales hasta alcanzar los senos petrosos inferiores. La localización de los dos catéteres se comprobaba radiológicamente. A continuación, se extraían muestras de sangre de una vena periférica y de cada uno de los senos petrosos inferiores simultáneamente al inicio del estudio y después de una inyección intravenosa en bolo de 100 μg de CRH. Las muestras posteriores a la estimulación se obtuvieron a los 3, 5, 10 y 15 minutos. Se completó el procedimiento obteniendo muestras de sangre periférica de cortisol y ACTH en tiempos 30, 60, 90 y 120 minutos tras estímulo de CRH. El valor de cortisol y de ACTH tras estímulo tomado en consideración fue el máximo obtenido. Todas las muestras para la determinación de ACTH fueron recolectadas en tubos que contenían ácido etilendiamina tetraacético (EDTA) e inmediatamente refrigeradas y transportadas a nuestro laboratorio. Después del procedimiento, los pacientes mantuvieron reposo en cama y observación durante seis horas. Se recogieron todas las complicaciones sucedidas peri-procedimiento en caso de haberlas.
Se estableció como valor de referencia indicativo de EC un gradiente de ACTH o C/P ≥ 2 en muestras basales o ≥ 3 en muestras obtenidas tras estimulación con CRH8,9. Además, se tuvo en cuenta un gradiente interpetroso ≥ 1,4 como sugestivo de una localización del adenoma en el lado del seno petroso con mayor concentración de ACTH9,10. Para determinar el diagnóstico etiológico final del SC, se tuvieron en cuenta los resultados del test de estímulo con CRH, el CSPI, la RMh, la histología e inmunohistoquímica, así como los criterios bioquímicos de curación después de la cirugía. Se consideraron criterios de curación un cortisol plasmático matutino < 5 mg/dL o una excreción normal de CLU de 24 horas.
Análisis estadísticoSe estudió la distribución de las variables cuantitativas con la prueba Shapiro-Wilk, mostrando una distribución no normal y por ende siendo expresadas como medianas y rangos intercuartílicos (p25-p75). Se utilizó la prueba de U de Mann-Whitney para comparar dos medianas de muestras independientes. Las variables cualitativas fueron expresadas en frecuencias absolutas y relativas (porcentajes). La prueba de X2 fue utilizada para estudiar asociaciones entre variables cualitativas, y en caso de que fuera necesario, se aplicó la corrección de Fisher.
Las curvas COR se realizaron para determinar el área bajo la curva (ABC) de: (a) incremento de ACTH (ΔACTH) tras estímulo con CRH, (b) Gradiente ACTH C/P basal, (c) Gradiente ACTH C/P tras estimulación con CRH para el diagnóstico de EC, evaluándose la sensibilidad y especificidad de los puntos de corte. Para la selección del mejor punto de corte se empleó la distancia al punto más cercano a 0,1.
Se consideró estadísticamente significativo un valor de p < 0,05. Para el análisis descriptivo e inferencial se utilizó el paquete estadístico SPSS versión 22.
ResultadosCaracterísticas clínicas de los pacientesSe evaluaron 23 pacientes con diagnóstico confirmado de SC ACTH-dependiente a quienes se les realizó CSPI.
La mediana de edad al diagnóstico de EC fue de 44,0 (37,0-62,0) años, y en SCE de 35,5 (30,0-51,0) años, sin diferencias estadísticamente significativas. La mayoría de los pacientes correspondieron al sexo femenino con 65,2% (n = 15), siendo en los casos de EC el 73,7% (n = 14) mujeres, mientras que en el SCE la mayoría fueron hombres con 75,0% (n = 3), sin diferencias estadísticamente significativas.
De los 23 casos incluidos, se asignó por los resultados del CSPI una secreción hipofisaria de ACTH en 19 pacientes (82,6%) y una secreción ectópica en 4 (17,4%). El diagnóstico de EC pudo confirmarse por inmunohistoquímica positiva para ACTH en 14 de 19 pacientes. En los cinco pacientes restantes, el diagnóstico de EC se asumió por criterios bioquímicos de curación tras cirugía/radioterapia hipofisaria y/o por pruebas diagnósticas concordantes (respuesta al test de CRH, identificación del tumor en la RMh y gradiente ACTH C/P)8. En cuanto a los casos de SCE, todos ellos fueron diagnosticados de tumor carcinoide pulmonar, los cuales fueron localizados por pruebas de imagen (tomografía computarizada corporal, gammagrafía de receptores de la somatostatina y/o tomografía por emisión de positrones-tomografía computarizada) y remitidos para biopsia o escisión, corroborándose en todos ellos el diagnóstico final histológicamente.
Referente a las complicaciones observadas durante y después del CSPI, únicamente se reportaron eventos adversos en dos casos: otalgia en el primero y tromboembolismo pulmonar de bajo riesgo en el segundo.
Entre las pruebas bioquímicas, los niveles de cortisol plasmático, cortisol libre urinario y ACTH fueron más elevados en pacientes con SCE en comparación con aquellos con EC. El test de estimulación con CRH mostró un promedio de aumento de cortisol y ACTH mayor en los pacientes con EC (p < 0,01) que permitió identificar a 18 de los 19 pacientes con Cushing hipofisario (tabla 1).
Pruebas bioquímicas y funcionales en pacientes con Síndrome de Cushing ACTH-dependiente y CSPI realizado. Hospital General Universitario Gregorio Marañón 2004-2019
| EC | SCE | ||||||
|---|---|---|---|---|---|---|---|
| Mediana | p25 | p75 | Mediana | p25 | p75 | p* | |
| CP (μg/dL) | 23,60 | 16,70 | 36,70 | 44,75 | 36,80 | 52,10 | 0,003 |
| CLU (μg/24h) | 314 | 194 | 1.080 | 2.164,50 | 1.068 | 6.246 | 0,002 |
| ACTH (pg/mL) | 41,40 | 28,60 | 200 | 183,90 | 110,40 | 263 | 0,003 |
| ΔCP tras CRH (%)a | 69,40 | 40 | 200 | 10,17 | 8,83 | 11,50 | 0,019 |
| ΔACTH tras CRH(%)a | 119,42 | 63,35 | 969,80 | 32,22 | 10,21 | 87,57 | 0,009 |
| Gradiente de ACTH C/P basalb | 4,96 | 3,23 | 30,89 | 1,39 | 1,21 | 1,78 | 0,006 |
| Gradiente de ACTH C/P tras CRHb | 26,10 | 8,44 | 225,50 | 1,51 | 1,43 | 1,73 | < 0,001 |
| Gradiente de ACTH interpetrosoc | 3,25 | 2,04 | 24,11 | 1,18 | 1,11 | 1,47 | < 0,001 |
CSPI: cateterismo de senos petrosos inferiores; CP: cortisol plasmático; CLU: cortisol libre urinario en orina de 24 horas; ACTH: hormona adrenocorticotrópica; C/P: central/periférico.
Valores normales: CP (5,0-25,0 μg/dL), ACTH (5,0-60,0 pg/mL), CLU (20,0-120,0 μg/24 h).
En la tabla 2 se muestra la asociación entre el diagnóstico final del SC ACTH-dependiente (hipofisario o ectópico) y los criterios de variación de CP y ACTH tras estimulación con CRH, así como los criterios de gradientes ACTH C/P (p < 0,01). La determinación del gradiente ACTH C/P tras estimulación con CRH incrementó la sensibilidad del CSPI, aumentando el número de pacientes con EC detectados de 17 a 19, sin cambios en la especificidad.
Sensibilidad y especificidad de la prueba de CRH y del CSPI en pacientes con Síndrome de Cushing ACTH-dependiente. Hospital General Universitario Gregorio Marañón 2004-2019
En cuanto a la localización del adenoma en pacientes con EC, un total de nueve sobre 19 pacientes (47%) presentaron una RMh positiva, con un tamaño promedio de 4,50 (2,50-8,00) mm, objetivándose una localización derecha en cinco casos e izquierda en cuatro. El CSPI predijo adecuadamente la localización en siete pacientes (77%), en un paciente no lateralizó y en el caso restante la lateralización localizó el adenoma en el lado opuesto al observado en la RMh. Respecto al análisis de los pacientes con RMh negativa, el CSPI lateralizó en todos los casos, pudiéndose confirmar posoperatoriamente una lateralización adecuada en siete de los 10 pacientes (el resto no eran operables o no han sido intervenidos hasta la fecha de esta publicación). En aquellos pacientes con SCE, la RMh reveló una lesión hipofisaria no funcional en un paciente y el CSPI no lateralizó en ningún caso (gradiente interpetroso basal y tras estimulación < 1,4).
Los resultados del análisis COR para todos los pacientes se muestran en la figura 1. El área bajo la curva (ABC) fue 0,908 (IC 95%, 0,736-1,068) para el test de CRH y de 0,921 (0,804-1,038) y 1.000 (1.000-1.000) para el gradiente de ACTH C/P antes y después de la estimulación, respectivamente. El valor de corte óptimo para la prueba de CRH (incremento de ACTH tras estimulación en forma de porcentaje) fue de 45,26%, con una sensibilidad del 100% y especificidad de 75%. En cuanto al gradiente ACTH C/P en el CSPI, el valor de corte óptimo determinado en nuestro estudio fue de 2,06 de forma basal (con una sensibilidad de 89,5% y especificidad de 100%) y de 2,49 tras estímulo con CRH (con una sensibilidad y especificidad ambas del 100%).
DiscusiónEstablecer el diagnóstico del SC resulta sencillo cuando el cuadro clínico es florido y las pruebas funcionales y de imagen son concordantes, permitiendo una correcta localización de la enfermedad. No obstante, algunas presentaciones del SC ACTH-dependiente pueden representar un reto diagnóstico. Esto es particularmente notorio en los casos en que las pruebas de imagen no obtienen hallazgos significativos, y donde las pruebas funcionales aportan resultados inconsistentes11. La diferenciación entre SC de origen hipofisario y ectópico es una cuestión fundamental en el tratamiento del SC ACTH-dependiente, puesto que requerirán abordajes terapéuticos diferentes. La extirpación quirúrgica del tumor mediante cirugía transesfenoidal es la primera opción terapéutica en la mayoría de los pacientes con enfermedad de Cushing, por eso es mandatario una correcta localización de la lesión con el objetivo de planificar correctamente la cirugía.
En nuestro estudio, 19 casos correspondieron a EC, mientras que cuatro se identificaron como SCE. Esto concuerda con las tendencias generales descritas en publicaciones previas, donde la prevalencia de EC es significativamente mayor, oscilando entre 60-80% de los SC ACTH-dependientes12,13. Asimismo, la edad promedio de presentación y la distribución entre sexos de nuestro estudio no diferían de la recogida en la literatura14–17.
El análisis de los parámetros bioquímicos entre los distintos grupos también reveló algunas características diferenciales. Los valores de cortisol plasmático, cortisol libre urinario en 24 horas y de ACTH fueron marcadamente superiores en pacientes con SCE como ya se ha observado en estudios previos3,18,19. Destaca una serie de nueve casos publicada por Araujo Castro et al.19 en Madrid en la que se encontró una media de cortisol libre urinario de 2.840 μg/dL en pacientes con SCE, lo cual se aproxima al valor obtenido en nuestra muestra. Sin embargo, las diferencias bioquímicas entre ambos grupos a menudo no resultan significativas, probablemente debido al escaso número de pacientes con secreción ectópica de ACTH en todas las series.
Por tanto, resulta de gran ayuda la realización de pruebas funcionales que permitan una mayor sensibilidad y especificidad diagnósticas. El test de estimulación con CRH en sangre periférica es una técnica que permite identificar casos de SC hipofisario ante porcentajes de incremento en los niveles séricos de ACTH por encima de un valor determinado, clásicamente se ha establecido como punto de corte un incremento igual o superior al 50%. En nuestra investigación se identificó un punto de corte óptimo de 45,26%, muy próximo al tradicional, con una sensibilidad de 94,7% y especificidad de 75%. Ritzel et al.20 han descrito resultados similares en una muestra de 96 pacientes con SC. De la misma forma, en un estudio multicéntrico italiano de Giraldi et al.21 realizado con 160 pacientes con SC, la respuesta al test CRH fue menor en los sujetos con lesiones adrenales, y no se observaron incrementos significativos de cortisol o ACTH en esta prueba en los pacientes con secreción ectópica de ACTH.
Las pruebas de imagen facilitan la localización de tumores, no obstante, los resultados pueden ser insuficientes por dos motivos principales: hasta el 20-30% de los adenomas secretores pueden no visualizarse en la RMh (falso negativo) o resultar los hallazgos inconcluyentes22–26, y hasta en el 10% pueden mostrar una lesión no funcional o incidentaloma (falso positivo) que no es responsable del exceso de secreción de ACTH23–27. Yogi-Morren et al.4 demuestran en su serie de pacientes con SC ACTH-dependiente un 23% de incidentalomas hipofisarios en pacientes con SC de origen ectópico y tan sólo lesión hipofisaria en un 68,3% de los diagnosticados de SC de origen hipofisario. Otras series publicadas muestran resultados similares, revelando hasta un 20% de incidentalomas hipofisarios en SCE28 y detectando la RMh entorno a un 50% de los adenomas corticotropos5,29–31. En nuestra serie, un caso de SCE presentó un incidentaloma hipofisario, lo que supone un 25% del total, y sólo el 47% de los pacientes con EC tenían una RMh que identificase la lesión.
La introducción de procedimientos diagnósticos como el CSPI constituyen una herramienta valiosa en este escenario9. El CSPI ofrece una elevada sensibilidad y especificidad para la distinción entre SC de origen central y de origen ectópico, y puede ser útil en la localización tumoral de lesiones hipofisarias; con un buen perfil de seguridad y tolerancia para el paciente23.
Tradicionalmente se han establecido como puntos de corte 2 (basal) y 3 (tras estimulación) para documentar una fuente hipofisaria de ACTH mediante el CSPI. En el estudio de Oldfield et al. no se indicó la razón por la que se eligieron dichos valores de corte, pero se puede inferir que eran aquellos que permitían maximizar la sensibilidad al mismo tiempo que se mantenía una especificidad del 100%32. Tales puntos de corte arrojaron una precisión excelente en este estudio. No obstante, el valor de corte óptimo puede variar entre los distintos centros y estudios33–35, y es preciso llevar a cabo estudios multicéntricos que permitan clarificar la heterogeneidad de resultados36.
Nuestro análisis con curvas COR estableció un punto de corte óptimo de gradiente ACTH C/P de 2,06 basal muy similar al tradicional32 con una sensibilidad de 89,5% y especificidad de 100%, pero el valor tras estimulación de CRH tuvo un punto de corte más bajo de 2,49 con una sensibilidad y especificidad del 100%. Resultados similares ya se habían observado en estudios previos en los que para aumentar la sensibilidad del procedimiento se requirió un punto de corte más bajo que el tradicional34–37. Por ejemplo, en el estudio retrospectivo de Machado et al.33 que incluyó 56 pacientes con SC dependiente de ACTH, el punto de corte para el gradiente ACTH C/P basal fue de 1,45, con una sensibilidad de 88,2%, y especificidad de 100%. De manera similar, en el estudio de Ilias et al.34 con 13 casos de SCE disminuyen el punto de corte para el gradiente basal a 1,6, pudiendo así incrementar la sensibilidad del 89 al 91%. Por último, resulta remarcable el estudio retrospectivo llevado a cabo por Chen et al.36 en el que su análisis de curvas COR establece como valores de corte óptimos 1,4 para el gradiente ACTH C/P basal y 2,8 tras estimulación. En este mismo estudio, llevan a cabo un metaanálisis que incluye 25 estudios con un total de 1.249 pacientes con EC y 152 con SCE a los que se practicó CSPI y se determinó el diagnóstico etiológico con los puntos de corte tradicionales, obteniendo como resultados una sensibilidad del 86 y 97% y especificidad del 98 y 100% antes y después de la estimulación, respectivamente.
A pesar de tratarse de una excelente prueba diagnóstica, el CSPI no se encuentra exento de limitaciones. Según las series consultadas el porcentaje de falsos positivos y falsos negativos puede variar. Doppman et al.38 describe una tasa de falsos negativos de 0,8% en su muestra de 501 pacientes que resultaron proceder de la existencia de un seno petroso hipoplásico o anómalo. Así, los falsos negativos pueden deberse a una mala colocación de los catéteres o de un drenaje venoso asimétrico o anómalo. En este punto, la medición de prolactina puede ayudar a demostar un correcta colocación de los mismos39. Por otro lado, la existencia de fasos positivos podrían resultar de una supresión incompleta del eje hipofisario en casos de SC suprarrenal o ectópico, o en pacientes con SC cíclico o leve40.
Con relación a la localización del adenoma hipofisario en los casos de EC, nuestra serie mostró una sensibilidad en la predicción de lateralidad del 70% con el CSPI. Nuestros resultados parecen estar en consonancia con estudios previos8,32. Según las últimas guías, el papel del CSPI para la localización del microadenoma en el lado derecho o izquierdo de la glándula hipofisaria es controvertido8. En el estudio de Oldfield et al32, un gradiente ACTH C/P basal ≥ 1,4 permitió la predicción de la ubicación del microadenoma con una precisión de aproximadamente el 70%. No obstante, cabe destacar un estudio más reciente de Andereggen et al.41 en el que la precisión del CSPI fue mucho mayor, prediciendo correctamente la localización del adenoma en el 96% de los pacientes con EC. Por el contrario, en el estudio de Tabarin et al.42 se obtuvo una localización errónea en un 41% de su muestra, haciendo eco de varios trabajos previos en los que ya se describe una ubicación fallida43–47. Se precisan mayores estudios multicéntricos que arrojen claridad en este aspecto.
Este estudio presenta algunas limitaciones importantes, aunque no difieren de las encontradas en la mayoría de los estudios previos7,36,37. Dado que el SC es una patología infrecuente, y especialmente los casos de SCE, nuestra muestra de pacientes es relativamente reducida, hecho que dificulta la extrapolación o generalización de los resultados. Asimismo, el estudio de muestras de mayor tamaño podría ofrecer curvas COR con pendientes más fluidas y un mejor reflejo del poder diagnóstico de estos procedimientos y métodos en la práctica. Finalmente, encontramos la dificultad de confirmar postoperatoriamente la EC en algunos pacientes dado que continuaban el seguimiento en sus hospitales de procedencia para la cirugía y estos datos no podían completarse, o bien no llegaron a ser intervenidos quirúrgicamente.
Finalmente, encontramos cierta dificultad en la recogida de datos en aquellos pacientes más antiguos o procedentes de otros hospitales en los que los informes médicos eran incompletos y no disponíamos de la descripción íntegra de la anatomía patológica. Por el mismo motivo de antigüedad de la muestra, no se ha incluido la determinación de prolactina en este estudio.
ConclusionesEl CSPI es una técnica con alta sensibilidad y especificidad en el procedimiento diagnóstico del SC ACTH-dependiente, resultando de gran utilidad especialmente en aquellos casos dudosos, sin suponer además elevados riesgos. El valor de corte óptimo del gradiente ACTH C/P para el diagnóstico de EC puede variar entre los distintos estudios y ser diferente al tradicionalmente establecido, por lo que recomendamos que cada centro experimentado evalúe sus propios puntos de corte.
El test de estimulación con CRH y el CSPI son técnicas de gran utilidad en el procedimiento diagnóstico del SC ACTH-dependiente para poder clasificar de manera correcta a los pacientes con EC y SCE. Nuestro estudio encontró un punto de corte óptimo para el incremento de ACTH tras estimulación de 45,26%, que se aproxima al valor tradicional. El valor de corte óptimo para el CSPI fue de 2,06 antes de la estimulación, pero de 2,49 tras la estimulación, lo que difiere del punto utilizado con los criterios clásicos. En este caso se demuestra que un gradiente ACTH C/P tras estímulo menor de 3 no excluye el origen central del SC ACTH-dependiente, sin embargo, no se encuentran diferencias en el gradiente sin estímulo. Recomendamos por ello que cada centro experimentado evalúe sus propios puntos de corte.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.