La resistencia a hormonas tiroideas (RHT) fue descrita por primera vez en 1967 por Refetoff et al., como un síndrome genético caracterizado por una disminución de la sensibilidad tisular a las hormonas tiroideas1,2. La mayor parte de los casos se debe a mutaciones en el gen Thyroid Hormone Receptor Beta (THRβ), que codifica uno de los 2 tipos del receptor nuclear de T3, el Thyroid Receptor β3.
Aunque se desconoce la contribución de la RHT al desarrollo de carcinoma diferenciado de tiroides (CDT), la evidencia disponible sugiere que la presencia de mutaciones en el gen del receptor β podría jugar un papel en la tumorogénesis4.
Mujer de 35 años, con antecedentes personales de migraña, remitida a consultas de endocrino por alteración de hormonas tiroideas en analítica realizada en el servicio de ginecología, donde había acudido por deseo gestacional. Aportaba analítica con T4l 2,1 (LN 0,8-1,8ng/dl) y TSH 5,85 (LN 0,55-4,78μU/ml). En la exploración física destacaba un bocio difuso grado 2, un peso de 60kg, con un índice de masa corporal dentro de la normalidad (23kg/m2) y una frecuencia cardíaca de 94lpm. La paciente se encontraba asintomática. Se le repitió la analítica, confirmándose dicha alteración tiroidea: T4l 1,90ng/dl; T3l 5,02 (2,3-4,2pg/ml), TSH 4,84μU/ml.
Ante la sospecha de hipertiroidismo secundario versus RHT, se solicitó estudio con resonancia magnética hipofisaria y test de hormona liberadora de tirotropina (TRH), obteniéndose un resultado normal de ambas pruebas. Así mismo se realizó el cociente molar subunidad α de TSH/TSH, con resultado inferior a 1. Todo ello hizo sospechar que la paciente presentaba una RHT, solicitándose estudio genético, y confirmando este nuestro diagnóstico de sospecha. Presentaba la mutación en heterocigosis p.Arg438his en el exón 10 del gen THRB. Debido a estos hallazgos, se reinterrogó a la paciente sobre antecedentes familiares y se recomendó estudio analítico y genético a familiares de primer grado (que no viven en España).
Por otro lado, ante la presencia de bocio difuso, se realizó ecografía tiroidea que mostraba un tiroides aumentado de tamaño, con un nódulo sólido en tercio inferior del lóbulo tiroideo derecho con calcificaciones puntiformes de 12mm de diámetro máximo. Dadas las características ecográficas sospechosas se realizó un estudio citológico, con resultado compatible con carcinoma papilar de tiroides.
La paciente es intervenida mediante tiroidectomía total (se le propuso lobectomía inicial que rechazó) con diagnóstico anatomopatológico de carcinoma papilar bien diferenciado patrón clásico intratiroideo (pT1b) con márgenes quirúrgicos libres, y en el resto de la glándula un patrón hiperplásico nodular con T. linfocitaria crónica.
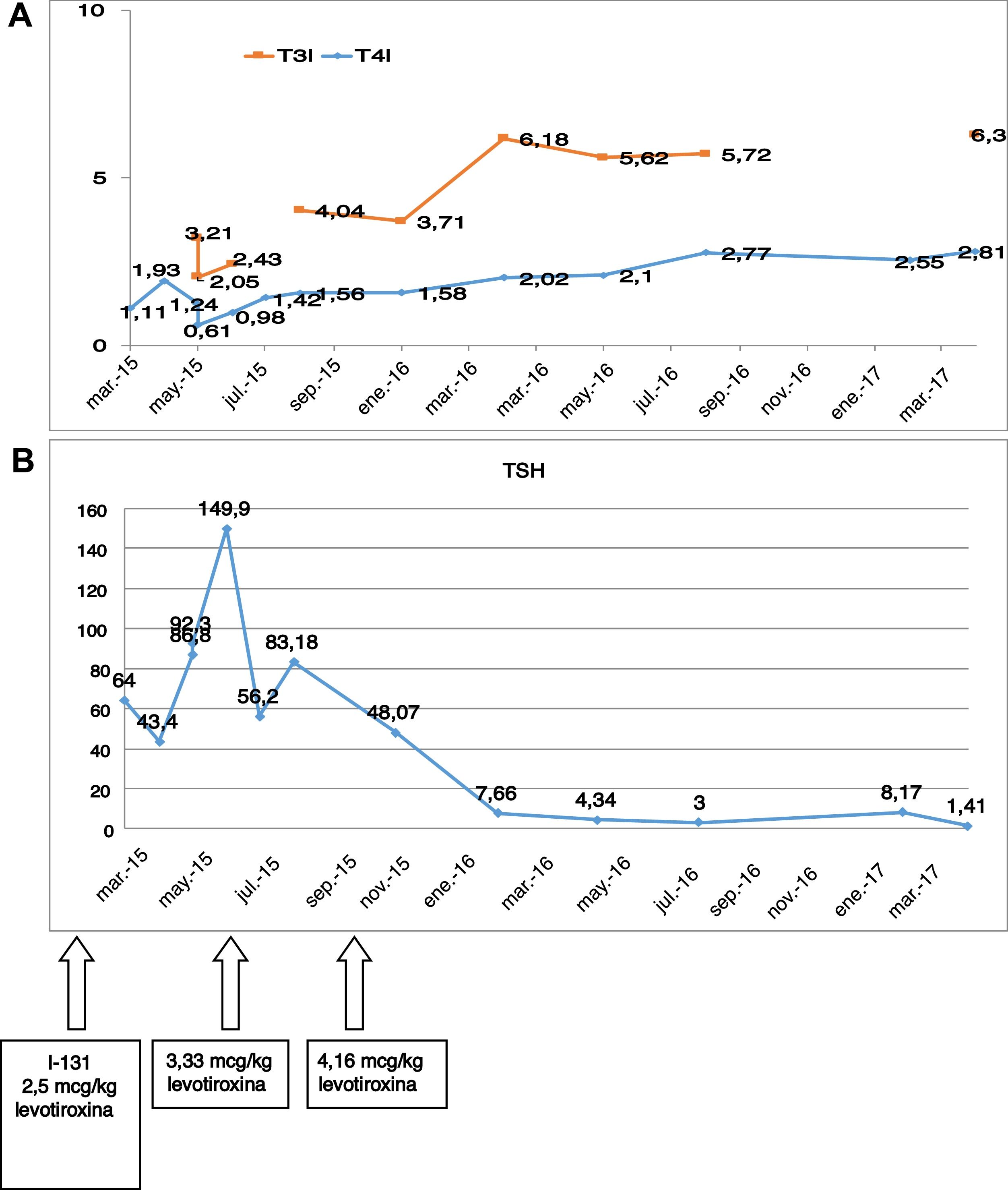
En el preoperatorio presentaba las siguientes pruebas de función tiroidea: TSH 3,4μU/ml; T4l 1,86ng/dl; T3l 7,15pg/ml. Tras la cirugía fue dada de alta con 100 microgramos (μg) de levotiroxina (1,6μg/kg). A pesar de ser una carcinoma papilar de bajo riesgo, se decidió dar una dosis ablativa de yodo-131, 2 meses después de la cirugía (50mCi) tras la suspensión de levotiroxina. Tras el ingreso se incrementó la dosis de levotiroxina a 2,5μg/kg. En la figura 1A y 1B, se puede ver la dificultad de control de los niveles de TSH tras cirugía, y la evolución de T3l y T4l.
En la última revisión realizada, presenta una respuesta excelente al tratamiento en relación a su CDT, y en relación a la RHT continúa clínicamente asintomática, tomando 4,16μg/kg de peso de levotiroxina diariamente.
La RHT consiste en una alteración en la respuesta tisular a las hormonas tiroideas. Se presenta en 1 de cada 40.000 nacimientos, afectando a ambos sexos por igual, y el patrón de herencia es autosómica dominante5. En el 85% de los casos se debe a mutaciones en el gen THRβ, y en menos del 1% a mutaciones en el gen Thyroid Hormone Receptor α6. Sus características principales, que deben hacernos sospechar del síndrome, son la elevación de la concentración de T4 y generalmente también de T3, con valores de TSH normales o moderadamente elevados, acompañados de bocio (que afecta a 2 de cada 3 pacientes). La respuesta de TSH a TRH se encuentra normal o aumentada y el diagnóstico final se confirma mediante la secuenciación del gen THRβ.
En los últimos años se han publicado varios casos de RHT en pacientes con CDT. Aunque no se conoce la contribución de la RHT al desarrollo de carcinoma de tiroides, la presencia de bocio difuso y la elevación de TSH pueden contribuir al crecimiento de nódulos y al desarrollo de CDT. Mutaciones en THRβ producen un incremento de TSH, esto aumenta la actividad de la adenilato ciclasa, aumentando la producción de AMPc y promoviendo el crecimiento celular. Se han descrito mutaciones somáticas puntuales en distintas zonas del gen del receptor β en pacientes con carcinoma de hígado, riñón, mama y colon4. En un estudio publicado por Puzianowska et al. se detectó la presencia de mutaciones en el gen THRβ en el 93,8% de pacientes con carcinoma papilar de tiroides y mutaciones del gen THRα en el 62,5%. En individuos sanos no se encontró la mutación, y en pacientes con adenomas en el 11-22%, respectivamente. Los autores concluyeron que estos hallazgos sugerían que, mutaciones en el gen del receptor de hormonas tiroideas, podrían contribuir a la tumorogénesis del carcinoma papilar de tiroides7.
En cuanto al manejo del síndrome de RHT, en la mayoría de los pacientes con defecto del receptor β, los elevados niveles de hormonas tiroideas circulantes compensan el defecto receptorial y el sujeto se encuentra clínicamente eutiroideo, por lo que no necesita tratamiento. En algunos casos se ha empleado el ácido triyodotiroacético (TRIAC), análogo de hormonas tiroideas, que suprime TSH sin aumentar el efecto tiromimético en los tejidos periféricos por sus dos propiedades: Mayor unión a receptor beta que alfa (menor acción en sistema cardiovascular) y por su mayor degradación8,9.
Sin embargo, el mecanismo de compensación anteriormente citado, fallará si las reservas tiroideas se reducen, como es el caso de nuestra paciente que fue sometida a tiroidectomía total. En estos casos se recomienda tratamiento con dosis suprafisiológicas de levotiroxina, entre 500 y 1.000μg/día. Si aparece taquicardia, esta puede tratarse con betabloqueantes.
Se he descrito que la combinación de levotiroxina y TRIAC puede ser efectiva en pacientes sometidos a tiroidectomía total y cáncer de tiroides10.
Por último destacar que dado el deseo genésico de la paciente, se recomienda, tras conseguir gestación, realizar un genotipo del feto con ADN fetal procedente de vellosidades coriónicas o amniocentesis para estudio mutación del gen del receptor de hormonas tiroideas. Si el feto está afectado, no precisará tratamiento durante la gestación. Si por el contrario el feto no está afectado, se recomienda que la madre durante la gestación no presente niveles de T4l superiores al 20% del límite de la normalidad, para evitar pérdidas e hipertiroidismo fetal11.