Se revisan los aspectos básicos del metabolismo de la creatina/creatinina y la íntima relación entre la creatinina y la masa muscular, lo que la convierte en un marcador bioquímico de ésta. Se hace énfasis en la utilidad pronóstica actual, tanto de la baja excreción urinaria de creatinina como de los niveles bajos de creatinina sérica, en diferentes contextos clínicos en los que la sarcopenia probablemente desempeña un papel importante en la morbilidad y mortalidad.
A review is made of the basic aspects of creatine/creatinine metabolism and the close relationship between creatinine and muscle mass, which makes the former a biochemical marker of the latter. Emphasis is placed on the current prognostic value of both the low urinary excretion of creatinine and low serum creatinine levels in different clinical settings in which sarcopenia probably plays a significant role in morbidity and mortality.
Cuando los clínicos interpretamos las cifras de creatinina habitualmente solemos estar pensando en términos de función renal, olvidándonos de que éstas informan también sobre la situación de la masa muscular (MM). La cuantificación de la MM es esencial en el enfoque de entidades tan prevalentes como la malnutrición, la sarcopenia primaria o secundaria, la obesidad sarcopénica o la diabetes mellitus tipo 2 (DM2). Este trabajo revisa el significado clínico de los niveles bajos de creatinina, un aspecto que suele pasar desapercibido fuera de las Unidades de Nutrición, y que, sin embargo, últimamente está demostrando un importante valor epidemiológico y pronóstico en múltiples contextos.
Referencia históricaEn 1832, Chevreul1 identificó una sustancia orgánica en el jugo de carne, a la que denominó creatina (del griego kreatos, carne). También comprobó que calentando la creatina en presencia de ácido clorhídrico ésta se transformaba en otra sustancia que se cristalizaba de forma diferente. En 1847 Liebig2 estableció la fórmula de la creatina (C4H9N3O2) y denominó creatinina a la sustancia derivada de ella, que identificó como creatina”anhídrida” (C4H7N3O).
En 1904, Otto Folin3, perfeccionando el método de Jaffe4, pudo empezar a medir la creatinina en sangre y orina. Este autor señaló que la excreción de creatinina en orina era relativamente estable en cada individuo a lo largo del tiempo (aunque había una gran variabilidad entre individuos distintos) y además estableció que <
En 1907, Spriggs6 observó que diversos tipos de atrofia muscular se asociaban a niveles bajos de creatinina en orina. En 1913 Myers y Fine7 demostraron que la excreción de creatinina en orina era directamente proporcional al contenido de creatina en el músculo. En 1919, Bürger8 estimó que la excreción urinaria de 1 g de creatinina/día en humanos correspondía aproximadamente a 22,9 kg de músculo esquelético, basándose en que un varón de 63,1 kg excretaba 1,36 g de creatinina/día y tenía 25,4 kg de músculo de acuerdo con los estudios postmortem. En posteriores trabajos esta cifra oscilaba algo arriba o abajo, dependiendo del método usado para medir la creatinina o la MM, y de otros factores que analizaremos abajo9-14. Por otro lado, el Baltimore Longitudinal Study on Ageing15 comprobó que el consumo basal de O2 disminuía con la edad a partir de los 45 años, de forma paralela a la pérdida de MM valorada por la excreción urinaria de 24 h (EUCr24h).
El primer trabajo que comparó directamente la excreción urinaria de creatinina con la cantidad de MM medida mediante tomografía axial computarizada (TAC) corporal total fue publicado en 1996 por Wang y cols.16, quienes confirmaron la existencia de una fuerte correlación entre ambos parámetros en 12 varones adultos sanos y físicamente activos, mantenidos con una dieta sin carne y en los que se obtuvo orina completa de 24 h. En estos individuos la relación entre la MM y la EUCr24h encajaba en el modelo MM = 21.8 X EUCr24h, muy parecido a los datos clásicos. Por otra parte, el grupo de Forbes17 demostró que la EUCr24h correlacionaba positivamente con las áreas transversales de los músculos del brazo y del muslo (r = 0,85 y 0,88, respectivamente), tanto en 15 varones y 9 mujeres jóvenes sanos (de menos de 32 años), como en 23 varones y 16 mujeres de más de 60 años. En 1999, Proctor y cols.18 compararon la utilidad de diferentes métodos de valoración de la MM (o de la masa magra) en hombres y mujeres jóvenes, de edad media y ancianos, y repitieron la valoración 3 meses después. Encontraron una fuerte correlación entre la EUCr24h y la MM medida por DEXA (absorciometría fotónica de Rayos X), con una r de 0,8 en todos los grupos. También confirmaron una fuerte correlación inversa entre la EUCr24h y la edad en hombres y mujeres. El principal problema con la EUCr24h era su baja reproducibilidad al repetir el estudio (17,7%) frente al 4,1% de la DEXA.
Teniendo en cuenta las dificultades que entrañaba obtener una adecuada recogida de orina de 24 h, especialmente en el ámbito clínico, a medida que se iban perfeccionando las técnicas para medir creatinina en sangre (CrS) se empezó a estudiar la posibilidad de medirla para valorar la MM. Finalmente se estableció la existencia de una correlación significativa de ambas EUCr24h y CrS con la MM valorada por diversos métodos19-22, entre ellos DEXA21 o bioimpedancia eléctrica (BIOE)22 en sujetos sanos de ambos sexos y con niveles de actividad variables.
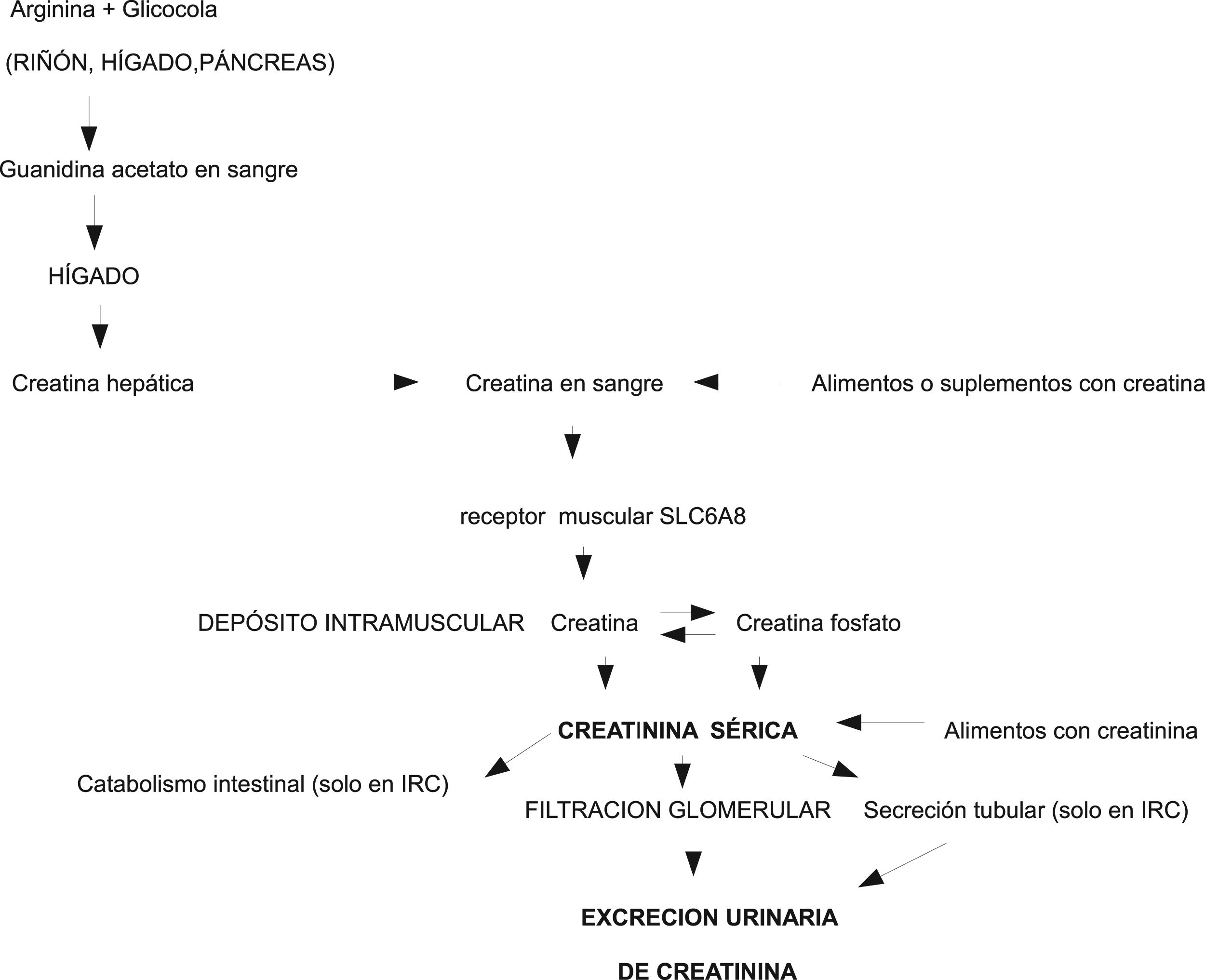
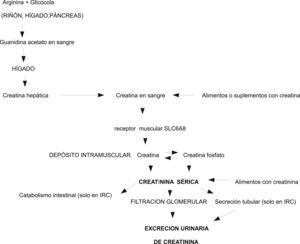
Fisiopatología de la creatina/creatininaLa creatinina es una molécula pequeña que se produce por deshidratación con ciclización espontánea no enzimática de la creatina y fosfocreatina muscular. In vivo el paso de creatina a creatinina es un proceso irreversible y constante23. Se calcula que un varón de 70 kg contiene aproximadamente 28 kg de tejido muscular y 120 g de creatina total (creatina más fosfocreatina), de la cual alrededor de 2 g/día se convierten en creatinina, y deben ser reemplazados por síntesis endógena o aporte exógeno. La ingestión de 500 g de carne o pescado sería capaz por sí sola de aportar todas las necesidades diarias de creatina23. La biosíntesis endógena de creatina está regulada enzimáticamente en el riñón y en el hígado23,24. La creatina sale del hígado a la sangre y a través de un transportador específico de membrana (SLC6A8) entra en el músculo, donde se almacena, se utiliza y se degrada, pero no se sintetiza. La creatina se localiza en el sarcómero, no aparece en los componentes no contráctiles y, por tanto, es independiente del componente hídrico, fibrótico o adiposo que puede acumularse dentro del músculo patológico23, y artefactar la cuantificación de la MM mediante DEXA o TAC (fig. 1).
La creatinina es permeable a las membranas celulares, difunde libremente de las células a la sangre, no se fija a las proteínas plasmáticas, no se almacena ni se metaboliza en ningún tejido y se excreta rápidamente al pasar por los riñones donde se elimina por filtración glomerular directa y, aunque se consideraba inicialmente que no se excretaba ni reabsorbía en los túbulos renales, se sabe que, en una parte variable se excreta a la orina desde los túbulos, y esta excreción es mayor a medida que se va deteriorando el filtrado glomerular25. Ya que la transformación no enzimática de creatina en creatinina es prácticamente constante y que más de 90% de la creatina corporal total se encuentra en los músculos, la EUCr24h se considera un buen marcador de la MM corporal total13.
Existen, sin embargo, numerosos factores que pueden modificar los resultados de la determinación de creatinina, tanto en sangre como en orina. Aparte de la propia técnica de determinación los más importantes son la dieta, la edad, el sexo, la raza, el ejercicio físico, la insuficiencia renal, determinados fármacos y enfermedades (especialmente las neuromusculares), y sobre todo la necesidad esencial de una recogida completa de toda la orina de 24 h, que suele ser el factor limitante en muchos casos (especialmente en personas con pérdidas urinarias involuntarias, incompleto vaciamiento de la vejiga o en los que no colaboren plenamente en la recogida de toda la orina)25. La dieta influye en la excreción de creatinina, por al menos tres mecanismos24: 1) las proteínas de la dieta son la fuente principal de los aminoácidos necesarios para sintetizar endógenamente la creatina, 2) la creatina de la dieta puede oscilar marcadamente desde casi cero en los vegetarianos estrictos hasta varios gramos al día en los individuos que toman suplementos de creatina, mientras que la dieta”americana” media de 200 g de carne es capaz de reemplazar de un tercio a un medio de las pérdidas urinarias normales de creatinina, y 3) la creatinina de la dieta, también de origen animal, supone entre 37 y 160 mg/día, dependiendo cómo haya sido cocinada. Por todo ello la dieta es un factor importante de variabilidad de la excreción de creatinina. La edad, el sexo, la raza y la actividad física del individuo condicionan la cantidad de MM, que, a su vez condiciona la EUCr24h. El ejercicio intenso aumenta la creatininuria temporalmente. Los procesos inflamatorios agudos graves asociados a fiebre o traumatismo y algunas enfermedades neuromusculares aumentan la excreción de creatinina cuando existe un excesivo catabolismo muscular. Determinados medicamentos (trimetroprim, cimetidina, imatinib, etc.) disminuyen transitoriamente la EUCr24h y elevan sus niveles en sangre, sin que esto signifique insuficiencia renal25. Para poder valorar adecuadamente los resultados de la creatinina en sangre y orina deben controlarse cuidadosamente todos los factores que se sistematizan en la tabla 1, así como el método usado para medir la creatinina (Jaffe modificado, enzimático, HPLC/LC, etc.).
Situaciones en las que se modifica la creatinina sérica
| Situaciones en las que baja la creatinina sérica |
|---|
| Causa prerrenal: Expansión de volumen (síndrome de secreción inadecuada de ADH, embarazo, sobrecarga aguda de volumen, etc.) |
| Causa renal: Hiperfiltración glomerular |
| Causa muscular: Masa muscular baja de cualquier causa (sarcopenia primaria del anciano, sarcopenia secundaria a enfermedades crónicas, malnutrición, falta de actividad física, amputación de extremidades, enfermedades neuromusculares [paraplejia, hemiplejia, esclerosis lateral amiotrófica, miopatías diversas]) |
| Causa hepática: Insuficiencia hepática grave |
| Tipo de dieta: Dieta vegetariana estricta |
| Situaciones en las que sube la creatinina sérica |
|---|
| Causa prerrenal: Depleción de volumen |
| Causa renal: Insuficiencia renal aguda o crónica, inhibidores de la excreción tubular de creatinina (cimetidina, trimetoprim, dronedarona, probenecid, salcilatos, dolutegravir, imatinib, etc.) |
| Causa muscular: Hipertrofia muscular (genética, hormonal, ejercicio físico crónico, etc.) o daño muscular agudo (ejercicio físico agudo excesivo, rabdomiólisis de cualquier causa, etc.) |
| Tipo de dieta: Ingestión de grandes cantidades de carne o pescado cocinado, ingestión de suplementos de creatina |
Metter y cols.26 fueron los primeros que comprobaron que la EUCr24h era más baja en los varones que fallecían que en los que sobrevivían en el Baltimore Longitudinal Study of Aging tras un seguimiento de 25 años, aunque la EUCr24h no fue el objetivo primario del estudio (en realidad estudiaban el valor pronóstico de la fuerza muscular).
El estudio PREVEND (cohorte prospectiva de población general de Groningen)27 publicado en 2009, que siguió a 8.092 individuos durante 7,5 años demostró que en mujeres la baja EUCr24h se acompañaba de un aumento claro en el riesgo de eventos cardiovasculares adversos mayores (EVCAM) y de un mayor riesgo de mortalidad global independientemente de factores como la edad, raza, tabaquismo, historia previa de enfermedad cardiovascular, resistencia a la insulina o inflamación de bajo grado valorada por Proteína C reactiva ultrasensible (PCRus). En varones también se detectó un significativo aumento de la mortalidad y una casi significativa elevación de los EVCAM a medida que disminuía la EUCr24h. Estos autores sugirieron por primera vez que los niveles bajos de EUCr24h, indicativos de malnutrición calórico-proteica o sarcopenia subclínica en la población general, podrían ser un marcador independiente de enfermedades crónicas graves como la arterosclerosis, aunque también podrían invocarse otros factores (dieta, sedentarismo, tipo de vida, etc.).
El Heart and Soul Study28 siguió de forma prospectiva a 903 pacientes con enfermedad coronaria estable al reclutamiento, durante 6 años. Los pacientes en el tercil más bajo de EUCr24h multiplicaban por 2 el riesgo de mortalidad de los del tercil más alto, después de múltiples ajustes por edad, sexo, raza, tasa de filtrado glomerular estimada por cistatina C, índice de masa corporal (IMC), factores tradicionales de riesgo cardiovascular y niveles de PCRus. En un estudio posterior de esta misma cohorte29 se comprobó que tanto los niveles bajos de EUCr24h como los de IMC se asociaban ambos con una mayor mortalidad por cualquier causa, pero la baja EUCr24h por sí sola no parecía explicar el aumento de mortalidad inducido por el IMC bajo.
El grupo de Groningen30 también evidenció que los pacientes con insuficiencia cardiaca sistólica crónica y EUCr24h baja se asociaba a dimensiones corporales más pequeñas e insuficiencia cardiaca más severa, y además la EUCr24h baja pronosticaba una evolución desfavorable del cuadro cardiaco. Asimismo, se ha señalado que los pacientes en el tercil más bajo de EUCr24h al ingreso por ictus tienen un peor pronóstico comparado con los pacientes en el tercil más alto31.
En 2013 Sinkeler y cols.32 publicaron un análisis posthoc de las bases de datos combinadas de los estudios RENAAL e IDNT (3228 pacientes seguidos durante una media de 3,5 años) en el que comprobaron que la EUCr24h baja se asociaba a un aumento de la tasa de mortalidad de cualquier causa en pacientes con DM2 y nefropatía diabética. Estudios multicéntricos posteriores33-35 confirmaron estos datos. Por otra parte, el grupo de Groningen comprobó que la EUCr24h baja se asociaba a un autodiagnóstico de fragilidad por los pacientes con IRC36. Este mismo grupo también demostró que la EUCr24h era más baja en trasplantados renales que en un grupo control con igual función renal y además ésta se correlacionaba con la fuerza muscular medida por un dinamómetro de fuerza de la mano37. Además, se ha evidenciado que la EUCr24h baja es un factor pronóstico independiente de mortalidad y de fallo del injerto tanto en trasplantados renales38 como hepáticos39.
Por otro lado, desde 1993 se sabía que algunos pacientes ingresados en Unidades de Cuidados Intensivos (UCI) presentaban una EUCr24h baja, sin que ello se debiera a inadecuada recogida de la orina ni insuficiencia renal40. El fenómeno se apreciaba hasta en un tercio de los pacientes, especialmente en mujeres y ancianos. En 2018, de nuevo el grupo de Groningen41, publicó los resultados de 6151 pacientes en los que se determinó la EUCr24h durante los tres primeros días de ingreso en la UCI y se excluyó insuficiencia renal grado 3 o más. En este contexto clínico la EUCr24h baja también se asociaba a más mortalidad a corto y largo plazo, independientemente de la edad, sexo, función renal y enfermedad causal.
Valor pronóstico de la creatinina sérica (CrS) bajaDel mismo modo que la EUCr24h baja se asocia a mal pronóstico en numerosas situaciones, la CrS baja también lo hace, aunque este aspecto ha tardado más en ser desvelado.
No hay datos específicos sobre el valor pronóstico de la CrS baja en población general, pero, en 2017 Thongprayoon y cols.42 analizaron 73.994 pacientes hospitalizados en la Clínica Mayo entre 2011 y 2013, en los que se había medido la CrS al ingreso y su evolución clínica. La relación entre la CrS basal y la mortalidad intrahospitalaria se distribuía en forma de U, y tras ajustar por edad, sexo, raza, diagnóstico principal y comorbilidades la CrS basal inferior a 0,4 mg/dL aumentaba el riesgo de mortalidad, comparada incluso frente a aquellos con una CrS superior a 1,5 mg/dL.
El primer trabajo que relacionó la CrS baja con la DM2 fue el de Harita y cols., publicado en 200943, que siguió prospectivamente durante 4 años a 8.570 varones japoneses no diabéticos de 40-55 años. Los que formaban parte del grupo con niveles de CrS basal más baja (0,4-0,6 mg/dL) tenían un mayor riesgo de desarrollar DM2 tras múltiples ajustes por factores de confusión (incluido el IMC) comparados con los que formaban parte del grupo con 0,71-0,8 mg/dL. Se atribuyó a que el grupo con niveles más bajos de CrS estaba constituido por aquellos con menor MM, aunque ésta no fue medida directamente. En este sentido varios grupos orientales44,45 han establecido que en adultos no diabéticos la MM baja medida por BIOE predice la evolución hacia DM2, independientemente de la presencia de obesidad. Sin embargo, en estos estudios no se midió la CrS o la EUCr24h.
Kashima y cols.46, comprobaron en 9.667 japoneses (hombres y mujeres) no diabéticos ni hipertensos con CrS basal normal seguidos durante 5,6 años, que los hombres con CrS inferior a 0,7 mg/dL y las mujeres con CrS inferior a 0,5 mg/dL tenían mayor riesgo de desarrollar DM2 que los que tenían cifras más altas. Otro estudio de 3.313 varones japoneses de 30-55 años no diabéticos seguidos 6,7 años47 señaló que el grupo con niveles más bajos de CrS basal (inferior a 0,7 mg/dL) comparado con el grupo de CrS entre 0,9-1,1 presentaba mayor riesgo tanto de aparición de DM2 como de alteración de la glucemia en ayunas (AGA). Aunque se hicieron ajustes por edad, IMC, ingestión alcohólica, actividad física e historia familiar de DM2 no se midió la MM. Tres estudios muy recientes en personas orientales48-50 nuevamente confirman que la CrS baja predice una evolución desde la normalidad a AGA y DM2.
Sin embargo, un estudio prospectivo de 2.676 hombres y mujeres coreanos seguidos durante 4-5 años51 no detectó diferencias en la CrS basal entre los que desarrollaban o no DM2, pero sí se apreció que el decremento de la CrS a lo largo del tiempo se asociaba a la aparición de DM2 tras ajustar por los factores habituales. En este trabajo se demostró que la CrS correlacionaba positivamente con la MM medida por BIOE. Con respecto al riesgo de DM2 y de AGA resulta llamativa la falta de estudios prospectivos midiendo CrS y MM en población europea o subsahariana.
Goel y cols.52 estudiaron la evolución de 4.394 pacientes sometidos a revascularización coronaria percutánea durante 4,2 años e identificaron un subgrupo con IMC normal y CrS baja (inferior a 0,7 mg/dL) en los que la mortalidad tanto cardiovascular como de cualquier causa estaba significativamente elevada respecto a los sujetos con CrS normal (0,71-0,97 mg/dL).
Huh y cols.53 demostraron en un grupo de 8.648 coreanos (que incluía más de 4.000 mujeres postmenopáusicas) con función renal normal, que la CrS correlacionaba positivamente con la MM apendicular y con el score T en femur y región lumbar, lo que nuevamente insiste en el concepto de que la CrS baja indica baja MM y además es un factor predictor de riesgo de osteoporosis densitométrica (no se valoraron fracturas).
Por otra parte, Cartin-Ceba y cols.54 ya habían hecho en 2007 la interesante observación de que la CrS baja al ingreso en más de 11.000 pacientes en la Unidad de Cuidados Intensivos (UCI) de la Clínica Mayo predecía la mortalidad independientemente del IMC y nuevamente especularon con la posibilidad de que la CrS baja indicase baja MM o malnutrición, de manera que ésta sería un marcador de menor capacidad de respuesta frente a la situación crítica. Sin embargo, la CrS baja también podría deberse a hemodilución por sobrecarga de líquidos o al síndrome de aclaramiento renal aumentado de los pacientes críticos, lo que exige estudios más detallados.
En 2016, Udy y cols.55 en un monumental trabajo multicéntrico retrospectivo que incluyó más de un millón de pacientes confirmaron que la CrS baja al ingreso en la UCI se asociaba a un aumento del riesgo de mortalidad intrahospitalaria, independientemente de otros factores de confusión. No obstante, tampoco se midió la MM por métodos directos, así que la relación con la MM no se pudo estudiar. Kang y cols.56 también demostraron que un descenso en la CrS durante la estancia en la UCI pronosticaba un aumento de mortalidad en estos pacientes.
ConclusiónExiste una robusta evidencia epidemiológica en los diferentes contextos clínicos revisados (población general, ancianos, enfermedad coronaria, nefropatía diabética, pacientes hospitalizados en plantas o en cuidados intensivos, trasplantados, etc.), de que tanto la EUCr24h como la CrS bajas indican un mal pronóstico en términos de morbilidad (aumento de riesgo cardiovascular, empeoramiento de la insuficiencia cardiaca, evolución hacia DM2, existencia de osteoporosis y de fragilidad, peor evolución de los injertos, etc.) y de mortalidad en general. Parafraseando el atinado y profético Editorial de Kalantari y Bolton57 podemos decir que”tenemos una buena razón para medir la EUCr24h, más allá de valorar la función renal”. Esta determinación es económica y fácil de llevar a cabo en pacientes colaboradores, ingresados o sondados, como los de la UCI, pero es difícilmente generalizable a todos. Sin embargo, parece aconsejable prestar más atención a todos los pacientes con CrS baja, un dato identificable y disponible en todas las historias clínicas, que muchas veces pasa desapercibido en las valoraciones habituales. En la mayor parte de los estudios el punto a partir del cual se eleva el riesgo de forma evidente es cuando la EUCr24h es inferior a 700 mg/día en varones (600 en mujeres) o la CrS es inferior a 0,6 mg/dL en hombres (0,5 en mujeres), aunque estas cifras dependen del contexto y de los múltiples factores señalados en la tabla 1, por lo que no existen recomendaciones oficiales al respecto. La causa más probable de la creatinina baja en estas situaciones es la sarcopenia (primaria o secundaria), teniendo en cuenta las buenas correlaciones entre creatinina y MM en sujetos sanos11-22 y en distintas patologías51-53,58, aunque se necesitan más estudios prospectivos en los que se determine simultáneamente la creatinina y la MM. En cualquier caso, ante un paciente con creatinina baja es aconsejable hacer una valoración nutricional y reevaluar la dieta y la actividad física, ya que potencialmente podríamos mejorar su pronóstico, aunque eso todavía debe demostrarse en ensayos clínicos bien planificados. Finalmente, existen otras situaciones en las que la creatinina baja también parece ser un marcador útil (caquexia del cáncer, de los pacientes en diálisis, de la insuficiencia hepática crónica, de la enfermedad pulmonar crónica, etc.), pero, debido a la gran complejidad inherente a estos procesos, se necesitan muchos más estudios. En cualquier caso, ante un paciente con creatinina baja se debería pensar en la presencia de sarcopenia y es aconsejable hacer una valoración nutricional y reevaluar la dieta y la actividad física.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.