La medición de la densidad mineral ósea mediante la absorciometría radiológica de doble energía es la técnica de elección para la valoración ósea y un predictor importante del riesgo de fractura. Sin embargo, la mayoría de las fracturas por fragilidad ocurren en personas sin osteoporosis densitométrica, especialmente en enfermedades endocrinológicas. Las herramientas para la estimación del riesgo de fracturas como FRAX han mejorado la sensibilidad diagnóstica aunque no consideran otras características óseas adicionales. La investigación de la microarquitectura ósea supone una mejoría en el abordaje de estos pacientes. En este documento elaborado por miembros del grupo de trabajo de Metabolismo Mineral y Óseo de la Sociedad Española de Endocrinología y Nutrición se revisan los nuevos avances en absorciometría radiológica de doble energía y otras técnicas más complejas para el estudio de la microarquitectura ósea así como los datos disponibles en diabetes tipo 2 y patología paratiroidea.
Bone mineral density using dual-energy X-ray absorptiometry is the gold standard for the assessment of bone and an important predictor of fracture risk. However, most fragility fractures occur in people without densitometric osteoporosis, especially in endocrinological diseases. Fracture risk estimation tools such as FRAX have improved diagnostic sensitivity but do not include additional skeletal features. Bone microarchitecture research represents an improvement in the treatment of these patients. In this document members of the Mineral and Bone Metabolism Working Group of the Spanish Society of Endocrinology and Nutrition review new advances in dual-energy X-ray absorptiometry and other complex techniques for the study of bone microarchitecture as well as the available data on type 2 diabetes and parathyroid pathology.
La densitometría ósea es una prueba no invasiva que permite la medición de la densidad mineral ósea (DMO) en determinadas localizaciones (habitualmente columna lumbar y fémur, también en tercio distal de radio). Está basada en la técnica de absorciometría radiológica de doble energía (DXA) como método de medición de referencia para la evaluación de la DMO y, por tanto, el diagnóstico y monitorización de la osteoporosis. Tiene como ventajas su alta precisión y ser una técnica de muy baja radiación, fácil realización y corta duración1–3. Además, es relativamente poco costosa en comparación con otras técnicas.
La DMO se considera la variable fundamental que refleja la resistencia ósea, pudiendo llegar a justificar un 70-85% de la fortaleza ósea, y siendo uno de los principales factores que condicionan el riesgo de fractura. Sin embargo, no tiene en cuenta otros factores que contribuyen al comportamiento biomecánico óseo y condicionan la calidad ósea4. El concepto de calidad ósea surge para diferenciar los componentes fundamentales que determinan la resistencia ósea: masa ósea (cantidad de tejido), geometría ósea (disposición espacial/tamaño) y calidad ósea (microarquitectura y composición del tejido óseo)5.
La incorporación conceptual de «alteración de la resistencia ósea” como núcleo definitorio del aumento del riesgo de fractura por fragilidad ha supuesto que se reconozcan las limitaciones que tiene la evaluación de la masa ósea mediante DXA como predictor clínico más relevante del riesgo de fractura5,6. La mayor limitación de las mediciones de DMO por DXA es que encontramos un alto grado de solapamiento entre individuos que sufren fracturas y los que no lo hacen, especialmente en patologías endocrinológicas como la diabetes mellitus tipo 2 (DM2) y el hiperparatiroidismo primario. De este modo, aunque la DMO medida por DXA tiene una alta especificidad para predecir el riesgo de fractura, su sensibilidad es baja, por lo que la mayoría de las fracturas por fragilidad ocurren en personas que no tienen osteoporosis densitométrica (T score≥−2,5).
Debemos considerar, además de la DMO, aquellos factores que contribuyen a mayor probabilidad de fractura7. Así pues, parece más adecuado valorar el riesgo absoluto de fractura, considerando la combinación de factores de riesgo para cuantificar el riesgo individual de fractura, que tener en cuenta únicamente la DMO, aumentando así la sensibilidad de detección de fractura manteniendo la especificidad1,2. Con ese objetivo, se han desarrollado herramientas para valoración del riesgo de fractura. De todas ellas, el Fracture Risk Assessment (FRAX) tiene un uso más generalizado seguramente por estar auspiciado por la Organización Mundial de la Salud y haber sido amplia y efectivamente divulgado, adaptándose a un gran número de países. Permite valorar el riesgo de fractura integrando factores de riesgo que predisponen a un mayor riesgo de fractura, con o sin los datos de la DMO. Su utilización se ha extendido y generalizado rápidamente y ha sido incluido en guías de práctica clínica. Sin embargo, esta herramienta tampoco está exenta de críticas y limitaciones destacando los sesgos poblacionales que presenta lo que dificulta que se puedan generalizar los umbrales determinados para intervención terapéutica (20% para fractura mayor y 3% para fractura de cadera). Así, estudios posteriores muestran que el instrumento FRAX infraestima el riesgo de fracturas osteoporóticas en la población española, concretamente en la estimación del riesgo de fractura mayor y determinados grupos de pacientes7.
La medición de la DMO y la estimación del riesgo de fracturas continúan siendo insuficientes para considerar todos los aspectos que influyen en la resistencia ósea y el riesgo de fractura6. La investigación de la microarquitectura ósea mediante nuevos avances en DXA y otras técnicas más complejas supone una mejoría en el abordaje de la fragilidad ósea8. En este documento elaborado por miembros del grupo de trabajo de Metabolismo Mineral y Óseo de la Sociedad Española de Endocrinología y Nutrición se revisan las tecnologías en la evaluación de la fragilidad ósea así como los datos disponibles en DM2 y patología paratiroidea.
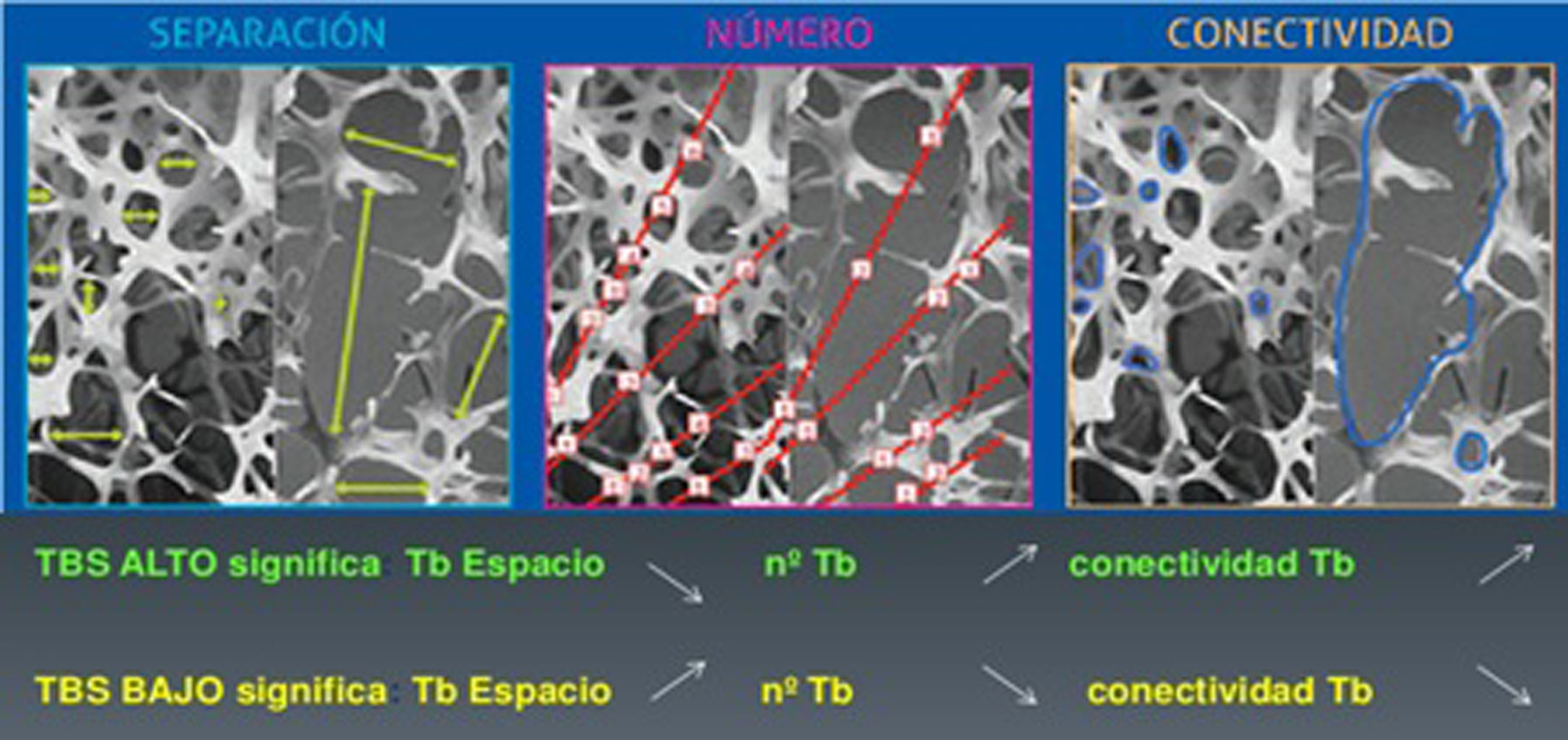
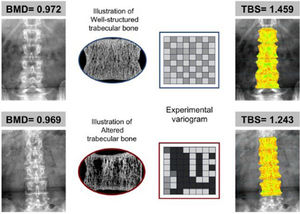
Nuevos avances en densitometría óseaTrabecular Bone ScoreEl Trabecular Bone Score (TBS) es un novedoso índice numérico que permite estimar la microarquitectura ósea trabecular a partir del análisis de textura de imágenes de la DXA de columna lumbar mediante la aplicación del software informático TBS iNsight® desarrollado por Medimaps9. Como TBS se basa en DXA, puede ser ampliamente accesible sin necesidad de adquirir nuevos equipos. El software analiza las variaciones de la intensidad de cada pixel estimando mediante un algoritmo matemático la microarquitectura ósea independientemente de la DMO10. Existe una correlación significativa del TBS con los parámetros de histomorfometría ósea: el TBS está directamente correlacionado con el número de trabéculas y su conectividad, y negativamente correlacionado con el espacio entre las trabéculas. Es decir, un alto valor TBS significa que la microarquitectura ósea es densa y está bien conectada, con pequeños espacios entre las trabéculas. Por el contrario, un bajo valor TBS significa que la microarquitectura del tejido óseo es incompleta y está mal conectada, con amplios espacios entre las trabéculas (figs. 1 y 2)10–12.
Correlación de TBS con los parámetros de microarquitectura ósea. Tomada de Del Río et al.11.
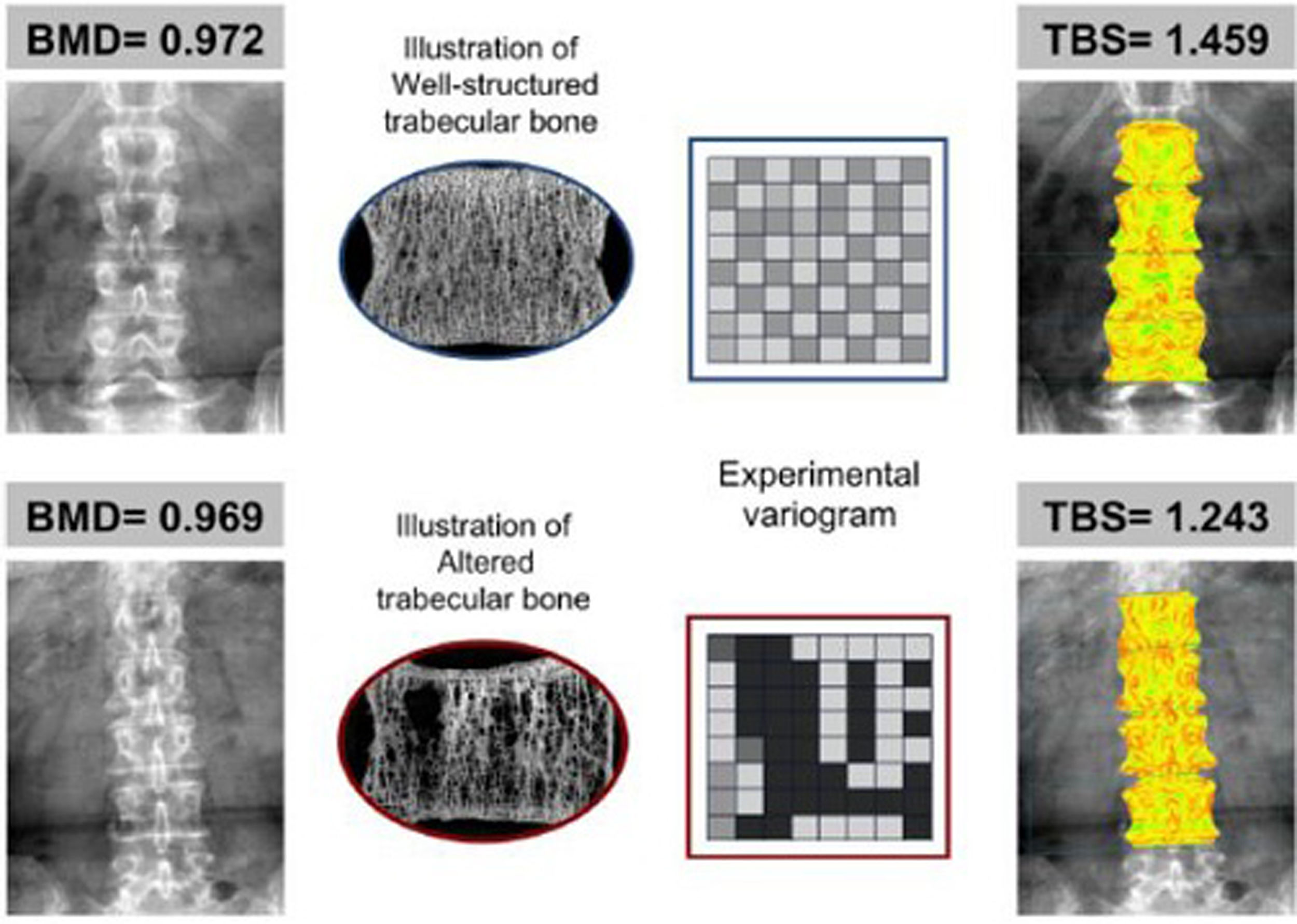
Ejemplo en el que 2 pacientes con similar DMO (en g/cm2) tienen diferentes valores de TBS de acuerdo a las características de su hueso trabecular. El panel superior, con hueso bien estructurado (trabéculas más numerosas y bien conectadas), proporciona un alto valor de TBS. En el panel inferior (pocas trabéculas y mal conectadas) el valor de TBS es bajo, lo que indica un deterioro de la microarquitectura y mayor probabilidad de fractura. Tomada de Silva et al.12.
La tabla 1 recoge los valores de referencia del TBS11.
Valores de referencia del TBS
| Microarquitectura normal | Microarquitectura parcialmente deteriorada | Microarquitectura degradada |
|---|---|---|
| TBS≥1.350 | TBS<1.350 y ≥1.200 | TBS<1.200 |
Tomada de Del Río et al.11.
Diversos estudios han demostrado que el TBS es un predictor del riesgo de fractura osteoporótica independientemente de la DMO y es, además, un contribuyente independiente que mejora la capacidad predictiva de las herramientas de evaluación de riesgo de fractura como FRAX13–15.
La Sociedad Española de Investigación Ósea y del Metabolismo Mineral (SEIOMM) ha publicado recientemente un documento de posición sobre la utilidad clínica del TBS9. La tabla 2 resume las posiciones oficiales de la SEIOMM según la revisión de la evidencia científica realizada por el comité de expertos.
Revisión de la evidencia científica sobre uso clínico del TBS: Posiciones oficiales de la SEIOMM (resumen)
| 1. ¿Se puede utilizar el TBS para evaluar el riesgo de fractura en la práctica clínica? |
| • El TBS puede utilizarse para valorar el riesgo de fractura vertebral, de fémur y fragilidad global en mujeres y hombres a partir de los 50 años [Nivel de evidencia, 2++. Grado de recomendación, B] |
| • El TBS puede usarse junto con la DMO para valorar la fragilidad vertebral, de fémur y global en hombres y mujeres a partir de los 50 años de edad [Nivel de evidencia, 2++. Grado de recomendación, B] |
| 2. ¿Se puede usar el TBS para el seguimiento de pacientes con osteoporosis? |
| • El TBS puede utilizarse en el seguimiento de pacientes con osteoporosis para evaluar cambios en el tiempo [Nivel de evidencia, 2+. Grado de recomendación, C] |
| • El TBS no mejora la DMO en la valoración del efecto del tratamiento a lo largo del tiempo. No debe utilizarse en la valoración de respuesta a los bifosfonatos [Nivel evidencia, 2++. Grado de recomendación, B] |
| 3. ¿En qué patologías el TBS es especialmente útil? |
| • El TBS se puede utilizar para evaluar el riesgo de fractura en sujetos que padecen diabetes y en sujetos tratados con glucocorticoides [Nivel de evidencia, 2+]. |
| • El TBS se puede usar para la orientación clínica de sujetos que padecen hipo- e hiperparatiroidismo [Nivel de evidencia, 2+] |
| • El TBS se puede usar para la orientación diagnóstica de pacientes en presencia de osteoartritis [Nivel de evidencia, 2+] |
Adaptada de Blanch Rubio et al.9.
Niveles de evidencia y grados de recomendación de la Red de Guías Intercolegiales Escocesas (SIGN).
La geometría ósea, la microarquitectura o la distribución tridimensional (3D) del contenido mineral, también desempeñan un papel importante en la resistencia ósea junto a la DMO. Se han propuesto parámetros estructurales para cuantificar mejor la resistencia mecánica del hueso y estimar el riesgo de fractura de cadera obtenidos mediante tomografía computarizada cuantitativa (QCT). La obtención de un modelo 3D de reconstrucción ósea a partir de imágenes de QCT requiere elevadas dosis de radiación a través de técnicas costosas. Recientemente, han surgido alternativas con la introducción de modelos 3D a partir de la reconstrucción de densitometrías planas en 2D obtenidas mediante DXA16,17. La técnica DXA-3D puede usarse para reconstruir con precisión en formato 3D la densidad interna del fémur a partir de imágenes DXA-2D. Esto puede ayudar a obtener nueva información de las imágenes clínicas de DXA para simular la estructura y fuerza mecánica del hueso ofreciendo información adicional sobre el riesgo real de fractura.
El algoritmo de software DXA-3D estima las densidades volumétricas de los compartimentos cortical y trabecular del hueso y la distribución anatómica del grosor cortical usando escaneos DXA de cadera estándar.
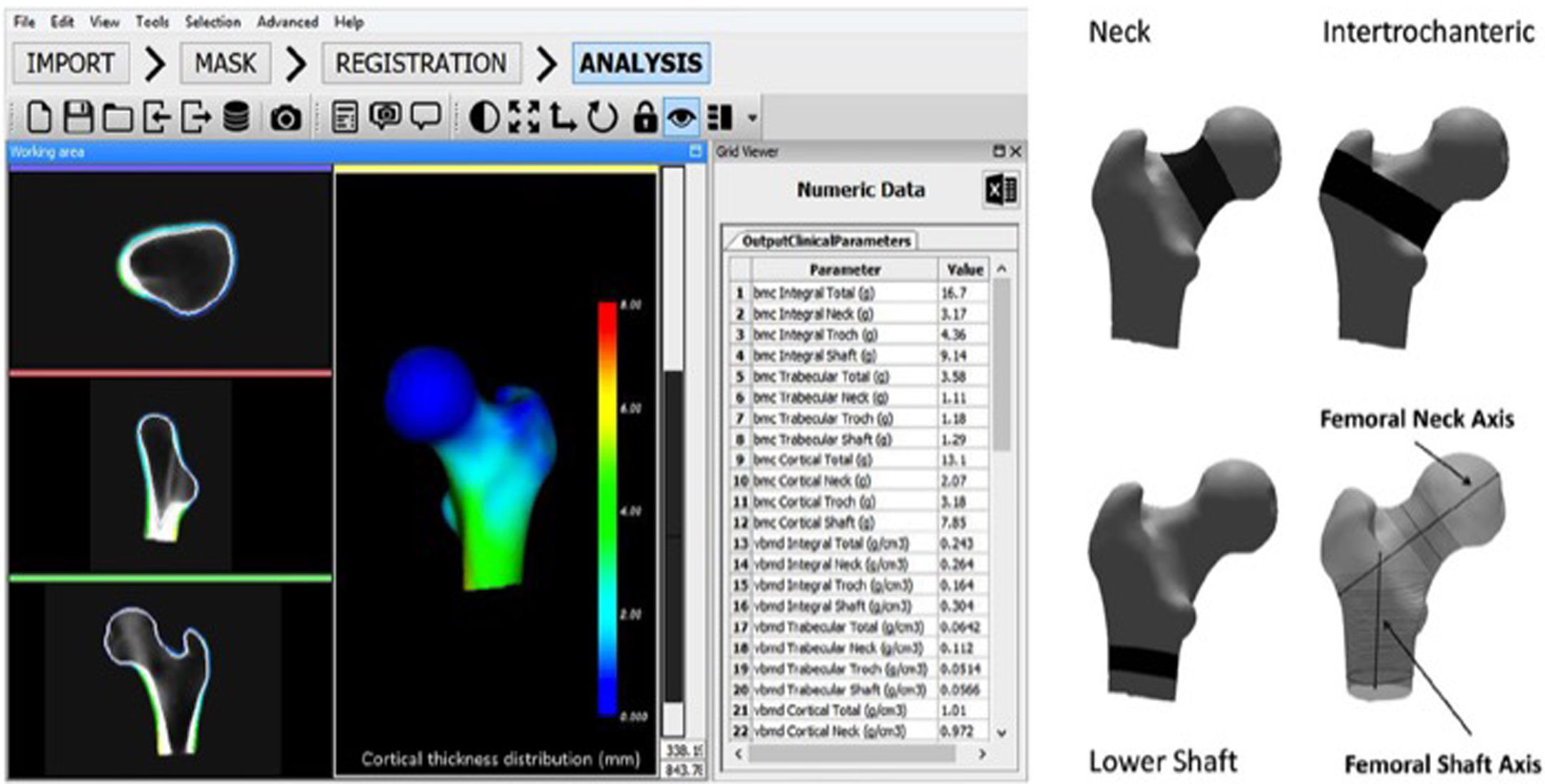
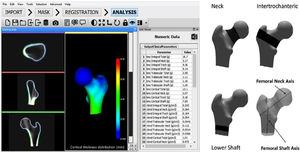
El software DXA-3D desarrollado por Galgo Medical (Barcelona, España) se basa en un modelo estadístico de forma y densidad del fémur proximal generado a partir de una base de datos de QCT de mujeres y hombres caucásicos17. El algoritmo se basa en un modelo de densidad y forma estadística que se registra sobre la imagen DXA para obtener un modelo 3D personalizado del fémur proximal. El grosor cortical y la densidad se calculan ajustando una función matemática al perfil de densidad calculado a lo largo del vector normal en cada nodo de la malla de superficie proximal del fémur. Las principales medidas de salida de DXA-3D son la densidad superficial del hueso cortical (en mg/cm2) y la DMO volumétrica del hueso trabecular e integral (en mg/cm3) (fig. 3).
Interfaz de software 3D-DXA (izquierda) y regiones de interés utilizadas en el cálculo de los parámetros estructurales de 3D-DXA (derecha). BMC: contenido mineral óseo; DXA: absorciometría radiológica de doble energía; vBMD: densidad mineral ósea volumétrica; 3D: tridimensional.
Tomada de Clotet et al.19.
Los estudios recientes han demostrado que las técnicas de DXA-3D proporcionan estimaciones precisas de la DMO volumétrica trabecular, cortical y espesor cortical con altos índices de correlación con los parámetros estructurales medidos con QCT16–19. Las ventajas de esta técnica son superponibles y complementarias a TBS puesto que al basarse en DXA es más accesible, menos costosa y con menor irradiación que QCT. Asimismo se pueden llevar a cabo análisis sobre DXA previas.
A nivel práctico, se ha demostrado su precisión en mediciones repetidas a corto plazo en mujeres posmenopáusicas20, la asociación de las mediciones de DXA-3D con fractura de cadera21 y fractura vertebral22 y su utilidad para valoración de los efectos de los fármacos osteoporóticos23.
Valoración densitométrica de fractura vertebral (Vertebral Fracture Assessment)La valoración densitométrica de fractura vertebral (Vertebral Fracture Assessement [VFA]) se ha desarrollado con el fin de evaluar la integridad vertebral en una imagen lateral de la columna mediante DXA. Este método se puede realizar al tiempo de la valoración de DMO y conlleva como ventaja una menor exposición de radiación al paciente comparado con la radiografía convencional (<1%) y un menor coste. Varios estudios han comparado la capacidad del VFA para detectar fracturas vertebrales, comparado con una radiografía convencional. Existe una buena concordancia entre ambas técnicas, si bien es menor para fracturas leves (grado 1) que para moderadas o severas (grados 2 o 3)24,25. Hay que tener en cuenta que solo con VFA no podemos determinar si la naturaleza de la fractura está relacionada con una patología no osteoporótica, por lo tanto además de la clínica del paciente se recomienda valorar otras técnicas de imagen cuando hay 2 o más deformidades leves y ninguna moderada o severa, cuando aparecen lesiones vertebrales no atribuibles a causas benignas o si el paciente presenta historia conocida de patología tumoral. VFA está diseñado para detectar fracturas vertebrales pero no otras anormalidades26. El método semicuantitativo de Genant mediante radiología convencional es el más recomendado en general para una evaluación inicial de las imágenes27.
Otras tecnologíasTomografía computarizada cuantitativa periférica de alta resoluciónLa tomografía computarizada cuantitativa periférica de alta resolución (HR-pQCT) permite una evaluación tridimensional de la microarquitectura ósea in vivo. Distingue el compartimento cortical y trabecular tanto de radio distal como de la tibia. Ofrece ventajas significativas sobre las medidas bidimensionales ya que realiza una valoración no solo de la DMO sino también de la estructura y fuerza en ambos compartimentos. HR-pQCT adquiere imágenes basadas en los mismos principios que las QCT tradicionales, pero puede lograr una resolución mucho mayor aunque en un campo de visión más pequeño. Esto permite solo la exploración de sitios periféricos como el radio y la tibia. La exposición a la radiación durante una exploración HR-pQCT es más baja que la TC de todo el cuerpo28,29.
- -
Análisis de densidad: se puede medir la DMO volumétrica (mgHA/cm3) total, de hueso trabecular y hueso cortical. Con las imágenes se puede simular la DMO bidimensional con alta concordancia con la DXA de radio ultradistal.
- -
Análisis de la estructura trabecular ósea: las mediciones trabeculares generalmente se calculan en lugar de medirse directamente a partir de las imágenes ya que la resolución del HRr-pQCT es muy cercana al tamaño de las trabéculas individuales. Con HR-pQCT se obtiene fracción de volumen óseo, número promedio de trabéculas, grosor trabecular promedio y separación. Otros parámetros métricos están más afectados por la resolución de la imagen.
- -
Análisis de estructura cortical: grosor cortical y porosidad cortical.
- -
Estimación de la fuerza ósea: puede estimarse usando un análisis de elementos finitos. El análisis de elementos finitos valora el comportamiento mecánico del hueso ante determinadas condiciones mediante simulación.
La técnica de HR-pQCT ha demostrado ser útil en la evaluación de diferencias microarquitecturales entre diferentes edades y sexo, así como para valorar el riesgo de fractura, con mejor resultado que DXA sola30. Por otro lado, la mayoría de estudios clínicos con HR-pQCT han examinado la asociación de fractura en mujeres posmenopáusicas con osteopenia y osteoporosis, encontrando que tanto el riesgo de fractura como la severidad de esta está relacionada con la microarquitectura ósea31,32. Otros estudios con HR-pQCT se han realizado en osteoporosis secundarias y enfermedades óseas relacionadas, especialmente porque estas enfermedades pueden afectar al compartimento cortical y trabecular de forma diferente28. Finalmente, su utilidad se ha visto también en monitorización terapéutica, para valoración de los efectos de distintos tratamientos en microarquitectura ósea. Uno de los primeros ensayos clínicos aleatorizados controlados con placebo compara los efectos de denosumab y alendronato tras 12 meses de tratamiento en 247 mujeres posmenopáusicas; en este se observa una prevención del declive de los parámetros de microarquitectura ósea con mejores resultados en los pacientes tratados con denosumab33. Se han realizado estudios definiendo los efectos de alendronato34, teriparatida y zoledrónico entre otros35,36.
Microindentación óseaLa microindentación es una técnica que puede evaluar directamente las características mecánicas del hueso cortical in vivo, lo que supone una nueva dimensión en la evaluación de la resistencia ósea a la fractura. Al insertar una sonda en la superficie de la tibia anterior e inducir fracturas microscópicas, la microindentación mide la resistencia mecánica del hueso a nivel tisular37. La prueba es mínimamente invasiva y se realiza con anestesia local. Inicialmente se desarrolló una técnica de indentación cíclica y posteriormente se ha desarrollado la microindentación de impacto. La microindentación cíclica se expresa en términos de distancias de indentación, midiendo las distancias a las que el microindentador es capaz de penetrar. Los resultados de microindentación de impacto se expresan como unidades de índice de resistencia del material óseo (Bone Material Strength index –BMSi–) que representan la relación entre la penetración de la sonda en el hueso y su penetración en un espectro de referencia de metacrilato de metilo.
La microindentación ha demostrado discriminar entre individuos con y sin fractura por fragilidad independientemente de la DMO38. También se han observado valores de BMSi más bajos en pacientes con fracturas por fragilidad independientemente de presentar osteopenia u osteoporosis en valoración de DMO39.
Aplicación en EndocrinologíaDiabetes mellitus tipo 2La DM2 es una enfermedad de alta prevalencia asociada a un aumento de la fragilidad ósea en la que la DMO medida mediante DXA y la escala FRAX infraestiman el riesgo de fractura40. Los mecanismos implicados en el aumento de la fragilidad ósea en esta enfermedad son complejos. Así, los diferentes factores implicados incluyen un bajo recambio óseo, la acumulación de productos finales de glucación avanzada, anomalías en la microarquitectura y la macroarquitectura ósea y alteraciones del material tisular41. Por este motivo son de gran interés los estudios realizados con nuevas tecnologías de evaluación de la calidad ósea.
Estudios epidemiológicos amplios han mostrado que TBS es un predictor independiente de fractura tanto en diabéticos como en no diabéticos. Leslie et al.42 incluyeron en un estudio a 29.407 mujeres canadienses de edad igual o superior a 50 años con exploraciones DXA disponibles, de las cuales 2.356 habían sido diagnosticadas de diabetes. Después del ajuste para los factores de riesgo clínicos, se encontró que las mujeres diabéticas tenían más probabilidades de situarse en el tercil inferior del TBS lumbar, pero eran menos propensas a estar en los terciles más bajos de la DMO de columna lumbar, cuello de fémur o de área total de fémur. Los valores del TBS fueron un predictor de fracturas incidentes independiente de la DMO. Otros estudios han mostrado que los valores de TBS se relacionan negativamente con los niveles de hemoglobina glicada, la glucosa plasmática y la insulina en ayunas43.
La aplicación de HR-pQCT al estudio de la estructura ósea en sujetos con DM2 ha demostrado que la porosidad cortical es mayor en pacientes con DM2 y este déficit en el componente cortical se ha observado con mayor intensidad en pacientes diabéticos con complicaciones microvasculares44. Los efectos de la DM2 en la DMO volumétrica, la geometría ósea y la resistencia en el fémur proximal se han investigado con resultados contradictorios. En el estudio de Melton et al.45, la DMO volumétrica trabecular fue superior en pacientes con DM2 cuando se comparó con sujetos no diabéticos, mientras que la DMO volumétrica cortical, área de sección transversal ósea y espesor cortical fueron similares en diabéticos y controles. Por el contrario, Heilmeier et al.46 compararon la DMO volumétrica femoral y la geometría ósea en un estudio transversal de mujeres posmenopáusicas diabéticas con y sin fractura. Los resultados mostraron una DMO volumétrica integral y trabecular significativamente menor y, también, un menor grosor cortical en las pacientes con fractura. Por tanto, se han evidenciado déficits en la estructura ósea cortical mientras que los resultados sobre estructura ósea trabecular no son concluyentes.
Actualmente existen estudios en marcha de DXA-3D, aunque aún se desconoce si estos parámetros serán útiles para identificar mejor la fragilidad ósea de los pacientes diabéticos.
La técnica denominada microidentación de impacto ha sido empleada en diversos estudios para determinar la calidad ósea en pacientes con DM2. Estos estudios han mostrado peor calidad ósea en los pacientes diabéticos que presentaban valores similares de DMO47. No obstante, por su carácter invasivo no parece un procedimiento que pueda generalizarse a la práctica clínica rutinaria.
Hiperparatiroidismo e hipoparatiroidismoEl hiperparatiroidismo primario (HPT) es una de las enfermedades endocrinas más frecuentes. Una de las manifestaciones clásicas del HPT es la enfermedad ósea. Principalmente en huesos de composición predominante cortical, el exceso de paratohormona puede llevar a osteítis fibrosa quística, manifestándose como dolor óseo y pudiendo ocasionar fracturas. Los signos radiológicos típicos son: resorción subperióstica de falanges medias y distales, cráneo con aspecto moteado o patrón en «sal y pimienta», quistes óseos y tumores pardos en los huesos largos y pelvis. La DMO lumbar y en cadera medida mediante DXA habitualmente está bien preservada, mientras que en el tercio distal del radio, donde el hueso es de tipo cortical, está disminuida48. Este hecho haría pensar en un aumento de fracturas no vertebrales en esta enfermedad; sin embargo, hay muchos estudios que indican que el riesgo de fractura está globalmente aumentado en el HPT49. Es decir, el fenotipo óseo del HPT determinado por DXA es discordante con los datos de estudios de fragilidad ósea, por ello las nuevas tecnologías en fragilidad ósea pueden ser útiles en esta enfermedad8.
El compromiso del hueso trabecular en HPT también ha sido corroborado por TBS50. En un estudio de casos y controles, TBS fue menor en los pacientes con HPT que los controles, a pesar de que no había diferencia en la DMO de la columna vertebral y los niveles de vitamina D eran similares. Además, en esta población de pacientes, TBS se correlacionó significativamente con muchos parámetros de HR-pQCT51. Asimismo se ha objetivado que los pacientes con HPT tienen mayor pérdida de masa ósea tanto en el hueso cortical como en el trabecular. Stein et al. publicaron que se producía una reducción del volumen cortical tanto en el tercio distal del radio como en la tibia52. Además, en el radio mostró una reducción no solo del volumen trabecular, sino también del número y el grosor y aumentó la separación trabecular. En la tibia, las anomalías fueron menos evidentes y solo el volumen trabecular y la separación demostraron reducciones significativas. Los distintos estudios con HR-pQCT confirman la implicación del hueso trabecular en el HPT y son consistentes con las observaciones clínicas del aumento general de fracturas en estos pacientes. El análisis de la segmentación trabecular individual del radio y de la tibia por HR-pQCT han demostrado mayor alteración de la microarquitectura trabecular en mujeres posmenopáusicas con HPT52. Estas alteraciones en la microarquitectura ósea trabecular se tradujeron en una resistencia ósea comprometida como demuestra el análisis de elementos finitos microestructurales.
El hipoparatiroidismo es una enfermedad endocrina poco común caracterizada por una deficiencia crónica o ausencia de paratohormona, lo que produce una disminución muy importante en el remodelado óseo. Los sujetos con hipoparatiroidismo generalmente tienen una DMO medida mediante DXA por encima de la media de su edad en todos los huesos del esqueleto, sobre todo en la columna lumbar. Distintos estudios han manifiesto que no hay diferencias en los valores de TBS entre pacientes con hipoparatiroidismo y controles, y que el valor de TBS en los pacientes con hipoparatiroidismo es muy cercano al valor normal53. La HR-pQCT confirma el aumento en el volumen cortical, pero demuestra una reducción del grosor cortical, asociado con una menor porosidad de la corteza en pacientes con hipoparatiroidismo53. Las discrepancias han sido observadas con respecto al fenotipo óseo trabecular. Rubin et al.54 informaron de un aumento del grosor trabecular en los pacientes con hipoparatiroidismo en comparación con los controles, mientras que Cusano et al.55 reportaron un menor grosor trabecular en esos pacientes. Esto puede explicarse en parte por las diferencias técnicas para la medición del compartimento trabecular53. No está claro cómo estos cambios estructurales pueden afectar a la resistencia ósea o al riesgo de fractura56.
Resumen y conclusionesSolo entre el 40% y el 50% de los pacientes que sufren una fractura por fragilidad tienen osteoporosis densitométrica, siendo la distribución tridimensional del contenido mineral de hueso cortical y trabecular un componente determinante en la resistencia a la fractura.
Los métodos directos que miden la calidad ósea como la microindentación son invasivos, los resultados difieren entre diversas cohortes y resultan inconsistentes con las propiedades mecánicas del hueso. La QCT permite una evaluación no solo de la DMO sino también de la estructura y fuerza de la microarquitectura ósea in vivo tanto del compartimento cortical como del trabecular. Los nuevos avances en densitometría con incorporación de software para la estimación de la microarquitectura trabecular a nivel lumbar (TBS) o para la reconstrucción en formato 3D de la densidad interna del fémur con obtención de parámetros estructurales a partir de imágenes planares de DXA (DXA-3D) así como la evaluación de fracturas vertebrales (VFA) conllevan como ventajas un menor coste y una menor exposición de radiación del paciente.
El desarrollo de nuevas tecnologías que determinen la calidad ósea y el riesgo de fractura en los pacientes con DM2 o con hiperparatiroidismo primario es de gran interés por las características inherentes a la afectación ósea en estas enfermedades. En la actualidad la técnica mejor validada es el TBS que ya puede utilizarse en la práctica clínica y combinarse con la escala FRAX. No obstante, se necesitan más estudios de carácter prospectivo para determinar su importancia en el manejo de estos pacientes.
Conflicto de interesesNinguno de los autores presenta conflictos de interés relevantes para esta actividad. No se ha recibido financiación específica para la elaboración de este documento.