Existen diversas controversias respecto a las pruebas diagnósticas y tratamiento de la pubertad precoz central (PPC). El objetivo de este estudio es exponer las experiencias adquiridas en un grupo de niñas con PPC tratadas con triptorelina, analizándose las características auxológicas y pruebas diagnósticas.
Materiales y métodosEstudio observacional retrospectivo en un grupo de 60 niñas con PPC atendidas entre 2010 y 2017. Al diagnóstico se registraron datos sociodemográficos, auxológicos y hormonales, realizándose ecografía pélvica y resonancia craneal. Fueron tratadas con triptorelina, y tras su retirada fueron seguidas hasta la menarquia.
ResultadosAl iniciar el tratamiento, la edad cronológica y edad ósea eran de 7,7±0,7 y 9,7±0,8 años, respectivamente (media±DE), con una velocidad de crecimiento de 8,3±1,6cm/año. La talla diana era de 161,1±5,8cm. El pico de LH tras estimulación era de 16,6±12,1 UI/l. El volumen ovárico era superior a 3 cc en el 35% de los casos. La resonancia magnética craneal fue patológica en 7 casos (11,7%). Al final del tratamiento, la edad cronológica y la edad ósea eran de 10,3±1,1 y 11,2±0,8 años, respectivamente, con una velocidad de crecimiento de 4,7±1,4cm/año. A la edad de la menarquia (11,9±0,9 años), la talla era de 157,5±5,7cm.
ConclusionesEl tratamiento de la PPC con triptorelina parece resultar beneficioso. La posibilidad de bloquear el desarrollo puberal y ralentizar la maduración ósea permiten que las pacientes alcancen su talla diana. No obstante, sería preceptiva una monitorización auxológica personalizada.
There are several controversies regarding the diagnostic tests and management of central precocious puberty (CPP). The aim of this study is to present the experience acquired in a group of girls with CPP treated with triptorelin, and to analyze the auxological characteristics and diagnostic tests.
Material and methodsAn observational, retrospective study in a group of 60 girls with CPP was conducted between January 2010 and December 2017. Sociodemographic, auxological and hormonal data were recorded at diagnosis, and pelvic ultrasound and magnetic resonance imaging of the head were performed. Girls were treated with triptorelin and monitored after treatment discontinuation until menarche.
ResultsAt treatment start, chronological age and bone age were 7.7±0.7 and 9.7±0.8 years respectively, and growth velocity was 8.3±1.6cm/year. Target height was 161.1±5.8cm. Peak LH level after stimulation was 16.6±12.1 IU/l. Ovarian volumes were greater than 3mL in 35% of cases. MRI of the head was pathological in seven girls (11.7%). At treatment completion, chronological age and bone age were 10.3±1.1 and 11.2±0.8 years respectively, and growth velocity was 4.7±1.4cm/year. At the age of menarche (11.9±0.9 years), height was 157.5±5.7cm.
ConclusionsTreatment of CPP with triptorelin appears to be beneficial. The possibility to block pubertal development and slow skeletal maturation allows patients to reach their target height. However, individualized auxological monitoring would be mandatory.
La pubertad precoz se define clásicamente como la aparición y desarrollo progresivo de los caracteres sexuales antes de los 8 años en niñas y 9 años en niños, acompañándose de un adelanto de la edad ósea y aceleración de la velocidad de crecimiento1-3.
A pesar de los avances en el estudio de la pubertad precoz central todavía existen controversias respecto a la idoneidad de las pruebas complementarias a realizar para su diagnóstico y, especialmente, para iniciar e interrumpir su tratamiento. Si bien se admite como prueba de referencia diagnóstica la determinación de LH tras estímulo, el avance en las técnicas de inmunoanálisis ha motivado que distintos autores hayan planteado la utilidad de la LH basal como método de cribado4–9. Respecto a las pruebas de imagen, si bien se admite que la ecografía pélvica es imprescindible, no existe unanimidad sobre la variable anatómica con mayores ventajas diagnósticas10–12; y, desde luego, la prescripción rutinaria de estudios de neuroimagen en las niñas con pubertad precoz central (PPC) es un tema ampliamente debatido3,13,14. Además, la ausencia de ensayos clínicos aleatorizados con análogos de hormona liberadora de gonadotropinas (aLHRH) en el tratamiento de la PPC hace que la evidencia científica en este campo dependa, en gran medida, de los estudios descriptivos (series amplias, metaanálisis, etc.)3,15–18.
El objetivo del presente trabajo consiste en exponer la experiencia adquirida en un grupo de niñas con pubertad precoz central que fueron tratadas con triptorelina, analizándose los resultados de las pruebas diagnósticas, así como la evolución de las características clínico-auxológicas.
Material y métodosSe trata de un estudio descriptivo longitudinal de carácter retrospectivo que incluye a todas las niñas menores de 8 años de edad diagnosticadas de pubertad precoz central, sin exclusión de ningún caso, y que fueron atendidas en una de las consultas externas de la Unidad de Endocrinología Pediátrica del Complejo Hospitalario de Navarra durante el periodo de tiempo comprendido entre enero de 2010 y diciembre de 2017.
En la primera consulta se registraron datos sociodemográficos (sexo, etnia y/o continente de origen, situación de adopción), familiares (talla paterna/materna, edad de menarquia materna) y clínico-auxológicos (edad al inicio de los síntomas, peso y talla, índice de masa corporal [IMC], edad ósea y velocidad de crecimiento). Se calcularon la talla diana y el pronóstico de talla adulta. A la totalidad de pacientes se realizaron determinaciones basales de estradiol, lutropina (LH) y folitropina (FSH), y de FSH y LH a las 4 h de la administración de 500 mcg de leuprorelina endovenosa mediante inmunoquimioluminiscencia, considerándose diagnóstico el punto de corte del pico de LH de 5 UI/l4. Asimismo, se realizaron estudios de imagen: ecografía pélvica, considerándose que un volumen ovárico de ≥ 3 cc apoyaría una activación del eje hipotalámico-hipofisario-ovárico10, y resonancia magnética craneal.
Tras el diagnóstico se prescribió triptorelina intramuscular en su fórmula depot mensual (80mg/kg/dosis) y se realizó un seguimiento evolutivo (controles semestrales) que incluía las siguientes variables: edad cronológica, dosis de triptorelina, peso y talla, índice de masa corporal, edad ósea, velocidad de crecimiento y pronóstico de talla adulta.
Las pacientes fueron seguidas periódicamente tras la retirada del tratamiento hasta que presentaron la menarquia, registrándose las siguientes variables: edad de la menarquia, tiempo transcurrido entre la finalización del tratamiento y la menarquia y talla en el momento de la menarquia.
Las valoraciones de peso y talla fueron realizadas en ropa interior y descalzas. El peso se midió con una báscula Año-Sayol con un intervalo de lectura de 0 a 120kg y una precisión de 100g, y la talla con un estadiómetro de pared Holtain de 60 a 210cm, con un intervalo de precisión de 0,1cm. La edad ósea y el pronóstico de talla adulta fueron calculadas mediante el método RUS-TW2.
Los valores de los Z-score de los pesos, tallas, IMC respecto a su edad cronológica y velocidad de crecimiento se calcularon con el programa Aplicación Nutricional de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (disponible en http://www.gastroinf.es/nutritional/), tomándose como referencia las tablas de crecimiento de Ferrández et al. (Centro Andrea Prader, Zaragoza 2002)19.
Los resultados se expresan como porcentajes (%) y medias±desviación estándar (DE). El análisis estadístico (estadística descriptiva, t de Student, ANOVA y correlación de Pearson) fue realizado mediante el programa informático Statistical Packages for the Social Sciences versión 20.0 (Chicago, Illinois, EE. UU.). La significación estadística fue asumida cuando el valor de p era inferior a 0,05.
En todos los casos los padres y/o tutores legales fueron informados y dieron su consentimiento para la participación en el estudio. Este estudio fue aprobado por el Comité de Ética Asistencial del Complejo Hospitalario de Navarra (de acuerdo con los estándares éticos establecidos en la Declaración de Helsinki de 1964 y enmiendas posteriores).
ResultadosLa muestra estaba formada por 60 niñas con edades comprendidas entre 5,4 y 7,6 años. La aparición del botón mamario estaba presente en todas ellas, bien de forma bilateral (n=56) o unilateral (n=4); siendo mucho menos frecuente la presencia de vello púbico (n=12) o axilar (n=6).
El 76,7% (n=46) de las pacientes eran de origen europeo (etnia caucásica), mientras que el resto procedían de distintos continentes: 7 de África (11,7%), 6 de América del Sur (10%) y una de Asia (1,6%). El 11,7% de las pacientes (n=7) eran adoptadas.
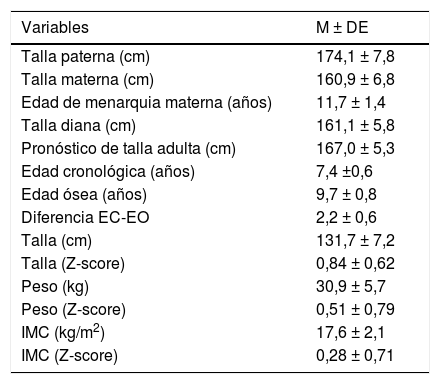
En la tabla 1 se exponen los valores medios de las variables auxológicas familiares y personales registradas en la primera consulta. El pronóstico de talla adulta superaba significativamente a la talla diana (P<0,05).
Valores medios de las variables auxológicas familiares y personales registradas en la primera consulta
| Variables | M ± DE |
|---|---|
| Talla paterna (cm) | 174,1 ± 7,8 |
| Talla materna (cm) | 160,9 ± 6,8 |
| Edad de menarquia materna (años) | 11,7 ± 1,4 |
| Talla diana (cm) | 161,1 ± 5,8 |
| Pronóstico de talla adulta (cm) | 167,0 ± 5,3 |
| Edad cronológica (años) | 7,4 ±0,6 |
| Edad ósea (años) | 9,7 ± 0,8 |
| Diferencia EC-EO | 2,2 ± 0,6 |
| Talla (cm) | 131,7 ± 7,2 |
| Talla (Z-score) | 0,84 ± 0,62 |
| Peso (kg) | 30,9 ± 5,7 |
| Peso (Z-score) | 0,51 ± 0,79 |
| IMC (kg/m2) | 17,6 ± 2,1 |
| IMC (Z-score) | 0,28 ± 0,71 |
EC: edad cronológica; EO: edad ósea; IMC: índice de masa corporal; M ± DE: media ± desviación estándar.
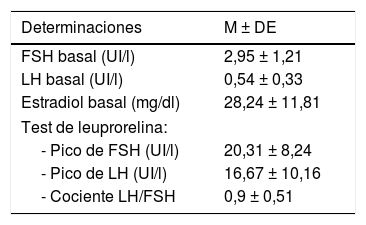
En la tabla 2 se exponen los valores medios de los niveles basales FSH, LH y estradiol; y de FSH, LH y cociente LH/FSH tras el test de leuprorelina. En el 61,4% de los casos (n=35) el cociente LH/FSH tras estimulación con leuprorelina era superior a 0,6. No existía correlación entre los niveles basales de LH con el pico de LH y el cociente LH/FSH tras la estimulación.
Valores medios basales y tras estimulación con leuprorelina de FSH, LH y estradiol
| Determinaciones | M ± DE |
|---|---|
| FSH basal (UI/l) | 2,95 ± 1,21 |
| LH basal (UI/l) | 0,54 ± 0,33 |
| Estradiol basal (mg/dl) | 28,24 ± 11,81 |
| Test de leuprorelina: | |
| - Pico de FSH (UI/l) | 20,31 ± 8,24 |
| - Pico de LH (UI/l) | 16,67 ± 10,16 |
| - Cociente LH/FSH | 0,9 ± 0,51 |
M ± DE: media ± desviación estándar.
En el estudio ecográfico pélvico se objetivaba un volumen ovárico máximo inferior a 3 cc en el 65,5% de los casos (n=39), mientras que en el 35% restante (n=21) el volumen ovárico superaba esta cifra.
La resonancia magnética craneal fue normal en el 83,3% de los casos (n=53), y en los 7 casos restantes se constataron diferentes hallazgos radiológicos: quiste de la glándula pineal (2 casos), quiste aracnoideo en línea media de fosa posterior (un caso), quiste aracnoideo parasagital derecho a nivel parietal (un caso), engrosamiento seudonodular del tallo hipofisario (un caso), hidrocefalia residual tras resección quirúrgica de tumor cerebeloso (un caso) e hidrocefalia secundaria a patología perinatal (un caso).
En el 96,7% de los casos (n=58) se prescribió tratamiento con triptorelina intramuscular en su fórmula depot mensual, siendo la dosis media inicial de 81,3±0,7 mcg/kg y la duración media del tratamiento de 2,5±0,9 años. Dos pacientes no recibieron tratamiento por decisión familiar. Una de ellas tuvo la menarquia a los 9,8 años de edad (edad ósea: 13,4 años) y actualmente con 14,1 años de edad tiene una talla de 147cm (talla diana: 161,5cm); y la otra paciente tuvo la menarquia a los 10,7 años de edad (edad ósea: 13,1 años) y actualmente con 13,4 años de edad tiene una talla de 160cm (talla diana: 158,5cm).
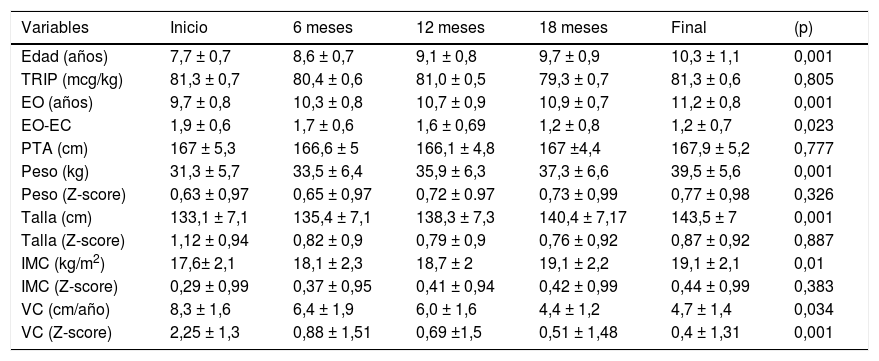
En la tabla 3 se exponen los valores medios de las variables auxológicas personales registradas en la primera consulta y a lo largo del tratamiento con triptorelina. La diferencia entre la edad ósea y la edad cronológica se redujo significativamente (p=0,023) a lo largo del tratamiento. Tanto las dosis de triptorelina como el pronóstico de talla adulta se mantuvieron constantes a lo largo del tratamiento. Aunque el incremento de los valores absolutos del peso, talla e IMC eran significativos; sin embargo no existían diferencias significativas entre los valores medios de peso (Z-score), talla (Z-score) e IMC (Z-score) respecto a su edad cronológica. La velocidad de crecimiento se fue reduciendo significativamente (p=0,001) a lo largo del tratamiento.
Valores medios de las variables auxológicas registradas desde el inicio hasta el final del tratamiento con triptorelina (M ± DE)
| Variables | Inicio | 6 meses | 12 meses | 18 meses | Final | (p) |
|---|---|---|---|---|---|---|
| Edad (años) | 7,7 ± 0,7 | 8,6 ± 0,7 | 9,1 ± 0,8 | 9,7 ± 0,9 | 10,3 ± 1,1 | 0,001 |
| TRIP (mcg/kg) | 81,3 ± 0,7 | 80,4 ± 0,6 | 81,0 ± 0,5 | 79,3 ± 0,7 | 81,3 ± 0,6 | 0,805 |
| EO (años) | 9,7 ± 0,8 | 10,3 ± 0,8 | 10,7 ± 0,9 | 10,9 ± 0,7 | 11,2 ± 0,8 | 0,001 |
| EO-EC | 1,9 ± 0,6 | 1,7 ± 0,6 | 1,6 ± 0,69 | 1,2 ± 0,8 | 1,2 ± 0,7 | 0,023 |
| PTA (cm) | 167 ± 5,3 | 166,6 ± 5 | 166,1 ± 4,8 | 167 ±4,4 | 167,9 ± 5,2 | 0,777 |
| Peso (kg) | 31,3 ± 5,7 | 33,5 ± 6,4 | 35,9 ± 6,3 | 37,3 ± 6,6 | 39,5 ± 5,6 | 0,001 |
| Peso (Z-score) | 0,63 ± 0,97 | 0,65 ± 0,97 | 0,72 ± 0.97 | 0,73 ± 0,99 | 0,77 ± 0,98 | 0,326 |
| Talla (cm) | 133,1 ± 7,1 | 135,4 ± 7,1 | 138,3 ± 7,3 | 140,4 ± 7,17 | 143,5 ± 7 | 0,001 |
| Talla (Z-score) | 1,12 ± 0,94 | 0,82 ± 0,9 | 0,79 ± 0,9 | 0,76 ± 0,92 | 0,87 ± 0,92 | 0,887 |
| IMC (kg/m2) | 17,6± 2,1 | 18,1 ± 2,3 | 18,7 ± 2 | 19,1 ± 2,2 | 19,1 ± 2,1 | 0,01 |
| IMC (Z-score) | 0,29 ± 0,99 | 0,37 ± 0,95 | 0,41 ± 0,94 | 0,42 ± 0,99 | 0,44 ± 0,99 | 0,383 |
| VC (cm/año) | 8,3 ± 1,6 | 6,4 ± 1,9 | 6,0 ± 1,6 | 4,4 ± 1,2 | 4,7 ± 1,4 | 0,034 |
| VC (Z-score) | 2,25 ± 1,3 | 0,88 ± 1,51 | 0,69 ±1,5 | 0,51 ± 1,48 | 0,4 ± 1,31 | 0,001 |
EO: edad ósea; IMC: índice de masa corporal; M ± DE: media ± desviación estándar; PTA: pronóstico de talla adulta; TRIP: triptorelina; VC: velocidad de crecimiento.
La edad media de la menarquia ha sido de 11,9±0,9 años. El tiempo medio transcurrido entre la finalización del tratamiento y la aparición de la menarquia ha sido de 18,3 meses (rango: 12-28 meses). El valor medio de la talla en el momento de la menarquia era de 157,5±4,8cm. La velocidad media de crecimiento entre la finalización del tratamiento y la menarquia fue de 9,3±3,1cm/año, siendo el incremento medio de la talla durante este periodo de 13,9±2,6cm.
DiscusiónLa experiencia acumulada en este trabajo permite advertir que el diagnóstico de la pubertad precoz sigue siendo subsidiario, en última instancia, del test de estimulación con GnRH (o análogos de LHRH), dado que las pruebas complementarias (LH basal y/o ecografía gonadal) adolecen de una sensibilidad y/o especificidad suficientes para proporcionar una seguridad diagnóstica. Y por otra parte, también permite intuir que el tratamiento con triptorelina, al bloquear el desarrollo puberal y ralentizar la maduración ósea, propicia que las pacientes alcancen su talla diana.
Las bases genéticas de la pubertad precoz son complejas y están todavía parcialmente dilucidadas. En la última década se han identificado mutaciones en diferentes genes capaces de expresar una precocidad sexual patológica. Por ejemplo, se han descrito diferentes mutaciones en el gen MKRN3 y, con menor frecuencia, en el gen de kisspeptina (KISS1) y de su receptor (KISS1R) asociadas a pubertad precoz central20,21. Además, se han descrito diversas anomalías cromosómicas (síndrome de Williams-Beuren, síndrome de Silver-Rusell, síndrome de Prader-Willi, síndrome de Rett, etc.) asociadas en grado variable a una precocidad sexual central22. En este estudio no se han realizado estudios moleculares y, en ningún caso, se apreciaron rasgos dismórficos sospechosos de alteraciones sindrómicas y/o cromosómicas.
La determinación de LH tras estímulo con GnRH (o análogos de LHRH) constituye la prueba de referencia para el diagnóstico de la pubertad precoz central3,5,16; no obstante, existe controversia respecto al punto de corte del pico de LH a partir del cual habría que considerar la existencia de una activación de la pubertad. Actualmente se admite como punto de corte unos valores que oscilan entre 5 y 10 UI/l según el método utilizado (en este estudio al emplearse la inmunoquimioluminiscencia se utilizó un punto de corte de 5 UI/l)4. En los últimos años, debido a la mayor sensibilidad de las técnicas que cuantifican las gonadotropinas basales ha surgido el debate sobre la utilidad de la LH basal como método de cribado. Se han propuesto distintos puntos de corte según el inmumoensayo utilizado, que oscilan entre 0,2 y 1,5 UI/l, pero la variabilidad en su sensibilidad y especificidad hace difícil diferenciar entre pacientes prepúberes y aquellos que presentan una activación precoz de la pubertad, especialmente en los estadios iniciales4–9,23. Por ello, la mayoría de los autores no consideran la determinación exclusiva de la LH basal como prueba de referencia diagnóstica4,6–9. Si tomáramos como referencia los puntos de corte de LH basal propuestos por aquellos autores que han utilizado para su determinación inmunoquimioluminiscencia (entre 0,1 y 0,3 UI/l)4,7,9,23 –tal y como fue utilizado en nuestro laboratorio–, en el 84,2% y 55,4% de los casos los valores de LH basal obtenidos eran superiores a 0,1 UI/l y 0,3 UI/l, respectivamente; lo que podría dar cierto valor como screening a la LH basal, pero sin poder obviar la estimulación con GnRH. Por último, cabe comentar que diversos autores han sugerido la valoración del cociente LH/FSH tras estímulo como indicador de inicio puberal cuando su valor supera la cifra de 0,6 en las niñas. Sin embargo, actualmente se considera a este cociente de baja utilidad diagnóstica24 y, de hecho, en este estudio tan solo fue detectado en el 61,4% de los casos.
La ecografía pélvica ayuda a valorar los efectos estrogénicos sobre el tamaño y morfología uterina y ovárica; siendo imprescindible su realización en todos los casos de pubertad precoz. No existe unanimidad respecto a la variable anatómica con mayores ventajas diagnósticas; mientras que algunos autores refieren que el volumen uterino sería la variable con mayor sensibilidad/especificidad11, para otros autores un volumen ovárico superior a 3,15 cc12 o 3,35 cc10 apoyaría la existencia de una activación del eje hipotalámico-hipofisario-ovárico. En este estudio, tan solo el 35% de las pacientes presentaban un volumen ovárico que superaba estos valores. No obstante, conviene reseñar que la ausencia de signos ecográficos de impregnación estrogénica no excluye la sospecha de la activación del eje hormonal ya que en los primeros meses del desarrollo puberal dicha activación es progresiva, e incluso oscilante25.
En los varones con precocidad puberal de origen central es preceptiva la realización de una resonancia magnética craneal dada su elevada prevalencia de patología endocraneal3,16,26-28 sin embargo, en las niñas su prescripción es motivo de controversia. Mientras que algunos autores ponen en duda la necesidad de incluir como exploración rutinaria los estudios de neuroimagen en las niñas con PPC, sobre todo en edades superiores a los 6 años13,14; otros autores recomiendan seguir realizando resonancia magnética craneal en todos los casos, independientemente del sexo del paciente, ya que las características clínico-auxológicas y hormonales de estos pacientes presentan dificultades de sensibilidad/especificidad como factores predictivos en el diagnóstico de una pubertad precoz central de causa orgánica26,29. En la totalidad de pacientes incluidas en este estudio se realizó una resonancia magnética craneal. Si bien dos pacientes presentaban patología neurológica conocida (hidrocefalia), los estudios de neuroimagen permitieron objetivar hallazgos estructurales anormales en otras cinco niñas que, salvo el caso de engrosamiento del tallo hipofisario, han sido relacionados con la precocidad sexual16.
La imposibilidad para llevar a cabo estudios aleatorizados y controlados dificulta establecer unos criterios uniformes tanto para iniciar como para interrumpir el tratamiento con análogos de GnRH en pacientes con pubertad precoz central. Sin embargo, la experiencia acumulada indica que el efecto beneficioso del tratamiento sobre el pronóstico de talla adulta parece estar inversamente relacionado con la edad de inicio del frenado puberal, y que, desde luego, no parece existir una mejoría en la talla final cuando el tratamiento se inicia más allá de los 8 años de edad cronológica en las niñas3,18,26,30,31. En todas las pacientes incluidas en este estudio los signos de desarrollo puberal tuvieron lugar antes de los 8 años de edad cronológica, siendo la aparición del botón mamario bilateral junto con un incremento significativo de la velocidad de crecimiento las manifestaciones clínicas más relevantes. El adelanto de la maduración ósea era de 1,9 años por encima de la edad cronológica; aunque cabe advertir que cuando la consulta se realiza precozmente podría no apreciarse todavía dicha aceleración ósea. En ningún caso los padres referían trastornos emocionales y/o conductuales asociados al desarrollo puberal precoz de las pacientes –quizás por la rapidez del estudio y prontitud del diagnóstico–, salvo en los dos casos que se asociaban con hidrocefalia, aunque podría ser debido a la comorbilidad con que pueden acompañarse los trastornos neurológicos. Aunque entre los criterios para iniciar el tratamiento con análogos de GnRH suele incluirse el pronóstico de la talla final de las pacientes respecto a sus tallas diana, habitualmente se evidencia –tal y como también ocurría en este estudio– que en el momento del diagnóstico la predicción de la talla adulta supera a la talla diana condicionado, a pesar de la aceleración ósea, por el significativo incremento de la velocidad de crecimiento para la edad de las pacientes.
Es conocido que no todas las pacientes necesitarían tratamiento frenador de la pubertad y, de hecho, entre las pacientes incluidas en este trabajo que no llegaron a recibir tratamiento una de ellas ya superaba su talla diana a los 13,4 años de edad. Si bien no existen determinaciones hormonales con un valor predictivo de la aceleración del desarrollo puberal en estas pacientes32, recientemente se ha sugerido que el análisis combinado de la hormona antimulleriana y la inhibina B podría ser utilizado como potencial biomarcador de la aceleración madurativa en la pubertad precoz33. No obstante, en los casos de lesiones orgánicas acompañantes la indicación del tratamiento con análogos está ampliamente aceptada, ya que generalmente son pubertades rápidamente progresivas18,31.
Quizás merezcan una mención aparte los casos de adopción y/o de etnias distintas a la nuestra, habiéndose calificado la adopción internacional como un factor de riesgo para desarrollar una precocidad puberal3,18. Las niñas adoptadas –además de su probable procedencia de distinta etnia– suelen presentar una recuperación de peso y talla que podría implicar un desarrollo puberal precoz y/o avanzado; y también habría que considerar las características del crecimiento y desarrollo autóctonos de su lugar de origen más que las de la población adoptiva. En este estudio, el 23,3% de los casos procedían de etnias no europeas; no obstante, ante la falta de documentación aborigen validada fueron atendidas siguiendo las tablas de referencia nacionales.
La totalidad de las pacientes incluidas en este estudio fueron tratadas con triptorelina intramuscular en su forma depot mensual dada su tolerabilidad, eficacia y seguridad contrastadas. De hecho, en las pacientes se ha objetivado una supresión del desarrollo y/o regresión del botón mamario junto a una disminución de la velocidad de crecimiento hasta niveles prepuberales; pero lo más importante a resaltar sería el significativo enlentecimiento del ritmo de la maduración ósea que presentaron estas pacientes, lo que ha permitido que a lo largo del periodo de tratamiento el pronóstico de talla adulta se mantuviera constante. La duración y/o retirada del tratamiento constituye otro motivo de controversia. Se han propuesto diversas variables para determinar el momento óptimo de la retirada del tratamiento, tales como la edad cronológica, la edad ósea, la velocidad de crecimiento, así como la relación entre la talla alcanzada y la talla diana18,20; siendo la edad ósea, la talla alcanzada y, sobre todo, el crecimiento residual tras suspender el tratamiento los factores más determinantes de la talla adulta17,34. Por ello, distintos autores aconsejan la retirada del tratamiento cuando la edad ósea alcance los 11,5 años en las niñas (y 12,5 años en los varones) con objeto de permitir que puedan presentar un «nuevo» estirón puberal tras su suspensión. Aunque el análisis de los casos es retrospectivo y no existía una definición previa y muy concreta de los criterios para su retirada, se procuró que la edad ósea no superase los 11,5 años. No obstante, entendemos que estas pacientes exigen una motorización individualizada. En este estudio el valor medio de la edad ósea al término del tratamiento era de 11,2 años; y el tiempo medio transcurrido desde el término del tratamiento hasta la menarquia fue de 18 meses, siendo este periodo de gran importancia porque sería cuando tendría lugar el crecimiento residual potencial que debería permitirles alcanzar, cuanto menos, su talla diana. De hecho, en este estudio se constataba cómo durante este intervalo de tiempo la velocidad media de crecimiento era de 9,3cm/año, lo que permitió un incremento medio de talla de 13,9cm. Como curiosidad, que no se refleja en la literatura revisada, cabe señalar que la edad media de la menarquia de las pacientes tras el tratamiento con triptorelina era prácticamente similar a la edad media de la menarquia de sus madres, lo que apoyaría –junto con la talla alcanzada– que el tratamiento habría resultado beneficioso para las pacientes.
Dentro de las limitaciones de este estudio destacar el carácter retrospectivo, así como la ausencia de grupo control y de información sobre la talla final y/o adulta de las pacientes. No obstante, conviene tener presente que el valor medio de la talla de las pacientes en el momento de la menarquia estaba muy próxima al de la talla diana y, obviamente, cabe considerar que el crecimiento y desarrollo todavía no estaban concluidos definitivamente. También cabe señalar que el pronóstico de talla adulta de las pacientes en el momento del diagnóstico y, en este estudio, también al término del mismo, probablemente podría estar sobrevalorado por condicionantes clínicos y auxológicos; aunque lo que parece evidente es que estas pacientes acabarían alcanzando una talla adulta similar a su talla diana.
ConclusionesA pesar de la ausencia de ensayos clínicos aleatorizados con análogos de LHRH –en este caso con triptorelina– en la pubertad precoz central, sus efectos parecen resultar beneficiosos, ya que al bloquear el desarrollo puberal y ralentizar la maduración ósea permiten que las pacientes alcancen su talla diana. No obstante, dadas las controversias respecto a las indicaciones del comienzo y retirada del tratamiento sería preceptivo disponer de una monitorización clínica-auxológica personalizada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.