Evaluar la seguridad y el rendimiento diagnóstico de la medición de PTH en el lavado del aspirado (PTHa) de posibles adenomas de paratiroides en pacientes con hiperparatiroidismo primario.
MetodologíaEstudio observacional retrospectivo en 47 pacientes (74% mujeres; edad media: 57,7±11,2 años) atendidos en consultas de endocrinología por hiperparatiroidismo primario (calcemia: 11,6±1,6mg/dl y PTH plasmática: 276±477pg/ml), a los cuales se les realiza PAAF para medir la PTHa. Se analiza la seguridad de la técnica y se calculan la sensibilidad, la especificidad y los valores predictivos positivo y negativo en los pacientes intervenidos.
ResultadosSe punzaron 47 lesiones (diámetro medio: 1,8±2,6cm) por: ausencia de lesiones en la gammagrafía (26 pacientes), discordancia entre gammagrafía y ecografía (6 pacientes), sospecha de adenomas intratiroideos (4 pacientes), positividad gammagráfica en más de una localización (4 pacientes), lesiones ectópicas (3 pacientes), enfermedad persistente (2 pacientes) y adenomas atípicos (2 pacientes). El nivel promedio de PTHa fue de 2.853±3.957pg/ml, considerándose positivo (PTHa≥100pg/ml) el 68% de los casos. No hubo complicaciones durante ni tras la punción. Se intervinieron 37 pacientes, curándose el 95%, y no se ha detectado ningún caso de paratiromatosis. La PTHa>100pg/ml presenta una sensibilidad del 93,7%, una especificidad del 100%, un valor predictivo positivo del 100% y un valor predictivo negativo del 71,4%.
ConclusiónEn pacientes con hiperparatiroidismo primario la medición de PTHa es una técnica diagnóstica sencilla, segura y con una elevada sensibilidad y especificidad que permite diferenciar entre adenomas paratiroideos y otras lesiones cervicales.
To evaluate the safety and diagnostic performance of parathyroid hormone assay in fine-needle aspirate (PTH-FNA) in patients with primary hyperparathyroidism and suspicious parathyroid adenomas.
MethodologyA retrospective observational study was performed in 47 patients (57.7±11.2 years of average age, 74% women) attending an endocrinology clinic for primary hyperparathyroidism (average calcemia: 11.6±1.6mg/dl and PTH: 276±477pg/ml) in which PTH-FNA was made. Sensibility, specificity, positive predictive value and negative predictive value were calculated in all surgical patients.
ResultsForty-seven lesions were punctured (mean adenoma maximum diameter: 1.8±2.6cm): negative image in the sestamibi scan (26 patients); the discordance between ultrasonography and the sestamibi scan (6 patients); possible intrathyroidal adenomas (4 patients); a positive sestamibi scan in 2 or more localizations (4 patients); ectopic adenoma (3 patients); persistent primary hyperparathyroidism (2 patients) and atypical adenomas (2 patients). Mean PTH-FNA was 2,853±3,957pg/ml and 68% were considered positive (PTH-FNA≥100pg/ml). No complications were detected during or after the puncture. Thirty-seven patients were operated on, 95% were cured and no parathyromatosis cases were detected. PTH-FNA≥100pg/ml as a diagnostic test had a sensitivity of 93.7%, a specificity of 100%, a positive predictive value of 100% and an negative predictive value of 71.4%.
ConclusionPTH-FNA is an easy and safe diagnostic test and has a high sensitivity and specificity for differentiating between parathyroid adenomas and other cervical masses in patients with primary hyperparathyroidism.
El hiperparatiroidismo primario (HPTP) es un trastorno endocrinológico frecuente, caracterizado por una secreción excesiva de hormona paratiroidea (PTH), procedente de una o más glándulas paratiroideas. Actualmente la forma de presentación más habitual (80%) es la asintomática, con hipercalcemia leve o intermitente y ausencia de síntomas y signos clásicos como litiasis, nefrocalcinosis u osteítis fibrosa quística. El diagnóstico bioquímico del HPTP es generalmente sencillo y se establece mediante la detección de hipercalcemia (de magnitud variable) y concentraciones elevadas o inapropiadamente normales de PTH, asociándose con frecuencia a hipofosfatemia, hipercalciuria y aumento moderado de marcadores de remodelado óseo1–3.
Si bien las técnicas de imagen no deben utilizarse para excluir o confirmar el diagnóstico de HPTP ni para establecer la indicación de tratamiento quirúrgico, en la actualidad la mayoría de las Guías de Práctica Clínica recomiendan su realización antes de la cirugía4–6, con los objetivos de posibilitar la paratiroidectomía mínimamente invasiva y facilitar la detección de nódulos tiroideos, los cuales son detectados en el 15-60% de los pacientes con HPTP7–9. En la actualidad, las técnicas de localización de referencia son la gammagrafía paratiroidea con Tc99 sestamibi (gammagrafía 99mTc-MIBI) (asociada o no a SPECT), con una sensibilidad diagnóstica en torno al 80%, y la ecografía cervical, con una sensibilidad muy variable que oscila entre el 55 y el 88%, dependiendo de la experiencia del examinador, el tamaño del adenoma, la frecuencia de lesiones ectópicas, la coexistencia de bocio multinodular y la presencia de ganglios linfáticos u otras lesiones cervicales que pudieran confundirse con adenomas paratiroideos1,9,10, siendo la combinación de ambas técnicas la estrategia que mejores resultados ofrece6,9–11. Sin embargo, la gammagrafía 99mTc-MIBI puede arrojar resultados falsos positivos (FP) en presencia de nódulos tiroideos y falsos negativos (FN) en casos de adenomas paratiroideos de pequeño tamaño, presencia de necrosis en el adenoma o coexistencia de enfermedad tiroidea autoinmune4,6,9,12. En este sentido, en un reciente estudio realizado en nuestro medio el 26% de los pacientes estudiados en consultas de endocrinología por HPTP no muestran lesiones en la gammagrafía 99mTc-MIBI9.
En pacientes con estudios de imagen discordantes o con gammagrafía 99mTc-MIBI negativa y con ecografía de localización paratiroidea positiva, diversos autores han propuesto realizar una punción aspiración con aguja fina (PAAF) para la medición de PTH en el lavado del aspirado (PTHa), ya que se trata de una técnica diagnóstica sencilla, segura, barata y altamente específica para confirmar prequirúrgicamente la localización de adenomas paratiroideos, distinguiendo entre lesiones paratiroideas y otro tipo de lesiones6,13–21. Sin embargo, la información disponible en la actualidad sobre la seguridad y eficacia diagnóstica de esta técnica está basada en un limitado número de estudios con escasos pacientes, realizados todos ellos fuera de España13–23. Por este motivo, el objetivo principal del estudio ha sido evaluar la seguridad y el rendimiento diagnóstico de la medición de PTHa en nuestra serie de pacientes con HPTP.
Material y métodosEstudio observacional retrospectivo en el que se evalúan las pruebas diagnósticas realizadas a 195 pacientes con criterios bioquímicos de HPTP atendidos en consulta de endocrinología entre enero de 2013 y enero de 2020, seleccionándose los casos en los cuales se realizó PAAF para la medición de PTHa por presentar lesiones sospechosas de adenomas de paratiroides. El estudio fue aprobado por el Comité de Ética de la Investigación de Cádiz y no se ha requerido obtener consentimiento informado para acceder a la información de la investigación, si bien todos los pacientes firmaron los correspondientes consentimientos informados antes de realizar la PAAF o de someterse a cirugía paratiroidea.
Evaluación analítica y de estudios de imagenEn todos los pacientes se determinaron los niveles de calcio, fósforo, proteínas totales, urea, creatinina, PTH, 25-OH-vitamina D y calciuria. La concentración de calcio sérico fue ajustada por el nivel de proteínas plasmáticas. Los niveles de PTH en plasma y en el PTHa fueron medidos mediante análisis inmunológico in vitro por electroquimioluminiscencia en un analizador automático Elecsys® E170 (Roche Diagnostics) (niveles de referencia plasmáticos: 15-65pg/ml).
En los casos de HPTP confirmado se realizó, en consultas de endocrinología, una ecografía cervical de localización utilizando los ecógrafos Sonosite MicroMaxx® e Hitachi Aloka® F37 con transductores de 10-18MHz, con la intención de localizar lesiones indicativas de adenomas de paratiroides. Estas lesiones suelen presentarse como nódulos ovalados, poligonales o triangulares, bien definidos e hipoecoicos, situados posteriormente al polo superior o inferior de ambos lóbulos tiroideos9–10. En caso de no encontrarse en estas localizaciones, la exploración ecográfica se amplió al resto del cuello hasta el mediastino superior (áreas iv, vi y vii). Independientemente del resultado de la ecografía, en aquellos pacientes candidatos a paratiroidectomía se solicitó una gammagrafía 99mTc-MIBI (asociada o no a SPECT), la cual fue realizada mediante administración de 15mCi intravenosa de 99mTc-MIBI para la obtención de imágenes precoz (15min) y tardía (2-3h) de cuello y tórax.
PAAF y medición de PTHaLa indicación de PAAF para la medición de PTHa en pacientes con criterios bioquímicos de HPTP fue establecida en los siguientes casos: 1) gammagrafía 99mTc-MIBI negativa e imagen ecográfica indicativa de adenoma de paratiroides; 2) discordancia de resultados en las pruebas de imagen: gammagrafía 99mTc-MIBI positiva en más de una localización o con localización diferente a la detectada ecográficamente; 3) sospecha de adenoma paratiroideo intratiroideo: imagen ecográfica compatible y gammagrafía 99mTc-MIBI negativa o positiva en el mismo lado de la lesión intratiroidea, pero no visualizada ecográficamente a nivel extratiroideo; 4) adenomas ectópicos: aquellas lesiones ecográficamente compatibles con adenomas paratiroideos separadas de la glándula tiroides al menos 2cm y situadas en las áreas iv, vi y vii, y 5) imagen ecográfica de adenoma de paratiroides «atípica»: lesiones con degeneración quística o posibles calcificaciones. La PAAF guiada por ecografía fue realizada por el mismo endocrinólogo en consultas, con el paciente tumbado con el cuello en hiperextensión y usando una aguja de 23G conectada a una jeringa de 20ml (sin tubo de enlace ni pistola de aspiración). En un único pase, la aguja se introducía en la imagen sospechosa de lesión paratiroidea realizando movimientos suaves hasta comprobar la existencia de material en el cono de la aguja, aplicando en caso contrario presión negativa hasta su obtención. Este material era diluido en 1cc de suero salino fisiológico e introducido en un tubo de bioquímica sin heparinizar, siendo remitido inmediatamente al laboratorio para la medición de PTHa. Si bien no existen puntos de corte de normalidad de PTHa estandarizados de lesiones paratiroideas24, en nuestro estudio se han considerado positivos los niveles de PTHa iguales o superiores a 100pg/ml.
Indicación quirúrgica y curaciónEn todos los casos la indicación de cirugía paratiroidea fue individualizada, incluyéndose como criterios generales: edad<50 años, calcemia>1mg/dl del rango superior de la normalidad, presencia de complicaciones asociadas (litiasis renal, osteoporosis, filtrado glomerular<60ml/min) o preferencia del paciente a la intervención. El abordaje quirúrgico paratiroideo fue establecido prequirúrgicamente en función de los resultados de los estudios de imagen, indicándose cirugía focal mínimamente invasiva en caso de adenomas únicos y un abordaje quirúrgico más amplio en caso de indicación de tiroidectomía por la presencia de enfermedad nodular tiroidea asociada. En ningún caso se realizó medición de PTH intraoperatoria. La curación bioquímica fue definida, siguiendo las recomendaciones de la Asociación Americana de Cirujanos Endocrinos, por la normalización de los niveles de calcio sérico corregido al menos 6 meses tras la paratiroidectomía6.
Efectos secundariosEn todos los casos se han registrado los efectos secundarios asociados a la PAAF (inflamación, infección local o hematomas) y, en los pacientes intervenidos, se han indagado los posibles casos de fibrosis local o de paratiromatosis, definida como la presencia de nódulos de tejido paratiroideo hiperfuncionante diseminados por el cuello o el mediastino que se especula se originan por la siembra de células paratiroideas durante la punción o la cirugía, por lo que los pacientes suelen requerir ser reintervenidos24,25.
Análisis estadísticoEl análisis estadístico fue realizado mediante el programa SPSS® versión 12.0 para Windows®. El test de Shapiro-Wilk fue aplicado para conocer si las variables continuas estaban distribuidas normalmente o no. Los resultados de las variables continuas se expresaron como media±desviación estándar y las variables cualitativas como números absolutos y porcentajes.
Con respecto a la evaluación de la medición de PTHa como prueba diagnóstica, se consideraron verdaderos positivos las lesiones con PTHa≥100pg/ml, localizada y extirpada por cirugía y confirmada histológicamente, FP las lesiones con PTHa≥100pg/ml, no localizada por cirugía y confirmada histológicamente en otra localización, verdaderos negativos las lesiones con PTHa<100pg/ml, no localizada y extirpada en otra localización, confirmada histológicamente, y FN las lesiones con PTHa<100pg/ml, localizada y extirpada por cirugía y confirmada histológicamente. El valor predictivo positivo fue calculado mediante la fórmula: verdaderos positivos/(verdaderos positivos+FP), y el valor predictivo negativo mediante la fórmula: verdaderos negativos/(verdaderos negativos+FN). En todas las estimaciones se evaluó el intervalo de confianza del 95%.
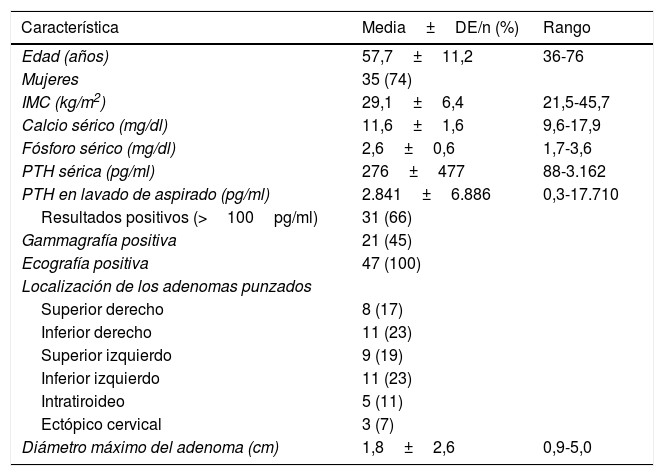
ResultadosEn los 8 años de actividad evaluados desde que se realizan ecografías en consultas de endocrinología se han atendido 195 pacientes con criterios bioquímicos de HPTP, realizándose PAAF para medición de PTHa de lesiones sospechosas de origen paratiroideo en 47 pacientes (24% del total). Como puede observarse en la tabla 1, la mayoría eran mujeres (74,5%) de edad media (promedio de edad: 57,7±11,2 años; mediana: 58 años) con calcemia y niveles promedio de PTH plasmática de 11,6±1,6mg/dl (mediana: 11,2mg/dl) y 276±447pg/dl (mediana: 151pg/ml), respectivamente. Las lesiones punzadas presentaban un diámetro máximo medio de 1,8±2,6cm (mediana: 1,5cm) y se distribuían de forma proporcionada entre las 4 glándulas paratiroideas, si bien se punzaron 5 lesiones intratiroideas y 3 lesiones ectópicas cervicales. El nivel promedio de PTHa fue de 2.853±3.957pg/ml (mediana: 2.454pg/ml), considerándose positiva para lesión de origen paratiroideo (PTHa≥100pg/ml) el 68% de los casos (32 pacientes). No hubo ningún caso de inflamación, dolor local o infección tras la punción.
Características clínicas, bioquímicas y de estudios de imagen de los pacientes con hiperparatiroidismo sometidos a PAAF para medición de PTHa (n=47)
| Característica | Media±DE/n (%) | Rango |
|---|---|---|
| Edad (años) | 57,7±11,2 | 36-76 |
| Mujeres | 35 (74) | |
| IMC (kg/m2) | 29,1±6,4 | 21,5-45,7 |
| Calcio sérico (mg/dl) | 11,6±1,6 | 9,6-17,9 |
| Fósforo sérico (mg/dl) | 2,6±0,6 | 1,7-3,6 |
| PTH sérica (pg/ml) | 276±477 | 88-3.162 |
| PTH en lavado de aspirado (pg/ml) | 2.841±6.886 | 0,3-17.710 |
| Resultados positivos (>100pg/ml) | 31 (66) | |
| Gammagrafía positiva | 21 (45) | |
| Ecografía positiva | 47 (100) | |
| Localización de los adenomas punzados | ||
| Superior derecho | 8 (17) | |
| Inferior derecho | 11 (23) | |
| Superior izquierdo | 9 (19) | |
| Inferior izquierdo | 11 (23) | |
| Intratiroideo | 5 (11) | |
| Ectópico cervical | 3 (7) | |
| Diámetro máximo del adenoma (cm) | 1,8±2,6 | 0,9-5,0 |
DE: desviación estándar; IMC: índice de masa corporal; PAAF: punción aspiración con aguja fina; PTH: hormona paratiroidea; PTHa: hormona paratiroidea en lavado de aspirado de punción aspiración con aguja fina.
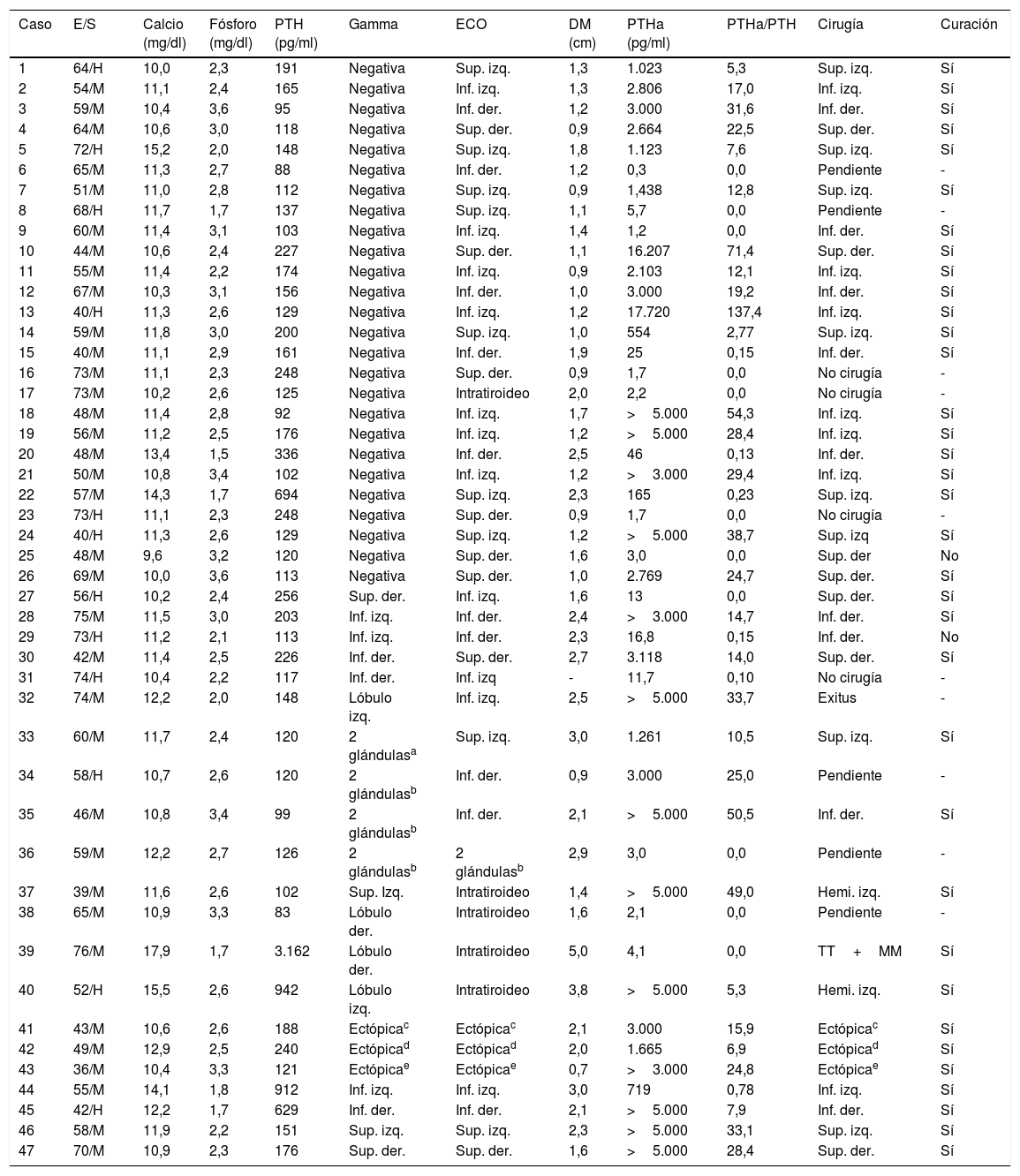
En la tabla 2 se expone un resumen de las características clínicas, analíticas, de pruebas de imagen y resultados tras la intervención de los pacientes estudiados. El principal criterio de indicación de PAAF para la medición de PTHa fue la ausencia de lesiones en la gammagrafía 99mTc-MIBI (26 pacientes; 52% del total) con resultados claramente positivos (PTHa promedio: 2.703±4.673pg/ml) en 17 de ellos (65%). Catorce pacientes (30% del total) fueron punzados por discordancia en la localización entre la gammagrafía y la ecografía (6 casos), por sospecha ecográfica de adenomas intratiroideos (4 casos) o por positividad gammagráfica en más de una localización (4 casos), con positividad en la PTHa en 8 pacientes (57%). Finalmente, 7 pacientes (15% del total) con concordancia entre la imagen gammagráfica y la ecográfica fueron punzados: 3 lesiones ectópicas, 2 pacientes con enfermedad persistente tras cirugía previa y 2 casos con adenomas paratiroideos ecográficamente atípicos, con positividad en la PTHa en todos los casos.
Resumen de las características clínicas, hormonales y de estudios de imagen (n=47)
| Caso | E/S | Calcio (mg/dl) | Fósforo (mg/dl) | PTH (pg/ml) | Gamma | ECO | DM (cm) | PTHa (pg/ml) | PTHa/PTH | Cirugía | Curación |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 64/H | 10,0 | 2,3 | 191 | Negativa | Sup. izq. | 1,3 | 1.023 | 5,3 | Sup. izq. | Sí |
| 2 | 54/M | 11,1 | 2,4 | 165 | Negativa | Inf. izq. | 1,3 | 2.806 | 17,0 | Inf. izq. | Sí |
| 3 | 59/M | 10,4 | 3,6 | 95 | Negativa | Inf. der. | 1,2 | 3.000 | 31,6 | Inf. der. | Sí |
| 4 | 64/M | 10,6 | 3,0 | 118 | Negativa | Sup. der. | 0,9 | 2.664 | 22,5 | Sup. der. | Sí |
| 5 | 72/H | 15,2 | 2,0 | 148 | Negativa | Sup. izq. | 1,8 | 1.123 | 7,6 | Sup. izq. | Sí |
| 6 | 65/M | 11,3 | 2,7 | 88 | Negativa | Inf. der. | 1,2 | 0,3 | 0,0 | Pendiente | - |
| 7 | 51/M | 11,0 | 2,8 | 112 | Negativa | Sup. izq. | 0,9 | 1,438 | 12,8 | Sup. izq. | Sí |
| 8 | 68/H | 11,7 | 1,7 | 137 | Negativa | Sup. izq. | 1,1 | 5,7 | 0,0 | Pendiente | - |
| 9 | 60/M | 11,4 | 3,1 | 103 | Negativa | Inf. izq. | 1,4 | 1,2 | 0,0 | Inf. der. | Sí |
| 10 | 44/M | 10,6 | 2,4 | 227 | Negativa | Sup. der. | 1,1 | 16.207 | 71,4 | Sup. der. | Sí |
| 11 | 55/M | 11,4 | 2,2 | 174 | Negativa | Inf. izq. | 0,9 | 2.103 | 12,1 | Inf. izq. | Sí |
| 12 | 67/M | 10,3 | 3,1 | 156 | Negativa | Inf. der. | 1,0 | 3.000 | 19,2 | Inf. der. | Sí |
| 13 | 40/H | 11,3 | 2,6 | 129 | Negativa | Inf. izq. | 1,2 | 17.720 | 137,4 | Inf. izq. | Sí |
| 14 | 59/M | 11,8 | 3,0 | 200 | Negativa | Sup. izq. | 1,0 | 554 | 2,77 | Sup. izq. | Sí |
| 15 | 40/M | 11,1 | 2,9 | 161 | Negativa | Inf. der. | 1,9 | 25 | 0,15 | Inf. der. | Sí |
| 16 | 73/M | 11,1 | 2,3 | 248 | Negativa | Sup. der. | 0,9 | 1,7 | 0,0 | No cirugía | - |
| 17 | 73/M | 10,2 | 2,6 | 125 | Negativa | Intratiroideo | 2,0 | 2,2 | 0,0 | No cirugía | - |
| 18 | 48/M | 11,4 | 2,8 | 92 | Negativa | Inf. izq. | 1,7 | >5.000 | 54,3 | Inf. izq. | Sí |
| 19 | 56/M | 11,2 | 2,5 | 176 | Negativa | Inf. izq. | 1,2 | >5.000 | 28,4 | Inf. izq. | Sí |
| 20 | 48/M | 13,4 | 1,5 | 336 | Negativa | Inf. der. | 2,5 | 46 | 0,13 | Inf. der. | Sí |
| 21 | 50/M | 10,8 | 3,4 | 102 | Negativa | Inf. izq. | 1,2 | >3.000 | 29,4 | Inf. izq. | Sí |
| 22 | 57/M | 14,3 | 1,7 | 694 | Negativa | Sup. izq. | 2,3 | 165 | 0,23 | Sup. izq. | Sí |
| 23 | 73/H | 11,1 | 2,3 | 248 | Negativa | Sup. der. | 0,9 | 1,7 | 0,0 | No cirugía | - |
| 24 | 40/H | 11,3 | 2,6 | 129 | Negativa | Sup. izq. | 1,2 | >5.000 | 38,7 | Sup. izq | Sí |
| 25 | 48/M | 9,6 | 3,2 | 120 | Negativa | Sup. der. | 1,6 | 3,0 | 0,0 | Sup. der | No |
| 26 | 69/M | 10,0 | 3,6 | 113 | Negativa | Sup. der. | 1,0 | 2.769 | 24,7 | Sup. der. | Sí |
| 27 | 56/H | 10,2 | 2,4 | 256 | Sup. der. | Inf. izq. | 1,6 | 13 | 0,0 | Sup. der. | Sí |
| 28 | 75/M | 11,5 | 3,0 | 203 | Inf. izq. | Inf. der. | 2,4 | >3.000 | 14,7 | Inf. der. | Sí |
| 29 | 73/H | 11,2 | 2,1 | 113 | Inf. izq. | Inf. der. | 2,3 | 16,8 | 0,15 | Inf. der. | No |
| 30 | 42/M | 11,4 | 2,5 | 226 | Inf. der. | Sup. der. | 2,7 | 3.118 | 14,0 | Sup. der. | Sí |
| 31 | 74/H | 10,4 | 2,2 | 117 | Inf. der. | Inf. izq | - | 11,7 | 0,10 | No cirugía | - |
| 32 | 74/M | 12,2 | 2,0 | 148 | Lóbulo izq. | Inf. izq. | 2,5 | >5.000 | 33,7 | Exitus | - |
| 33 | 60/M | 11,7 | 2,4 | 120 | 2 glándulasa | Sup. izq. | 3,0 | 1.261 | 10,5 | Sup. izq. | Sí |
| 34 | 58/H | 10,7 | 2,6 | 120 | 2 glándulasb | Inf. der. | 0,9 | 3.000 | 25,0 | Pendiente | - |
| 35 | 46/M | 10,8 | 3,4 | 99 | 2 glándulasb | Inf. der. | 2,1 | >5.000 | 50,5 | Inf. der. | Sí |
| 36 | 59/M | 12,2 | 2,7 | 126 | 2 glándulasb | 2 glándulasb | 2,9 | 3,0 | 0,0 | Pendiente | - |
| 37 | 39/M | 11,6 | 2,6 | 102 | Sup. Izq. | Intratiroideo | 1,4 | >5.000 | 49,0 | Hemi. izq. | Sí |
| 38 | 65/M | 10,9 | 3,3 | 83 | Lóbulo der. | Intratiroideo | 1,6 | 2,1 | 0,0 | Pendiente | - |
| 39 | 76/M | 17,9 | 1,7 | 3.162 | Lóbulo der. | Intratiroideo | 5,0 | 4,1 | 0,0 | TT+MM | Sí |
| 40 | 52/H | 15,5 | 2,6 | 942 | Lóbulo izq. | Intratiroideo | 3,8 | >5.000 | 5,3 | Hemi. izq. | Sí |
| 41 | 43/M | 10,6 | 2,6 | 188 | Ectópicac | Ectópicac | 2,1 | 3.000 | 15,9 | Ectópicac | Sí |
| 42 | 49/M | 12,9 | 2,5 | 240 | Ectópicad | Ectópicad | 2,0 | 1.665 | 6,9 | Ectópicad | Sí |
| 43 | 36/M | 10,4 | 3,3 | 121 | Ectópicae | Ectópicae | 0,7 | >3.000 | 24,8 | Ectópicae | Sí |
| 44 | 55/M | 14,1 | 1,8 | 912 | Inf. izq. | Inf. izq. | 3,0 | 719 | 0,78 | Inf. izq. | Sí |
| 45 | 42/H | 12,2 | 1,7 | 629 | Inf. der. | Inf. der. | 2,1 | >5.000 | 7,9 | Inf. der. | Sí |
| 46 | 58/M | 11,9 | 2,2 | 151 | Sup. izq. | Sup. izq. | 2,3 | >5.000 | 33,1 | Sup. izq. | Sí |
| 47 | 70/M | 10,9 | 2,3 | 176 | Sup. der. | Sup. der. | 1,6 | >5.000 | 28,4 | Sup. der. | Sí |
der.: derecha; DM: diámetro máximo; E: edad; ECO: ecografía; H: hombre; Hemi.: hemitiroidectomía; Inf.: inferior; izq.: izquierda; M: mujer; MM: masa mediastínica; S: sexo; Sup.: superior; PTH: hormona paratiroidea; PTHa: hormona paratiroidea en lavado de aspirado de PAAF; TT: tiroidectomía total.
Se intervinieron mediante paratiroidectomía 37 pacientes; un paciente falleció durante el seguimiento, 5 pacientes se encuentran pendientes de intervención y 4 pacientes fueron descartados para la cirugía. En los 30 pacientes con PTHa≥100pg/ml la cirugía y la histología confirmaron la presencia de tejido paratiroideo y todos los pacientes se curaron, 3 pacientes con PTHa<100pg/ml se intervinieron y se extirparon adenomas en localizaciones diferentes a la punzada y se curaron, 4 pacientes con PTHa<100pg/ml se intervinieron extirpándose la lesión puncionada: 2 se curaron y 2 persisten con criterios bioquímicos de HPTP. En la tabla 3 se expone el rendimiento de la medición de PTHa como técnica diagnóstica en los 37 pacientes intervenidos, objetivándose una elevada sensibilidad (93,7%) y especificidad (100%). No se ha informado de ningún caso de fibrosis local o inflamación que dificultara la extirpación quirúrgica, y tras un seguimiento promedio de 1,7±1,5 años (0,3-4,9 años) no se ha detectado ningún caso de paratiromatosis.
Rendimiento diagnóstico de la medición de PTHa en los pacientes intervenidos (n=37)
| Sensibilidad(IC 95%) | Especificidad(IC 95%) | VPP(IC 95%) | VPN(IC 95%) | Rendimiento diagnósticoa(IC 95%) | |
|---|---|---|---|---|---|
| PTHa≥100pg/ml | 93,7(77,8-98,6) | 100,0(66,2-98,1) | 100,0(85,8-99,7) | 71,4(30,3-94,9) | 94,6(80,5-99,1) |
IC 95%: intervalo de confianza al 95%; PTHa: hormona paratiroidea en el lavado de aspirado de punción aspiración con aguja fina; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La PAAF para la medición de PTHa de lesiones sospechosas de origen paratiroideo es un método de diagnóstico de localización de tejido paratiroideo descrito por primera vez en 198325, con una elevada especificidad para distinguir entre glándulas paratiroideas y otros tejidos13–23 y con ausencia de FP cuando se consideran niveles de PTHa≥100pg/ml14,19 o simplemente niveles de PTHa superiores a los niveles plasmáticos17,18,20–22. Sin embargo, esta prueba presenta las limitaciones de la ausencia de estandarización de la técnica (pases y dilución), de la prueba diagnóstica (PTHa o cociente PTHa/PTH plasmática) y de los puntos de corte para considerar como positivo un resultado23,24. En primer lugar, si bien no existe unanimidad, la mayoría de los autores recomiendan una o 2 punciones y diluciones de la muestra con 1cc de suero fisiológico, y al respecto de la prueba diagnóstica, no parecen existir diferencias en el rendimiento diagnóstico cuando se utiliza la medición de PTHa o el cociente PTHa/PTHp23,24. Sin embargo, las mayores discrepancias surgen en los puntos de corte a utilizar, los cuales oscilan entre 20 y 103pg/ml23,24 para la medición de PTHa y entre≥1 y≥2 para el cociente PTHa/PTHp23,24. En nuestra experiencia, en la mayoría de los casos los niveles de PTHa fueron francamente elevados (superiores a 1.000pg/ml) y generaron pocas dudas. Sin embargo, un caso considerado negativo con PTHa de 46pg/ml se curó tras la extirpación de la glándula punzada, lo que plantea la posibilidad de reducir en nuestra población el punto de corte de positividad de PTHa, tal como recomiendan algunos autores13,26. Por otro lado, en esta técnica es necesario tener en cuenta que un valor elevado de tiroglobulina en el aspirado no excluye la posible naturaleza de tejido paratiroideo en el nódulo punzado, y que la rentabilidad diagnóstica de la citología oscila entre el 17 y el 53%17,19,21, ya que por un lado se documenta un elevado número de punciones no diagnósticas y, por otro, la citomorfología de las proliferaciones paratiroideas es muy difícil de diferenciar de las proliferaciones tiroideas, y aunque la inmunohistoquímica podría ser útil, esto no siempre es posible por lo inadecuado del material17.
En nuestra serie, la sensibilidad de la medición de PTHa es del 93,7% (IC 95%: 77,7-98,6), en consonancia con otros estudios que comunican una sensibilidad entre el 83 y el 100%15–21. En este sentido, una reciente revisión sistemática y metaanálisis de 9 estudios clínicos que incluyen 222 lesiones punzadas para medición de PTHa ha comunicado una sensibilidad combinada del 95% (IC 95%: 91-98%), con un valor predictivo positivo del 97% (IC 95%: 93-100), sin informar complicaciones mayores asociadas al procedimiento23. No obstante, el rendimiento de esta técnica depende directamente del número de FN ocasionado por fallos técnicos (como no llegar a punzar la lesión), por el aspirado de áreas quísticas de adenomas paratiroideos o por considerar como negativos casos con PTHa entre 40 y 100pg/ml15,23,26, siendo por tanto dependiente tanto de la pericia del explorador como de los criterios de selección de pacientes, reduciéndose la sensibilidad en el caso de exploradores poco experimentados o de protocolos que amplíen los criterios de indicación de PAAF a todos los pacientes con posibles adenomas paratiroideos detectados ecográficamente.
La principal limitación de esta técnica es su dependencia en la identificación ecográfica de lesiones sospechosas de adenomas de paratiroides. De esta forma, recientes revisiones sistemáticas informan de que la sensibilidad y el valor predictivo positivo para la detección ecográfica de adenomas paratiroideos oscila entre el 70 y el 88%27,28, siendo del 85 y el 95%, respectivamente, en la serie comunicada recientemente por nuestro grupo de trabajo9. Especialmente interesantes son los casos con gammagrafía 99mTc-MIBI de localización negativa, cuya prevalencia oscila entre el 10 y el 38% de los pacientes con criterios bioquímicos de HPTP, en los cuales se identifica mediante ecografía la presencia de lesiones sospechosas de adenomas de paratiroides en el 51-77% de los casos9,29,30. Estos pacientes serían potenciales candidatos a PAAF para medición de PTHa con el objetivo de distinguir estas lesiones de nódulos tiroideos, adenopatías u otras lesiones cervicales12,21. En estos casos una posible limitación consiste en la dificultad de punción de algunas lesiones difícilmente accesibles por su localización o pequeño tamaño9,15,20–23. Así, en nuestra serie, se han punzado el 52% (26 de 50 casos) de los pacientes con HPTP gammagráficamente negativos9, no realizándose el procedimiento por dificultad técnica en 13 pacientes (26%) y por negatividad ecográfica en 11 pacientes (22%).
Con respecto a la seguridad, en nuestra serie no hemos observado complicaciones asociadas a la punción durante el procedimiento, el acto quirúrgico o el seguimiento. La ausencia de efectos adversos locales también ha sido comunicada en la amplia mayoría de las series de casos de pacientes sometidos a PAAF para medición de PTHa13,23, y tan solo Bancos et al., en la Clínica Mayo21, informan de que 3 de 74 pacientes presentaban alteraciones inflamatorias o hematomas en el lecho quirúrgico que obligaron a que la técnica quirúrgica mínimamente invasiva fuera modificada a una técnica estándar, con la consiguiente prolongación del tiempo quirúrgico. Los autores plantean que las complicaciones asociadas a esta técnica podrían estar en relación con la experiencia del explorador, el calibre de la aguja utilizada y el número de punciones21, por lo que parece razonable proponer un único pase con aguja fina (23-25G), tal y como realizamos en nuestros pacientes. Por último, los casos de paratiromatosis asociados a esta técnica son excepcionales31–34, si bien no disponemos de estudios con un suficiente número de pacientes seguidos durante un tiempo prolongado que permitan establecer conclusiones al respecto.
En conclusión, en nuestro medio la medición de PTHa de PAAF es una técnica diagnóstica sencilla, segura y con una elevada sensibilidad y especificidad que permite diferenciar entre adenomas paratiroideos y otras lesiones cervicales (nódulos tiroideos, adenopatías) en pacientes con HPTP bioquímico confirmado. En la actualidad esta técnica diagnóstica no se recomienda de forma generalizada en pacientes con HPT1,6 y debe evitarse en casos sospechosos de cáncer de paratiroides35, estando indicada en pacientes con HPTP candidatos a paratiroidectomía que presenten gammagrafía 99mTc-MIBI (y otras técnicas de imagen complementarias) negativas o con hallazgos discordantes respecto de los detectados ecográficamente. No obstante, queda por dilucidar si la combinación de ecografía con la medición de PTHa de lesiones sospechosas de adenomas de paratiroides podría ser utilizada como primera técnica de localización prequirúrgica en el HPTP, relegando la gammagrafía 99mTc-MIBI (con o sin SPECT) exclusivamente a aquellos casos negativos o dudosos, lo cual deberá ser evaluado en futuras investigaciones.
FinanciaciónEste estudio ha sido parcialmente financiado por sendas becas de investigación no condicionadas concedidas por Laboratorios Menarini, S. A. y por la Sociedad Andaluza de Endocrinología, Diabetes y Nutrición (SAEDYN).
Conflicto de interesesLos autores del presente artículo no presentan ningún conflicto de intereses en relación con el objetivo ni los resultados del mismo.