El objetivo de este estudio es conocer la prevalencia de alteraciones hidrocarbonadas en pacientes diagnosticados de acromegalia y evaluar qué ocurre a los 2 años del tratamiento. También se pretende valorar qué factores se asocian a la aparición de estas alteraciones.
Material y métodosSe incluyeron 66 pacientes diagnosticados de acromegalia en nuestro centro. Se clasificó a los pacientes en función del metabolismo glucémico: normal, prediabetes y diabetes. A los 2 años del tratamiento de la acromegalia se analizó de nuevo la prevalencia de alteraciones hidrocarbonadas, en función del estado del paciente (curado, controlado con tratamiento médico o no controlado).
ResultadosAl diagnóstico de acromegalia, el 27,3% de los pacientes tenían diabetes (n=18), el 39,4% prediabetes (n=26) y el 33,3% no presentaba alteraciones (n=22). Se encontraron diferencias significativas en los niveles de IGF-1 y z-score de IGF-1 (mediana de 18,1 en diabéticos y 10,6 en no diabéticos, p=0,005) entre los 3 grupos.
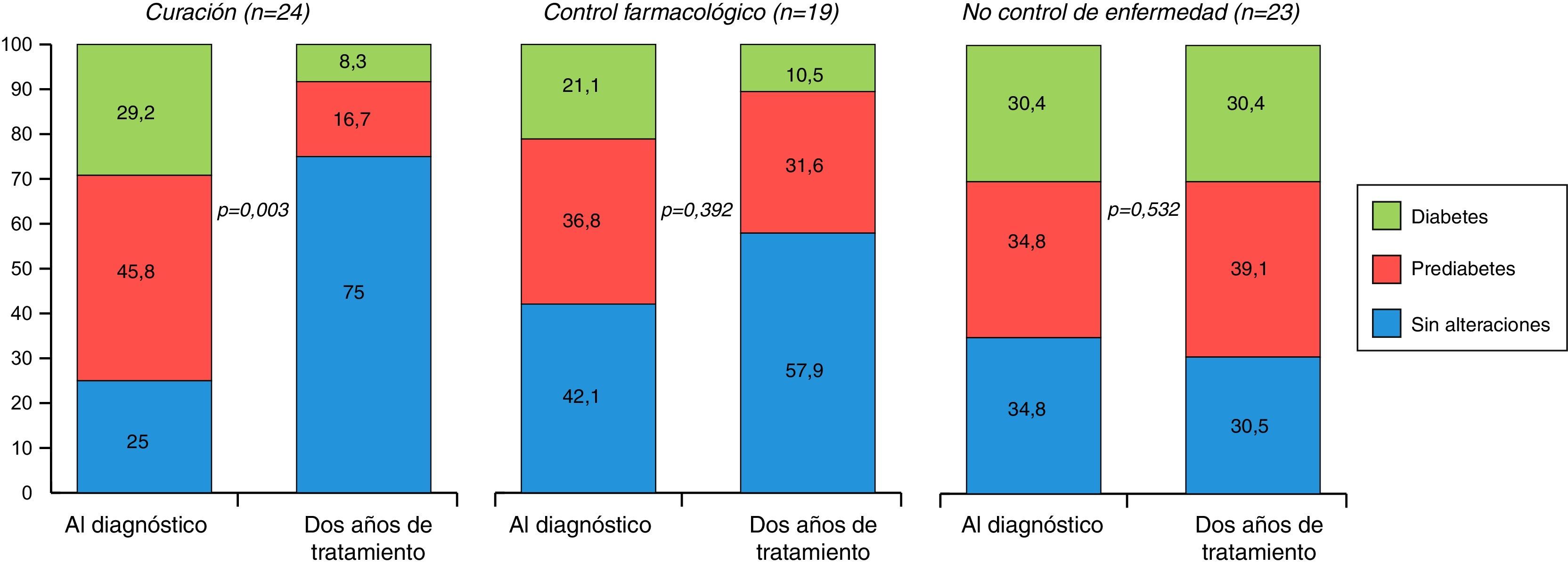
A los 2 años del tratamiento, se observa una importante reducción de la prevalencia de diabetes y prediabetes en los pacientes curados (del 29,2 al 8,3% y del 45,8 al 16,7% respectivamente, p=0,003) pero no en los pacientes controlados con tratamiento médico o no controlados.
ConclusiónEn nuestro centro, el 66,6% de los pacientes con acromegalia presentan alteraciones en el metabolismo hidrocarbonado al diagnóstico, con una prevalencia de diabetes del 27,3%.
A los 2 años del tratamiento de la acromegalia, se objetiva un descenso de la prevalencia de diabetes y prediabetes en el grupo de pacientes curados.
The aim of this study was to ascertain the prevalence of carbohydrate changes in patients diagnosed with acromegaly, and to evaluate what happens two years after treatment. It was also intended to assess which factors are associated to the occurrence of such changes.
Material and methodsSixty-six patients diagnosed with acromegaly at our center were enrolled and divided into groups with normal glucose metabolism, prediabetes, and diabetes. After 2 years of treatment of acromegaly, prevalence carbohydrate changes was assessed again depending on the patient condition (cured, controlled with medical treatment, or uncontrolled).
ResultsAt the time of diagnosis of acromegaly, 27.3% of the patients had diabetes (n=18), 39.4% had prediabetes (n=26), and 33.3% had no changes (n=22). Significant differences were found in IGF-1 and z-score of IGF-1 (median of 18.1 in diabetics and 10.6 in non-diabetics, P=.005).
Two years after treatment, there was a significant decrease in the prevalence of diabetes and prediabetes in cured patients (from 29.2% to 8.3% and from 45.8% to 16.7%, respectively, P=.003), but not in patients controlled with medical treatment or not controlled.
ConclusionAt our center, 66.6% of patients with acromegaly had changes in carbohydrate metabolism at diagnosis, with a prevalence of diabetes of 27.3%. Two years after treatment of acromegaly, prevalence of diabetes and prediabetes decreased in cured patients.
La acromegalia es una enfermedad causada por una hiperproducción crónica e inapropiada de hormona de crecimiento (GH), en la mayoría de los casos debido a un adenoma hipofisario. Es habitual la asociación con alteraciones del metabolismo hidrocarbonado que pueden ir desde una glucemia basal alterada hasta una diabetes con grandes requerimientos de insulina1–3. La prevalencia de diabetes en la acromegalia es variable según los distintos estudios, oscilando entre un 20 y un 55%4–9. Esta variabilidad puede ser debida a diferencias en la edad, raza y duración de la acromegalia antes del diagnóstico. De forma similar, la prevalencia de glucemia basal alterada e intolerancia a la glucosa varía entre un 16 y un 46%4–9.
La resistencia a la insulina a nivel hepático y periférico que produce la GH parece ser el mecanismo por el que se produce este efecto hiperglucemiante, así como el aumento de producción hepática de glucosa10–12. Hay estudios que demuestran también cierto grado de insulinopenia que podría contribuir al inicio y el mantenimiento de la hiperglucemia13.
Diferentes factores se han asociado con la aparición de alteraciones hidrocarbonadas en pacientes con acromegalia, pero sin consistencia en los distintos estudios excepto la edad4,14.
La resistencia a la insulina y la diabetes son factores de riesgo conocidos para la enfermedad cardiovascular, que en pacientes con acromegalia es más prevalente y condiciona un aumento de la mortalidad comparando con sujetos sanos14–16. Por otra parte, el tratamiento de la acromegalia mejora el control glucémico y reduce el riesgo cardiovascular17,18.
El objetivo de este estudio es conocer la prevalencia de alteraciones en el metabolismo hidrocarbonado en pacientes diagnosticados de acromegalia en Navarra y estudiar cuáles son los factores que favorecen la aparición de diabetes y prediabetes en estos pacientes. Por otra parte, se pretende analizar qué ocurre con estas alteraciones a los 2 años del tratamiento de la acromegalia, en función de si se ha conseguido la curación de la enfermedad, está controlada con tratamiento médico o no está controlada.
Material y métodosSe incluyeron todos los pacientes diagnosticados de acromegalia por un adenoma hipofisario secretor de GH en el Complejo Hospitalario de Navarra entre los años 1980 y 2014. Para la realización de este trabajo se han seguido los protocolos de nuestro centro respecto al acceso a historia clínica y publicación de datos.
Se estableció el diagnóstico en sujetos con clínica compatible y valores elevados de IGF-1 (comparado con un rango de referencia ajustado por edad y sexo) y GH tras sobrecarga oral de glucosa (SOG). Un valor nadir de GH superior a 1ng/ml se consideró diagnóstico de acromegalia.
Para la clasificación de las alteraciones hidrocarbonadas se disponía de glucemia basal, glucemia tras SOG y en algunos de los casos hemoglobina glucosilada (HbA1c). Se utilizaron los criterios de la ADA de 2010 para su clasificación19. Se establecieron 3 grupos en base a dichos criterios: sin alteraciones en el metabolismo hidrocarbonado, prediabetes y diabetes. En el grupo sin alteraciones del metabolismo hidrocarbonado, se incluyeron sujetos sin antecedentes de diabetes, con glucemia basal inferior a 100mg/dl y/o una glucemia a las 2h de la SOG inferior a 140mg/dl. El grupo prediabetes presentaba una glucemia basal entre 100 y 125mg/dl, una glucemia a las 2h de SOG entre 140 y 199mg/dl y/o una HbA1c entre 5,7 y 6,4%. El grupo diabetes incluía a pacientes previamente diagnosticados de diabetes o que presentaban glucemia basal igual o superior a 126mg/dl, glucemia tras SOG igual o superior a 200mg/dl o HbA1c igual o superior a 6,5% (todo ello repetido en 2 o más ocasiones).
De la historia clínica informatizada se obtuvieron otros datos clínicos de interés como peso, talla, índice de masa corporal (IMC), tamaño tumoral (diámetro máximo en el estudio mediante resonancia magnética) y presencia de HTA y dislipidemia al diagnóstico. Se clasificó a los pacientes como hipertensos si se encontraban en tratamiento antihipertensivo. Los pacientes con tratamiento hipolipidemiante y aquellos con un LDL igual a superior a 160mg/dl fueron clasificados como dislipidémicos. También se recogieron los niveles de GH basal, GH tras SOG e IGF-1. Para evaluar el impacto de la IGF-1 en las alteraciones hidrocarbonadas se calculó el z-score, ya que tiene en cuenta la diferencia de los valores del paciente con la normalidad según edad y sexo.
Se evaluó la frecuencia de alteraciones hidrocarbonadas a los 2 años del tratamiento inicial de la acromegalia con los mismos criterios ADA de 201019. Se clasificó a los pacientes en 3 grupos en función de la evolución de la enfermedad de base: curados, controlados con tratamiento médico y no controlados. Para ello se siguieron los criterios establecidos por las últimas guías2.
Métodos de laboratorioLa medición de los niveles de GH e IGF-1 se realizó mediante radioinmunoanálisis hasta 2005 y a partir de esta fecha por quimioluminiscencia (Siemens Immulite 2000, Deerfield, IL, EE. UU.).
Análisis estadísticoSe utilizó media y desviación estándar para presentar las variables cuantitativas y porcentaje para las cualitativas. La comparación de variables cuantitativas en los distintos grupos de alteraciones hidrocarbonadas se realizó con el test de ANOVA y con el test de Kruskal-Wallis si la distribución no era normal o no había homogeneidad de varianzas. Para comparar variables cualitativas se utilizó el test de chi-cuadrado o el test de Fisher si la frecuencia esperada en alguno de los supuestos era inferior a 5 pacientes. Para evaluar el cambio en la prevalencia de alteraciones hidrocarbonadas a los 2 años del tratamiento se utilizó el test de McNemar.
El análisis estadístico se realizó con el programa estadístico SPSS versión 20.
ResultadosLa tabla 1 muestra las características basales de los 66 pacientes incluidos en el estudio. La edad media fue de 49,41±14,44 años con una mayor frecuencia de mujeres (62,1%, n=44). El tamaño tumoral medio fue de 16,5±8,03mm, siendo en el 85% de los casos (n=51) macroadenomas. La prevalencia de alteraciones en el metabolismo de la glucosa al diagnóstico fue del 66,7% (el 39,4% presentaron prediabetes y el 27,3% diabetes). Además, el 34,8% (n=23) estaba diagnosticado de HTA y el 22,7% (n=15) de dislipidemia.
Características basales de los pacientes diagnosticados de acromegalia
| n=66 | |
|---|---|
| Edad (años) | 49,41 (14,44) |
| Sexo | |
| Mujer | 41 (62,1%) |
| Varón | 25 (37,9%) |
| IMC (kg/m2) | 26,25 (3,53) |
| Tamaño tumoral (mm) | 16,5 (8,03) |
| Tamaño | |
| Microadenoma | 9 (15%) |
| Macroadenoma | 51 (85%) |
| Déficit hormonal | |
| TSH | 6 (9,1%) |
| ACTH | 1 (1,5%) |
| FSH/LH | 10 (15,2%) |
| GH (μg/L) | 23,5 (10-47,9) |
| Nadir de GH tras SOG (μg/L) | 17 (6,63-39) |
| IGF-1 (μg/L) | 748,5 (602-1117,75) |
| IGF-1 z-score | 12,5 (7,7-19,6) |
| Glucemia basal (mg/dl) | 106,88 (22,87) |
| Glucemia tras SOG 120min (mg/dl) | 154,98 (62,5) |
| HTA | |
| Sí | 23 (34,8%) |
| No | 43 (65,2%) |
| Dislipidemia | |
| Sí | 15 (22,7%) |
| No | 51 (77,3%) |
| Alteraciones hidrocarbonadas | |
| DM | 18 (27,3%) |
| Prediabetes | 26 (39,4%) |
| Normal | 22 (33,3%) |
Las variables edad, IMC, tamaño, glucemia basal y glucemia tras SOG se expresan como media (desviación estándar); las variables GH, GH tras SOG, IGF-1 e IGF-1 z-score como mediana (rango intercuartílico); las variables categóricas como número total (porcentaje).
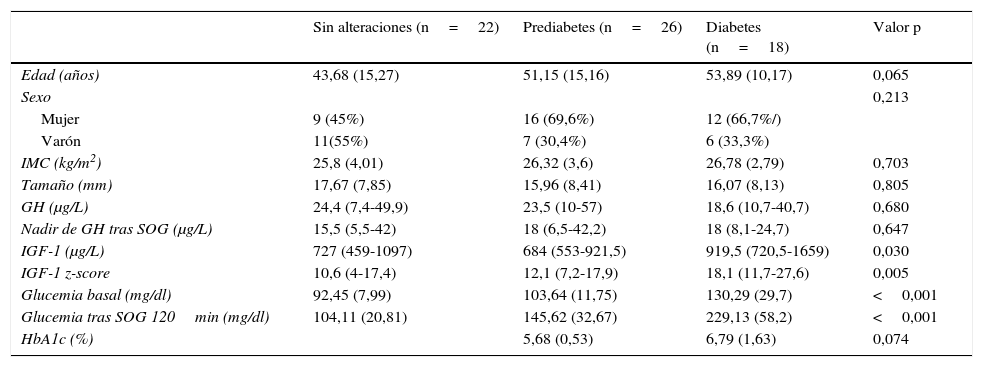
Las diferencias clínico-analíticas entre los pacientes sin alteraciones hidrocarbonadas, pacientes con prediabetes y diabetes quedan reflejadas en la tabla 2.
Diferencias clínico-analíticas entre los pacientes sin alteraciones hidrocarbonadas, pacientes con prediabetes y diabetes
| Sin alteraciones (n=22) | Prediabetes (n=26) | Diabetes (n=18) | Valor p | |
|---|---|---|---|---|
| Edad (años) | 43,68 (15,27) | 51,15 (15,16) | 53,89 (10,17) | 0,065 |
| Sexo | 0,213 | |||
| Mujer | 9 (45%) | 16 (69,6%) | 12 (66,7%/) | |
| Varón | 11(55%) | 7 (30,4%) | 6 (33,3%) | |
| IMC (kg/m2) | 25,8 (4,01) | 26,32 (3,6) | 26,78 (2,79) | 0,703 |
| Tamaño (mm) | 17,67 (7,85) | 15,96 (8,41) | 16,07 (8,13) | 0,805 |
| GH (μg/L) | 24,4 (7,4-49,9) | 23,5 (10-57) | 18,6 (10,7-40,7) | 0,680 |
| Nadir de GH tras SOG (μg/L) | 15,5 (5,5-42) | 18 (6,5-42,2) | 18 (8,1-24,7) | 0,647 |
| IGF-1 (μg/L) | 727 (459-1097) | 684 (553-921,5) | 919,5 (720,5-1659) | 0,030 |
| IGF-1 z-score | 10,6 (4-17,4) | 12,1 (7,2-17,9) | 18,1 (11,7-27,6) | 0,005 |
| Glucemia basal (mg/dl) | 92,45 (7,99) | 103,64 (11,75) | 130,29 (29,7) | <0,001 |
| Glucemia tras SOG 120min (mg/dl) | 104,11 (20,81) | 145,62 (32,67) | 229,13 (58,2) | <0,001 |
| HbA1c (%) | 5,68 (0,53) | 6,79 (1,63) | 0,074 | |
Las variables edad, IMC, tamaño, glucemia basal y glucemia tras SOG se expresan como media (desviación estándar); las variables GH, GH tras SOG, IGF-1 e IGF-1 z-score como mediana (rango intercuartílico); las variables categóricas como número total (porcentaje).
Se observaron niveles más elevados de IGF-1 en el grupo diabetes respecto a los otros grupos, de manera estadísticamente significativa (p=0,030). Los pacientes con diabetes presentaban niveles medianos de IGF-1 de 919,5μg/L (rango intercuartílico 720,5-1659), superiores a los pacientes con prediabetes mediana (684μg/L, rango intercuartílico 553-921,5) y sin alteraciones (mediana 727μg/L, rango intercuartílico 459-1097). Se objetivaron también valores más elevados de z-score de IGF-1 de forma significativa (p=0,005) en pacientes con diabetes (mediana 18,1, rango intercuartílico 11,7-27,6) que en pacientes con prediabetes (mediana 12,1, rango intercuartílico 7,2-17,9) y sin alteraciones (mediana 10,6, rango intercuartílico 4-17,4). Sin embargo, no se encontraron diferencias en los valores de GH basal y tras SOG.
Los pacientes con diabetes presentaban una tendencia a una edad mayor (53,89±10,17 años, vs. 51,15±15,16 en el grupo prediabetes y 43,68±15,27 en el grupo sin alteraciones), aunque las diferencias no eran estadísticamente significativas (p=0,065).
No encontramos diferencias en cuanto a IMC ni tamaño tumoral.
Respecto al tratamiento, en el 90,9% de los casos (n=60) se realizó cirugía y en el 9,1% de los pacientes (n=6) el tratamiento fue farmacológico por alto riesgo quirúrgico.
A los 2 años del diagnóstico de la enfermedad y tras realizar el tratamiento correspondiente, 24 pacientes (36,4%) mostraban criterios de curación, 19 pacientes (28,8%) tenían niveles de IGF-1 controlados con tratamiento farmacológico y 23 pacientes (34,8%) presentaban enfermedad no controlada a pesar de tratamiento. El cambio en la frecuencia de los 3 subgrupos de alteraciones en el metabolismo de la glucosa en función del control de la acromegalia queda reflejado en la figura 1. En los pacientes curados se observa una disminución significativa de la prevalencia de diabetes y prediabetes a los 2 años del diagnóstico (del 29,2 al 8,3% y del 45,8 al 16,7% respectivamente, p=0,003). Entre los pacientes con enfermedad controlada con tratamiento médico no existe una disminución de la presencia de alteraciones hidrocarbonadas (diabetes del 21,1 al 10,5% y prediabetes del 36,8 a 31,6%, p=0,392), y tampoco cuando la enfermedad está activa a los 2 años (diabetes del 30,4 a 30,4% y prediabetes del 34,8 al 39,1%, p=0,532).
DiscusiónEn nuestro estudio se observa una prevalencia elevada de alteraciones en el metabolismo de la glucosa en pacientes con acromegalia, con una prevalencia de diabetes del 27,3% y de prediabetes del 39,4%. Distintos estudios se han publicado para conocer la frecuencia de diabetes e intolerancia hidrocarbonada en estos pacientes, con resultados similares a lo observado en nuestro trabajo. En uno de los estudios con mayor número de pacientes, la prevalencia de diabetes fue del 31,9% y de prediabetes del 40,5% en una población de 248 pacientes8. Alexopoulou et al. observaron una prevalencia de alteraciones hidrocarbonadas del 54% (el 26% prediabetes y el 28% diabetes) en una muestra de 148 pacientes4. Dreval et al. describen una frecuencia mayor de pacientes con diabetes (52,5%)5. Esta elevada prevalencia puede estar justificada por una mayor edad de los pacientes de este trabajo (56±8,5 años vs. 45±20 años en el estudio de Alexopoulou et al. y 49,41±14,44 años en nuestro estudio). El mecanismo por el que la GH produce alteraciones en el metabolismo de la glucosa ha sido muy estudiado10,11. A pesar de que es la GH y no la IGF-1 la que tiene esa capacidad hiperglucemiante, es esta última la que mejor se ha correlacionado como marcador de actividad y con la presencia de alteraciones hidrocarbonadas4,5,9,20–23. En nuestro estudio no se observan diferencias entre los niveles basales de GH ni tras SOG en los distintos grupos pero sí en los niveles de IGF-1 y el z-score de IGF-1. En los trabajos realizados por Alexopoulou et al. y Dreval et al. se señala una relación con el z-score de IGF-1, sin encontrarse diferencias con los niveles de GH ni de GH tras SOG4,5. En el estudio de Stelmachowska-Banaś et al.9 el z-score de IGF-1 presentaba mejor correlación con el hiperinsulinismo y la resistencia a la insulina, al igual que lo señalado por Niculescu et al.23. En distintos estudios la edad se correlaciona con la presencia de diabetes en pacientes con acromegalia4,8,9. En nuestro estudio se observa una tendencia a mayor edad en los pacientes con diabetes y prediabetes pero las diferencias no son estadísticamente significativas (p=0,065).
Por otra parte, existen pocos estudios en los que se ha analizado lo que ocurre con el metabolismo de la glucosa tras el tratamiento de la acromegalia18,24. En nuestro estudio, los pacientes curados presentan un descenso significativo de la prevalencia de diabetes y prediabetes a los 2 años del diagnóstico. En los pacientes en los que el control de la enfermedad se realiza con tratamiento médico tras la cirugía se observa también un ligero descenso de la frecuencia de alteraciones hidrocarbonadas aunque no de forma estadísticamente significativa. Hay que tener en consideración que la mayoría de estos pacientes estaba en tratamiento con análogos de la somatostatina, que tienen un efecto hiperglucemiante. Los pacientes con acromegalia activa a los 2 años tenían una frecuencia similar de alteraciones en el metabolismo de la glucosa que en el momento del diagnóstico. Jonas et al. encuentran una prevalencia similar de alteraciones hidrocarbonada al diagnóstico y durante el seguimiento18. Únicamente los pacientes curados tras un tratamiento quirúrgico presentan un descenso de la glucemia basal. Kinoshita et al. demuestran que en pacientes curados tras la cirugía únicamente mejora la resistencia a la insulina si la función de la célula beta pancreática está preservada24. Por lo tanto, parece que es fundamental un diagnóstico precoz y buscar la curación con el tratamiento inicial para conseguir corregir las alteraciones en el metabolismo de la glucosa y, con ello, disminuir el exceso de riesgo cardiovascular que presentan estos pacientes.
Una de las limitaciones de este estudio es que al ser un trabajo retrospectivo no disponemos de glucemia basal, glucemia tras SOG y HbA1c de todos los pacientes. Tampoco podemos valorar la demora entre el inicio de los síntomas y el diagnóstico, que podría condicionar la aparición de complicaciones como las alteraciones glucémicas. Además sería interesante conocer los valores de insulina y péptido C para entender mejor el mecanismo fisiopatológico de las alteraciones del metabolismo hidrocarbonado en estos pacientes. Un tema interesante para futuros estudios sería el evaluar la prevalencia de los distintos factores de riesgo cardiovascular y enfermedad cardiovascular establecida en función de la curación o no de la acromegalia.
ConclusiónLas alteraciones en el metabolismo de la glucosa son muy frecuentes en pacientes diagnosticados de acromegalia, siendo IGF-1 el marcador que mejor se correlaciona con estas alteraciones.
La curación de la acromegalia produce una disminución importante de las alteraciones hidrocarbonadas a los 2 años del tratamiento inicial, por lo que podría disminuir el riesgo cardiovascular y el aumento de mortalidad asociado a esta enfermedad.
FinanciaciónLos autores no han recibido financiación para la realización del artículo.
Conflicto de interesesNinguno.
Los autores agradecen a todos los componentes del servicio de Endocrinología y Nutrición del Complejo Hospitalario de Navarra su colaboración.