El tratamiento con hormona de crecimiento recombinante (rhGH) ha demostrado mejorar la talla adulta de los pacientes pediátricos con déficit de GH (DGH). Sin embargo, cuando los pacientes son reevaluados al llegar a la talla final, se evidencia que existen pacientes en los que el déficit de GH es permanente (DPGH) y otros en los que el déficit ha sido transitorio (DTGH). El objetivo es evaluar, en una cohorte de pacientes pediátricos con DGH, si existen diferencias en la respuesta al tratamiento con GH en función de que dicho déficit sea permanente o transitorio.
Materiales y métodosEstudio retrospectivo de 89 pacientes con DGH, que fueron seguidos desde el diagnóstico y durante todo el seguimiento hasta la talla adulta. Se obtuvieron parámetros clínicos, auxológicos, radiológicos y analíticos al diagnóstico, así como tras el primer año de tratamiento y en la revisión de la talla final.
ResultadosEl 28% de los pacientes presentaron un DPGH. Talla inicial de −2,46 ± 0,86 DE en el DPGH y −2,24 ± 0,68 DE en el DTGH. El valor pico de GH al diagnóstico fue de 4,26 ± 2,78 y 6,20 ± 2,01 ng/mL, respectivamente (p < 0,01). Tras el primer año de tratamiento el incremento de la velocidad de crecimiento fue mayor en el grupo de DPGH: 4,33 ± 3,53 DE vs. 2,95 ± 2,54 DE (p = 0,043). Talla final de −0,81 ± 0,87 DE los DPGH y de −0,95 ± 0,83 DE los DTGH (p = 0,47).
ConclusionesLos pacientes con DPGH obtienen un mayor beneficio del tratamiento con rhGH tanto a corto como a largo plazo. Además, muestran niveles más bajos de GH en las pruebas de estímulo al diagnóstico, como ha sido descrito previamente.
Treatment with recombinant human growth hormone (rhGH) has been shown to improve adult height in pediatric patients with GH deficiency (GHD). However, reassessment of patients after they reach their final height shows some of them have permanent GH deficiency (PGHD), while others had a transient deficiency (TGHD). The study objective was to assess, in a cohort of pediatric patients with GHD, potential differences in response to treatment with rhGH depending on whether deficiency is permanent or transient.
Materials and methodsA retrospective study of 89 patients with GHD, who were monitored from diagnosis to adult height. Clinical, auxological, radiographic and laboratory variables were collected at diagnosis, after the first year of treatment, and when they had reached their adult height.
ResultsPGHD was found in 28% of patients. Initial height was −2.46 ± 0.86 SD and −2.24 ± 0.68 SD in subjects with PGHD and TGHD respectively. Peak GH level at diagnosis was 4.26 ± 2.78 and 6.20 ± 2.01 ng/mL (p < 0.01) in the PGHD and TGHD groups respectively. After the first year of treatment, increase in growth velocity was greater in the PGHD group: 4.33 ± 3.53 SD vs. 2.95 ± 2.54 SD in the PGHD group (p = 0.043). Final height was −0.81 ± 0.87 SD in the PGHD and −0.95 ± 0.83 SD in the TGHD group (p = 0.47).
ConclusionsPatients with PGHD had a better short- and long-term response to rhGH. They also showed lower GH levels in stimulation tests at diagnosis, as previously reported.
La talla baja y el retraso del crecimiento en la edad pediátrica son problemas frecuentes en la práctica clínica. Desde la aprobación del uso de la hormona de crecimiento recombinante (rhGH) para el tratamiento del déficit de hormona del crecimiento (growth hormone, GH) en el año 1985 por la Food and Drug Administration (FDA) son muchos los estudios que demuestran su efectividad en la mejoría de la talla adulta o talla final1-4. En España su uso está aprobado, además de para el déficit clásico de GH, para el síndrome de Turner, el paciente pequeño para edad gestacional, la insuficiencia renal crónica, las alteraciones del gen SHOX y el síndrome de Prader Willi.
A lo largo de los años se han modificado los criterios diagnósticos del déficit de GH (DGH) y existe controversia respecto a su definición, así como sobre los parámetros de buena respuesta y el beneficio del tratamiento tras la finalización del crecimiento. Clásicamente se consideraba el diagnóstico de DGH cuando el pico de GH era inferior o igual a 10 ng/mL tras 2 pruebas de estímulo (clonidina, hipoglucemia insulínica, propranolol-ejercicio, etc.). El déficit era severo cuando el nivel era inferior o igual a 5 ng/mL y dependiendo de la técnica de análisis utilizada5,6. En la actualidad se considera patológica una respuesta < 7,7 ng/mL tras las pruebas de estímulo, dependiendo de la técnica de medida utilizada7.
Asimismo, se han descrito diferencias en la respuesta a corto y largo plazo entre los pacientes con déficit permanente de hormona de crecimiento (DPGH) y aquellos con déficit transitorio (DTGH). Los pacientes con DTGH se diagnostican al alcanzar la talla adulta, cuando en la reevaluación (periodo de transición) consiguen un valor pico de GH normal (se han descrito distintos puntos de corte: GH ≥ 5 ng/mL, ≥ 5,62 ng/mL, ≥ 6,1 ng/mL) en el test de hipoglucemia insulínica o presentan niveles normales de IGF-18-10. En España el diagnóstico de DGH en la edad adulta se hace cuando se obtiene un nivel pico de GH menor o igual a 3 ng/mL tras una prueba de estímulo (test de hipoglucemia insulínica como primera opción), según los criterios del Comité Asesor de Hormona del Crecimiento actualizados en el año 200411.
El estudio de los datos auxológicos de ambos grupos puede ayudar a entender mejor la evolución y la respuesta al tratamiento de estos pacientes, ya que hasta la fecha no hay consenso definitivo sobre la evaluación del DGH en el periodo de transición a la edad adulta y la continuidad del tratamiento a partir de este periodo.
El objetivo principal del estudio fue evaluar la respuesta al tratamiento con rhGH tras el primer año de tratamiento y a la talla final (periodo de transición a la edad adulta) en 2grupos de pacientes diagnosticados de DPGH y DTGH.
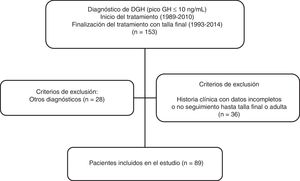
MétodosEstudio transversal, descriptivo y retrospectivo realizado en 89 pacientes con diagnóstico de DGH tratados con rhGH y seguidos hasta la talla adulta en la Unidad de Endocrinología y Diabetes Pediátrica del Hospital Universitario Ramón y Cajal (fig. 1). Se definió «talla final» como la talla alcanzada con velocidad de crecimiento inferior a 1cm/año. Los criterios de inclusión fueron: pacientes con talla baja (definida según las curvas y tablas de crecimiento de la Fundación Faustino Orbegozo Eizaguirre)12 y diagnóstico de déficit aislado de GH con test de estímulo para GH patológico (test de clonidina y de hipoglucemia insulínica), con niveles de IGF-1 sérica por debajo de 2 DE para edad y sexo y que recibieron tratamiento con rhGH al menos durante un año y alcanzaron talla final o adulta. Los criterios de exclusión fueron los pacientes con historia clínica incompleta o que abandonaron el seguimiento antes de alcanzar la talla final y los pacientes con déficit hormonal múltiple.
Los pacientes fueron clasificados según el nivel pico de GH en la prueba de estímulo. Al inicio del tratamiento, el diagnóstico de DGH se definió por pico ≤ 10 ng/mL. Tras la reevaluación a talla adulta, el DTGH se definió cuando el pico de GH fue ≥ 6,1 ng/mL; el resto de los pacientes fueron catalogados como DPGH, ya que este punto de corte posee gran sensibilidad (96%) y especificidad (100%)10. Las técnicas utilizadas para la determinación de IGF-1 fueron inmunoanálisis y radioinmunoanálisis, mientras que la determinación de GH se hizo también a través de métodos de inmunoanálisis: fueron varios los kit comerciales utilizados, al tratarse de un estudio retrospectivo que incluye un periodo de tiempo extenso.
Los datos fueron recogidos de las historias clínicas. Los datos obtenidos al inicio del tratamiento fueron: sexo, edad cronológica, talla inicial, talla genética, índice de masa corporal, estadio puberal, edad ósea con predicción de talla adulta (PTA) calculada según el método de Bayley-Pinneau13, nivel pico de GH en test de estímulo y dosis de rhGH. En la revisión tras el primer año de tratamiento y la revisión a talla final se analizaron, además de los anteriores: la dosis de rhGH, la PTA, la velocidad de crecimiento así como la talla final. Se catalogó como respuesta satisfactoria al primer año de tratamiento cuando se objetivó un aumento de la talla en más de 0,3 DE con respecto a la talla inicial, tomando como referencia el estudio de Cohen et al.14. Finalmente, se realizaron comparaciones entre la variación de la talla final sobre la talla inicial, así como de la talla final con respecto a la PTA inicial. Los datos fueron expresados en valor absoluto, porcentajes y media ± desviación estándar (DE). Los análisis estadísticos se hicieron mediante el programa SPSS (versión 19.0). Se usó el test de t de Student para variables cuantitativas y el de U de Mann-Whitney para datos no distribuidos simétricamente. Los resultados se consideraron estadísticamente significativos si p < 0,05.
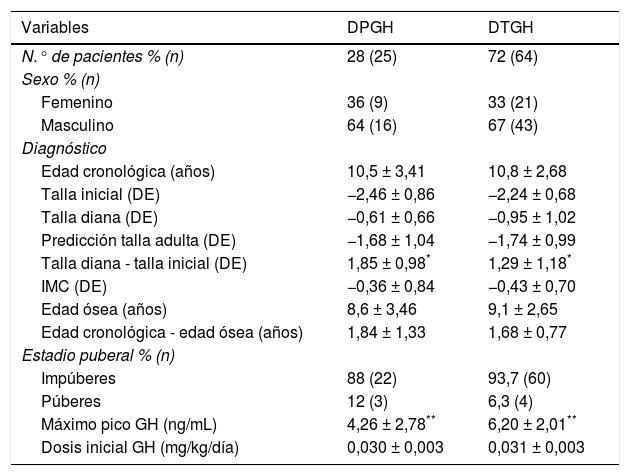
ResultadosSe revisaron un total de 153 historias clínicas de pacientes tratados con rhGH y 89 pacientes (67% varones) cumplieron los criterios de inclusión para el diagnóstico de DGH aislado (fig. 1). Los datos antes de empezar tratamiento y durante el seguimiento están analizados según el tipo de DGH (tablas 1 y 2). De ellos, 25 pacientes (28%) presentaron un DPGH en la reevaluación final mientras que 64 presentaron un déficit transitorio (72%). La edad cronológica al inicio del tratamiento fue de 10,5 ± 3,41 años y talla inicial de −2,46 ± 0,86 DE (niños: −2,47 ± 0,83 DE y niñas: −2,44 ± 0,96 DE, 68% del total con talla inicial < −2 DE y 52% con PTA-TD (talla diana) > 1 DE) para los pacientes con DPGH y edad cronológica de 10,8 ± 2,68 años y talla de −2,24 ± 0,68 DE (niños: −2,12 ± 0,64 DE y niñas: −2,49 ± 0,72 DE, de los que el 59% tenían una talla inicial < −2 DE y el 42% una PTA-TD > 1 DE) para el DTGH. En los pacientes con DPGH se objetivó una mayor talla genética y menor talla inicial, con una diferencia entre ambas estadísticamente significativa comparada con el grupo de DTGH (p = 0,026). En cuanto a la diferencia por sexos, la talla diana fue en el primer grupo de −0,41 ± 0,67 DE (172,2 ± 4,5cm) para niños y de −0,96 ± 0,51 DE (156,5 ± 3,3cm) para niñas, mientras que los valores respectivos en el segundo grupo fueron de −1,05 ± 0,87 DE (168,7 ± 5,5cm) y de −0,76 ± 1,27 DE (156,8 ± 6,8cm). El valor de PTA inicial dividido por sexos fue en el primer grupo de −1,33 ± 0,86 DE (166,4 ± 5,7cm) en niños y de −2,31 ± 1,08 DE (148,5 ± 6,5cm) en niñas; mientras que en el segundo grupo fueron de −1,71 ± 1,06 DE (164,5 ± 6,5cm) y de −1,81 ± 0,86 DE (151,5 ± 5,0cm), respectivamente.
Comparación de datos entre los pacientes con déficit permanente (DPGH) y transitorio de GH (DTGH) al inicio del tratamiento
| Variables | DPGH | DTGH |
|---|---|---|
| N.° de pacientes % (n) | 28 (25) | 72 (64) |
| Sexo % (n) | ||
| Femenino | 36 (9) | 33 (21) |
| Masculino | 64 (16) | 67 (43) |
| Diagnóstico | ||
| Edad cronológica (años) | 10,5 ± 3,41 | 10,8 ± 2,68 |
| Talla inicial (DE) | −2,46 ± 0,86 | −2,24 ± 0,68 |
| Talla diana (DE) | −0,61 ± 0,66 | −0,95 ± 1,02 |
| Predicción talla adulta (DE) | −1,68 ± 1,04 | −1,74 ± 0,99 |
| Talla diana - talla inicial (DE) | 1,85 ± 0,98* | 1,29 ± 1,18* |
| IMC (DE) | −0,36 ± 0,84 | −0,43 ± 0,70 |
| Edad ósea (años) | 8,6 ± 3,46 | 9,1 ± 2,65 |
| Edad cronológica - edad ósea (años) | 1,84 ± 1,33 | 1,68 ± 0,77 |
| Estadio puberal % (n) | ||
| Impúberes | 88 (22) | 93,7 (60) |
| Púberes | 12 (3) | 6,3 (4) |
| Máximo pico GH (ng/mL) | 4,26 ± 2,78** | 6,20 ± 2,01** |
| Dosis inicial GH (mg/kg/día) | 0,030 ± 0,003 | 0,031 ± 0,003 |
IMC: índice de masa corporal.
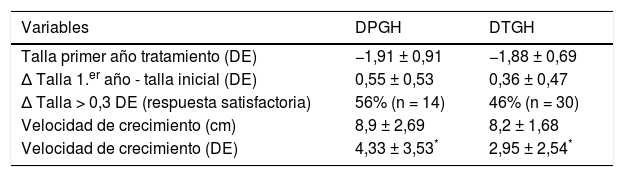
Comparación de datos entre los pacientes con déficit permanente (DPGH) y transitorio de GH (DTGH) tras el primer año de tratamiento con rhGH
| Variables | DPGH | DTGH |
|---|---|---|
| Talla primer año tratamiento (DE) | −1,91 ± 0,91 | −1,88 ± 0,69 |
| Δ Talla 1.er año - talla inicial (DE) | 0,55 ± 0,53 | 0,36 ± 0,47 |
| Δ Talla > 0,3 DE (respuesta satisfactoria) | 56% (n = 14) | 46% (n = 30) |
| Velocidad de crecimiento (cm) | 8,9 ± 2,69 | 8,2 ± 1,68 |
| Velocidad de crecimiento (DE) | 4,33 ± 3,53* | 2,95 ± 2,54* |
Δ: Diferencia entre 2 valores/incremento del valor.
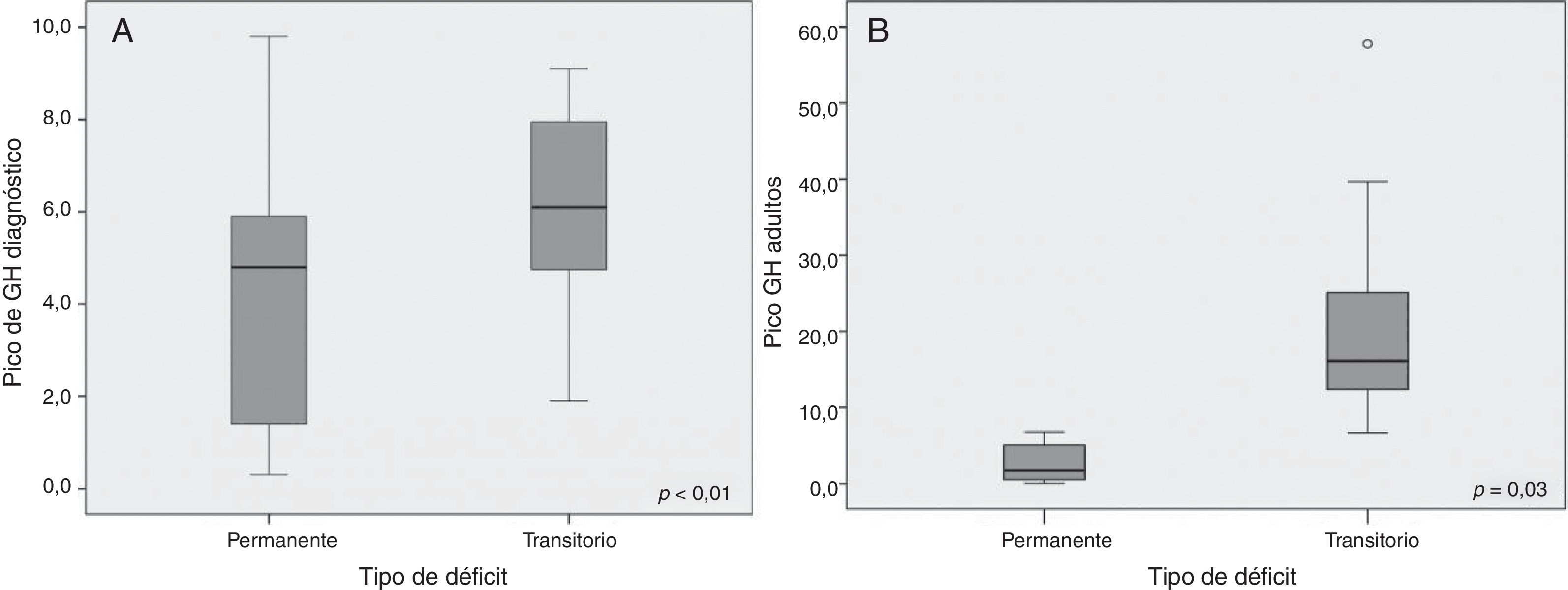
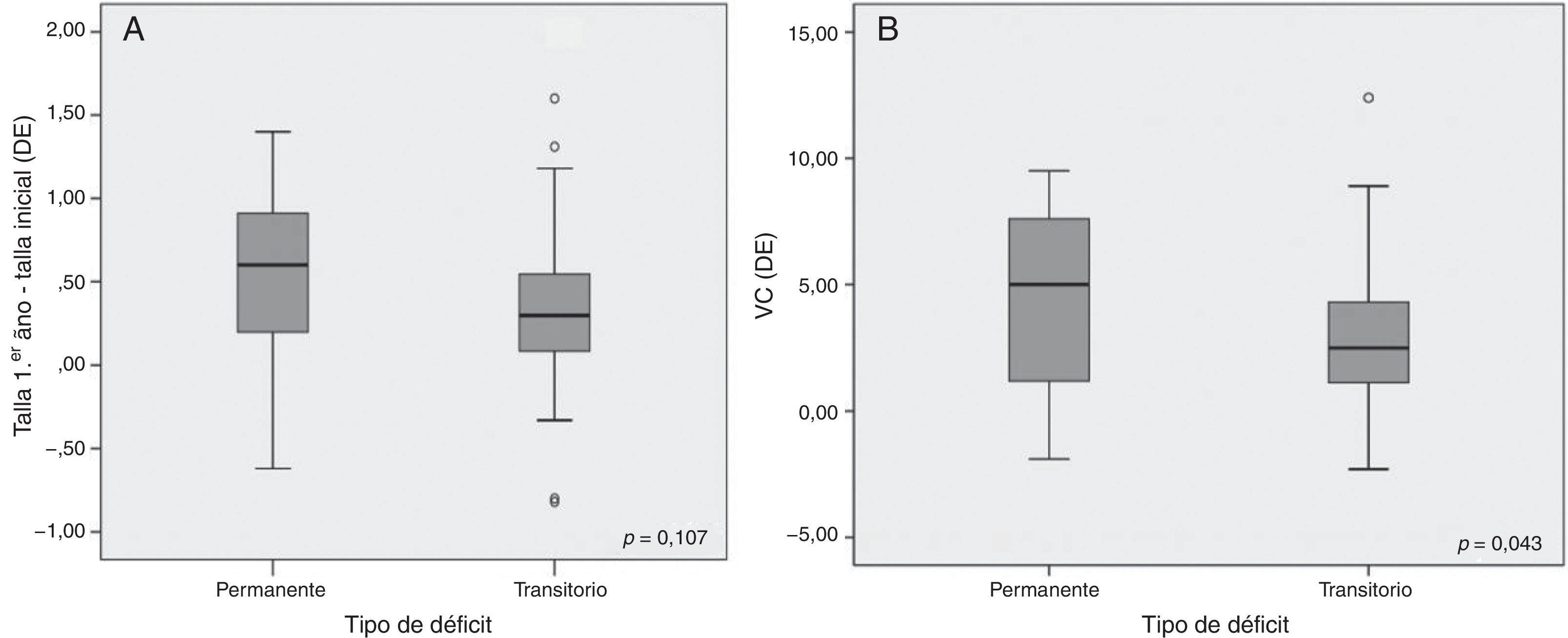
Se objetivaron resultados significativos en cuanto a la determinación de GH tras las pruebas de estímulo: el valor pico de GH al diagnóstico fue de 4,26 ± 2,78 en el DPGH y de 6,20 ± 2,01 ng/mL en el DTGH (p < 0,01) (fig. 2A). También en la reevaluación con el test de hipoglucemia insulínica realizado al alcanzar la talla final (pico de GH de 2,60 ± 2,54 vs. 19,59 ± 10,75 ng/mL respectivamente, p = 0,003) (fig. 2B). No se hallaron diferencias significativas entre la dosis inicial de rhGH, el índice de masa corporal, la edad ósea y el estadio puberal entre ambos grupos. Tras el primer año de tratamiento (tabla 2), se observó un 56% de buenos respondedores en los pacientes con DPGH y un 46% en el DTGH cuando se valoró un cambio en la talla mayor de 0,3 DE (incremento de talla de 0,55 ± 0,53 DE vs. 0,36 ± 0,47 DE, respectivamente). Además, la variación de la velocidad de crecimiento fue significativamente mayor en el grupo con DPGH (4,33 ± 3,53 DE vs. 2,95 ± 2,54 DE en el grupo con DTGH; p = 0,043) (fig. 3A y 3B).
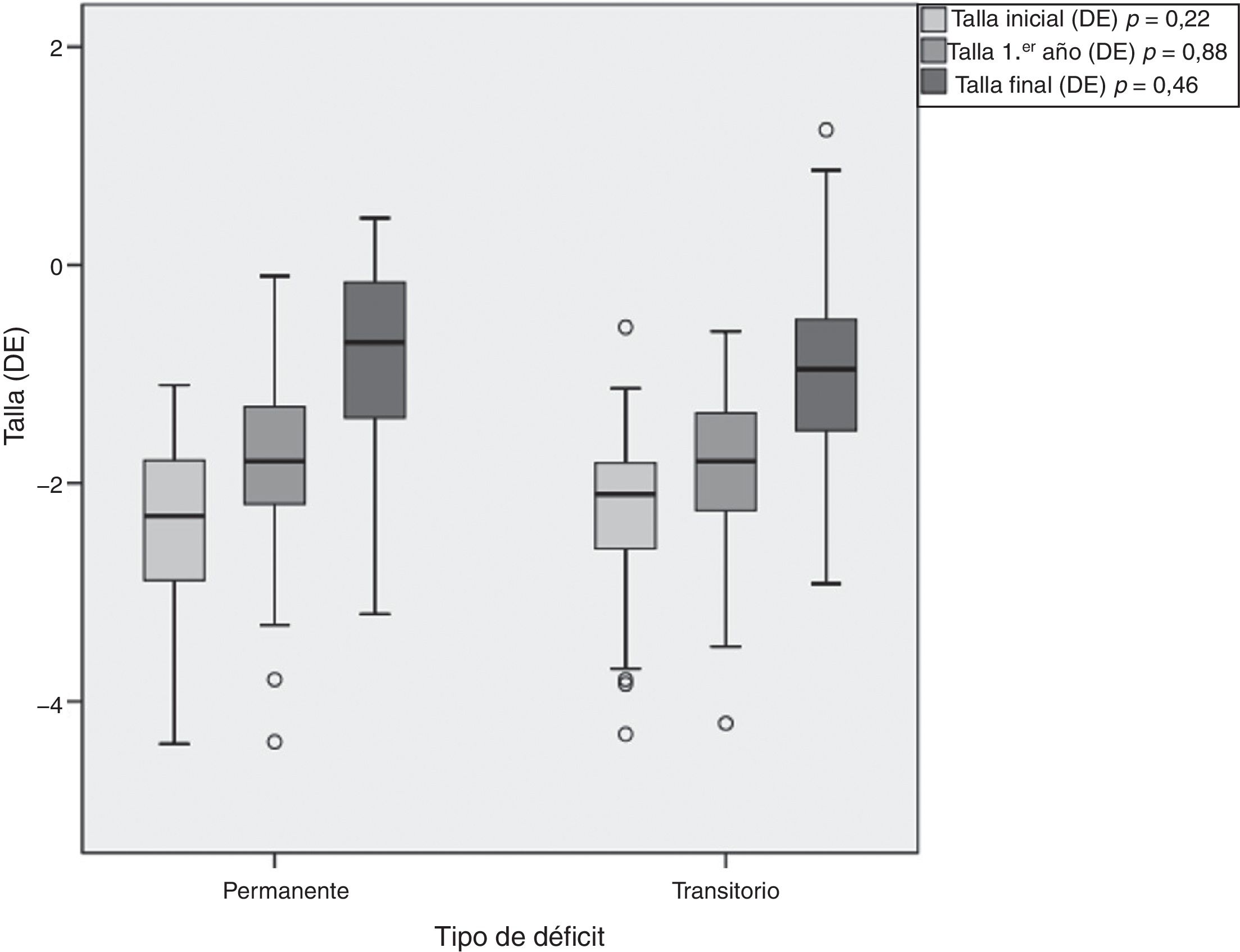
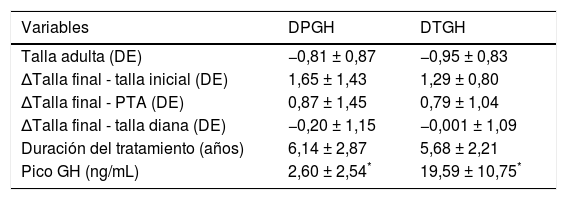
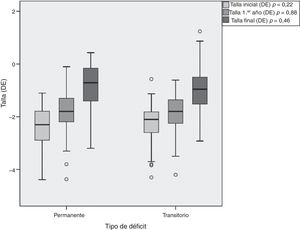
La duración del tratamiento fue de 6,14±2,87 años para los pacientes con DPGH y de 5,68±2,21 años para los del DTGH (tabla 3). Los pacientes con DPGH alcanzaron una talla final de −0,8±0,87 DE (niños de −0,68±0,86 DE [170,6±6,0cm] y niñas de −1,03±0,84 DE [156,4±4,1cm]) y los pacientes con DTGH de −0,95±0,83 DE (niños de −0,86±0,80 DE [168,3±5,4cm] y niñas de −1,15±0,89 DE [155,2±5,5cm]). Aunque se objetivó mayor recuperación con respecto a la talla inicial en los pacientes con DPGH (1,65±1,43 vs. 1,29±0,80 DE), estas diferencias no fueron significativas (p = 0,46) (fig. 4).
Comparación de datos entre los pacientes con déficit permanente (DPGH) y transitorio de GH (DTGH) al finalizar tratamiento y alcanzar talla final
| Variables | DPGH | DTGH |
|---|---|---|
| Talla adulta (DE) | −0,81 ± 0,87 | −0,95 ± 0,83 |
| ΔTalla final - talla inicial (DE) | 1,65 ± 1,43 | 1,29 ± 0,80 |
| ΔTalla final - PTA (DE) | 0,87 ± 1,45 | 0,79 ± 1,04 |
| ΔTalla final - talla diana (DE) | −0,20 ± 1,15 | −0,001 ± 1,09 |
| Duración del tratamiento (años) | 6,14 ± 2,87 | 5,68 ± 2,21 |
| Pico GH (ng/mL) | 2,60 ± 2,54* | 19,59 ± 10,75* |
Δ: diferencia entre 2 valores/incremento del valor; PTA: predicción de talla adulta.
Desde el año 1998, en que se aprobó en España el uso del tratamiento con rhGH en el paciente adulto con DGH, se han ido modificando las indicaciones de tratamiento tanto en la edad pediátrica como en los adultos: están vigentes las aceptadas en el año 200815. En la edad pediátrica, los criterios de tratamiento hacen referencia a una talla de < −2 DE, talla o PTA que se encuentren por debajo de 1 DE respecto a la talla genética, velocidad de crecimiento < p10 para su correspondiente edad ósea y retraso de la maduración ósea de al menos un año respecto a la edad cronológica.
Se han publicado diferentes formas de evaluar la respuesta al tratamiento con GH, con un amplio espectro de efectividad en términos de talla adulta16-18. La mayoría de las publicaciones confirman una mejor respuesta al tratamiento en los pacientes con déficit severo de GH, que son los tienen un menor valor pico de GH tras las pruebas de estímulo y persisten con DGH en la edad adulta19-21.
En este estudio se presentan datos sobre la respuesta a corto y largo plazo de los pacientes diagnosticados de DGH en la edad pediátrica clasificándolos en 2grupos de DPGH y DTGH cuando fueron reevaluados en la transición a las consultas de adultos. En ambos grupos se objetivó un incremento de la talla (medida en DE) tanto en comparación con la talla al inicio del tratamiento como con la PTA correspondiente. Sin embargo, destaca la mayor recuperación de talla en el grupo de pacientes que tenían un defecto permanente de GH o diagnóstico final de DPGH.
En la muestra descrita, los pacientes con DPGH presentaron al diagnóstico una talla inicial más baja y mayor diferencia respecto a su talla genética, características similares a las encontradas por Wetsphal et al.22. Asimismo, este grupo de pacientes representó el 28% del total de la muestra, proporción algo menor comparada con el 40% hallado en el estudio de Tauber et al.23 y el 44% objetivado por Deillon et al.2. La mayoría de los pacientes fueron varones (66%), con una relación 2:1 con mujeres, de acuerdo con lo descrito en otros estudios24-26. Asimismo, se halló un valor pico de GH significativamente menor en los DPGH que en los DTGH, y una mejor respuesta de la talla, como se ha mencionado previamente.
En cuanto a la efectividad del tratamiento tras el primer año con rhGH, se ha definido como buena respuesta al tratamiento un incremento de >0,3-0,5 DE con respecto a la talla inicial, aunque esta respuesta es considerada dosis-dependiente y tiene gran variabilidad14. En nuestro estudio, se objetivó un incremento en la talla de 0,55 ± 0,53 DE y de 0,36±0,47 DE para el grupo de DPGH y de DTGH, respectivamente. Con relación a la velocidad de crecimiento, se observó la fase inicial de catch-up durante este primer año de tratamiento, que fue de 4,33±3,53 DE (8,9±2,69cm) y de 2,95±2,54 DE (8,2±1,68cm) en los pacientes con DPGH y DTGH, respectivamente, resultados estadísticamente significativos. Salah et al.20 describieron una mejoría de la talla de 0,8 y 0,6 DE en pacientes con déficit severo y parcial de GH, tras el primer año de tratamiento. Asimismo, describieron un incremento de la velocidad de crecimiento de 4,7 DE (9,3cm) y de 3,4 DE (8,3cm), respectivamente, resultados que concuerdan con los hallados en nuestro estudio. Por el contrario, Cardoso et al.19 hallaron un mayor incremento en el primer año de tratamiento en el grupo de pacientes con DPGH en ambos parámetros (ganancia de talla de 0,41 DE vs. 0,52 DE y velocidad de crecimiento de 7,43cm vs. 8,42cm, respectivamente).
La seguridad del tratamiento con rhGH no fue evaluada en este estudio, ya que se precisa un tiempo de observación después de suspendido. Sin embargo, no se objetivaron efectos secundarios graves durante su uso. Por otro lado, varios autores demuestran que el tratamiento con rhGH podría ser seguro, siempre y cuando la indicación sea individualizada y el seguimiento estrecho27,28.
En cuanto a las limitaciones del estudio, podemos señalar el pequeño tamaño muestral debido a los estrictos criterios de inclusión y que solo se incluyó a pacientes con talla final y revaluación con test de estímulo tras finalizar el tratamiento. Otra de las limitaciones podría estar en relación con las técnicas de análisis empleadas a lo largo del tiempo que incluyó el estudio, concretamente en la determinación de IGF-1 y GH como ya hemos mencionado. Además, no contamos con un grupo control (talla baja idiopática sin tratamiento) con el que hacer las comparaciones respectivas.
En conclusión, se han descrito las características auxológicas de un grupo de pacientes pediátricos diagnosticados de DGH en los que se ha observado una mayor efectividad en términos de crecimiento, tanto a corto como a largo plazo, en el grupo con diagnóstico final de DPGH. Sin embargo, se precisan estudios con un mayor número de pacientes en los que se evalúe el beneficio global con relación al crecimiento, aparición de efectos adversos y mejoría de la calidad de vida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.