El tratamiento con el sistema MiniMed 640G-SmartGuard® (640G-SG, infusión subcutánea continua de insulina con sensor de monitorización continua de glucosa intersticial implementado con suspensión automática por predicción de hipoglucemia) ha demostrado en estudios previos, disminución del riesgo de hipoglucemia sin producir alteraciones en el control metabólico en pacientes con DM1. El objetivo del estudio fue evaluar la efectividad del sistema 640G-SG sobre la frecuencia de hipoglucemia y su impacto sobre el control metabólico en una población pediátrica con DM1.
Pacientes/métodosEstudio retrospectivo que incluyó 21 niños tratados con 640G-SG. Se analizaron previo y durante su uso: HbA1c, glucemia media (mg/dl), coeficiente de variación de glucosa, frecuencia de hipoglucemia (<70mg/dl) e hiperglucemia (>180mg/dl), controles de glucemia capilar/día, episodios de cetosis/cetoacidosis e hipoglucemias graves. En el último mes de uso: glucemia en ayunas, frecuencia de uso del sensor y número y duración de eventos de suspensión.
ResultadosLos pacientes llevaron el sistema continuamente durante 5,0±2,1 meses con mediana de uso del 92%. Objetivamos disminución significativa de la frecuencia de hipoglucemia (10,4±5,2% a 7,6±3,3%, p=0,044) y del número de controles de glucemia capilar/día (11,3±2,2 a 8,1±2,1, p<0,001), sin aumento de hiperglucemia (p=0,65). Duración media de suspensión de infusión de insulina 3,1±1,2 h/día (37,3% suspensión nocturna). Sin cambios significativos en HbA1c, glucemia media, ni coeficiente de variación. Ningún paciente presentó cetosis/cetoacidosis ni hipoglucemia grave.
ConclusionesLa suspensión automática de infusión de insulina por predicción de hipoglucemia implementada en MiniMed 640G-SmartGuard® ayuda a evitar el riesgo de hipoglucemia, sin empeorar el control metabólico ni provocar cetosis/cetoacidosis, y reduce la carga de controles adicionales de glucemia en nuestra cohorte pediátrica.
Treatment with the MiniMed 640G-SmartGuard® system (640G-SG, sensor-augmented insulin pump system with low predicted glucose suspension feature) has been shown to decrease risk of hypoglycemia without altering metabolic control in patients with T1DM. The study purpose was to assess the impact of 640G-SG on hipoglycemia frequency and on metabolic control in a pediatric population with T1DM.
Patients/methodsA retrospective study on 21 children treated with 640G-SG. HbA1C, mean blood glucose (mg/dl), glucose variation coefficient, frequency of hypoglycemia (<70mg/dl) and hyperglycemia (>180mg/dl), daily capillary blood glucose measurements, ketosis/diabetic ketoacidosis, and severe hypoglycemic episodes were analyzed and compared before and during use of the system. Fasting blood glucose, frequency of sensor use and number and duration of system suspension events were also assessed in the last month of use of the system.
ResultsAll patients used the system continuously (5.0±2.1 months), with a median sensor use of 92%. Significant decreases were seen in hypoglycemia frequency (10.4±5.2% to 7.6±3.3%, p=.044) and number of capillary blood glucose measurements (11.3±2,2 to 8.1±2,1, p<.001), and there was no increase in hyperglycemia frequency (p=.65). Mean system suspension time was 3.1±1.2hours/day (37.3% of overnight stops). Changes in HbA1c, mean blood glucose, and variation coefficient were not significant. No patient experienced diabetic ketoacidosis or severe hypoglycemia.
ConclusionsThe sensor-augmented pump with the predictive low glucose suspension management system, as implemented in the 640G-SG system, can help avoid risk of hypoglycemia without significantly affecting metabolic control or causing diabetic ketoacidosis, and decrease the burden of additional capillary blood glucose measurements in our pediatric cohort.
La intensificación del tratamiento de la diabetes mellitus tipo 1 (DM1) ha demostrado la mejora del control metabólico, así como el mantenimiento de la reserva pancreática durante más tiempo, con la consecuente disminución del riesgo de desarrollar complicaciones a corto y largo plazo1,2. Sin embargo, aún no se ha podido superar el temor a la hipoglucemia, que puede ser provocada por el ejercicio, exceso de bolos de insulina, disminución de la ingesta, etc., y que representa en la actualidad un factor limitante para establecer la terapia intensiva. Como es conocido, en población pediátrica así como en adultos, la mayoría de estos eventos se presentan en periodo nocturno3,4 y muchos de ellos pueden llegar a ser graves5,6, lo que genera gran ansiedad y compromete la calidad de vida, tanto de los padres o cuidadores7 como de los propios pacientes. Además, las hipoglucemias nocturnas no diagnosticadas pueden ser la causa de posteriores hipoglucemias inadvertidas, teniendo repercusión a corto y largo plazo en el sistema nervioso y cardiovascular8,9.
El tratamiento con infusión subcutánea continua de insulina (ISCI) junto con la monitorización continua de glucosa intersticial (MCG) e implementado con suspensión automática ante hipoglucemia ha demostrado su eficacia en la reducción de los eventos de hipoglucemia10. Este sistema detiene automáticamente la infusión de insulina durante 2 h al llegar a un umbral predeterminado de niveles de glucosa con el objetivo de reducir la duración de dicho evento11. Con este sistema se ha conseguido una reducción de la duración de las hipoglucemias sin incremento significativo de la frecuencia de hiperglucemia ni aparición de cetosis4.
El siguiente paso hacia el páncreas artificial se ha conseguido al desarrollar un sistema integrado (SI) consistente en dicha ISCI más MCG, con la característica añadida de suspensión automática de la infusión de insulina por predicción de hipoglucemia, con reanudación automática de la misma cuando se ha superado este riesgo. Con ello, se lograría prevenir la aparición de eventos de hipoglucemia, así como también reducir su duración si se presentasen. Se ha comprobado la seguridad de este SI incluso en estudios en donde se evalúa solo el periodo nocturno (por la mayor frecuencia de hipoglucemias inadvertidas), donde se ha registrado una reducción de la frecuencia de las mismas hasta en un 50%12.
Este sistema está disponible actualmente en la bomba MiniMed 640G-SmartGuard® ([640G-SG], Medtronic MiniMed, Northridge, California, EE. UU.) con la característica de suspensión antes de la hipoglucemia («predictive low glucose suspension») que detiene la infusión de insulina basal cuando se predice la aparición de hipoglucemia. Se ha evaluado este sistema en un número reducido de pacientes adultos y pediátricos en estudios con control hospitalario en los que se ha demostrado disminución significativa de los eventos de hipoglucemia sin aumentar por ello la frecuencia de hiperglucemias ni evidenciar aparición de cetosis13.
El objetivo principal de este estudio fue evaluar la efectividad del sistema 640G-SG en cuanto al riesgo de presentar eventos de hipoglucemia y su impacto sobre el control metabólico en la práctica clínica habitual, en una cohorte pediátrica con DM1.
Material y métodosSe diseñó un estudio de tipo retrospectivo y descriptivo que incluyó 21 pacientes pediátricos con DM1 (43% varones) seguidos en la Unidad de Diabetes pediátrica del Hospital Universitario Ramón y Cajal, que fueron tratados con el Sistema Integrado MiniMed 640G-SmartGuard®, el cual incluye la función de suspensión por predicción de hipoglucemia. El sistema SmartGuard suspende automáticamente la infusión de insulina si se prevé que la glucosa intersticial va a disminuir hasta 20mg/dl por encima del límite umbral preestablecido dentro de los siguientes 30 min y el valor de la glucosa es 70mg/dl o menos por encima del límite fijado. Se reanuda de forma automática la infusión de insulina cuando la glucosa intersticial se encuentra 20mg/dl por encima del límite umbral preestablecido, se prevé que llegará a estar 40mg/dl por encima de dicho umbral en los próximos 30 min y dicha infusión ha estado suspendida por lo menos 30 min (si no se realiza la reanudación manual de la infusión).
Los pacientes recibieron educación previa acerca del funcionamiento del sistema 640G-SG y del glucómetro Contour® Next Link 2,4 (Bayer, Indianapolis, IN) por parte de los pediatras diabetólogos y educadores de la Unidad de Diabetes. Asimismo, fueron entrenados en el uso del sensor Enlite™ (Medtronic) y el transmisor Guardian™ 2 Link (Medtronic) por parte de personal entrenado de Medtronic. Al momento de iniciar el uso del 640G-SG se estableció 60mg/dl de glucosa como nivel umbral de hipoglucemia durante las 24 h que consideramos adecuado para maximizar el efecto de la función de suspensión por predicción. Para evitar hiperglucemias aconsejamos a los padres/cuidadores dejar actuar al sistema excepto en los casos que existiera mucha insulina activa, ejercicio previo intenso o presencia de flechas de tendencia que indiquen disminución rápida de la glucosa. Este umbral de suspensión, aunque menor que los establecidos en otros estudios (nivel umbral de 70mg/dl14,15 y 80mg/dl12,16–18 se ha propuesto en un protocolo publicado recientemente19. Se desactivaron todas las alarmas, salvo la de presencia de hipoglucemia que viene predefinida por defecto, con el fin de minimizar el riesgo de sobreactuación por parte de los padres o cuidadores. Los pacientes realizaron glucemias capilares antes de tomar decisiones terapéuticas tales como administración de bolos preingesta o de corrección, ante eventos de hipoglucemia, y ante el ejercicio.
Los datos fueron recogidos de las historias clínicas, descargas de glucómetro y del sistema en el programa Care Link® Pro Software (Medtronic), en el momento previo al inicio del SI, y en el momento del análisis de las variables, coincidiendo con una revisión clínica programada.
Se realizaron las siguientes comparaciones antes y después del uso del sistema 640G-SG (datos de los últimos 90 días): hemoglobina glicosilada (valor normal 5,31±0,31% [HbA1c, HPLC-Menarini]), glucemia media (mg/dl), coeficiente de variación de glucosa (%, DE/glucemia media x 100), frecuencia de hipoglucemia (glucemia <70mg/dl) e hiperglucemia (glucemia >180mg/dl) sobre el total de controles de glucosa capilar (CGC) realizados en dicho periodo, y número de CGC al día, los cuales fueron obtenidos mediante descarga de glucómetro, teniendo como referencia los controles mínimos recomendados.
Además, se analizó en los últimos 30 días de tratamiento: glucemia en ayunas (mg/dl), frecuencia del uso del sensor y eventos de suspensión del sistema con el tiempo de duración media de los mismos. Los datos fueron expresados en valor absoluto y relativo, media±desviación estándar (DE), mediana y rango. Se utilizó el programa estadístico SPSS para el análisis de datos, mediante pruebas no paramétricas y Chi cuadrado. Los resultados se consideraron estadísticamente significativos si p<0,05.
ResultadosLa edad media (±DE) de los pacientes en el momento del estudio fue 10,0±3,4 (rango: 2,4-16,3) años y la edad al diagnóstico de la DM1 fue de 4,3±3,2 (0,9-11,9) años, con una media de duración de la enfermedad de 5,7±2,9 (0,7-11,0) años. En cuanto al tratamiento previo al inicio del sistema 640G-SG: 8 pacientes (33%) usaban ya ISCI y algún otro tipo de MCG, 10 pacientes (48%) eran portadores de ISCI sin MCG y 3 pacientes (19%) que iniciaron el SI (MiniMed 640G-SmartGuard®) de forma simultánea estaban tratados previamente con múltiples dosis de insulina. De los 8 pacientes usuarios de ICSI y MCG, solo 2 tenían el sistema de suspensión automática por hipoglucemia previo al inicio del estudio. El tiempo de uso de ISCI previo al inicio del 640G-SG fue 5,3±2,9 (0,2-10,4) años. Ninguno de los pacientes tenía antecedentes de episodios de hipoglucemia grave o CAD. Las indicaciones de 640G-SG fueron: en el 48% de los pacientes hipoglucemias leves frecuentes (> 10%), en el 19% hipoglucemias inadvertidas (test de Clarke en los niños mayores de 8 años, n=17) y en el 33% para mejorar la calidad de vida. El uso del sistema fue de 5,0±2,1 (1,0-9,2) meses y 14,3% de los pacientes lo utilizaron menos de 3 meses en el momento del análisis de datos. Durante este tiempo los pacientes lo llevaron de manera continuada, con una mediana de uso del sensor de 92% (rango intercuartílico: 81,5–94%).
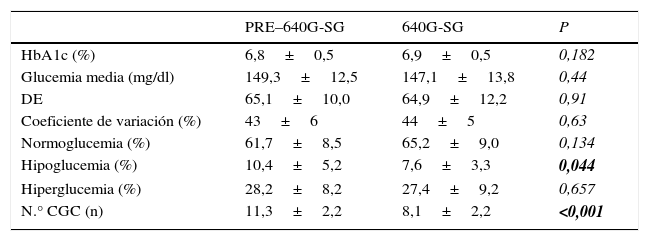
Como resultado principal se objetivó disminución significativa en la frecuencia de hipoglucemia (tabla 1): de 10,4±5,2% a 7,6±3,3% (p=0,044) previo y tras uso de 640G-SG, respectivamente, sin aumentar de forma significativa la frecuencia de hiperglucemia (28,2±8,3% vs. 27,4±9,2%, p=0,65). Además objetivamos una reducción significativa en el número de CGC: de 11,3±2,2 a 8,1±2,1 CGC en 24 h (p<0,001).
Parámetros metabólicos de control de la DM1 antes y durante el uso del sistema integrado
| PRE–640G-SG | 640G-SG | P | |
|---|---|---|---|
| HbA1c (%) | 6,8±0,5 | 6,9±0,5 | 0,182 |
| Glucemia media (mg/dl) | 149,3±12,5 | 147,1±13,8 | 0,44 |
| DE | 65,1±10,0 | 64,9±12,2 | 0,91 |
| Coeficiente de variación (%) | 43±6 | 44±5 | 0,63 |
| Normoglucemia (%) | 61,7±8,5 | 65,2±9,0 | 0,134 |
| Hipoglucemia (%) | 10,4±5,2 | 7,6±3,3 | 0,044 |
| Hiperglucemia (%) | 28,2±8,2 | 27,4±9,2 | 0,657 |
| N.° CGC (n) | 11,3±2,2 | 8,1±2,2 | <0,001 |
CGC: controles de glucemia capilar; DE: desviación estándar; HbA1c: hemoglobina glicosilada; 640G-SG: MiniMed 640G-SmartGuard.
Los resultados en negrita indican que los valores son estadísticamente significativos (p<0,05).
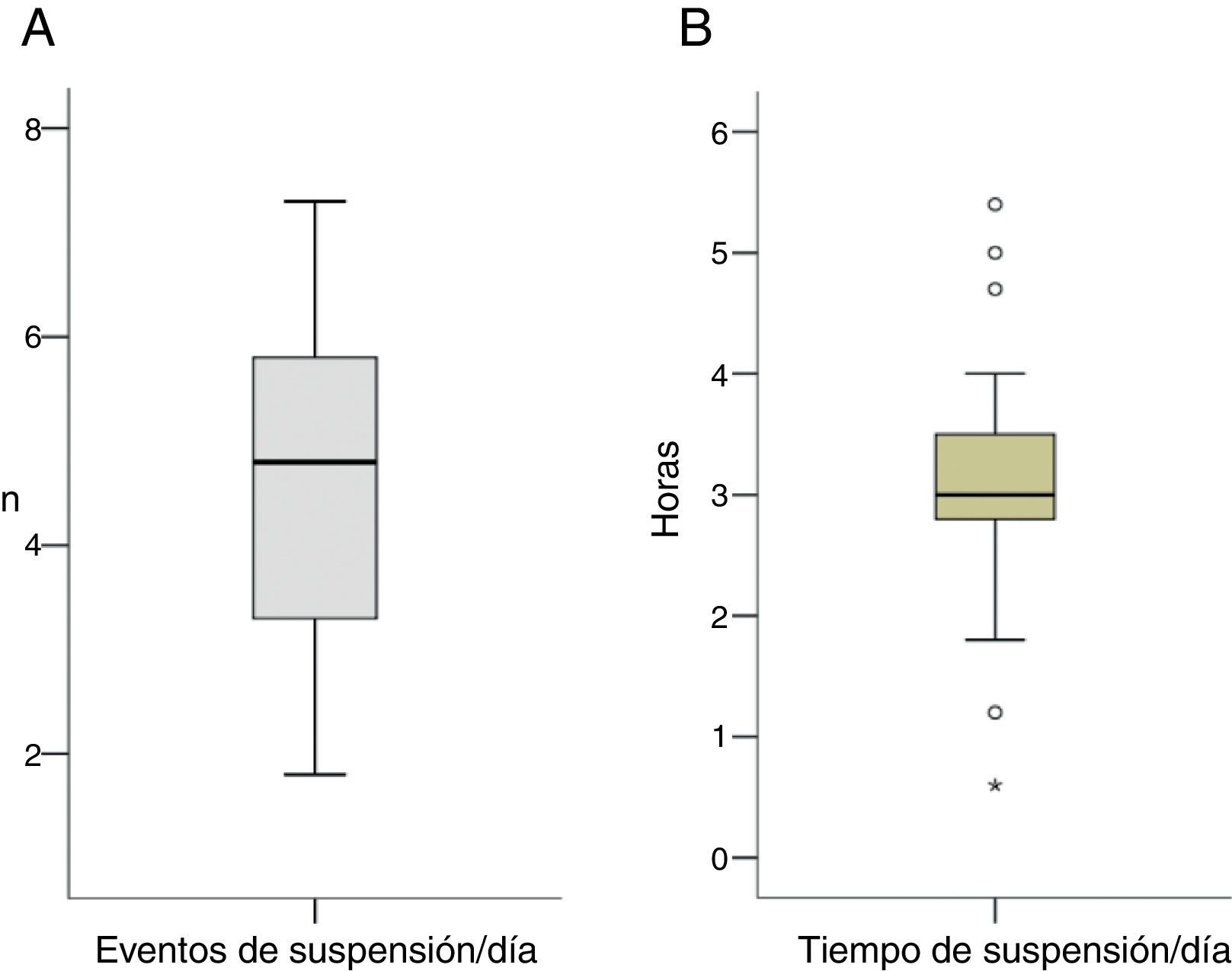
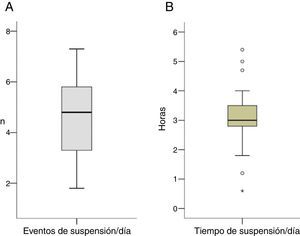
Con respecto a la suspensión del SI se registraron una media de 4,6±1,6 (1,8-7,3) eventos de suspensión al día (40,4% de eventos nocturnos), con una duración de la suspensión de 3,1±1,2 (0,6-5,4) h al día, con 37,3% de tiempo de suspensión nocturna (fig. 1A, 1B). La mayoría de las suspensiones con duración de 2 h se registraron en periodo nocturno (39% suspensiones diurnas vs. 61% de suspensiones nocturnas). Por otra parte, se objetivó una tendencia a la disminución de los niveles de la glucemia en ayunas tras SI, aunque esta no fue significativa (p=0,16).
No se hallaron diferencias significativas entre los niveles de glucosa en ayunas tras suspensión nocturna del SI vs. niveles de glucosa tras no suspensión nocturna (138,9±14,6mg/dl vs. 133,1±21,1mg/dl, p=0,11). Por último, no se hallaron diferencias en cuanto a HbA1c (6,8±0,48% vs. 6,9±0,49%, p=0,18), glucemia media (149,3±12,5 vs. 147,2±13,8mg/dl, p=0,44) ni CV (43,1±5,9% vs. 43,8±5,3%, p=0,64) al comparar datos previos y con el uso del SI. Ningún paciente presentó episodios de CAD, cetosis o HG durante el periodo estudiado.
Cabe mencionar que tres pacientes retiraron el sistema 640G-SG por decisión de la familia, con tiempo medio de uso del sistema de 2,41±0,78 (1,07-3,77) meses.
DiscusiónAún no existen datos publicados sobre la experiencia clínica con MiniMed 640G-SmartGuard® en la población pediátrica española. Este sistema está disponible en nuestro país desde abril de 2015. Dado que la DM1 es una de las patologías crónicas más relevantes desde el punto de vista sociosanitario, los datos mostrados sugieren que a corto plazo, este sistema 640G-SG permite reducir el riesgo de presentar eventos de hipoglucemia de forma significativa. En nuestro estudio esta reducción alcanzó el 26,9% (de 10,4 a 7,6%). Asimismo, objetivamos la buena tolerancia y adherencia al sistema, como lo demuestra el 92% de uso continuado de la MCG.
Dentro de los estudios actuales que evalúan la efectividad de este sistema se encuentra el estudio de Choudhary et al.13 que incluyó a 16 pacientes pediátricos, mostrando datos concordantes con los encontrados en nuestro estudio en cuanto a prevenir los eventos de hipoglucemia, sin que por esto aumente la frecuencia de hiperglucemia. Biester et al., en un estudio reciente evalúa también este sistema en niños y adolescentes (2 semanas con ISCI y sensor vs. 6 semanas con SI), concluyendo que este algoritmo de suspensión automática por predicción de hipoglucemia es seguro para evitar dichos eventos en esta población, sin empeorar por ello el control metabólico en términos de HbA1c15. De la misma manera, comunicaciones recientemente expuestas comprueban la disminución en la frecuencia de hipoglucemia20 así como una mejoría de la calidad de vida21.
Adicionalmente, en el estudio PILGRIM14, que dividió a los pacientes en tres grupos y empleó un modelo desarrollado «in silico» para comparar un sistema similar (ISCI Paradigm®VEO con sensor de glucemia Enlite™ [Medtronic, Inc.]) frente a la suspensión automática por hipoglucemia y al control (no suspensión de ISCI), se objetivó una disminución significativa del número de hipoglucemias en 22 pacientes de 14 a 20 años, tras la realización de ejercicio como inductor de las mismas. La frecuencia de hipoglucemia se redujo en 26,7% frente a la no suspensión de la bomba y en 5,3% frente a la suspensión automática en hipoglucemia. Asimismo se halló una reducción significativa de la duración de los eventos de hipoglucemia comparada con la suspensión automática.
Cuando se evaluó, en el medio hospitalario, un sistema similar (ISCI Medtronic Paradigm Veo™ y sensor de glucemia Enlite™) frente a la administración de bolos extra de insulina y aumento de los tramos basales hasta 180% en periodo nocturno, se objetivó disminución significativa de la necesidad de administrar hidratos de carbono como tratamiento de la hipoglucemia en los pacientes que utilizaron el sistema con parada por predicción de hipoglucemia, sin registrar hiperglucemia postsuspensión de bomba incluso con suspensiones de 2 h de duración16.
En relación con el número de controles de glucemia capilar, objetivamos una disminución significativa de las mismas de 11,3±2,2 a 8,1±2,1, sin que por esto los pacientes dejaran de realizarse los CGC mínimos necesarios para un adecuado control metabólico, lo que sugiere una mejoría en la calidad de vida, como ya se ha sugerido en estudios previos22.
El uso continuo del sistema no se ha asociado con peor evolución del control metabólico en términos de HbA1c, CV y glucemia media global, como lo han demostrado varios estudios, en donde las variaciones no resultan ser significativas13,17. En nuestro estudio observamos una ligera mejora de la glucemia media tras el uso del SI, aunque no significativa.
Uno de los principales inconvenientes de la suspensión de la administración de insulina por periodos de tiempo prolongados es el riesgo de cetoacidosis diabética. A este respecto, se realizó un estudio que evaluó el riesgo de presentar episodios de cetosis tras suspensión prolongada del SI, incluso con cifras normales de glucemia, en donde no se demostraron variaciones significativas en la cifra de β-hidroxibutirato en ayunas tras suspensión nocturna, lo que sugiere que no es necesaria la medición rutinaria de cuerpos cetónicos y las indicaciones de medición no deben ser distintas a las de los pacientes con tratamiento convencional con ISCI18. Además, esto ya se había demostrado en estudios previos con los sistemas de suspensión por detección de hipoglucemia, en donde no se registraron episodios de cetonuria ni cetonemia tras suspensión continua de 2 h del sistema10,23. En nuestro estudio ningún paciente refirió episodios de cetosis durante el uso del sistema.
En cuanto a los eventos de suspensión y el tiempo medio de duración diaria de dichos eventos, en nuestro estudio se objetivó una media de 4,6±1,6 (1,8-7,3) eventos de suspensión en 24 h, correspondiendo 40,4% a eventos nocturnos, con un tiempo medio de dicha suspensión de 3,1±1,2 (0,6-5,4) h al día, con 37,3% del tiempo ocurrido en periodo nocturno; lo cual corresponde con lo referido en el estudio de Choudary et al.13 en una cohorte de 31,7±17,1 años, en donde se objetiva más eventos de suspensión durante el día, sin embargo, refieren un menor tiempo de duración por cada evento. Además registra un tiempo medio de suspensión del sistema de 56,4±9,6 min, cifra menor que la descrita en nuestro estudio, lo que podría estar en relación con la menor edad de nuestra población. Como se ha mencionado anteriormente, los estudios describen que la mayoría de los eventos de hipoglucemia suelen presentarse en el periodo nocturno. Un estudio publicado en 2015 con población exclusivamente pediátrica (4 a 14 años) evaluó el sistema MiniMed Paradigm REAL-Time Veo con sensor de glucemia Enlite™ (Medtronic, Inc) en relación con la reducción del tiempo de hipoglucemia durante la noche, concluyendo una reducción significativa del 54% y 50% del tiempo en hipoglucemia en los niños de 11 a 14 años y de 4 a 10 años, respectivamente, sin encontrar diferencias en cuanto a eventos de cetosis17. Además analizaron la glucemia en ayunas comparando el SI activo vs. el SI inactivo (controles), no evidenciando diferencias significativas en el grupo de 4 a 10 años (158±22mg/dl vs. 154±25mg/dl, respectivamente, p=0,11) lo que coincide con los resultados de nuestro estudio (glucemia en ayunas tras suspensión nocturna del SI de 138,9±14,6mg/dl vs. 133,1±21,1mg/dl tras no suspensión del SI, p=0,11). Sin embargo, sí se hallaron en el mismo estudio diferencias significativas en el grupo de 11 a 14 años (176±28mg/dl vs. 159±29mg/dl, respectivamente, p<0,001). Esto coincide con los resultados hallados por Sherr et al.23 en donde se evaluó el sistema con suspensión por hipoglucemia y se halló mayor glucemia en ayunas de forma significativa en los usuarios del sistema comparados con los controles (191±68mg/dl vs. 141±75mg/dl, respectivamente, p<0,0001).
Una de las principales limitaciones hallada en este estudio, al ser de tipo retrospectivo, fue la imposibilidad de realizar una MCG ciega previa al inicio del tratamiento, para tener una mayor fiabilidad al comparar los datos de descarga del sistema integrado en cuanto a la frecuencia, duración y severidad de los eventos de hipoglucemia y la frecuencia de hiperglucemia. Por la misma razón, podrían considerarse dificultades para comparar datos de frecuencia de hipoglucemias sintomáticas y asintomáticas, siendo estas últimas producidas en su mayoría en periodo nocturno, es por esto que se realizó el análisis de los dos periodos de tiempo por separado. Asimismo, también se ha considerado que estos pacientes, al tener el sistema de MCG en tiempo real podrían no haber confirmado con CGC los valores de hipoglucemia del sensor por lo que podría verse infraestimada la frecuencia de hipoglucemia tras el uso del SI, sin embargo, pese a la disminución del número de CGC, estos no dejaron de ser el número necesario recomendado para un adecuado control metabólico. Por otro lado, uno de los factores que podría influir en una mayor glucemia en ayunas y que hemos considerado en nuestro estudio es que no siempre los pacientes o los padres reflejan las actitudes terapéuticas ante un episodio de hipoglucemia concreto, y en algunos casos podrían estar sobrecorrigiendo al dar hidratos de carbono que en algunos casos podrían no ser necesarios, manteniendo al paciente en normoglucemia solo con «dejar actuar al SI». Otra limitación a tener en cuenta y que podría ser considerada para siguientes estudios de tipo prospectivo es la realización de cuestionarios de calidad de vida, cuestionarios de miedo a la hipoglucemia en padres y pacientes o encuestas de satisfacción con el tratamiento. Sin embargo, la disminución significativa del número de controles de glucemia capilar (de 11,3±2,2 a 8,1±21 CGC al día) y la frecuencia de uso del sensor de más del 90% en estos pacientes son signos indirectos de la buena acogida del mismo.
En conclusión, el uso de ISCI implementado con MCG y la característica añadida de suspensión automática por predicción de hipoglucemia (MiniMed 640G-SmartGuard®) ayuda a evitar la aparición de dichos eventos, sin aumentar significativamente la frecuencia de hiperglucemia. Se evidencia además que no se modifican de forma significativa las cifras de glucemia en ayunas y que en la práctica clínica habitual no se registran eventos de CAD, cetosis ni hipoglucemia grave.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.