Los niños y adolescentes con diabetes mellitus tipo1 (DM1) presentan un alto riesgo de desarrollar enfermedad celiaca (EC), ya que ambas entidades tienen características genéticas comunes. Los objetivos son investigar la frecuencia de los genotipos HLA (sistema de histocompatibilidad de antígenos leucocitarios humanos) de EC en pacientes pediátricos con DM1 y establecer si el estudio HLA es un método adecuado para el cribado de EC en esa población y su coste-efectividad comparándolo con la estrategia del cribado serológico de EC.
Pacientes y métodosEstudio retrospectivo y descriptivo de 296 pacientes (148 niñas; 148 niños) menores de 18años con DM1 en seguimiento en un hospital terciario de Madrid. Se recogen datos de frecuencia de los genotipos DQ2/DQ8 en un subgrupo de 92 pacientes y del coste adicional de realizar HLA para el cribado de EC. Solo cuando el haplotipo HLA de riesgo (DQ2/DQ8) es negativo no es necesario continuar el estudio serológico seriado para EC.
ResultadosVeintitrés pacientes con DM1 (7,77%) fueron diagnosticados de EC. El 91,3% de los pacientes en los que se estudió el haplotipo HLA presentaron los alelos DQ2 o DQ8. En consecuencia, solo un 8,7% con haplotipo negativo (no DQ2 ni DQ8) se habrían beneficiado del estudio HLA para evitar su seguimiento serológico. En nuestra población el coste adicional de realizar el estudio HLA representa un coste sin beneficio de 105,2€/paciente en cada paciente positivo para DQ2 o DQ8.
ConclusionesEl estudio HLA no es coste-efectivo como método de cribado de EC en la DM1 dada la frecuente asociación de DM1 con los genotipos de riesgo de desarrollar EC.
Children and adolescents with type1 diabetes mellitus (T1DM) are at high risk for the development of celiac disease (CD) because of the common genetic characteristics of both conditions. The study objectives were to investigate the frequency of the human leukocyte antigen system (HLA) for CD in pediatric T1DM patients and to determine whether HLA testing is suitable for CD screening in that population and is cost-effective as compared to serological screening for CD.
Patients and methodsA retrospective, descriptive study was conducted in 296 patients (148 girls; 148 boys) with T1DM aged <18years who attended a hospital in Madrid. Data on the frequency of genotypes DQ2/DQ8 in a subgroup of 92 patients and the additional cost of performing HLA typing for screening CD were collected. Only when the risk HLA haplotype (DQ2/DQ8) is negative no further serological screening for CD is required.
ResultsTwenty-three patients with T1DM (7.77%) also had CD. Alleles DQ2 or DQ8 were found in 91.3% of patients in whom the HLA haplotype was studied. Thus, only 8.7% with a negative haplotype would have benefited from HLA testing. The additional cost of HLA typing was €105.2 for each patient with positive DQ2 or DQ8 in our population.
ConclusionsHLA typing is not a cost-effective screening method for CD in T1DM because of the frequent association of T1DM with risk genotypes for CD.
La diabetes mellitus tipo1 (DM1) se asocia con frecuencia con otras enfermedades autoinmunes, entre ellas con la enfermedad celiaca (EC), que es una enfermedad mediada por anticuerpos provocada por el gluten y las prolaminas relacionadas en individuos genéticamente predispuestos que se caracteriza por la presencia de una combinación variable de manifestaciones clínicas dependientes del gluten, anticuerpos específicos, haplotipos HLA-DQ2 y HLA-DQ8, y enteropatía1.
La frecuencia de EC en la DM1 es 6 veces mayor que en la población general, habiéndose descrito una prevalencia de EC en DM1 entre el 1,6 y el 16,4%2,3. Esta diferencia está relacionada con el origen étnico de las poblaciones, la diferente prevalencia de EC en los distintos países, los grupos de edad estudiados, la realización de un cribado activo frente a uno basado en síntomas, y en los diferentes criterios utilizados para el diagnóstico de la EC.
Se conoce la existencia de una fuerte asociación de la EC con los haplotipos HLA-DQ2 y DQ81. Más del 90% de pacientes con EC expresan la molécula de claseII del HLA-DQ2 y la mayoría restante son portadores del HLA-DQ8 (8-10%). El 20-30% de los controles de población sana son DQ2 y el 40% DQ2 o DQ8, pero solo el 3% de los sujetos HLA-DQ2 y/o DQ8 positivos desarrollan EC. Por ello, el ser DQ2 y/o DQ8 positivo tiene poca especificidad para el diagnóstico de EC, aunque el valor predictivo del negativo de este haplotipo es muy elevado, ya que en ausencia de DQ2/DQ8 la EC es extremadamente improbable.
Los haplotipos HLA-DR3 y DR4 tienen una fuerte asociación con la DM1 y aproximadamente el 30-50% de los pacientes son heterocigotos DR3/DR4; en Estados Unidos el 35%, frente al 2,4% de la población general4.
El 60-70% de los pacientes con DM1 y EC son asintomáticos o tienen pocos síntomas5,6. Los niños con DM1 y síntomas de EC tienden a ser diagnosticados de la EC en edades más precoces (por debajo de los 5años de edad) que aquellos sin síntomas. El riesgo de EC es mayor en los pacientes en los que la diabetes se diagnostica a menor edad y durante los 5 primeros años tras el diagnóstico. Habitualmente la DM1 se desarrolla antes que la EC, y cuando es al contrario, los pacientes son de más edad cuando se diagnostica la DM1.
Algunos autores refieren peor control metabólico de la DM1 y un mayor riesgo de hipoglucemia y retinopatía en pacientes con EC asociada no diagnosticada7. Además, la EC puede ser responsable de manifestaciones clínicas importantes, como anemia ferropénica, alteración del crecimiento, fallo en la ganancia de peso, osteopenia y disfunción hepática, con riesgo incrementado de complicaciones posteriores de yeyunitis ulcerativa y linfoma.
Se acepta que es necesario realizar el cribado de EC en los niños y adolescentes con DM1 asintomáticos para prevenir los efectos adversos y las complicaciones asociadas y maximizar el crecimiento. Existen diferentes guías clínicas o recomendaciones en estos grupos de edad, no basadas en una suficiente evidencia, y no se dispone de guías clínicas en la edad adulta1,8-11 (tabla 1).
Recomendaciones y guías clínicas para el cribado de enfermedad celiaca en niños y adolescentes con diabetes tipo11,8-11
| Guía clínica | Año | Recomendaciones | Método | Frecuencia |
|---|---|---|---|---|
| ADA | 2019 | Considerar cribado | tTG-A | Según clínica |
| ISPAD | 2018 | Considerar cribado | tTG-A y/o EMA | Anual en 5 primeros años y cada 2 años después |
| BSPGHN | 2013 | Cribado en niños asintomáticos de grupos de riesgo | HLA-DQ y tTG-A | |
| ESPGHAN | 2012 | Cribado en niños y adolescentes asintomáticos con riesgo ↑ de EC | HLA-DQ y tTG-A o EMA o DGP | Repetir |
| NASPGHN | 2005 | Cribado en niños asintomáticos de grupos de riesgo | tTG-A | Repetir |
ADA: American Diabetes Association; BSPGHN: British Society of Pediatric Gastroenterology, Hepatology and Nutrition; DGP: anticuerpos antipéptido deamidado de gliadina; EMA: anticuerpos anti-endomisio; ESPGHAN: European Society of Pediatric Gastroenterology, Hepatology and Nutrition; ISPAD: International Society for Pediatric and Adolescent Diabetes; NASPGHN: North American Society of Pediatric Gastroenterology, Hepatology and Nutrition; tTG-A: anticuerpos anti-transglutaminasa.
La sociedad más importante en gastroenterología pediátrica es la European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). Sus guías (y las de otras sociedades) proponen realizar el tipaje HLA (sistema de histocompatibilidad de antígenos leucocitarios humanos), siempre que esté disponible, en todos los pacientes con enfermedades asociadas a la EC (incluida la DM1) como primera prueba diagnóstica antes de iniciar el cribado serológico1,10. El estudio del haplotipo HLA sería útil para descartar la EC, y para ello argumentan que es una prueba coste-efectiva, ya que la EC puede ser excluida con una certeza del 99% en los pacientes con HLA negativo para DQ2 o DQ8, y este subgrupo no precisaría continuar con el seguimiento serológico. En los positivos debería realizarse la determinación de la inmunoglobulina IgA en suero y de anticuerpos anti-transglutaminasa IgA (tTG-A).
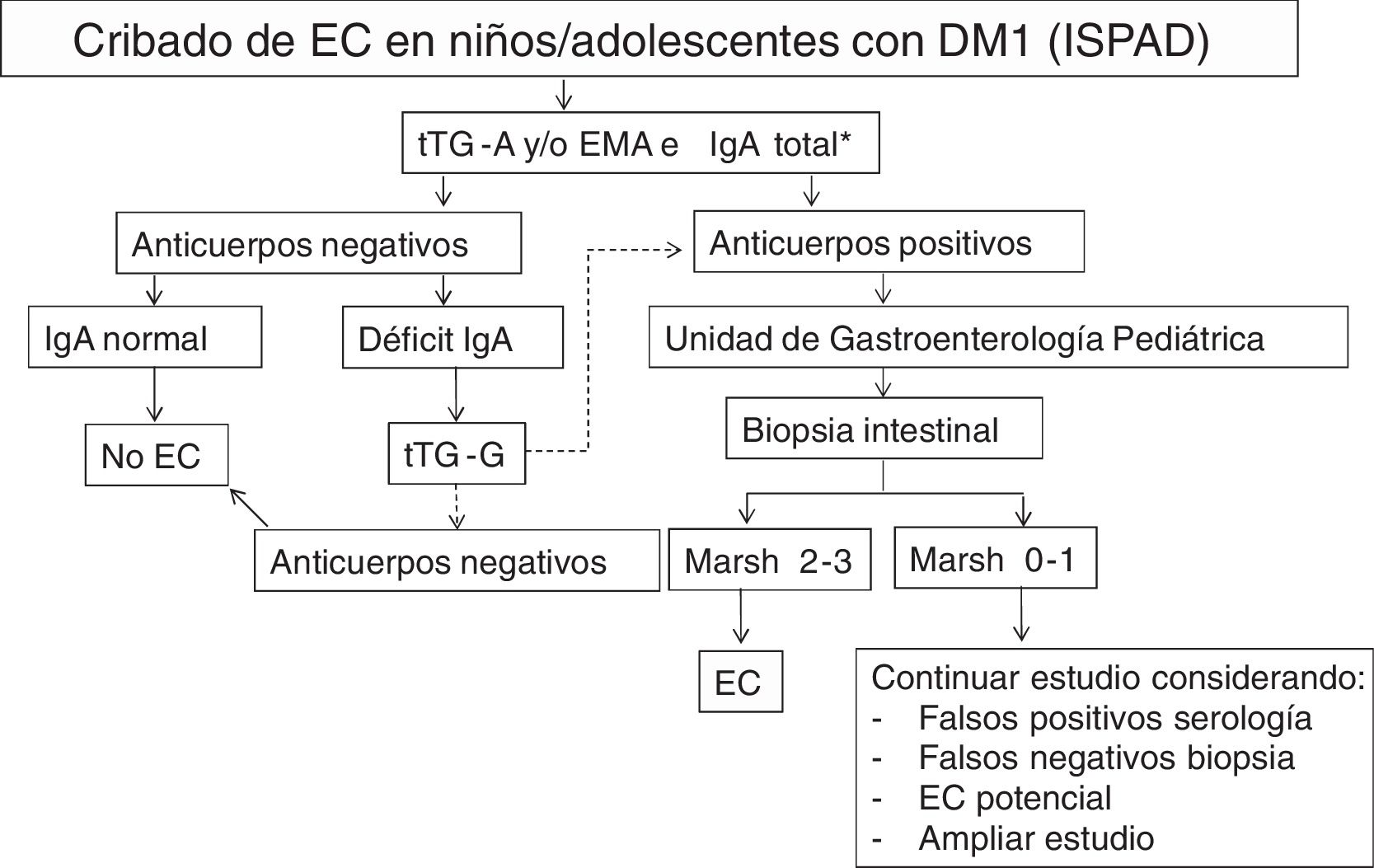
La International Society for Pediatric and Adolescent Diabetes (ISPAD) recomienda que debe hacerse el cribado serológico de la EC en todos los pacientes con DM1 al comienzo de la diabetes mediante la determinación de tTG-A9. Cuando se detecta un déficit de IgA (en la población general es 1:500, pero parece más frecuente en DM1 con EC) debe hacerse con anticuerpos específicos IgG. Luego, el cribado debe ser anual o cada 2años, y más frecuente si la situación lo requiere o el niño tiene un familiar de primer grado con EC. Extiende continuar la realización del cribado más allá de los 5años del debut de la DM1. Cuando los anticuerpos son positivos, los pacientes deben ser remitidos al gastroenterólogo para confirmar el diagnóstico y explicarles la dieta.
La estrategia utilizada en el cribado tiene importantes implicaciones coste-económicas y psicológicas en los pacientes y sus familias. La ausencia de los haplotipos HLA-DQ2 y/o DQ8 hace altamente improbable/excluye el diagnóstico de EC, y solo en esos casos es innecesario continuar el cribado serológico. Ocurre, sin embargo, que los alelos DR3 y DR4 están en un fuerte desequilibrio de ligamiento con DQ2 y DQ8, y que una mayoría de los pacientes con DM1 son portadores de los haplotipos de riesgo de EC y así, en algunas series aproximadamente el 90% de los pacientes con DM1 expresan los haplotipos DQ2 o DQ8, frente al 40% de la población general4.
Los objetivos de este estudio son conocer la proporción de pacientes con HLA no DQ2 o DQ8 en una muestra de niños y adolescentes con DM1 y analizar diferentes estrategias para el cribado de la EC en la DM1 desde un punto de vista clínico y de coste-efectividad.
Pacientes y métodosPoblación a estudioEs un estudio retrospectivo y descriptivo, mediante revisión de historias clínicas, de 296 pacientes (148 niñas y 148 niños) con DM1 en seguimiento en la unidad de diabetes pediátrica del Hospital Universitario Ramón y Cajal de Madrid. El trabajo ha sido realizado con la aprobación del comité ético de nuestra institución.
Criterios de inclusiónEl estudio está limitado a niños y adolescentes con DM1 hasta los 18años de edad, que es cuando se realiza la transición a unidades de adultos.
Criterios de exclusiónHasta el momento no existen guías clínicas para el cribado de EC en pacientes con DM1 en edad adulta, motivo por el que no incluimos a esta población.
Estudios analíticosEl cribado de EC fue realizado en todos los casos tras cribado del déficit de IgA sérica y utilizando anticuerpos tTG-A. Se utilizó el kit ELISA org A-T-TRANGLUTAM® (Palex Medical S.A.), valor positivo >16. La identificación de los antígenos de histocompatibilidad HLA fue realizada en un subgrupo de pacientes en el laboratorio de Inmunología del Hospital Ramón y Cajal mediante ensayo tipaje por SSO (hibridación de oligonucleótidos), One Lambda® (RSSO 2Q_008_03).
Análisis estadísticoSe utilizó el programa SPSS 24. Los datos descriptivos se expresan como medias y desviación estándar.
Análisis económicoEn nuestro hospital, el coste de los reactivos del estudio HLA es de 35€, el de una determinación de IgA, de 1,21€, y el de tTG-A, de 2,1€. Para realizar el estudio de coste-efectividad consideramos el coste por unidad de producto: IgA 1,69€, tTG-A 21,97€ y HLA-DQ 114,92€.
Para la evaluación económica se realizó un análisis de coste-efectividad para las dos estrategias propuestas.
Investigamos el número de pacientes en los que se había realizado el estudio HLA como análisis previo a decidir implantar las nuevas guías clínicas formuladas por la ESPGHAN. Planteamos el estudio como una estimación ajustándonos a las recomendaciones actuales para el cribado de EC en la población pediátrica con DM1 en los primeros años tras el diagnóstico y analizamos los costes derivados de 5años de seguimiento.
ResultadosLos 296 pacientes fueron diagnosticados de DM1 entre los 6meses y los 16años de edad. La edad media al diagnóstico de DM1 fue de 6,1±4,1años, y el tiempo de seguimiento de la DM1 (tiempo de evolución) hasta la realización del estudio fue de 6,6±4,1años.
El estudio HLA fue realizado en un subgrupo de 92 pacientes, de los cuales el 91,3% presentaron los alelos DQ2 o DQ8. En consecuencia, solo el 8,7% con haplotipo negativo (no DQ2 ni DQ8) se habrían beneficiado del estudio HLA para evitar su seguimiento serológico. Los genotipos encontrados se detallan en la tabla 2.
Genotipos HLA-DQ de los niños y adolescentes con diabetes tipo1 y de los pacientes diagnosticados de diabetes tipo1 (DM1) y enfermedad celiaca (EC)
| Genotipos HLA (n=92) | DM1 | DM1+EC |
|---|---|---|
| Número de niños estudiados | 92 | 20 |
| Homocigoto DQ2 | 11 (12,0%) | 4 (20,0%) |
| Heterocigoto DQ2 | 22 (23,9%) | 4 (20,0%) |
| Heterocigoto DQ2/8 | 36 (39,1%) | 10 (50,0%) |
| Homocigoto DQ8 | 2 (2,2%) | 0 (0%) |
| Heterocigoto DQ8 | 13 (14,1%) | 2 (10,0%) |
| Negativo DQ2 y DQ8 | 8 (8,7%) | 0 (0%) |
Veintitrés pacientes (7,77%) fueron diagnosticados de EC, es decir, asociaban DM1 +EC; 15 fueron niñas y 8 varones (5,41% de los niños y 10,14% de las niñas de nuestra muestra). La edad media al diagnóstico de DM1 fue de 4,4±4,4años, y de la EC, de 5,1±3,6años. El estudio HLA aparecía realizado en 20 casos. Todos los pacientes con EC fueron positivos para DQ2 o DQ8. El tiempo medio de evolución de la DM1 al diagnóstico de EC fue de 1,4±2,5años: el 86,9% de los niños con EC fueron diagnosticados durante los primeros 5años tras el debut de DM1.
En cualquier caso, y aunque estos datos sean coherentes con la literatura científica para la población europea, el número de pacientes incluido no permite extrapolar los datos de nuestra muestra a la población sin confirmar dichas conclusiones con una muestra mayor.
Estudio de los costes de los reactivosLa realización del estudio HLA en la muestra analizada (n=92) representa un coste en reactivos durante 5años de 3.220€, y en el total de nuestra población habría sido de 10.360€. El coste del seguimiento serológico, realizado en los 296 pacientes, durante los 5 primeros años del diagnóstico sería de 3.466,16€ (una única determinación de IgA/paciente +una determinación anual de anticuerpos/paciente =11,71€/paciente). Se demostró un déficit de IgA en un paciente.
El estudio HLA habría sido útil para evitar el seguimiento serológico solo en el 8,7% de los pacientes (25/296), lo que da un coste en reactivos de 875€. Si se hubiera estudiado en los 296 niños, el coste habría sido de 10.360€. Por lo tanto, se habrían gastado 9.485€ sin beneficio (32€/paciente).
Estudio de coste-efectividadLos datos son más contundentes cuando se tienen en cuenta los costes directos.
En nuestro centro realizamos el cribado serológico de EC de acuerdo con las recomendaciones de la ISPAD9 (fig. 1). El coste del seguimiento serológico en cada paciente durante los 5 primeros años después del diagnóstico es de 111,54€/paciente: 1 determinación de IgA 1,69 €+realización de tTG-A (de forma anual 21,97€ x 5años) 109,85 €.
Recomendaciones de la ISPAD para el cribado de enfermedad celiaca (EC) en niños y adolescentes con diabetes tipo1 (DM1).
EMA: anticuerpos anti-endomisio IgA; tTG-A: anticuerpos anti-transglutaminasa IgA; tTG-G: anticuerpos anti-transglutaminasa IgG.
* En caso de déficit selectivo de IgA, realizar determinación de anticuerpos de clase IgG
Fuente: adaptado de Mahmud et al.9.
El coste del seguimiento serológico durante los 5 primeros años del diagnóstico en nuestra población de 296 pacientes fue de 33.015,8€ (111,54€/paciente). Establecida una frecuencia de pacientes con DQ2 o DQ8 negativo del 8,7% (casos en los que el estudio HLA es útil para evitar el seguimiento serológico), y excluyendo así 25 casos del seguimiento (33.015,8−2.788,5€), el coste total del cribado serológico se habría reducido a 30.227,3€.
El coste de realizar un estudio HLA es de 114,92€/paciente. El coste del estudio HLA en la muestra analizada (n=92) es de 10.572,64€. Solo habría sido útil su realización en el 8,7% de pacientes con HLA no DQ2 ni DQ8, con un coste extrapolado en la muestra de 296 pacientes de 2.873€.
Por lo tanto, en nuestra población (n=296) el coste adicional de realizar el estudio HLA sería de 31.143,32€ (34.016,32−2.873 €), lo que representa un coste sin beneficio de 105,2€/paciente en cada paciente positivo para DQ2 o DQ8.
DiscusiónEn la actualidad se acepta que es necesario realizar el cribado de EC en pacientes con DM1 asintomáticos, aunque no existe consenso sobre cuál debe ser el método a utilizar o cuándo habría que iniciarlo, o la frecuencia con la que habría que realizar el seguimiento serológico, y cuál sería el beneficio de la dieta sin gluten sobre la reducción de las comorbilidades.
En los últimos años se han publicado estudios que aportan datos que sugieren que el estudio HLA no es coste-efectivo para el cribado de EC en niños y adolescentes con DM1 y que las guías de gastroenterología pediátrica, pese a su difusión, no están siendo utilizadas en la práctica clínica12-16.
El primer dato a resaltar es que, de acuerdo con los resultados publicados en población holandesa, escocesa y austriaca, solo un pequeño porcentaje de pacientes con DM1 podría ser excluido de continuar con el cribado serológico para EC tras el estudio HLA. En esos estudios, el 86, el 94, el 92 y el 82,8% de niños y adolescentes con DM1, respectivamente, presentaron un haplotipo HLA-DQ2 o DQ812-15.
Por este motivo, antes de la implementación definitiva de las nuevas guías para el cribado de EC en DM1, investigamos la proporción de pacientes en los que se había estudiado el haplotipo DQ2 o DQ8 en nuestra población de 296niños y adolescentes con DM1. La tipificación HLA se había realizado en 92 de 296 casos. El 91,3% presentaron los alelos DQ2 o DQ8 (son datos en población de origen español, ya que hay muy pocos casos incluidos de otras etnias). Este resultado se explica por el desequilibrio de ligamiento entre los genotipos HLA específicos para DM1 y los genotipos HLA específicos para EC4. En nuestra muestra, solo 8 de 92 pacientes (8,7%) con haplotipo HLA-DQ negativo se habría beneficiado del estudio.
Además, cuando valoramos el beneficio clínico del estudio HLA en pacientes con DM1 concluimos que no aportaba ninguno, ya que en la mayoría habría que continuar el cribado serológico, y que era cuestionable realizar el estudio HLA en la población restante.
Realizamos el estudio de coste-efectividad para el cribado de EC en DM1 en la edad pediátrica analizando dos estrategias diagnósticas: la primera el estudio de IgA sérica y tTG-A, y la segunda, el estudio HLA. Se utilizó como marcador para el cribado serológico los tTG-A, porque la identificación de la enzima transglutaminasa tisular (tTG) como el autoantígeno principal de los anticuerpos anti-endomisio hace preferible su utilización como método de cribado al ser posible su detección por la técnica de enzimoinmunoanálisis (enzyme-linked immunosorbent assay [ELISA]), que es estandarizable, más económica y más ecológica que la inmunofluorescencia indirecta utilizada para la detección de los anticuerpos anti-endomisio.
Como es lógico, los costes pueden ser diferentes en cada país o sistema de salud. En nuestro centro, el coste del seguimiento serológico por paciente durante los 5 primeros años después del diagnóstico es de 111,54€ y el coste del estudio HLA es de 114,92€/paciente. Al estudiar los costes de realizar el estudio HLA en la muestra analizada, que solo habría sido útil en el 8,7% de los casos, este se tradujo en un incremento del gasto sin beneficio por paciente de 105,2€. Decidimos entonces no continuar con la determinación del HLA en los niños y adolescentes con DM1.
Los estudios realizados en los Países Bajos, Escocia y Austria también sugieren que el coste del genotipado HLA es alto en comparación con el cribado serológico12-15. En hospitales pequeños el estudio HLA no está disponible y es necesario remitir las muestras a un laboratorio especializado, lo que supone un mayor incremento en los costes. El coste se podría disminuir si se empleara un método que detectara únicamente la presencia de DQ2 y/o DQ8.
Además, el estudio genético precisa de un consentimiento informado por el paciente y/o los padres. También habría que considerar la potencial carga psicológica añadida por la realización de un estudio que no va a ser útil en la mayoría de los pacientes.
Nuestro estudio demuestra que el genotipado HLA en pacientes con DM1 no es suficiente para identificar a los pacientes con riesgo de desarrollar una EC. La muestra incluye 23 pacientes con DM1 y EC, de los cuales 20 tienen el estudio HLA realizado y todos ellos tienen los haplotipos de riesgo DQ2 o DQ8. Esto demuestra que el estudio HLA es útil en pacientes con EC sintomáticos o en los diagnosticados mediante cribado, pero no como método poblacional de cribado. En cualquier caso, el diagnóstico de confirmación de la EC en pacientes con DM1 es la biopsia intestinal, y el estudio HLA no evita este procedimiento1.
Es controvertido y motivo de discusión durante cuántos años realizar el cribado. Dado que la mayoría de los casos de EC se diagnostican en los 5 primeros años de la DM1, el cribado debe hacerse al diagnóstico de la DM1 y entre 2 y 5años después, como proponen Pham-Short et al.2 en su revisión sistemática, y hay que considerar hacerlo en otros momentos si hay síntomas sugestivos de EC. Sin embargo, se puede producir una seroconversión de los anticuerpos de EC en cualquier momento después del diagnóstico de la DM1, y para otros autores esto haría aconsejable continuar el cribado después de los 5años del diagnóstico de la diabetes17.
En conclusión, no resulta coste-efectivo estudiar el HLA como método de cribado de EC en la DM1 dada la frecuente asociación de DM1 y EC con los haplotipos de riesgo de desarrollar EC, lo que haría obligatorio continuar realizando el cribado serológico.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los Doctores J.L. Castañer Alabau y G. Roy Ariño, de las Secciones de Histocompatibilidad y Autoinmunidad del Servicio de Inmunología del Hospital Universitario Ramón y Cajal, por la realización del tipaje del haplotipo HLA y de los estudios serológicos en los pacientes con diabetes tipo1.