La sarcopenia es un síndrome caracterizado por pérdida de masa y fuerza muscular. El objetivo del estudio es determinar la asociación entre la densidad muscular y la supervivencia global (SG) de los pacientes con cáncer de próstata de debut metastásico (CaPM).
Materiales y métodosEstudio retrospectivo de pacientes diagnosticados de CaPM entre 2009 y 2015 que recibieron únicamente terapia de privación androgénica como tratamiento inicial. La densidad muscular se calculó usando el Hounsfield Unit Average Calculation (HUAC) de ambos psoas en la tomografía computarizada (TC) del diagnóstico.
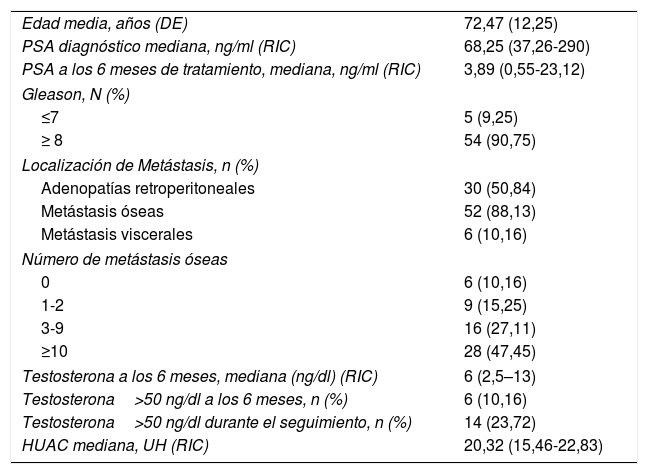
ResultadosIdentificamos 59 pacientes diagnosticados de CaPM. La media de edad fue de 72,47 años. La mediana del antígeno prostático específico (PSA) al diagnóstico fue de 68,25 ng/dl (RIC 37,26-290). El 90,75% presentaban un Gleason≥8, 88,13% metástasis óseas y 10,16% viscerales. La mediana de HUAC fue de 20,32 UH (RIC 15,46-22,83).
En el análisis univariante, el número de metástasis óseas, la presencia de metástasis viscerales y la presencia de niveles de testosterona≥50 ng/dl en el seguimiento se asociaron a una peor SG, mientras que niveles elevados de HUAC se asociaron a mejor SG. En el análisis multivariante, el número de metástasis óseas [hazard ratio (HR)=1,573, intervalo de confianza (IC) 95%=1,103-2,243, p=0,012], la presencia de metástasis viscerales (HR=7,404, IC=2,233-24,549,p=0,001) y el Gleason(HR=2,001, IC=1,02-3,923, p=0.044) se asociaron a un aumento de la mortalidad global y el HUAC (HR=0,902, IC=0,835-0,973, p=0,008) se asoció a una mejor SG.
ConclusionesEn nuestra serie, el aumento de los valores de HUAC de los músculos del psoas, como reflejo de la densidad muscular, en el diagnóstico del CaPM, tuvo un efecto protector sobre la SG en estos pacientes.
Sarcopenia is a syndrome characterized by the loss of muscle mass and strength. The study objective was to determine the association between muscle density and overall survival (OS) in patients with metastatic onset prostate cancer (MPCa).
Materials and MethodsThis was a retrospective study of patients diagnosed with MPCa between 2009 and 2015 who received androgen deprivation therapy alone as initial treatment. Muscle density was calculated using the Hounsfield Unit Average Calculation (HUAC) in both psoas muscles in the computed tomography (CT) scan performed for diagnosis.
ResultsA total of 59 patients diagnosed with MPCa, with a mean age of 57.5±72.47 years, were found. Median prostate-specific antigen (PSA) level at diagnosis was 68.25 ng/dL (IQR 37.26-290). Gleason scores≥8 were recorded in 90.75% of the patients, bone metastases in 88.13%, and visceral metastases in 10.16%. Median HUAC was 20.32 HU (IQR 15.46-22.83).
In a univariate analysis, the number of bone metastases, the presence of visceral metastases, and testosterone levels≥50 ng/dL at follow-up were associated with poorer OS, while high HUAC levels were associated with better OS. In a multivariate analysis, the number of bone metastases [hazard ratio (HR)=1.573, 95% confidence interval (CI)=1.103-2.243, p=0.012], the presence of visceral metastases (HR=7.404, CI=2.233-24.549, p=0.001), and the Gleason score (HR=2.001, CI=1.02-3.923, p=0.044) were associated with greater overall mortality, and HUAC (HR=0.902, CI=0.835-0.973, p=0.008) was associated with better OS.
ConclusionsIn our series, increased HUAC values in the psoas muscles, as a reflection of muscle density, when MPCa was diagnosed had a protective effect on OS in these patients.
Históricamente, se han descrito diferentes factores pronósticos de supervivencia global (SG) en pacientes con cáncer de próstata metastásicos (CaPM). Los factores clásicos descritos han sido el Gleason score y los valores del antígeno prostático específico (PSA) y de testosterona a los 6 meses del inicio de tratamiento de privación androgénica (TPA)1. Otros factores asociados a la SG de estos pacientes han sido la presencia de dolor, la presencia de metástasis viscerales, valores de LDH y fosfatasa alcalina elevados y la presencia de anemia2.
En 2010, el European Working Group on Sarcopenia in Older People (EWGSOP) definió la sarcopenia como un síndrome caracterizado por la pérdida de masa muscular y de fuerza muscular que puede asociarse a un bajo desempeño físico3. Además, definieron la presarcopenia como la disminución de la masa muscular sin estar afectada la fuerza muscular o el desempeño físico.
En 2019, el EWGSOP2 actualizó la definición de sarcopenia. La sarcopenia fue definida como un trastorno del músculo esquelético generalizado y progresivo que está asociado a un incremento de la probabilidad de resultados adversos que incluyen caídas, fracturas, discapacidad física y mortalidad4. La EWGSOP2 también actualizó los criterios de diagnóstico de sarcopenia (tabla 1).
Definición de sarcopenia según la EWGSOP24
| La probable sarcopenia es identificada por el criterio 1.El diagnóstico de sarcopenia se confirma por la documentación adicional del criterio 2.Si se encuentran todos los criterios 1, 2 y 3, la sarcopenia se considera severa | |
|---|---|
| Criterios EWGSOP2 | 1. Baja fuerza muscular2. Baja cantidad o calidad muscular3. Bajo desempeño físico |
EWGSOP=European Working Group on Sarcopenia in Older People.
Referencia bibliográfica: Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyere O, Cederholm T, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019;48:16–31. doi:10.1093/ageing/afy169.
Para calcular la cantidad de masa muscular se pueden usar diversas técnicas de imagen: la DXA (dual energy X-ray absorptiometry), el BIA (bioelectric impedence analysis), la resonancia magnética y la tomografía computarizada (TC)5.
Diversos estudios han demostrado que la presencia de sarcopenia en el diagnóstico de un tumor sólido tiene un impacto negativo en la SG 6.
El objetivo de nuestro estudio fue valorar el efecto pronóstico que tiene la densidad de la masa muscular en pacientes diagnosticados de CaPM de debut tratados únicamente con TPA.
Material y métodosSe realizó un estudio retrospectivo de los pacientes diagnosticados con CaPM de debut entre los años 2009 y 2015. Se excluyeron del análisis aquellos pacientes que no tuvieran una TC basal. Todos los pacientes recibieron únicamente TPA como primer tratamiento inicial, mediante el uso inicial de antiandrógenos (bicalutamida 50mg/día) para evitar el fenómeno de «flare up» y posteriormente con análogos de la LHRH semestrales, suspendiendo la bicalutamida a los 30 días de su inicio. A todos los pacientes se les recomendó mantener un nivel de actividad física adecuado con ejercicios de resistencia y de fuerza.
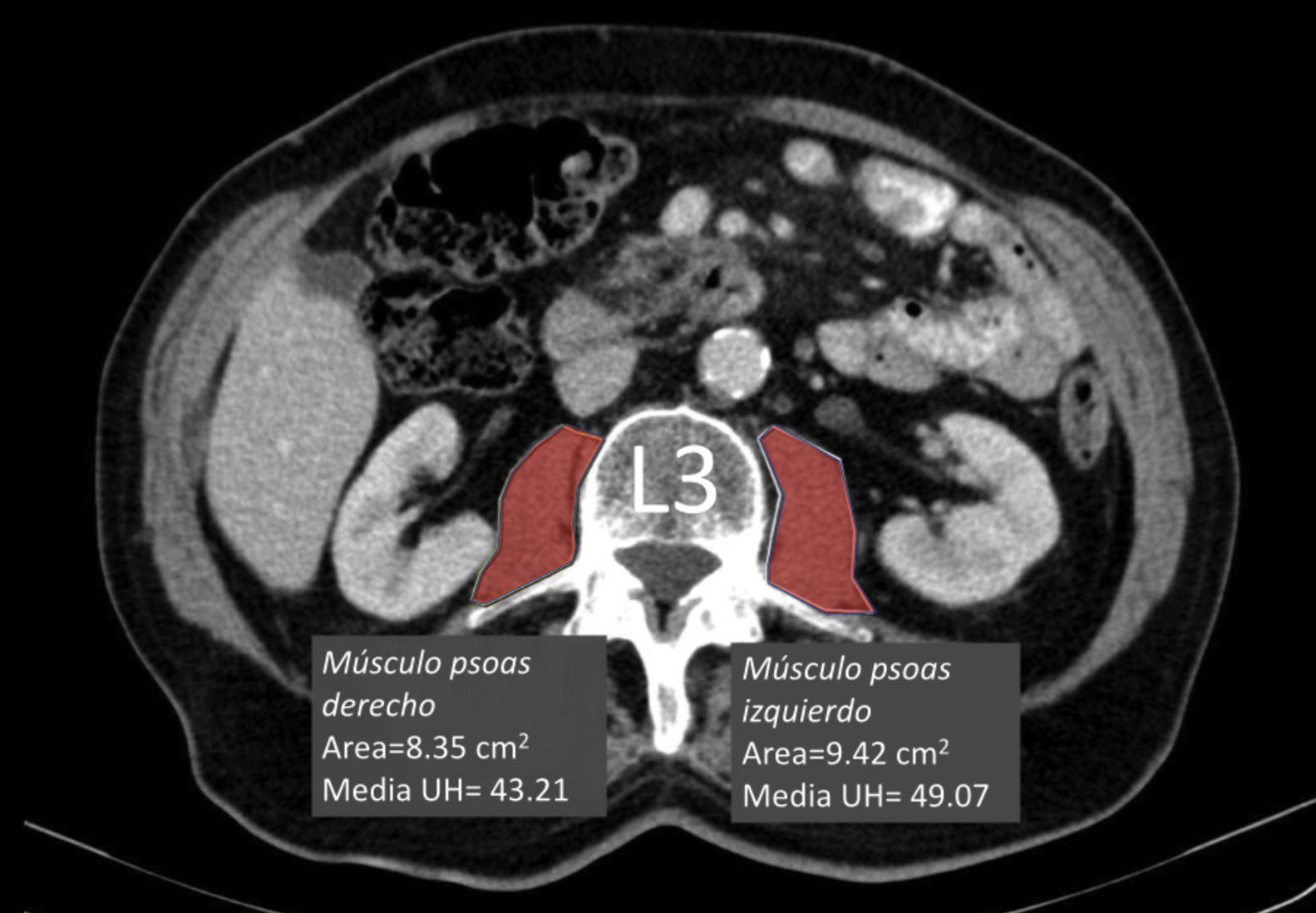
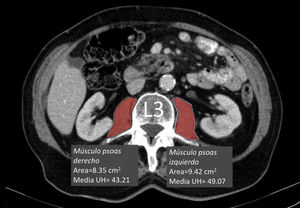
Medición de la densidad muscularSe calculó el Hounsfield Unit Average Calculation (HUAC) (fig. 1) de los músculos psoas, según definieron Joglekar et al.7 en 2015.
El HUAC es una medida que valora la densidad magra y la infiltración grasa a través de las unidades Hounsfield (UH) del área (en cm2) de ambos psoas a nivel del cuerpo de la tercera vértebra lumbar (L3), usando la TC realizada al diagnóstico de la enfermedad.
Para poder calcular el valor de HUAC se utilizó la siguiente fórmula7En primer lugar, se calcula el Right Hounsfield Unit Calculation (RHUC)=(Hounsfield Unit psoas derecho x área psoas derecho) / (área total psoas).
Posteriormente el Left Hounsfield Unit Calculation (LHUC)=(Hounsfield Unit psoas izquierdo x área psoas izquierdo) / (área total psoas).
Por último, se calcula el HUAC=(RHUC+LHUC)/2.
HUAC se ha asociado sobre todo a los resultados después de la cirugía oncológica hepatobiliopancreática y gastrointestinal7–9.
Estudio estadísticoSe evaluó la edad de los pacientes que se presenta con la media y DE. Se analizó el PSA basal, HUAC en el TC basal, PSA a los 6 meses, la testosterona a los 6 meses del inicio de TPA que se representan con la mediana y el rango intercuartílico (RIC). El número de metástasis óseas se categorizó en 0, 1-2, de 3-9 y≥10, ofreciendo el resultado con el número total y el porcentaje. La presencia de metástasis viscerales (M1c) se expresó también con el número total y el porcentaje.
La SG se ha calculado usando el método de Kaplan-Meier.
Se utilizó el test de regresión de Cox para determinar si HUAC (valorada como variable continua) se asociaba de forma unilateral a la SG. Posteriormente, se realizó un análisis multivariante mediante el método de eliminación paso a paso hacia atrás (backward stepwise selection) incluyendo los factores significativos en el estudio univariante, así como los factores pronósticos clásicos.
Se consideró la significancia estadística cuando el valor de p<0.05.
ResultadosIdentificamos 70 pacientes con CaPM de debut que fueron diagnosticados en nuestro centro durante el período de estudio. De estos, solo 59 pacientes pudieron ser analizados porque el resto no disponía de TC de abdomen basal en el momento del diagnóstico.
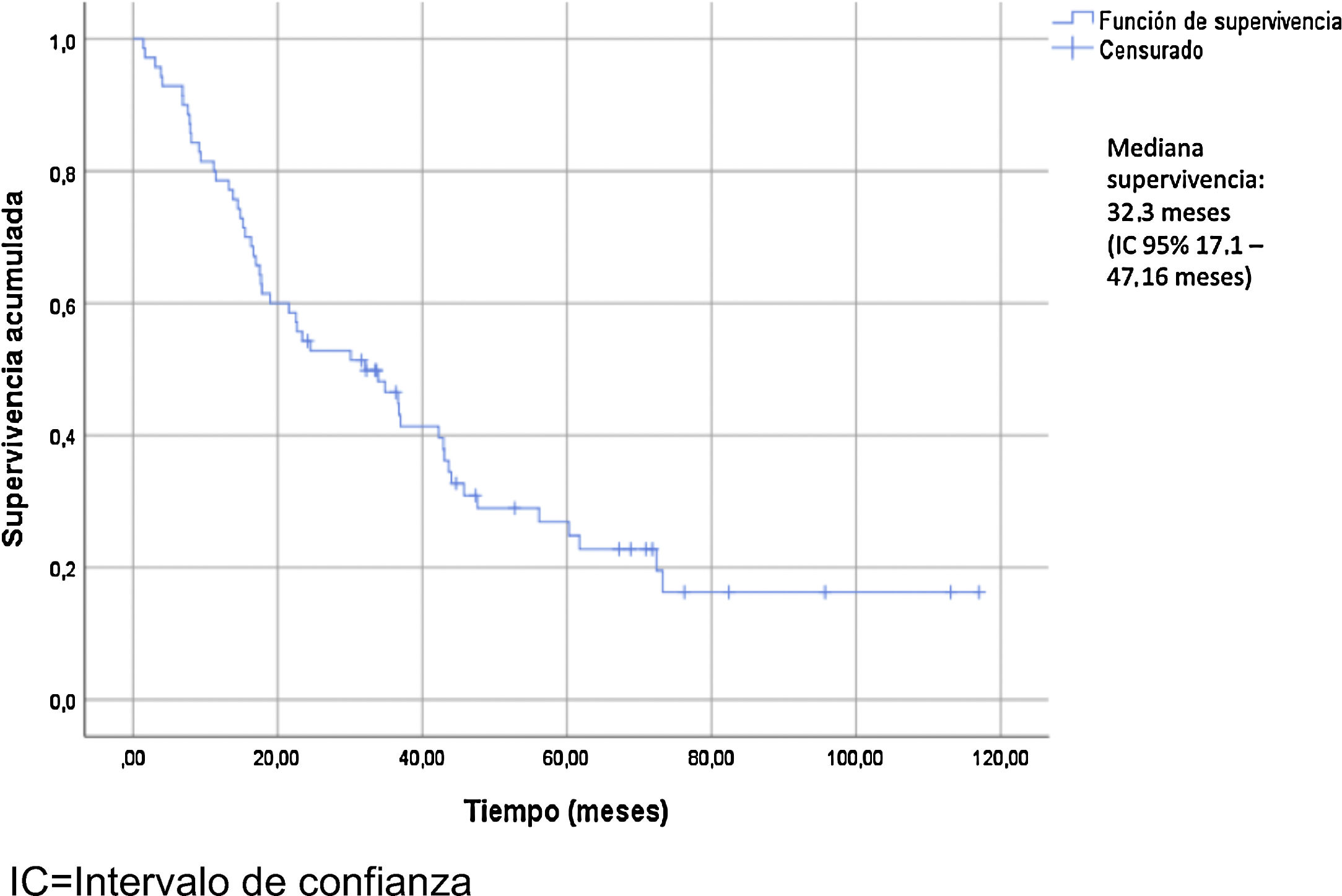
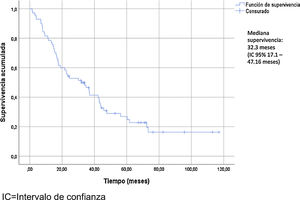
Las características de los pacientes se describen en la tabla 2. La edad media de los pacientes fue de 72,47+/- 12,25 años. El 90,75% presentaron un Gleason score≥8. El 88,13% fueron diagnosticados con metástasis óseas, teniendo el 74,56% de ellos más de 3 metástasis óseas. La presencia de metástasis viscerales (M1c) fue observada en el 10,16% de los pacientes. La mediana de seguimiento fue de 30,5 meses (RIC 15-45,75). La mediana de supervivencia usando Kaplan-Meier fue de 32,3 meses (IC 95% 17,1 – 47,16) (fig. 2).
Características de la población
| Edad media, años (DE) | 72,47 (12,25) |
| PSA diagnóstico mediana, ng/ml (RIC) | 68,25 (37,26-290) |
| PSA a los 6 meses de tratamiento, mediana, ng/ml (RIC) | 3,89 (0,55-23,12) |
| Gleason, N (%) | |
| ≤7 | 5 (9,25) |
| ≥ 8 | 54 (90,75) |
| Localización de Metástasis, n (%) | |
| Adenopatías retroperitoneales | 30 (50,84) |
| Metástasis óseas | 52 (88,13) |
| Metástasis viscerales | 6 (10,16) |
| Número de metástasis óseas | |
| 0 | 6 (10,16) |
| 1-2 | 9 (15,25) |
| 3-9 | 16 (27,11) |
| ≥10 | 28 (47,45) |
| Testosterona a los 6 meses, mediana (ng/dl) (RIC) | 6 (2,5–13) |
| Testosterona>50 ng/dl a los 6 meses, n (%) | 6 (10,16) |
| Testosterona>50 ng/dl durante el seguimiento, n (%) | 14 (23,72) |
| HUAC mediana, UH (RIC) | 20,32 (15,46-22,83) |
DE=desviación estándar; PSA=antígeno prostático específico; RIC=rango intercuartílico; HUAC=Hounsfield Unit Average Calculation; UH=unidades Hounsfield.
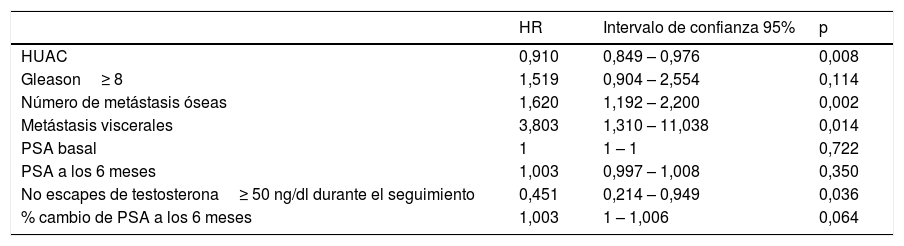
Las variables que tuvieron una asociación significativa con un descenso en la SG en el análisis univariante fueron el número de metástasis óseas (p=0,002), la presencia de metástasis viscerales (p=0,014) y la ausencia de niveles de testosterona por encima de los niveles de castración (p=0,036), mientras que el valor HUAC de los músculos psoas (p=0,008) presentó un efecto protector y se asoció a mejor SG (tabla 3).
Análisis univariante de la asociación de diversas variables con la supervivencia
| HR | Intervalo de confianza 95% | p | |
|---|---|---|---|
| HUAC | 0,910 | 0,849 – 0,976 | 0,008 |
| Gleason≥ 8 | 1,519 | 0,904 – 2,554 | 0,114 |
| Número de metástasis óseas | 1,620 | 1,192 – 2,200 | 0,002 |
| Metástasis viscerales | 3,803 | 1,310 – 11,038 | 0,014 |
| PSA basal | 1 | 1 – 1 | 0,722 |
| PSA a los 6 meses | 1,003 | 0,997 – 1,008 | 0,350 |
| No escapes de testosterona≥ 50 ng/dl durante el seguimiento | 0,451 | 0,214 – 0,949 | 0,036 |
| % cambio de PSA a los 6 meses | 1,003 | 1 – 1,006 | 0,064 |
HUAC=Hounsfield Unit Average Calculation; PSA=antígeno prostático específico; HR=hazard ratio.
Todas las variables que tuvieron un impacto significativo en el análisis univariante se incluyeron en el estudio multivariante. Se incluyó también el Gleason de la biopsia, a pesar de no ser significativo en el estudio univariante, debido a que sabemos de su impacto pronóstico clásico. También se incluyó el cambio de valor de PSA a los 6 meses, expresado en tanto por ciento, ya que en el análisis univariante estuvo cerca de la significancia estadística (p=0,064).
En el estudio multivariante (tabla 4) se observó que el Gleason score≥8 [Hazard ratio (HR)=2,001, intervalo confianza 95% (IC)=1,02-3,923, p=0,044), la presencia de metástasis viscerales (M1c) al diagnóstico (HR=7,404, IC=2,233-24,549, p=0,001), un mayor número de metástasis óseas (HR=1,573, IC=1,103-2,243, p=0,012) tienen una asociación negativa en la supervivencia.
Análisis multivariante de la asociación de diversas variables con la supervivencia
| HR | IC 95% | p | |
|---|---|---|---|
| HUAC | 0,902 | 0,835 – 0,973 | 0,008 |
| Gleason≥ 8 | 2,001 | 1,02 – 3,923 | 0,044 |
| Número de metástasis óseas | 1,573 | 1,103 – 2,243 | 0,012 |
| Metástasis viscerales | 7,404 | 2,233 – 24,549 | 0,001 |
| PSA basal | 1,000 | 0,999 – 1,000 | 0,357 |
| % cambio de PSA a los 6 meses | 0,998 | 0,994 – 1,003 | 0,467 |
| No escapes de testosterona≥ 50 ng/dl durante el seguimiento | 0,636 | 0,261 – 1,548 | 0,318 |
HUAC=Hounsfield Unit Average Calculation; PSA=antígeno prostático específico; HR=hazard ratio; IC=intervalo de confianza.
Mientras que una mayor densidad muscular, valorada con el HUAC de ambos psoas, tiene una asociación significativa con mejor SG de los pacientes con CaPM (HR=0,902, IC=0,835-0,973, p=0,008). Ni la respuesta al tratamiento valorada como cambio de valor de PSA a los 6 meses de inicio de la TPA, ni la presencia de niveles de testosterona por encima de los niveles de castración tuvieron impacto en la supervivencia (HR=0,998, IC=0,994-1,003, p=0,467 y HR=0,636, IC=0,261-1,548, p=0,318, respectivamente).
DiscusiónEl tratamiento del CaPM de debut ha presentado cambios en los últimos años. Inicialmente la TPA era considerada el tratamiento estándar en estos pacientes. La aparición de nuevos estudios a partir del 2015, que demostraron un aumento de SG con la administración de docetaxel, abiraterona, apalutamida y enzalutamida10–14 han cambiado el paradigma terapéutico de estos pacientes. Nuestro estudio está realizado con pacientes diagnosticados de CaPM entre los años 2009 y 2015, anterior a la aparición de estos nuevos tratamientos, por lo que solo fueron tratados con TPA.
Soloway et al.15 en 1988, describieron que un mayor número de metástasis óseas se asociaba a una peor supervivencia. En 2003, Glass et al16 analizaron cuáles eran los posibles factores pronósticos de supervivencia en pacientes afectos de un CaPM. Dentro de las variables estudiadas se analizaron la localización de las metástasis (apendiculares y/o viscerales vs. axiales), performance status (0 vs. 1-3), valor de PSA basal al diagnóstico (<65 vs.≥65 ng/ml) y Gleason score (<8 vs.≥8). Los pacientes con peor pronóstico fueron aquellos que presentaban metástasis óseas apendiculares y/o viscerales, un performance status≥1 y un PSA≥65 ng/ml (HR=2,8). Gravis et al.2 halló en la población de pacientes incluidos en el estudio GETUG-1517 que los valores de la fosfatasa alcalina, la LDH, la hemoglobina y la intensidad del dolor también se comportaban como factores pronósticos. En nuestra serie de pacientes hemos observado que el grado de Gleason, el número de metástasis óseas y las metástasis viscerales tienen un impacto en la SG de estos pacientes, datos que son congruentes con los obtenidos en las series publicadas con anterioridad.
Posterior a la aparición de nuevos tratamientos, se han ido identificando diferentes factores de mal pronóstico. En los pacientes tratados con docetaxel se definió el término de enfermedad de alto volumen (presencia de metástasis viscerales o ≥4 metástasis óseas con ≥1 lesión ósea más allá de cuerpos vertebrales y pelvis)10. En pacientes tratados con abiraterona, se definió el concepto de alto riesgo como la presencia de dos o más de los siguientes factores: Gleason score≥8, al menos tres lesiones óseas y la presencia de metástasis viscerales)11.
Perachino et al.1 publicó la importancia pronóstica del PSA como respuesta a los 6 meses de iniciado el tratamiento con TPA y también de los niveles de testosterona en ese mismo periodo. En nuestro estudio, los niveles de testosterona a los 6 meses, la presencia de un nivel de testosterona>50 ng/dl en algún momento del seguimiento y el PSA a los 6 meses no tuvieron impacto en la supervivencia.
La sarcopenia se ha mostrado como un factor de mal pronóstico en diversas neoplasias como el melanoma, el cáncer esofágico18, el cáncer gastrointestinal o pulmonar19 y el hepatocarcinoma20. También se ha estudiado el impacto negativo que tienen en neoplasias urológicas como el cáncer renal metastásico21 y el carcinoma urotelial (tanto en pacientes sometidos a cistectomía22 como tras nefroureterectomías23). En la mayoría de dichos estudios, la sarcopenia fue definida en función del área de masa muscular usando la TC a nivel abdominal, pero sin valorar la pérdida de fuerza o desempeño físico.
Versteeg et al.24 hallaron que la presencia de sarcopenia (calculando la masa y la densidad con TC y valorando la fuerza muscular), en población neoplásica avanzada entre la que se incluían pacientes con cáncer de próstata, se asociaba a una menor supervivencia. Stangl-Kremser et al.25 hallaron en pacientes afectos de cáncer de próstata metastásico resistente a la castración que el bajo volumen muscular se comportó como un factor de mal pronóstico independiente para la progresión de la enfermedad en su población de estudio. En nuestra población, la presencia de mayor nivel de densidad muscular se comportó como un factor protector. Hasta donde conocemos, nuestro trabajo es el primer estudio en explorar la asociación entre la densidad muscular utilizando el HUAC de los músculos psoas y la SG en pacientes con CaPM en el momento del diagnóstico.
Se ha demostrado que la masa muscular medida con TC a nivel abdominal se asocia a la masa muscular corporal total26. Además, también se ha visto que, incluso valorando únicamente la masa del músculo psoas mediante TC, ésta se correlaciona con la masa muscular total27. Tan importante como el volumen muscular es la atenuación de la radiación de dicho músculo valorado en el TC y la densidad del mismo. A menor densidad muscular, peor calidad presenta dicho músculo28.
Uno de los problemas al valorar la sarcopenia son los diferentes criterios usados en los estudios publicados. Además, la mayoría de los estudios publicados son retrospectivos y únicamente valoran la masa muscular sin tener en cuenta las recomendaciones de la EWGSOP en la que se debe valorar también la función muscular6. En nuestro estudio hemos valorado el HUAC ya que integra en un único valor tanto el área muscular (cantidad) como el grado de infiltración grasa (calidad del mismo). Joglekar et al.7 fueron los primeros al definir el HUAC y valorarlo como predictor de complicaciones en pacientes sometidos a pancreatectomía, pero erróneamente referían asociarlo de forma indirecta a la presencia de sarcopenia, puesto que no valoraron la fuerza muscular. Si tuviera relación, el valor de HUAC se asociaría mejor a la presencia de presarcopenia. Muchos otros estudios posteriormente han valorado la asociación de HUAC con resultados oncológicos y postquirúrgicos, asociando erróneamente la densidad muscular con el término sarcopenia8,9.
Aunque no existe clara evidencia de ello, parece lógico pensar que mejorando la masa muscular de los pacientes conseguiremos un impacto beneficioso en los pacientes oncológicos29, ya que es un factor pronóstico modificable. La European Society for Clinical Nutrition and Metabolism (ESPEN) recomienda mantener o incrementar la actividad física en pacientes neoplásicos para mejorar la masa muscular y la función física con un nivel de evidencia alto y un grado de recomendación fuerte. En relación al tipo de ejercicio, recomiendan ejercicios de resistencia junto con ejercicios aeróbicos, aunque con un nivel de evidencia bajo y un grado de recomendación débil30. Además, en el caso de pacientes con cáncer de próstata, Peisch et al.31 en una revisión hallaron que la práctica de ejercicio físico vigoroso de forma regular parece disminuir su riesgo de progresión.
La valoración de la densidad muscular mediante el cálculo de HUAC en la TC es una técnica fácil y reproducible, que se podría correlacionar con la presencia de una presarcopenia, requiriendo estudios para poder demostrar esta posible asociación. Además, la presarcopenia se definiría como sarcopenia si además el paciente asociara una disminución de la fuerza.
Nuestro estudio presenta diversas limitaciones. Es un diseño retrospectivo y tiene bajo tamaño muestral, lo que no permite realizar generalizaciones con certeza. Otra limitación del estudio es el no poder aportar un valor de corte de normalidad para la densidad muscular mediante el HUAC debido a que toda nuestra población es metastásica y consideramos que tendrán un valor de HUAC más bajo respecto a población sana. Por último, otra limitación es que en 11 de los 70 pacientes que debutaron con un CaPM, en el período del estudio, no disponían de TC basal para valorar el HUAC y no pudieron incluirse en el estudio. A pesar de esto, los resultados obtenidos van en línea con los publicados en artículos similares, lo que ratifica la veracidad de los mismos. Serán necesarios estudios prospectivos, con muestras de mayor tamaño para poder obtener conclusiones más robustas en relación a la densidad muscular valorada con HUAC en la población diana estudiada.
ConclusionesEn nuestra serie, el aumento de los valores de HUAC de los músculos del psoas como reflejo de la ausencia de sarcopenia en el diagnóstico del CaPM, tuvo un efecto protector sobre la SG de los pacientes diagnosticados de cáncer de próstata con debut metastásico.
Fuentes de financiaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflictos de interesesLos siguientes autores reportan honorarios por ponencias: Jesus Muñoz-Rodriguez: Astellas Pharma, Bayer, Janssen. Arturo Dominguez: Astellas Pharma, Janssen. Victor Parejo: Janssen. Enrique Gallardo: Astellas Pharma, Bayer, Janssen, Ipsen, Sanofi, Pfizer. Teresa Bonfill: Astellas Pharma. Dario Garcia-Rojo: Janssen. Leticia De Verdonces: Astellas Pharma.
Los siguientes autores declaran honorarios por advisory boards: Jesus Muñoz-Rodriguez: Astellas Pharma, Bayer, Janssen; Enrique Gallardo: Astellas Pharma, Bayer, Janssen, Ipsen, Pfizer.
El resto de autores no declara ningún conflicto de intereses.
Los autores desean agredecer a Joan Carles Oliva por su ayuda en el análisis estadístico.