Las personas adultas mayores tienen un mayor riesgo de desarrollar sarcopenia debido a la movilidad reducida, la desnutrición, los cambios en la dieta y determinadas enfermedades. Actualmente, no existen revisiones sistemáticas que analicen los efectos de la suplementación con leucina sola o como parte de un suplemento, ya sea con o sin la práctica de ejercicio físico en personas adultas mayores con sarcopenia. Nuestro objetivo es revisar sistemáticamente la evidencia en los estudios de intervención sobre el efecto de la suplementación con leucina, ya sea sola, junto con otro suplemento y con o sin ejercicio físico en personas adultas mayores con sarcopenia.
Materiales y métodosSe realizaron búsquedas bibliográficas relacionadas con el tema en tres bases de datos (PubMed/MEDLINE, Cochrane y SciELO) buscando artículos publicados antes de diciembre de 2020. Esta revisión incluye estudios de intervención en personas adultas mayores de 60 años con antecedentes de sarcopenia donde los investigadores informaron sobre el efecto de la suplementación con leucina, con o sin ejercicio físico, en relación con los tratamientos o resultados de la enfermedad.
ResultadosLa revisión sistemática identificó tres estudios de intervención que examinaron el efecto de la leucina sin ejercicio físico, uno de leucina con ejercicio físico, siete de leucina combinada con otro nutriente y sin ejercicio físico, y doce de leucina combinada con otro nutriente y ejercicio físico. Los resultados encontraron que la suplementación con leucina sola y sin ejercicio físico no mejoró los marcadores de sarcopenia, mientras que las intervenciones que combinan leucina con suplementos, particularmente suplementos proteicos enriquecidos con leucina son un tratamiento prometedor para la mejora de los marcadores de sarcopenia, ya sean con o sin ejercicio físico.
ConclusionesSe observó que la suplementación con leucina, específicamente combinada con suplementos de proteínas, con y sin ejercicio físico, es una intervención dietética eficaz para la mejora de la sarcopenia. Se necesitan más intervenciones dietéticas para calcular las cantidades de dosis efectivas tanto para la leucina como para la suplementación de nutrientes como parte integral del tratamiento.
Older adults are at a greater risk of developing sarcopenia as a result of reduced mobility, malnutrition, dietary changes and certain diseases. There are no systematic reviews in the literature analysing the effects of supplementation with leucine alone or as part of a supplement, and with or without physical exercise in older people with sarcopenia. We aimed to systematically review the evidence in intervention studies on the effects of supplementation with leucine, either alone, combined with other supplements, or combined with other supplements and physical exercise in older people with sarcopenia.
Materials and methodsLiterature searches related to the topic were conducted in three databases (PubMed/MEDLINE, Cochrane and SciELO) looking for articles published prior to December 2020. This review includes intervention studies in older adults over 60 years of age with a history of sarcopenia where researchers reported on the effects of leucine supplementation, with or without physical exercise, related to the disease's treatments or outcomes.
ResultsThe systematic review identified three intervention studies examining the effect of leucine without physical exercise, one on leucine with physical exercise, seven on leucine paired with another nutrient and without physical exercise, and twelve on leucine paired with another nutrient and physical exercise. The results revealed that leucine supplementation alone and without physical exercise did not improve markers of sarcopenia, whereas interventions pairing leucine with supplements, particularly leucine-enriched protein supplements, are a promising treatment for the improvement of sarcopenic markers, whether with or without physical exercise.
ConclusionsLeucine supplementation, specifically paired with protein supplements, both with and without physical exercise, was found to be an effective dietary intervention for the improvement of sarcopenia. Further dietary interventions are necessary to calculate effective dosage quantities for both leucine and nutrient supplementation as an integral part of the treatment.
El proceso normal de envejecimiento en el ser humano se presenta, a nivel fisiológico, como uno de los principales factores de riesgo del deterioro funcional del organismo, así como de la salud en general, provocando una mayor susceptibilidad a enfermedades. Ciertos factores son inherentes a la funcionalidad del músculo esquelético como la inflamación crónica de bajo grado1, la disminución del número de células satélite y unidades motoras funcionales2, la disfunción mitocondrial3, la disminución de los niveles de hormonas anabólicas4 y la pérdida o deficiencia a nivel proteostático5, lo que produce numerosos cambios en la composición corporal a medida que los músculos se debilitan y los niveles de grasa corporal aumentan. Estos cambios dan como resultado lo que se denomina sarcopenia, término que fue nombrado por primera vez por Rosenberg en 19896. La sarcopenia se presenta como un síndrome en el que el desgaste muscular se caracteriza por una pérdida generalizada y progresiva de la masa y/o calidad muscular, fuerza muscular y/o baja capacidad física producida durante el envejecimiento7. Por lo tanto, la sarcopenia puede contribuir a un mayor riesgo de caídas y fracturas, trastornos de la movilidad, deterioro funcional (la velocidad de la marcha, el tiempo que tarda la persona en sentarse o levantarse de una silla, en subir escaleras, etc.), lo que provoca un aumento en el grado de dependencia, descenso de la calidad de vida, mayor riesgo de disfuncionalidad, aumento del coste económico para el mantenimiento y cuidado de la salud y, en último lugar, un mayor riesgo de muerte7.
El reconocimiento de la sarcopenia como un síndrome geriátrico fue establecido por el Grupo de Trabajo Europeo en Sarcopenia en personas adultas mayores (EWGSOP). Este grupo de trabajo fija como criterios principales para su diagnóstico clínico una función muscular deficiente caracterizada por baja fuerza muscular y masa muscular reducida7. En el año 2019, la EWGSOP, en una nueva reunión para el consenso del diagnóstico de sarcopenia (EWGSOP2), actualizó las pautas de definición de sarcopenia, ofreciendo una definición operativa, la cual la identifica y prioriza por una disminución de la fuerza muscular como parámetro principal, se confirma por una baja calidad o cantidad muscular y se considera grave por un bajo rendimiento físico8.
La edad es el principal factor determinante del aumento de la sarcopenia y directamente proporcional al paso de los años9. La pérdida de masa del músculo esquelético comienza de forma gradual a la edad de 50 años de edad y se acelera después de los 70 años9. Su prevalencia va desde un 5-13% aproximadamente entre las personas de 60-70 años, hasta llegar al 50% entre los individuos de 80 años10. Además, la pérdida de la capacidad funcional en las personas adultas mayores con sarcopenia, que puede comportar situaciones de inmovilidad, inestabilidad y deterioro intelectual, y se identifica como un predictor de discapacidad, hospitalización y muerte, puede llegar hasta un 3% anual a partir de los 60 años10. Igualmente, la pérdida del músculo esquelético asociada a la edad se debe a una interrupción en el recambio de proteínas del músculo esquelético11, causada principalmente por la falta de ejercicio físico y la desnutrición proteica, siendo ambos motivos las principales causas de sarcopenia12.
El sedentarismo y los hábitos alimentarios pueden afectar a las condiciones musculoesqueléticas de una persona adulta mayor. El ejercicio físico, sobre todo, los ejercicios de fuerza, y las intervenciones de tipo nutricional son las estrategias más utilizadas para atenuar esta pérdida de masa muscular y fuerza muscular, sobre todo, a través de la mejora en la cantidad y calidad de la proteína dietética ingerida13,14. Por un lado, el ejercicio estimula directamente la síntesis de proteína muscular post-ejercicio13. Por otro lado, evidencia reciente muestra que las recomendaciones nutricionales oficiales actuales para la ingesta de proteínas en la persona adulta mayor no son suficientes para provocar una síntesis proteica apreciable que disminuya el riesgo de sarcopenia15–19. Estas recomendaciones varían entre los 0,8 y 1,2 g/kg de peso corporal/día por igual para todos los grupos de edad, independientemente del sexo, la actividad física o el estado de salud. Sin embargo, queda demostrado que una ingesta diaria de proteínas de al menos 1,2-1,5 g/kg de peso repartidas a lo largo del día, es segura y beneficiosa en la población adulta mayor14,16. En consecuencia, se ha sugerido la ingesta de unos 20-30 g de proteína de alto valor biológico (10-15 g de aminoácidos esenciales con al menos 3 g de leucina), preferentemente de origen animal, repartida en las comidas principales (desayuno, almuerzo y cena) como una de las principales estrategias efectivas para contrarrestar el catabolismo proteico y la atrofia muscular relacionada con la edad20,21.
El consumo de proteínas y, en especial, la suplementación con leucina, un aminoácido esencial de cadena ramificada, es una de las estrategias más utilizadas para el aumento de la síntesis proteica muscular, ya que provoca un aumento en la expresión de la vía de señalización más importante que se encuentra regulada por nutrientes, denominado complejo de la diana de la rapamicina de mamíferos 1 (mTORC1)21,22. La vía de señalización mTOR interviene en diversas funciones celulares como la síntesis proteica y la autofagia21,22. Igualmente, el consumo de proteínas ricas en leucina provoca una modificación en el recambio de proteínas en los músculos esqueléticos y una disminución de la proteólisis mediante la estimulación del eje de señalización formado por el coactivador 1-alfa del receptor gamma activado por el proliferador de peroxisomas (PGC-1α), que, entre otras funciones, se encarga de la regulación de la biogénesis mitocondrial, la degradación proteica y la autofagia, así como del eje de señalización relacionado con la proteína quinasa activada por la adenosina monofosfato (AMPKα) y la sirtuina 1 (SIRT1) (SIRT1-AMPKα), formando ambos el eje SIRT1-AMPKα-PGC-1α21,22.
Al igual que el aminoácido leucina, el β-hidroxi-β-metilbutirato (HMB), un metabolito activo que deriva del catabolismo del aminoácido leucina se presenta como una sustancia coadyuvante en la prevención de la atrofia muscular por desuso, así como en la mejora de la recuperación del músculo esquelético, característica propia de las personas adultas mayores con sarcopenia. La principal función del HMB es aumentar la síntesis proteica través de la activación de la vía de señalización mTOR y el factor de crecimiento similar a la insulina-1 (IGF-1), así como funciones anti catabólicas mediante la disminución de la vía ubiquitina-proteasoma y el aumento del anabolismo proteico21,22.
Por tanto, la administración de alimentos junto a suplementos de leucina o suplementos proteicos enriquecidos con leucina, y la realización de ejercicio físico, se presenta como una medida terapéutica prometedora en el tratamiento de los factores condicionantes de la sarcopenia, como son la fuerza y masa muscular y el rendimiento físico23, ya que como muestran diferentes estudios, la administración de leucina sola no proporciona los mismos resultados que si se combinan junto a suplementos proteicos y ejercicio físico22,23.
Por ello, se realiza la presente revisión sistemática con el objetivo de identificar y evaluar el efecto que produce la suplementación con leucina, ya sea sola, junto con otro suplemento y con o sin ejercicio físico en personas adultas mayores con sarcopenia. El objetivo secundario es identificar la cantidad exacta de leucina en los diferentes tipos de intervenciones, así como determinar el tipo de ejercicio físico que de forma sinérgica provocan una mejora en los principales marcadores de sarcopenia.
Materiales y métodosEl protocolo para esta revisión sistemática se registró en la base de datos PROSPERO en mayo del 2021: CRD42021243674. Esta revisión sistemática se diseñó y desarrolló conforme a los criterios PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) para la realización de revisiones sistemáticas y meta-análisis24, que es un conjunto de elementos mínimos basados en la evidencia para evaluar los daños y beneficios de una posible intervención sanitaria.
Con el fin de encontrar una respuesta específica del ámbito de la nutrición y la clínica, y la mejor búsqueda y análisis de la información, se revisaron varias bases de datos científicas. Para acceder a las bases de datos se emplearon las siguientes bibliotecas: PubMed/MEDLINE, base de datos Cochrane y SciELO para todas las entradas, hasta el 30 de diciembre de 2020. Tanto el español como el inglés fueron los dos idiomas preferentes para la selección de estudios. De la misma forma, no se aplicaron filtros a nivel de raza o sexo para aumentar la potencia del análisis.
Los principales términos utilizados para la estrategia de búsqueda en las tres bases de datos fueron sarcopenia, leucine y elderly ((sarcopenia [MeSH Terms] OR sarcopenia [All Fields]) AND Sarcopenia [Mesh] AND (leucine [MeSH Terms] OR leucine [All Fields]) AND (aged [MeSH Terms] OR aged [All Fields] OR elderly [All Fields]), así como uno de los siguientes términos de forma secundaria: older, trial, review y animals.
Para seleccionar los estudios incluidos en esta revisión sistemática se revisaron los títulos y resúmenes de cada una de las entradas mostradas en la búsqueda, examinándose de forma completa los estudios donde los participantes cumplían de forma exhaustiva con todos los criterios de inclusión: a) estudios experimentales, ensayos aleatorios y controlados y estudios observacionales como estudios de cohorte, transversales, y de casos y controles sobre personas adultas mayores con sarcopenia; b) estudios en los que se midiera al menos uno de los criterios de diagnóstico de la sarcopenia, como son la masa muscular y/o fuerza muscular y/o rendimiento físico; c) estudios experimentales sobre el efecto de la suplementación oral con leucina sola sin ejercicio físico, suplementación oral con leucina junto a ejercicio físico, suplementación oral con leucina junto a otro nutriente sin ejercicio físico y suplementación oral con leucina junto a otros nutrientes y ejercicio físico en el tratamiento de las personas adultas mayores con sarcopenia; d) estudios experimentales en los que la dosis de leucina administrada a los sujetos del estudio viniese especificada o se pudiese calcular.
Al igual que con los criterios de inclusión, para eliminar aquellos artículos que no cumpliesen los requisitos se utilizaron los siguientes criterios de exclusión: a) estudios en los que la población de estudio tuviera menos de 60 años; b) estudios en los que no se incluyera un grupo placebo; c) estudios en los que el tiempo de duración fuera inferior a una semana; d) estudios que estuvieran realizados en animales, y que los resultados se emplearan en humanos para el tratamiento de la persona adulta mayor con sarcopenia.
Para la determinación y selección de los estudios que cumpliesen con el objetivo principal de la presente revisión y que debieran de ser incluidos en la misma, se seleccionaron y revisaron de forma independiente cada uno de los títulos y resúmenes, recuperándose los textos al completo en base a los criterios de inclusión y exclusión especificados para su revisión de forma independiente e individualizada. Conjuntamente se realizaron referencias cruzadas para identificar y poder excluir los artículos duplicados.
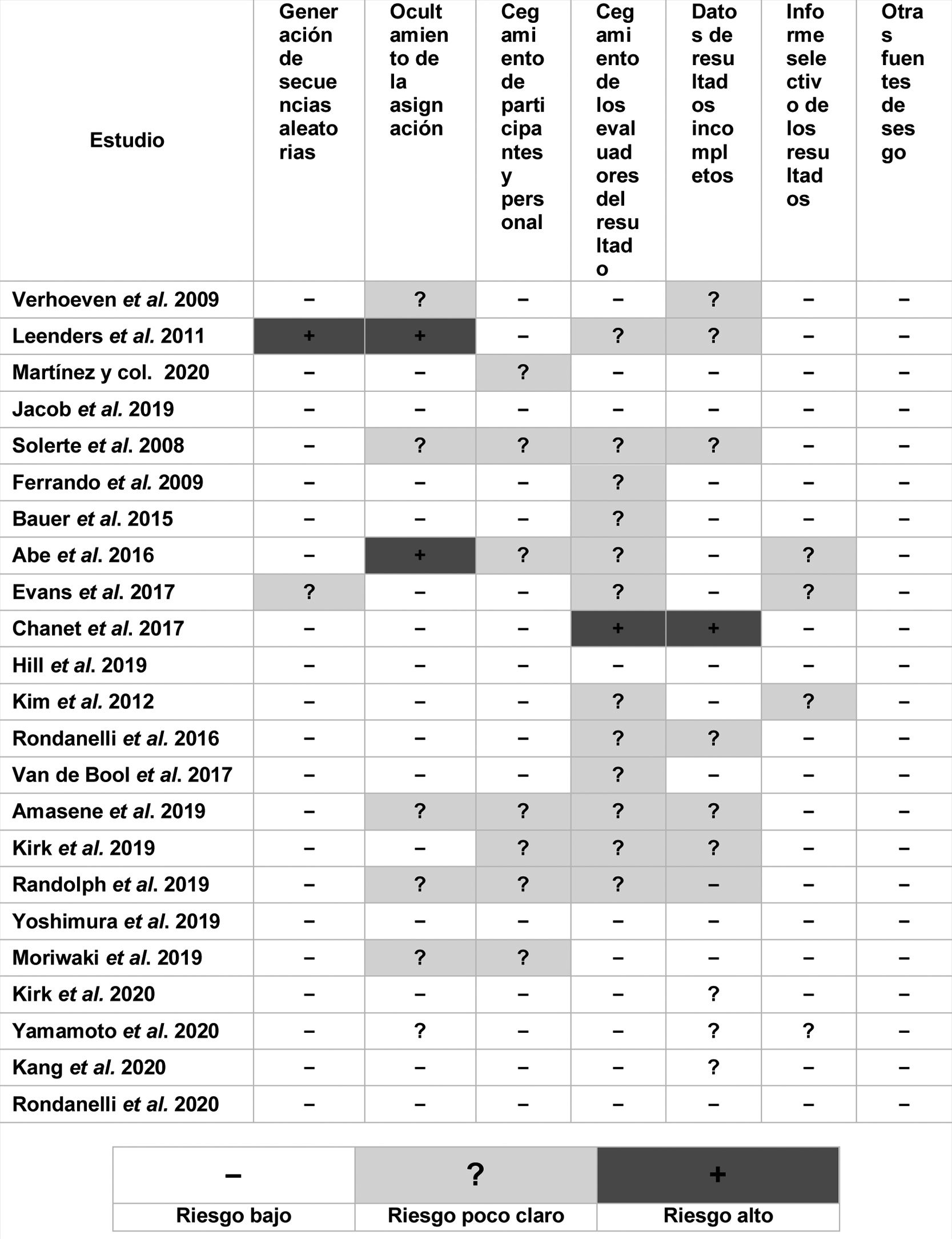
La calidad metodológica de los ensayos se evaluó mediante la aplicación de la herramienta del riesgo de sesgo del Manual Cochrane 5.1025, mediante la evaluación del sesgo. Se asignó un riesgo de sesgo bajo a aquellos estudios que abordaron cada dominio presentado en la tabla de dominios de sesgo de forma apropiada y riesgo de sesgo alto cuando no lo hacían. Si no hubo suficiente información disponible para alcanzar una valoración del riesgo de sesgo se respondió con la valoración ̈riesgo poco clarö. La evaluación incluyó los siguientes dominios del sesgo: la generación de secuencias aleatorias, el ocultamiento de la asignación, cegamiento de los participantes, del personal y de los evaluadores de los resultados, datos de resultados incompletos, la notificación selectiva de los resultados y otras fuentes de sesgo.
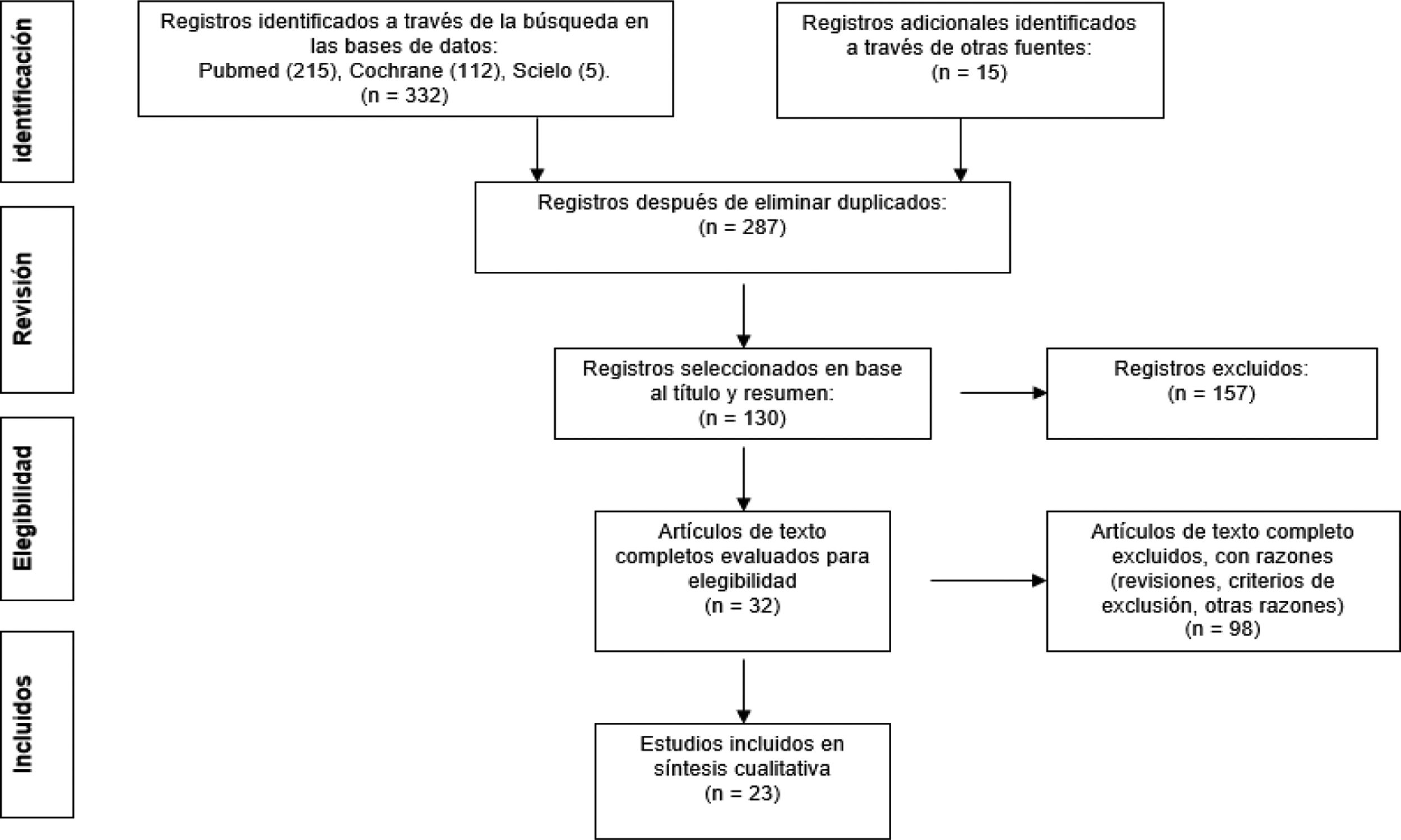
ResultadosMediante la estrategia de búsqueda utilizada se identificaron inicialmente un total de 332 artículos pertenecientes a las tres bases de datos utilizadas, PubMed (215 artículos), Cochrane (112 artículos) y SciELO (cinco artículos). Además, se realizó una búsqueda manual de la bibliografía de 15 ensayos relevantes que no generó ningún estudio adicional para su inclusión. Después de aplicar los criterios de inclusión y de exclusión, eliminar los artículos repetidos, y el análisis y lectura de los artículos seleccionados, se incluyeron un total de 23 estudios para la realización de la presente revisión sistemática. En la figura 1 se muestra el diagrama de flujo que describe la estrategia de búsqueda, selección, eliminación e inclusión de los artículos que cumplieron con los criterios de elegibilidad mencionados.
Los 23 estudios incluidos fueron publicados en el periodo temporal 2008-2020 (tablas 1 y 2). Todas las personas adultas mayores habían sido diagnosticadas con sarcopenia y tenían más de 60 años de edad.
Estudios que incluyen suplementación con leucina sola con ejercicio físico y suplementación con leucina sin ejercicio físico
| Estudio, año (ref) | Tamaño de la muestra (n) hombre/mujeres | Edad(años) | Cantidad de leucina | Tiempo de suplementación | Ejercicio físico sí/no | Duración | Tipo de ejercicio | Resultado |
|---|---|---|---|---|---|---|---|---|
| Verhoeven et al. 2009/ECA(26) | n: 30H: 30 / M: 0 | ≥ 70 | 7,5 g/día | 12 semanas | NO | --- | --- | ↔ MM↔ FM↔ SI |
| Leenders et al. 2011/ECA(27) | n: 60H: 60 / M: 0 | ≥ 70 | 7,5 g/día | 24 semanas | NO | --- | --- | ↔ MM↔ FM↔ MG |
| Martínez et al. 2020/ECA(28) | n:42H: 14 / M: 29 | ≥ 65 | 6 g/día | 6 semanas | NO | --- | --- | ↑ MM↑ FU |
| Jacob et al. 2019/ECA(29) | n: 19H: 0 / M: 19 | ≥ 75 | 7,5 g/día | 12 semanas | SÍ | 60 minutos. Todos los días | 5́ Clm + 3 ser. x 15 rep. (ps-p, ex- p, ps-b, ja-pe) + 5́ est. | ↑ MM↑ FU↓ MG |
Ca: calcio; Clm: calentamiento; DMO: densidad mineral ósea; EAA: aminoácidos esenciales; ECA: ensayo aleatorio controlado; EF: ejercicio de fuerza; ER: ejercicio de resistencia; Est: estiramiento; ex-p: extensiones de pierna; FM: fuerza muscular; FU: funcionalidad; GR: grasa; H: hombres; HC: hidratos de carbono; ja-pe: jalón al pecho; M: mujeres; MCT: triglicéridos cadena media; MG: masa grasa; MM: masa muscular; n: tamaño de la muestra; ps-b: press de banca; ps-p: press de piernas; rep: repeticiones; ser: series; SI: sensibilidad insulina; TCL: triglicéridos cadena larga; Vit. D: Vitamina D; ↑: aumento; ↓: disminución; ↔: sin cambios.
Estudios que incluyen suplementación con leucina junto a otro nutriente sin ejercicio y suplementación con leucina junto a otros nutrientes y ejercicio físico
| Estudio, año (ref) | Tamaño de la muestra (n) hombre/mujeres | Edad(años) | Suplemento utilizado (g/día) | Tiempo de suplementación | Ejercicio físico sí/no | Duración | Tipo de ejercicio | Resultado |
|---|---|---|---|---|---|---|---|---|
| Solerte et al. 2008/ECA (30) | n: 41H: 41 / M: 0 | 66–84 | 8 g EAA (2,5 g LEU) | 18 meses | NO | --- | --- | ↑ MM↓ MG↑ SI |
| Ferrando et al. 2009/ECA (31) | n: 22H: 7 / M: 15 | ≥ 65 | 3 x 15 g EAA (5,3 g LEU) | 10 días | NO | --- | --- | ↔ MM↔ FM |
| Bauer et al. 2015/ECA(32) | n: 380H: 131 / M: 249 | ≥ 65 | 2 x (20 g de Prot-S + 3 g LEU + 9 g HC + 800 UI Vit. D + vitaminas y minerales) | 13 semanas | NO | --- | --- | ↑ FM↑ MM↑ FU |
| Abe et al. 2016/ECA (33) | n: 38H: 11 / M: 27 | ≥ 85 | 1,2 g LEU + 800 UI Vit. D + 6 g MCT | 12 semanas | NO | --- | --- | ↑ FM↑ FU |
| Evans et al. 2017/ECA(34) | n: 42H: 15 / M: 27 | 55-70 | 2,2 g CAR + 3 g de CREAT + 2 g LEU + 400 UI Vit. D | 8 semanas | NO | --- | --- | ↑ FM↑ MM |
| Chanet et al. 2017/ECA(35) | n: 24H: 0 / M: 24 | ≥ 70 | 2 (x 21 g de Prot-S + 3 g LEU + 9 g HC + 3 g GR + 800 UI Vit. D + vitaminas y minerales) | 6 semanas | NO | --- | --- | ↑ FM↑ FU↑ MM |
| Hill et al. 2019/ECA(36) | n: 380H: 131 / M: 249 | ≥ 65 | 2 x (20 g de Prot-S + 3 g LEU + 9 g HC + 800 UI Vit. D + 500 mg Ca + vitaminas y minerales) | 13 semanas | NO | --- | --- | ↑ FM↑ MM↑ FU↑ DMO |
| Kim et al. 2012/ECA(37) | n: 155H: 0 / M:155 | ≥ 75 | 6 g EAA (42% LEU (2,5 g)) | 12 semanas | SÍ | 60 minutos. Sin especificar veces/semana | 5́Clm + 30́EF (band. elast: Flex cad-bi-tri, ex − r) | ↑ FM↑ MM↑ FU |
| Rondanelli et al. 2016/ECA(21) | n: 130H: 53 / M: 77 | ≥ 80 | Prot-S 22 g + 10,9 g EAA (4 g LEU), 4,4 g HC + 100 UI Vit. D | 12 semanas | SÍ | 20 minutos. 5 veces/semana | 5́Clm + 5́ EFU (8 rep. pp, ex − r, elp, flex cad-bi-tri) + 5́aeb + 5́est. | ↑ FM↑ MM↑ FU |
| van de Bool et al. 2017/ECA(38) | n: 81H: 41 / M: 40 | ≥ 60 | 3 x (4,2 g Prot-S + 4,2 g CAS + 0,09 g/Kg/día LEU + 28,3 g HC + 4,2 g GR + Vitaminas y minerales | 16 semanas | SÍ | Sin especificar | Ejercicios de fuerza y aeróbicos. Sin especificar | ↑ FM↑ RFA↑ FMI |
| Amasene et al. 2019/ECA(39) | n: 28H: 0 / M: 28 | ≥ 70 | 20 g Prot-S (3 g LEU) | 12 semanas | SÍ | 60 minutos2 veces/semana | EF (Flex cad-bi-tri, ex − r, ex-r) + EQ + 5́ est.Carga personalizada | ↑ FM↑ MM |
| Kirk et al. 2019/ECA(40) | n: 46H: 25 / M: 21 | ≥ 65 | 1,5 g/kg/día Prot-S + 0,09 gr/kg/día LEU | 16 semanas | SÍ | 2 veces/semana EFU + 1 vez/semana EFUN | 8 EFU (ps-b, ps-p, ps-h, sent, ja-pe, flex-bi-tri) + 12 EFUN | ↔ MM↔ FM↑ CA |
| Randolph et al. 2019/ECA(41) | n: 42H: 13 / M: 29 | 65-85 | 12,5 g EAA (6 g LEU | 22 semanas | SÍ | 45 minutos3 veces/semana | Cinta andadora | ↑ FM↑ RF↑ FU |
| Yoshimura Y. et al. 2019/ECA(42) | n: 44H: 14 / M: 30 | ≥ 75 | 7 g EAA (3 g LEU) + 9,7 g HC. | 8 semanas | SÍ | Sin determinar.Todos los días | Estar de pie, pasamanos(2 series x 10 rep hasta llegar 120 rep). | ↑ FM↑ MM ↑ RFA↑ FU |
| Moriwaki et al. 2019/ECA(43) | n: 55H: 30 / M: 15 | < 75 y ≥ 75* | 2 x (2,5 g BCAA (1,4 g LEU) + 400 UI Vit. D) | 12 semanas | SÍ | 90 minutos | Estar de pie, caminar, sala rehabilitación (no especifica ejercicio) | ↑ MM↑ PC |
| Kirk et al. 2020/ECA(44) | n: 100H: 48 / M: 52 | ≥ 65 | 1,5 g/kg/día Prot-S + 0,09 g/kg/día LEU | 16 semanas | SÍ | 2 veces/semana EFU + 1 vez/semana EFUN | 8 EFU (ps-b, ps-p, ps-h, sent, ja-pe, flex-bi-tri) + 12 EFUN | ↔ MM↔ FM↑ CA |
| Yamamoto et al. 2020/ECA(45) | n: 53H: 28 / M: 25 | 70-79 | 2 x 3 g Prot (1,2 g LEU + 1,8 g OA + 0,04 g GRAS + 0,2 g HC) | 48 semanas | SÍ | 15 min/día7 veces/semana EFU | Band. Elast. 1 x 20 Rep (Ab. P + el-f + CuM + ex-p + el-g + sent) | ↑ MM↑ FM |
| Kang et al. 2020/ECA(46). | n: 120H: 23 / M: 87 | ≥ 65 | 2x 20 g M-Prot (50% CAS + 40% Prot-S + 10% SOJ (3 g LEU total) + 800 UI Vit. D + 300 g Ca + 1,1 g GR + 2,5 g HC) | 12 semanas | SÍ | 20 min/día7 veces/semana EFU | Ejercicios sin especificar | ↑ MM↑ FM |
| Rondanelli et al. 2020/ECA(47) | n: 140H: 140 / M: 0 | ≥ 65 | 2x 40 r M-Pol (20 g Prot-S + 2,8 g LEU + 9 g HC + 800 UI Vit. D + 500 mg Ca + FIB | 8 semanas | SÍ | 20-30 min/día5 veces/semana 20-30́ EFU | 5́Clm + 5-10́ EFU (8 rep: el-dp; el-g;ex-r; el-r; flex-ex-rs; flex-ex-rdp; ex-p; flex-cad; flex-bi) + 5-10́ EQ + 5́est. | ↑ MM↑ FM↑ RFA↓ DRE |
Ab. P: abertura de pecho; aeb: ejercicio aeróbico; BCAA: aminoácidos cadena ramificada; band. elast: banda elástica; Ca: Calcio; CA: capacidad aeróbica; CAR: carnitina; CAS: caseína; Clm: calentamiento; CREAT: creatina; CuM: curl martillo DMO: densidad mineral ósea; DRE: duración de rehabilitación; EAA: aminoácidos esenciales; ECA: ensayo aleatorio controlado; EF: ejercicio físico; EFU: ejercicio de fuerza; EFUN: ejercicios funcionales; el-dp: elevación dedo del pie; el-f: elevación frontal brazos; el-g: elevación de gemelos; el-p: elevación lateral de pierna; el-r: elevación de rodilla; EQ: ejercicios de equilibrio; ER: ejercicio de resistencia; Est: estiramiento; ex-p: extensiones de pierna; ex−r: extensión de rodilla; FIB: fibra; FM: fuerza muscular; FMI: fuerza muscular inspiratoria; flex-bi: flexión de bíceps; flex-cad: flexión de cadera; flex cad-bi-tri: flexión de cadera-bíceps-tríceps; flex-ex-rs: flexión extensión rodilla sentado; flex-ex-rdp: flexión extensión rodilla de pie; FU: funcionalidad; g: gramo; GR: grasa; H: hombres; HC: hidratos de carbono; Ja-pe: jalón al pecho; LEU: leucina; M: mujeres; MCT: triglicéridos cadena media; MFM: mantenimiento fuerza muscular; mg: miligramos; MG: masa grasa; MM: masa muscular; M-Pol: mezcla de polvo; M-Prot: mezcla de proteínas; n: tamaño de la muestra; OA: otros aminoácidos; PC: peso corporal; Prot-S: proteína de suero; Ps-b: press de banca;: Ps-h: press horizontal; Ps-p: press de piernas; Rep: repeticiones; RFA: resistencia física aeróbica; sent: sentadillas; Ser: series; SI: sensibilidad a la insulina; SOJ: soja; TCL: triglicéridos cadena larga; UI: Unidades Internacionales; Vit. D: Vitamina D; ↑: aumento; ↓: disminución; ↔: sin cambios/mantenimiento.
Las principales características de los 23 estudios seleccionados se resumen en la tabla 1 y tabla 2. La información mostrada en ambas tablas hace referencia a: la fuente de estudio (autor/es y año de publicación); el tipo de estudio; la edad, el sexo y el número de participantes de la población de estudio; el tipo de intervención (dosis de leucina y de otros ingredientes, protocolo de administración, realización de ejercicio físico, duración y tipo de ejercicio), y los resultados obtenidos tras la suplementación oral con leucina sola o con ejercicio físico (tabla 1), y suplementación oral con leucina junto a otro nutriente o junto a otro nutriente y ejercicio físico (tabla 2).
Los principales parámetros analizados para identificar la mejora de la sarcopenia en las intervenciones realizadas fueron la masa muscular y la fuerza muscular, ya que ambos son los componentes clave en la determinación de la sarcopenia. También se tuvieron en cuenta otros parámetros relacionados con la mejora de la calidad de vida de las personas adultas mayores con sarcopenia y de pronóstico de mejora de la salud: la densidad mineral ósea, la masa grasa, la funcionalidad, la sensibilidad a la insulina, la resistencia física, la capacidad aeróbica, la fuerza muscular inspiratoria y la duración de la rehabilitación (tablas 1 y 2).
En aquellos estudios en los que, junto a la suplementación, ya fuese con leucina sola o junto a otro nutriente, se realizó ejercicio físico independientemente del tipo y duración, o no se realizara ejercicio físico, la suplementación nutricional se mantuvo durante todo el tiempo que duró la intervención (tablas 1 y 2).
De los 23 estudios incluidos, los realizados por Verhoeven et al. y Leenders et al. en los que se ofrecieron suplementos de leucina sola sin ejercicio físico, no mostraron mejoras en la masa y la fuerza muscular26,27. Tan solo el estudio presentado por Martínez-Arnau et al.28 observó que el grupo suplementado con leucina sola sin ejercicio físico sí produjo efectos reducidos pero significativos sobre el índice de masa muscular, ya que ésta se mantuvo durante todo el periodo que duró la intervención en contraposición al grupo placebo donde hubo una disminución del índice de masa muscular. Este efecto de mantener estable la masa muscular a lo largo del tiempo se relacionó con la mejora del estado nutricional de los individuos suplementados con leucina al finalizar la intervención. Por el contrario, se observó una mejora significativa en el rendimiento físico, medido a través del tiempo de caminata, después de la suplementación con leucina en comparación con los valores iniciales en el grupo de intervención, sin observarse ningún efecto en el grupo de control suplementado con placebo. En cambio, la combinación de leucina junto a ejercicios de fuerza mostró mejoras significativas en marcadores de sarcopenia como la fuerza muscular y la masa muscular, consiguiendo de forma secundaria una disminución en la masa grasa sin alterar los niveles de sensibilidad a la insulina29.
De los 7 estudios que incluyeron suplementación oral con leucina junto a otro nutriente sin ejercicio físico30–36, cuatro mostraron mejoras en la masa y fuerza muscular tras la combinación de leucina junto a otros suplementos como aminoácidos esenciales, proteína de suero de leche, hidratos de carbono, carnitina, creatina y triglicéridos de cadena media32,34–36. El estudio realizado por Solerte et al.30, que tan solo estudió el efecto de la suplementación con aminoácidos esenciales enriquecidos con leucina sin ejercicio físico, observó mejoras en la masa muscular, así como una disminución de la masa grasa y una mejora de la sensibilidad a la insulina como mejoras secundarias30. El estudio de Abe et al.33, observó mejoras en la fuerza muscular, así como en la funcionalidad de forma secundaria tras la suplementación con leucina, vitamina D y triglicéridos de cadena media, así como en la funcionalidad de forma secundaria33. Los estudios que incluyeron, junto a proteína de suero de leche enriquecida con leucina, entre 400 y 800 UI de vitamina D al día, además de un aumento de la masa y la fuerza muscular, también mostraron mejoras en la densidad mineral ósea32 y la funcionalidad32,33,35,36, consiguiendo así una mejor calidad de vida. Tan solo el estudio de Ferrando et al.31, que ofreció un suplemento compuesto de aminoácidos esenciales enriquecidos con leucina y sin ejercicio físico, mostró que los participantes no tuvieron mejoras de masa y fuerza muscular al finalizar el estudio en comparación con los datos obtenidos al inicio del estudio31.
Aquellos estudios en los que se incluyeron suplementos con leucina junto a otro nutriente y ejercicio físico mostraron mejoras de forma significativa en la masa y fuerza muscular, la funcionalidad y la reducción del tiempo duración de la rehabilitación en hospitales para personas adultas mayores, sobre todo, aquellos que combinaron junto a la suplementación ejercicios de fuerza21,37–39,40–44,45–48. El estudio de Rondanelli et al.47 fue el único que, junto a un aumento de la masa y fuerza muscular y resistencia física aeróbica, obtuvo mejoras en la reducción del tiempo de duración de la rehabilitación tras la suplementación con mezcla de proteínas enriquecidas con leucina, hidratos de carbono, vitamina D, calcio y fibra alimentaria. En el estudio realizado por van de Bool et al.38, junto a las mejoras en la fuerza muscular, los participantes también mostraron otras mejoras funcionales añadidas tras añadir caseína y grasas junto a proteína de suero de leche enriquecida con leucina junto a ejercicio físico, como fue la mejora en fuerza muscular inspiratoria y en la resistencia física aeróbica. Tan solo en dos estudios diferentes realizados por Kirk et al. en años diferentes41,43, los resultados de fuerza y masa muscular se mantuvieron iguales tanto al inicio como al final de la intervención, mejorando solamente la capacidad aeróbica.
El análisis de la calidad metodológica y del riesgo de sesgo de los estudios incluidos se muestra en la figura 2.
Resumen del riesgo del sesgo: revisión de la opinión de los diferentes autores sobre cada elemento de riesgo de sesgo para cada uno de los estudios incluidos. El signo menos (-) indica bajo riesgo de sesgo; el signo más (+) indica alto riesgo de sesgo; el signo de interrogación (?) indica riesgo poco claro.
La pérdida de masa y fuerza muscular, así como sus consecuencias funcionales propias de la sarcopenia, ocurre en mayor o menor medida como parte integrante de los cambios fisiológicos que se producen durante el proceso de envejecimiento normal2,3, así como en ciertas patologías que aumentan el tiempo de reposo en cama23. Uno de los principales problemas observados en las personas adultas mayores sedentarias es que poseen ciertas limitaciones o falta de iniciativa para realizar ejercicio físico, siendo en este caso la intervención nutricional, y en especial la suplementación con leucina, una de las principales actuaciones para prevenir la aparición de la sarcopenia, así como sus consecuencias23,28. No obstante, los resultados de la presente revisión muestran que la administración de leucina de forma aislada no proporciona los mismos resultados que si se consume de forma conjunta con otros suplementos o junto con la práctica de ejercicio físico. Por ello, el análisis de los diferentes estudios revisados muestran que intervenciones nutricionales que incluyen leucina sola sin otro nutriente y sin ejercicio físico no mejoraron los aspectos relacionados con la sarcopenia26–27.
Tan solo el estudio realizado por Martínez-Arnau et al.28 mostró que los participantes que consumieron 6 g de leucina/día mantuvieron la masa muscular magra durante períodos de tiempo más prolongados, mejorando el estado nutricional de los individuos que recibieron la suplementación a pesar de no realizar ningún tipo de ejercicio físico. Esto podría ser una buena estrategia en aquellas personas adultas mayores con sarcopenia que se encuentran inmovilizadas por diferentes motivos, sobre todo, aquellas personas adultas hospitalizadas. En cambio, los estudios que sí incluyeron ejercicio físico junto a suplementos de leucina sola o junto a otro suplemento, mostraron mejoras tanto en la masa y fuerza muscular, la funcionalidad, la sensibilidad a la insulina, la composición corporal (reducción de la masa grasa) y la densidad mineral ósea, en especial los que incluyeron creatina, carnitina y vitamina D junto a leucina en sus fórmulas26,29,32–36.
Los estudios que incluyeron suplementos de leucina junto a otro suplemento y la práctica de ejercicio físico, y en especial ejercicios de fuerza, fueron los que mostraron un aumento y mejora significativa en la cantidad de masa y fuerza muscular, lo que se transformó en una reducción de comorbilidades, caídas y fracturas, aumentando la calidad de vida de los participante21,37–39,41–43,45–48. Hay que destacar que aquellos estudios que suplementaron a los participantes con fórmulas nutricionales a base de proteína de suero de leche enriquecida con leucina y vitamina D, ya fuese con ejercicio físico o sin ejercicio físico, fueron los que mostraron mejores resultados, tanto en los principales marcadores de sarcopenia, como la masa muscular, la fuerza muscular y el rendimiento físico, así como en los marcadores secundarios, como la densidad mineral ósea, la funcionalidad, el peso corporal y la fuerza muscular inspiratoria21,32–36,43,46,47. Por ello, revertir las deficiencias de vitamina D mediante su suplementación en combinación con leucina y proteína de suero de leche, podría contribuir a un efecto favorable sobre los parámetros musculares principales de la sarcopenia, así como a los marcadores secundarios. Igualmente, aquellas personas adultas mayores hospitalizadas que incluyeron un suplemento nutricional de proteína de suero de leche enriquecida con leucina y vitamina D, o suplementos de aminoácidos de cadena ramificada, enriquecidos con leucina, y vitamina D mostraron, junto a un aumento de la masa y la fuerza muscular, mejoras del rendimiento físico y del estado funcional, lo que provocó una reducción en la duración de la rehabilitación y una mayor proporción de altas hospitalarias21,39,43. Debido a ello, se sugiere que un suplemento nutricional compuesto de proteína de suero de leche enriquecida con leucina y vitamina D estimula casi el doble la síntesis de proteína muscular posprandial en un entorno agudo, mejorando los marcadores propios de la sarcopenia y atenuando la inflamación, que es el factor clave que contribuye a la enfermedad21,39,43.
Al igual que con la suplementación de suero de leche enriquecida con leucina y vitamina D, con la suplementación de creatina junto a L-Carnitina y leucina también se observaron mejoras significativas en la masa muscular total, así como en la fuerza muscular34. Tal y como demostraron Evans et al.34, la adición de leucina y creatina puede tener acciones sinérgicas cuando se incorpora con L-Carnitina, provocando mejoras en los principales marcadores de sarcopenia, independientemente de si se realiza ejercicio físico. Este hecho puede estar determinado, probablemente, por un mecanismo común que promueve el aumento de la síntesis de proteínas, aumenta la biodisponibilidad de los aminoácidos ramificados y disminuye la degradación de las proteínas34.
Tanto la duración como el número total de series de cada sesión de entrenamiento no fueron determinantes a la hora de mostrar mejoras en los principales marcadores de sarcopenia en las personas adultas mayores no institucionalizadas incluidas en las diferentes intervenciones revisadas21,37–39,41–43,45–48. En cambio, en aquellas personas adultas mayores que se encontraban hospitalizadas y que se les administró suplementación oral de leucina junto a otro nutriente, se observaron mejoras significativas en la capacidad funcional (incluida la capacidad de marcha y caminar), la masa y la fuerza muscular a medida que iban aumentando en las sesiones de entrenamiento tanto la intensidad como el tiempo de duración de la sesión, lo que resultó en una disminución en el tiempo de rehabilitación, un aumento en las altas hospitalarias más tempranas y disminución en los costes sanitarios42,43,47.
Respecto al tiempo de duración de la intervención, estudios como los de Luiking et al.49, Holwerda et al.50 y Churchward-Venne et al.51 mostraron que intervenciones inferiores a una semana solo mejoraron aspectos relacionados con la síntesis proteica y la masa muscular, pero no en la fuerza muscular ni en la calidad de vida. Por ello, y teniendo en cuenta los resultados de esta revisión, parece que la duración del tratamiento con leucina debe ser superior a una semana para que se produzcan efectos a largo plazo en la mejora de los parámetros de la masa muscular, la fuerza y ??la funcionalidad en las personas adultas mayores con sarcopenia, aunque son necesarios más estudios para confirmar estos hallazgos.
Los estudios presentados en la revisión incluyeron personas adultas mayores de 60 años que se encontraban tanto en hospitales, en comunidades de ancianos, así como en sus hogares, lo que reafirma la idea de que los resultados presentes en esta revisión podrían aplicarse a la mayoría de los que padecen sarcopenia.
Se ha observado que utilizar estrategias nutricionales ricas en suplementos que contienen leucina como parte de sus fórmulas, junto a ejercicio físico, y en especial ejercicios de fuerza, puede mejorar de forma significativa los marcadores propios de la sarcopenia, así como la calidad de vida. Esta mejoría es independiente del tiempo que duren las sesiones de entrenamiento, así como su volumen, sobre todo en personas adultas mayores tanto de carácter ambulatorio como no hospitalizadas. Queda por determinar la dosis exacta de leucina que deben de presentar los suplementos, ya que se han observado mejoras tanto en los estudios que ofrecen 2,5 g/día de leucina como parte integrante de sus fórmulas, así como en los que ofrecen hasta 6 g/día. Además, los tratamientos de leucina sola como estrategias nutricionales no proporcionan, en la actualidad, una mejora significativa en la prevención y tratamiento de la sarcopenia en el adulto mayor, ya que solo se ha observado un ligero mantenimiento de la masa y fuerza muscular durante el tiempo que duró la intervención.
En la literatura científica encontramos estudios que describen cómo la suplementación con leucina sola garantiza un mantenimiento de la fuerza y masa muscular durante todo el tiempo que dura la intervención en adultos mayores28. Igualmente hay estudios que muestran que tras la práctica de ejercicio físico hay una estimulación de la acumulación de proteínas musculares en las persona adultas mayores, siendo los ejercicios de fuerza una estrategia terapéutica eficaz para aumentar la masa del músculo esquelético y mejorar el rendimiento funcional en ellas13,14. Sin embargo, ninguna revisión sistemática publicada hasta el día de hoy ha incluido estudios donde se comparen de forma separada la influencia de la suplementación con leucina sola, junto a otro nutriente o junto a otro nutriente y con ejercicio físico en el tratamiento del adulto mayor con sarcopenia.
Los estudios incluidos en la presente revisión que presentan suplementación con leucina sola han resultado muy limitados en número, por lo que se necesita más evidencia para poder definir la dosis de leucina sola como parte del tratamiento y prevención de la sarcopenia. Por ello, se precisan futuras investigaciones en esta área para poder determinar la dosis exacta de suplementación de leucina sola y poder valorar el impacto que produce la suplementación con leucina en la prevención de la sarcopenia.
ConclusionesLa inactividad física, junto a una ingesta inadecuada de nutrientes, en especial de proteínas de alto valor biológico, puede derivar en un aumento del riesgo de padecer sarcopenia. Una adecuada alimentación, que contenga un consumo de proteína de alta calidad rica en leucina, junto a la realización de ejercicio físico, y, en particular de ejercicio de fuerza, es una de las estrategias más eficaces para retrasar la aparición de la sarcopenia, así como los eventos asociados a esta condición.
El uso de suplementación que contenga proteínas, leucina y vitamina D, entre otros suplementos, ejerce funciones protectoras y de mantenimientos del músculo esquelético, en especial de la masa y fuerza muscular, mejorando sustancialmente la calidad de vida de los adultos mayores, independientemente de si realizan ejercicio físico como si no lo realizan. Igualmente, en personas adultas mayores con sarcopenia ingresadas ??en hospitales para rehabilitación, el consumo de suplementación a base de proteína de suero de leche enriquecida con leucina y vitamina D se propone como un tratamiento prometedor para la mejora del rendimiento y la función física, así como la masa muscular y reducción de los costos hospitalarios en las personas adultas mayores con sarcopenia.
La suplementación oral de leucina junto a L-carnitina y creatina se plantea como otra base de suplementación prometedora en la mejora de la sarcopenia.
Hasta el momento, la administración de suplementos de leucina sola, y sin la práctica de ejercicio físico, como parte del tratamiento de la sarcopenia, no han mostrado unas mejoras significativas en los marcadores propios de la sarcopenia como para incluirlo en la estrategia nutricional del tratamiento de la enfermedad.
Aún queda por determinar, cuál es la cantidad adecuada de leucina que se debe incluir en los suplementos nutricionales ofrecidos, ya sea de forma independiente junto a la práctica de ejercicio físico, así como enriqueciendo los suplementos elaborados con proteína de suero de leche junto a otros nutrientes. Sin embargo, los resultados de los diferentes estudios incluidos en la revisión justifican la realización de más investigaciones sobre el papel de los suplementos nutricionales específicos como parte del tratamiento para la prevención de resultados adversos en las personas adultas mayores con riesgo de sarcopenia.
Respecto a los ejercicios de fuerza, el aumento de la intensidad de forma progresiva, incrementándose a medida que la fuerza aumenta, es lo que ha demostrado mejorar y/o conservar tanto la fuerza como la masa muscular. Aunque no queda claro cuál es el volumen de entrenamiento apropiado, así como el tipo de ejercicio que produce una mejora significativa en los marcadores de sarcopenia, existiendo discrepancia si se debe de realizar de manera concéntrica o excéntrica, por lo que futuros estudios serían necesarios para establecer las pautas correctas de cada sesión de entrenamiento, ya sea a nivel hospitalario como ambulatorio.
FinanciaciónLos autores declaran no haber recibido ninguna financiación externa para la realización de este trabajo de investigación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.