Evaluar el grado de control metabólico y los tratamientos hipoglucemiantes en una cohorte de pacientes con diabetes mellitus tipo 2 (DM2) tras su valoración en endocrinología.
Material y métodosEstudio de cohortes prospectivo. Se incluyeron 465 pacientes con DM2 que no realizaban seguimiento en una consulta de endocrinología. Se recogieron datos de control glucémico y tratamientos recibidos en una visita inicial y tras 26 semanas de seguimiento.
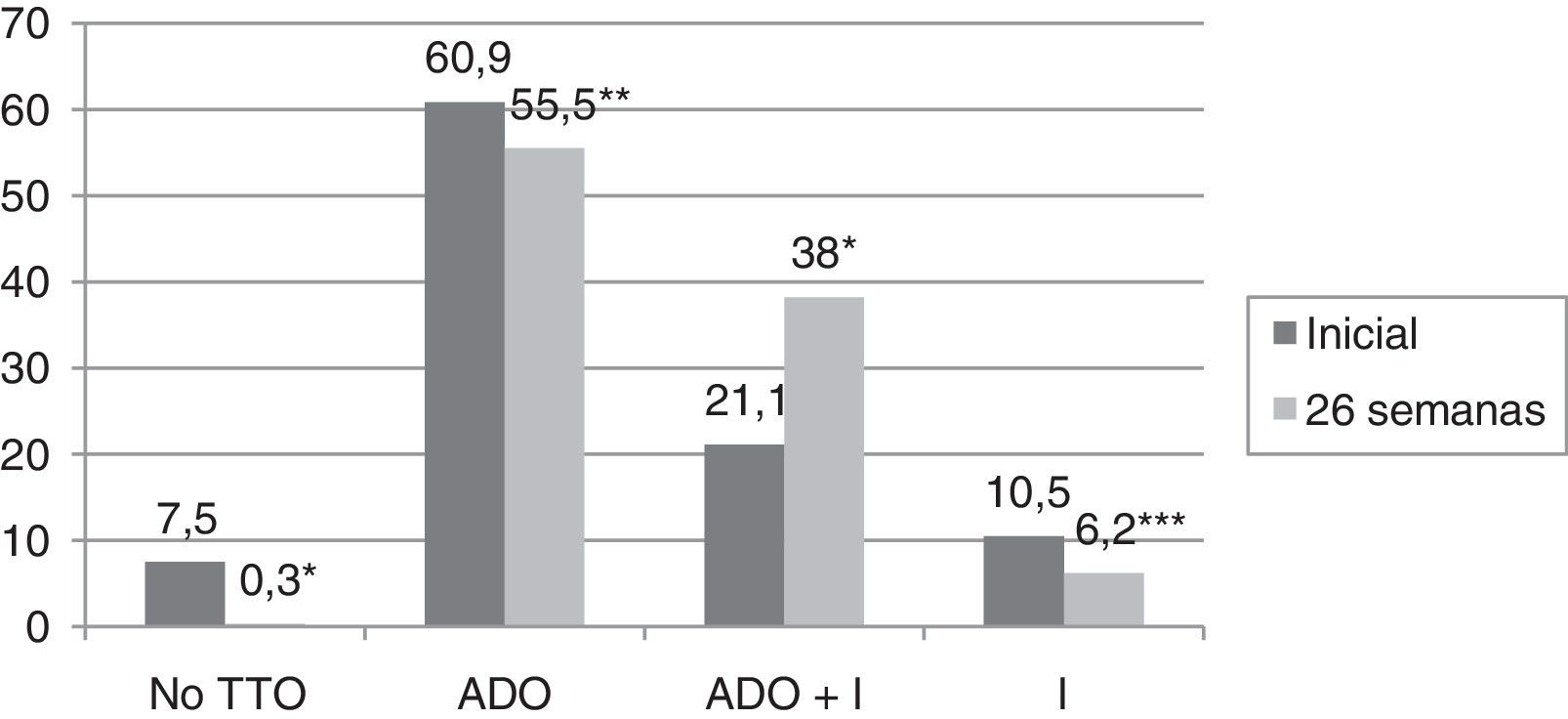
ResultadosLa hemoglobina glucosilada (HbA1c) inicial fue de 8,3±1,8%, mientras que tras 26 semanas de seguimiento fue de 6,6±0,9% (p<0,0001). El porcentaje de pacientes con HbA1c<7% ascendió de 33,1 a 71,3% (p<0,0001). En el 59,9% de los pacientes se observó un descenso ≥0,8% de HbA1c. En el análisis multivariante, las variables que predijeron una mejoría en el grado de control metabólico fueron una mayor edad (OR 1,038; IC 95%: 1-1,07; p=0,041), una mayor HbA1c inicial (OR 5,51; IC 95%: 3,4-9; p<0,0001), un tiempo de evolución de la DM2<5 años (OR 4,63; IC 95%: 1,6-13,3; p=0,005) y el cambio de tratamiento hipoglucemiante (OR 2,77; IC 95%: 1,1-6,9; p=0,03). En el 75,1% de los sujetos con DM2 incluidos en el estudio se modificó el tratamiento hipoglucemiante. El porcentaje de pacientes que no recibía tratamiento disminuyó del 7% al 0,3% tras 26 semanas de seguimiento (p<0,0001), así como el porcentaje de pacientes que recibía tratamiento con antidiabéticos orales (60,9 vs 55,5%) (p=0,003) e insulina (10,5 vs 6,2%) (p=0,021). Sin embargo, aumentó el porcentaje de pacientes que recibían tratamiento con insulina combinada con antidiabéticos orales de 21,1% a 38% (p<0,0001).
Conclusionesse produce una mejoría del control metabólico en esta cohorte de pacientes con DM2 tras su valoración en una consulta de endocrinología. No obstante, en el 28,7% no se alcanza un HbA1c<7%, lo que pone de manifiesto la dificultad en conseguir un buen control en la práctica clínica.
To assess the degree of metabolic control and hypoglycemic treatments in a cohort of patients with type 2 diabetes mellitus (T2DM) after evaluation in an endocrinology clinic.
Material and methodsA prospective cohort study on 465 patients with T2DM who were not being monitored at an endocrinology clinic. Blood glucose control data and treatments received were recorded at an initial visit and after 26 weeks of follow-up.
ResultsBaseline glycosylated hemoglobin (HbA1c) level was 8.3±1.8%, as compared to 6.6±0.9% after 26 weeks of follow-up (P<.0001). The proportion of patients with HbA1c levels <7% increased from 33.1% to 71.3% (P<.0001). In 59.9% of patients, a decrease ≥0.8% in HbA1c was seen. In the multivariate analysis, variables predicting for an improvement in the degree of metabolic control were older age (OR 1.038; 95%CI 1-1.07; P=.041), higher baseline HbA1c values (OR 5.51; 95%CI 3.4-9; P<.0001), T2DM duration <5 years (OR 4.63; 95%CI 1.6-13.3; P=.005), and change in hypoglycemic treatment (OR 2.77, 95%CI 1.1-6.9; P=.03). Hypoglycemic therapy was changed in 75.1% of study patients with T2DM. After 26 weeks of follow-up, decreases were seen in both the proportion of patients who receiveding no treatment (from 7% to 0.3%, P<.0001) and the proportions of patients on oral antidiabetic therapy (60.9% vs 55.5%, P=.003) and insulin (10.5% vs 6.2%, P=.021). However, the proportion of patients receiving insulin combined with oral antidiabetic drugs increased from 21.1% to 38% (P<.0001).
ConclusionsAn improved metabolic control was seen in this cohort of patients with T2DM after their evaluation in an endocrinology clinic. However, HbA1c levels <7% were not achieved in 28.7% of patients, which shows the difficulty to achieve adequate control in clinical practice.
La diabetes mellitus (DM) constituye un importante problema de salud pública y presenta una gran repercusión sanitaria y social debido a las complicaciones crónicas micro y macroangiopáticas asociadas y a la alta mortalidad cardiovascular que comporta1. El tratamiento de esta enfermedad y de sus complicaciones supone un gran impacto económico en el sistema sanitario español. El estudio Seccaid2 indica que el coste directo anual de la DM asciende en España a 5.809 millones de euros, lo que representa el 8,2% del gasto sanitario.
La prevalencia de DM está aumentando de forma importante en los últimos años, fundamentalmente a expensas de la DM tipo 2 (DM2), que representa el 85-95% de la totalidad de casos en los países desarrollados3. De acuerdo con la International Diabetes Federation, la prevalencia mundial estimada en el año 2015 fue de 415 millones y se prevé que aumente a 642 millones de personas en el año 2040 si no se toman medidas urgentes4. En el estudio Di@bet.es5, realizado en una muestra representativa de la población española, la prevalencia de cualquier alteración en el metabolismo de hidratos de carbono (DM, glucemia basal alterada o intolerancia oral a la glucosa) fue del 30%. La prevalencia de DM fue del 13,8%, de la cual cerca de la mitad se correspondía con casos no conocidos (6%). En el estudio PREDIMERC, realizado en la Comunidad de Madrid, la prevalencia de DM2 fue del 8,1%, siendo más elevada en hombres (10,2%) que en mujeres (6%)6. Algunas de las causas que pueden explicar esta epidemia de DM como la obesidad, el sedentarismo y el envejecimiento poblacional están íntimamente ligadas a la sociedad de consumo de los países occidentales y a los cambios en el estilo de vida de los países en vías de desarrollo7. En el año 2012 el 53,7% de la población española mayor de 18 años padecía sobrepeso u obesidad, mientras que el 41,3% se declaraba sedentaria8. La obesidad es el principal factor de riesgo para desarrollar una DM2, y además es un factor asociado a un peor control metabólico9.
En España la DM2 se diagnostica y maneja principalmente por profesionales de atención primaria (AP) y especialistas en endocrinología. El que se atienda en un nivel u otro depende generalmente de la complejidad de la enfermedad y de los tratamientos. El estudio Pathways, que evalúa los motivos de derivación de pacientes con DM2 entre AP y atención especializada (AE), recoge que el criterio de derivación hacia AE más frecuente fue la presencia de inestabilidad metabólica (80,5% de los casos), mientras que hacia AP fue la consecución de objetivos terapéuticos (96,5% de los casos)10.
El tratamiento de los pacientes con DM2 se basa tanto en la optimización del control glucémico como en el abordaje del resto de factores de riesgo cardiovascular (FRCV) para prevenir la aparición de complicaciones crónicas y la mortalidad11,12, aunque en la práctica clínica los objetivos de control sean difíciles de alcanzar.
El objetivo del presente trabajo es evaluar el grado de control metabólico, FRCV y tratamientos hipoglucemiantes recibidos en una cohorte de pacientes con DM2 que no realizaban seguimiento habitual en una consulta de endocrinología, y la evolución de estos parámetros a las 26 semanas de ser valorados en AE.
Material y métodosEstudio de cohortes prospectivo realizado en el Hospital Universitario de Guadalajara. Desde noviembre de 2013 hasta marzo de 2016 se reclutaron un total de 465 pacientes con DM2 que acudieron de forma consecutiva por primera vez a una consulta de endocrinología como pacientes nuevos, y también se incluyeron aquellos pacientes que no habían sido vistos en el año previo y que, o habían abandonado el seguimiento o habían sido dados de alta, y volvían a ser remitidos a la consulta como pacientes nuevos. Para el diagnóstico de la DM2 se utilizaron los criterios de la Asociación Americana de Diabetes (ADA)13. Se excluyeron del estudio aquellos pacientes con otras formas de DM (DM gestacional, DM tipo 1 o DM asociada a defectos genéticos de la célula β) y aquellos pacientes que hubieran sido revisados en el año previo. Se valoró a ese mismo grupo a las 26 semanas de seguimiento habitual en la consulta de endocrinología. Del grupo inicial se perdieron 106 pacientes (22,8%): 72 (67,9%) porque no acudieron a la revisión, 15 (13,3%) por exitus (8 pacientes debido a su proceso neoplásico de base, 5 por enfermedad cardiovascular y 2 por causa infecciosa), 15 (14,3%) por ser dados de alta en la primera visita y no realizar seguimiento posterior al tratase de un estudio realizado según la práctica clínica habitual y 4 (3,8%) por gestación.
Se recogieron las siguientes variables clínicas:
- 1.
Variables sociodemográficas: edad y sexo.
- 2.
Tiempo de evolución de la DM2. Se clasificó a los pacientes en 4 grupos: <1 año de evolución; ≥1 y <5 años de evolución; ≥5 y <10 años de evolución y ≥10 años de evolución.
- 3.
FRCV iniciales y a las 26 semanas de seguimiento: hipertensión arterial (HTA), dislipidemia y obesidad. Se consideró que los pacientes tenían HTA si la presión arterial sistólica (PAS) medida en el momento de la visita era ≥140mmHg y/o presión arterial diastólica (PAD) era ≥90mmHg y/o recibían tratamiento hipotensor. Se consideró que los pacientes tenían dislipidemia si presentaban valores de colesterol asociado a lipoproteínas de baja densidad (cLDL) ≥130mg/dl o triglicéridos ≥150mg/dl y/o recibían tratamiento hipolipidemiante. Por último, se empleó el criterio recomendado por la Sociedad Española para el Estudio de la Obesidad publicado en el año 200714 para definir la obesidad como el índice de masa corporal (IMC) ≥30kg/m2. En la visita inicial se valoró la presencia de tabaquismo definido como el consumo de al menos un cigarrillo al día en el último mes.
- 4.
Variables antropométricas iniciales y a las 26 semanas: peso, talla, IMC, PAS y PAD.
- 5.
Variables analíticas: glucosa, filtrado glomerular (FG), cLDL, colesterol asociado a lipoproteínas de alta densidad (cHDL), triglicéridos y hemoglobina glucosilada (HbA1c). Estas variables se recogieron inicialmente (durante los 6 meses previos a la inclusión en el estudio) y tras 26 semanas de seguimiento. Una mejoría del control glucémico se definió como el descenso ≥0,8% de HbA1c. En aquellos pacientes con DM2 de más de 2 años de duración se analizó además la media de HbA1c en los 2 años previos a su inclusión en el estudio. La medición de HbA1c se realizó por cromatografía de alta presión de intercambio iónico (Menarini), método certificado por el National Glycohemoglobin Standarization Program (NGSP) y estandarizado al método de referencia del DCCT (valores de normalidad: 4-6%). El FG se determinó utilizando la ecuación Chronic Kidney Disease Epidemiology Collaboration que incluye como variables la creatinina sérica, la edad, el sexo y la raza15.
- 6.
Grado de control metabólico (glucémico, lipídico y tensional): se utilizaron las recomendaciones de la ADA13. Se consideraron como objetivos de buen control: HbA1c<7%, cLDL<100mg/dl, cHDL >40mg/dl en varones y >50mg/dl en mujeres, triglicéridos <150mg/dl, PAS <140mmHg y PAD <90mmHg.
- 7.
Presencia de hipoglucemias moderadas o graves en el año previo a la inclusión en el estudio y a las 26 semanas de seguimiento. Se definió la hipoglucemia moderada o grave como aquella que se presentaba con clínica neuroglucopénica o pérdida de conocimiento, y precisaba de la ayuda de una tercera persona para solventar el episodio.
- 8.
Tratamientos recibidos inicialmente y a las 26 semanas:
- -
Tratamiento con ADO exclusivamente. Se valoró tanto el número como el tipo de ADO: metformina, sulfonilureas (SFU), glinidas, tiazolidindionas (TZD), inhibidores de las disacaridasas (ID), inhibidores de la dipeptidil-peptidasa 4 (IDPP-4), agonistas del receptor del péptido 1 semejante al glucagón (a-RGLP1) e inhibidores del transportador de sodio-glucosa tipo 2 (I-SGLT2).
- -
Tratamiento con insulina exclusivamente. Se valoró la dosis diaria expresada como UI/kg/día. Se definieron 5 pautas de insulinización: insulina basal en una o 2 dosis diarias; pauta basal-plus, pauta basal-bolus, insulinas premezcladas en 2 o 3 dosis diarias e insulina rápida según control de glucemia capilar.
- -
Tratamiento con insulina y ADO.
- -
Se consideró cambio del tratamiento hipoglucemiante cuando se modificaba el tipo de ADO y/o se añadía tratamiento con insulina y/o se cambiaba la pauta de insulina. No se consideró cambio en el tipo de tratamiento hipoglucemiante cuando se modificaba la dosis o de un ADO que ya tomaba previamente o de insulina.
- 9.
Tratamiento con fármacos hipotensores y fármacos hipolipidemiantes inicialmente y a las 26 semanas.
Este estudio fue aprobado por el Comité de Ética e Investigación Clínica del Hospital Universitario de Guadalajara. Se recogió el consentimiento informado de cada paciente antes de la participación en el estudio.
Análisis estadísticoLas variables cualitativas se expresaron como porcentaje mientras que las variables cuantitativas se expresaron como media y desviación estándar (DE). Para comparar variables cualitativas y cuantitativas se empleó la prueba de la Chi cuadrado y la «t» de Student para muestras independientes respectivamente. Para la comparación de datos relacionados entre los 2 periodos se utilizó la prueba de McNemar o Wilcoxon para variables cualitativas y la «t» de Student para muestras relacionadas para variables cuantitativas. Se realizó un análisis de regresión logística múltiple con exclusión escalonada paso a paso, utilizando como variable dependiente la mejoría del control metabólico (descenso de HbA1c≥0,8%) entre los 2 períodos de tiempo. Como variables independientes se incluyeron aquellas que eran predictoras de control glucémico en otros estudios. Todos los test fueron de 2 colas y el umbral de significación que se adoptó para todas las pruebas fue p<0,05. El análisis de los datos se realizó con el paquete estadístico SPSS V 20.
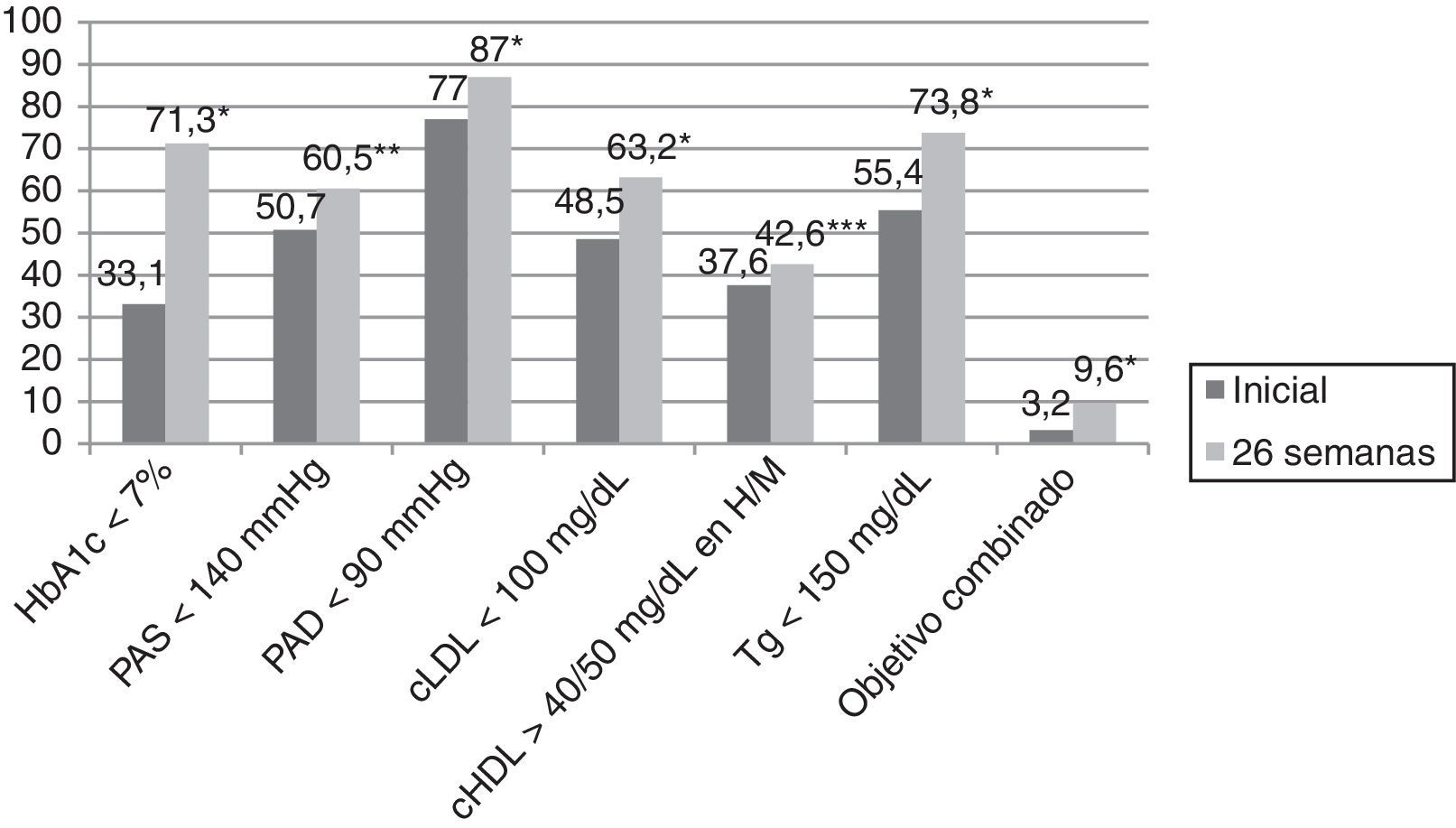
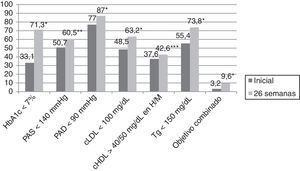
ResultadosLa media de edad fue de 63,4±12,5 años, siendo el 61,5% varones. El motivo de derivación de la consulta de endocrinología fue la DM en el 73,3% de los casos, mientras que el 9%, 8,6% y 4,5% fueron remitidos para valoración ponderal, estudio de enfermedad tiroidea y valoración del estado nutricional, respectivamente, y el 4,5% restante fue remitido por otros motivo. El tiempo de evolución de la DM2 fue <1 año en el 8,6% de los casos, ≥1 y <5 años en el 21,5%, ≥5 y <10 años en el 24,3% y ≥10 años en el 45,6%. En aquellos pacientes en los que el motivo de derivación fue la DM, el tiempo de evolución de la misma fue <1 año en el 8,2% de los casos, ≥1 y <5 años en el 18,2%, ≥5 y <10 años en el 23,2% y ≥10 años en el 50,4% (p=0,03). El 25,4% de los pacientes había sido visto de forma previa en la consulta de endocrinología. El número de solicitudes de HbA1c en los 2 años previos que presentaban aquellos pacientes con más de 2 años de evolución de la DM2 era de 2,3±1,4 y la media era de 7,9±1,7%. El 36,5% de los pacientes presentaba una HbA1c en los 2 años previos <7%, mientras que el 23,6%, 28,2% y 11,7% presentaban una HbA1c ≥ 7% y <8%, ≥8% y <10% y ≥10% respectivamente. El 80% de los pacientes presentaba HTA inicialmente y el 80,6% a las 26 semanas (p=0,35). Por otro lado, el 78,6% presentaban dislipidemia inicialmente, y ese porcentaje ascendió al 83,1% a las 26 semanas (p=0,009). El 16,8% de los sujetos presentaba tabaquismo inicialmente, y ese dato no se recogió al final del estudio. Por último, el 61,5% frente al 59,8% presentaba obesidad inicial y a las 26 semanas del estudio (p=0,082). En la tabla 1 se describe la evolución de los datos clínicos y antropométricos en esta cohorte de pacientes, y en la figura 1 la consecución de objetivos terapéuticos según la ADA. Inicialmente, el 33,1% de los pacientes presentaba una HbA1c <7%, mientras que el 17%, 32% y 17,9% presentaban una HbA1c ≥7% y <8%, ≥8% y <10% y ≥10% respectivamente. A las 26 semanas de seguimiento en la consulta de endocrinología el 71,6% de los pacientes presentaba una HbA1c<7%, mientras que el 21%, 6,3% y 1,1% presentaban una HbA1c≥7 y <8%, ≥8 y <10% y ≥10% respectivamente (p<0,0001). El 25,9% de pacientes no presentaba una determinación de HbA1c en los 6 meses previos a la visita inicial, siendo este porcentaje del 23,1% en aquellos pacientes cuyo motivo de derivación a la consulta de AE era la DM.
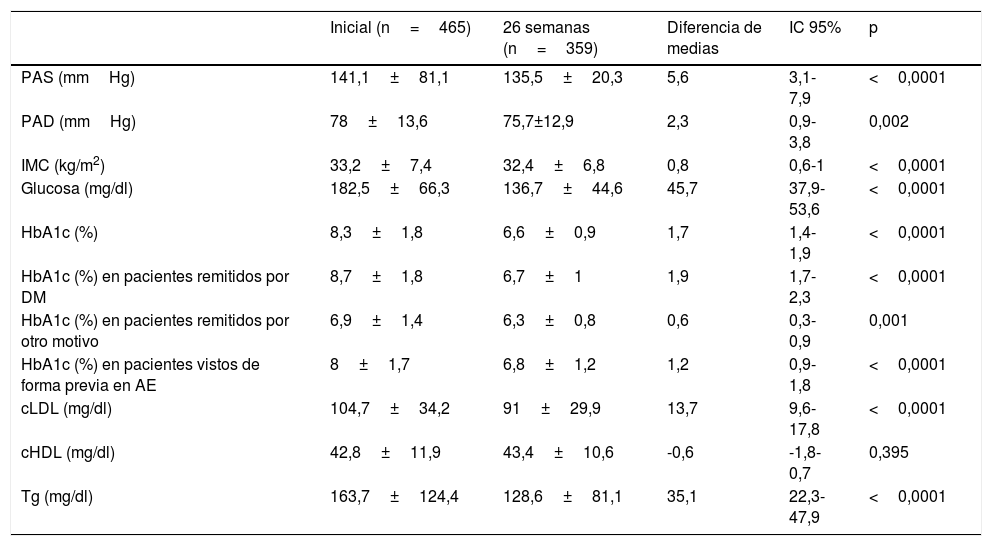
Evolución de los datos clínicos y antropométricos a las 26 semanas de seguimiento en la consulta de endocrinología
| Inicial (n=465) | 26 semanas (n=359) | Diferencia de medias | IC 95% | p | |
|---|---|---|---|---|---|
| PAS (mmHg) | 141,1±81,1 | 135,5±20,3 | 5,6 | 3,1-7,9 | <0,0001 |
| PAD (mmHg) | 78±13,6 | 75,7±12,9 | 2,3 | 0,9-3,8 | 0,002 |
| IMC (kg/m2) | 33,2±7,4 | 32,4±6,8 | 0,8 | 0,6-1 | <0,0001 |
| Glucosa (mg/dl) | 182,5±66,3 | 136,7±44,6 | 45,7 | 37,9-53,6 | <0,0001 |
| HbA1c (%) | 8,3±1,8 | 6,6±0,9 | 1,7 | 1,4-1,9 | <0,0001 |
| HbA1c (%) en pacientes remitidos por DM | 8,7±1,8 | 6,7±1 | 1,9 | 1,7-2,3 | <0,0001 |
| HbA1c (%) en pacientes remitidos por otro motivo | 6,9±1,4 | 6,3±0,8 | 0,6 | 0,3-0,9 | 0,001 |
| HbA1c (%) en pacientes vistos de forma previa en AE | 8±1,7 | 6,8±1,2 | 1,2 | 0,9-1,8 | <0,0001 |
| cLDL (mg/dl) | 104,7±34,2 | 91±29,9 | 13,7 | 9,6-17,8 | <0,0001 |
| cHDL (mg/dl) | 42,8±11,9 | 43,4±10,6 | -0,6 | -1,8-0,7 | 0,395 |
| Tg (mg/dl) | 163,7±124,4 | 128,6±81,1 | 35,1 | 22,3-47,9 | <0,0001 |
AE: atención especializada; cHDL: colesterol asociado a lipoproteínas de alta densidad; cLDL: colesterol asociado a lipoproteínas de baja densidad; DM: diabetes mellitus; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; Tg: triglicéridos.
Cumplimiento de objetivos terapéuticos según la Asociación Americana de Diabetes.
cHDL: colesterol asociado a lipoproteínas de alta densidad; cLDL: colesterol asociado a lipoproteínas de baja densidad; H: hombres; HbA1c: hemoglobina glucosilada; M: mujeres; PAD: presión arterial diastólica; PAS: presión arterial sistólica; Tg: triglicéridos; objetivo combinado glucémico, lipídico y tensional.
*p<0,0001.
**p=0,003.
***p=0,027.
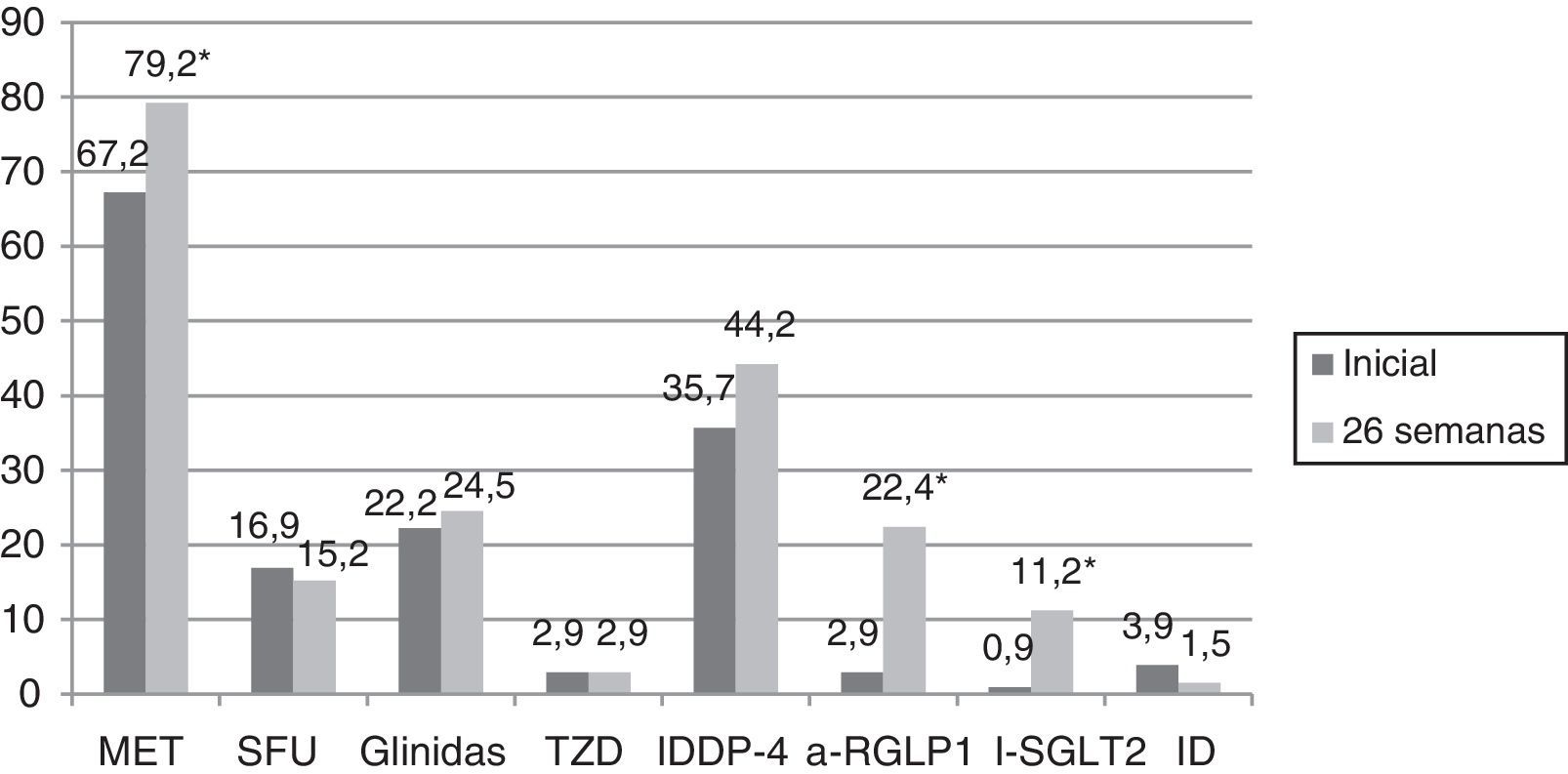
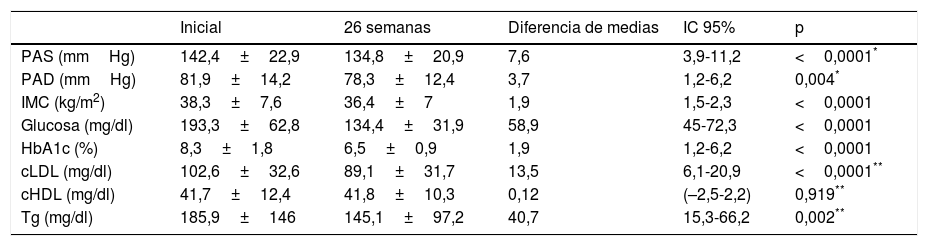
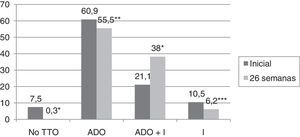
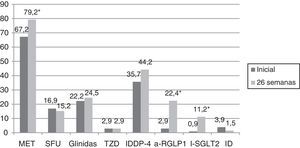
En el 75,1% de los sujetos con DM2 incluidos en el estudio se modificó el tratamiento hipoglucemiante. Aquellos pacientes en los que se cambió el tratamiento presentaban de promedio una HbA1c en los 2 años previos a la inclusión en el estudio 0,83% mayor que los pacientes en los que no se cambió el tratamiento (IC 95%: 0,4-1,2; p<0,0001). También presentaban una HbA1c en la visita inicial 1,1% mayor (IC 95% 0,6-1,6; p<0,0001) y una glucosa plasmática 35,3mg/dl mayor (IC 95% 21,5-49,1; p<0,0001). Sin embargo, el cambio de tratamiento no se asoció de forma estadísticamente significativa con la edad, el sexo, el tiempo de evolución de la DM2, la presencia de otros FRCV (HTA, DL, obesidad) ni con el tipo de tratamiento hipoglucemiante que recibían los sujetos. En la figura 2 se describe el tipo de tratamiento hipoglucemiante que recibían los pacientes inicialmente y a las 26 semanas. En la primera visita los pacientes que nunca habían sido valorados de forma previa en la consulta de AE no recibían tratamiento farmacológico en el 9,2% de los casos, mientras que este porcentaje disminuía a 2,5% en el caso de haber sido vistos de forma previa. Por otro lado, el 66,3% de los pacientes no valorados vs el 44,9% de los vistos previamente recibían tratamiento con ADO, y el 24,5% vs 52,6% con insulina (exclusivamente o asociada a ADO) (p<0,0001). Tal y como se puede ver en la figura 2, a las 26 semanas de seguimiento el 44,2% de los sujetos con DM2 recibían tratamiento con insulina (sola o asociada a ADO). Los pacientes que recibían tratamiento con insulina presentaban de promedio un FG estimado 6ml/min/1,73 m2 menor (IC 95%: 1,3-10,9; p=0,013). El tratamiento con insulina también se asoció con el tiempo de evolución de la DM2 (tratamiento con insulina en el 5,7%, 12%, 17,7% y 64,6% de los pacientes con <1 año, ≥1 y <5 años, ≥5 y <10 años y ≥10 años de evolución respectivamente; análisis de tendencia lineal: p<0,0001). Así mismo, se asoció con un peor control glucémico (HbA1c en los 2 años previos 1,5% mayor [IC 95%: 1,1-1,8; p<0,0001], HbA1c en la visita inicial 1,5% mayor [IC 95% 1,1-1,9; p<0,0001] y HbA1c a las 26 semanas de seguimiento 0,5% mayor [IC 95%: 0,3-0,7; p<0,0001]). Sin embargo, el tratamiento con insulina en la visita final no se asoció de forma estadísticamente significativa con la edad, el sexo y la presencia de otros FRCV en esta cohorte de pacientes con DM2. En aquellos pacientes en tratamiento con insulina la dosis empleada fue de 0,53±0,38UI/kg/día inicialmente vs 0,52±0,33UI/kg/día a las 26 semanas de seguimiento (p=0,42). En cuanto a las pautas de insulinización empleadas el 46,3% inicialmente vs el 54,1% a las 26 semanas realizaban tratamiento con insulina basal en una o 2 dosis, el 17,7% vs el 16,4% con una pauta bolo-basal, el 32% vs el 27% con insulinas premezcladas en 2 o 3 dosis, el 2% vs el 0,6% con una pauta de insulina rápida según control de glucemia capilar y el 2% vs el 1,9% con una pauta de insulina basal más una dosis de rápida (p=0,261). En la figura 3 se muestran los tipos de ADO empleado. Inicialmente, el número de ADO fue de 1,7±0,9, mientras que a las 26 semanas aumentó a 2,1±0,8 (p<0,0001). A las 26 semanas de seguimiento en la consulta de endocrinología el 31% de los pacientes recibía tratamiento con a-RGLP1 y/o I-SGLT2, con o sin insulina asociada. Este grupo de pacientes tenía de media 9 años menos que aquellos en los que se iniciaba otro tipo de ADO (IC 95%: 6,6-11,4; p<0,0001) y un tiempo de evolución de la DM2 mayor (tratamiento con a-RGLP1 y/o I-SGLT2 en el 9,5%, 28,6%, 34,8% y 37,1% de los pacientes con <1 año, ≥1 y <5 años, ≥5 y <10 años y ≥10 años de evolución respectivamente; análisis de tendencia lineal: p=0,046). La evolución de los parámetros analíticos y antropométricos en este grupo de pacientes se muestra en la tabla 2.
Tipos de antidiabéticos orales utilizados en los pacientes con DM2 inicialmente y a las 26 semanas de evolución.
a-RGLP1: agonistas del receptor del péptido 1 semejante al glucagón; ID: inhibidores de las disacaridasas; IDPP-4: inhibidores de la dipeptidil-peptidasa 4; I-SGLT2: inhibidores del transportador de sodio-glucosa tipo 2; MET: metformina; SFU: sulfonilureas; TZD: tiazolidindionas.
*p<0,0001.
Evolución de los datos clínicos y antropométricos a las 26 semanas de seguimiento en la consulta de endocrinología en pacientes en tratamiento con agonistas del receptor del péptido 1 semejante al glucagón y/o inhibidores del transportador de sodio-glucosa tipo 2
| Inicial | 26 semanas | Diferencia de medias | IC 95% | p | |
|---|---|---|---|---|---|
| PAS (mmHg) | 142,4±22,9 | 134,8±20,9 | 7,6 | 3,9-11,2 | <0,0001* |
| PAD (mmHg) | 81,9±14,2 | 78,3±12,4 | 3,7 | 1,2-6,2 | 0,004* |
| IMC (kg/m2) | 38,3±7,6 | 36,4±7 | 1,9 | 1,5-2,3 | <0,0001 |
| Glucosa (mg/dl) | 193,3±62,8 | 134,4±31,9 | 58,9 | 45-72,3 | <0,0001 |
| HbA1c (%) | 8,3±1,8 | 6,5±0,9 | 1,9 | 1,2-6,2 | <0,0001 |
| cLDL (mg/dl) | 102,6±32,6 | 89,1±31,7 | 13,5 | 6,1-20,9 | <0,0001** |
| cHDL (mg/dl) | 41,7±12,4 | 41,8±10,3 | 0,12 | (–2,5-2,2) | 0,919** |
| Tg (mg/dl) | 185,9±146 | 145,1±97,2 | 40,7 | 15,3-66,2 | 0,002** |
cHDL: colesterol asociado a lipoproteínas de alta densidad; cLDL: colesterol asociado a lipoproteínas de baja densidad; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; Tg: triglicéridos.
Inicialmente el 71% de los pacientes con DM2 recibía tratamiento hipotensor, mientras que el 71,3% lo recibía a las 26 semanas (p=0,083). Sí que se observaron diferencias en cuanto al tratamiento hipolipidemiante, puesto que inicialmente el 62,6% recibía tratamiento y ese porcentaje aumentó hasta el 71,3% a las 26 semanas (p<0,0001).
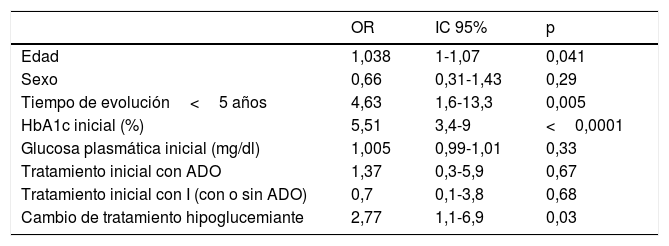
En este estudio se produce una mejoría del grado de control metabólico (descenso de HbA1c≥0,8%) en el 59,9% de los sujetos. En la tabla 3 se muestran los resultados de la regresión logística para determinar los factores asociados con una mejoría del grado de control metabólico. El coeficiente R cuadrado de Nagelkerke del presente modelo fue de 0,676, y por tanto, las variables incluidas en el modelo son capaces de explicar el 67,6% del descenso ≥0,8% de la HbA1c.
Factores asociados con una mejoría del control glucémico (descenso de HbA1c≥0,8%) en el análisis de regresión logística multivariante
| OR | IC 95% | p | |
|---|---|---|---|
| Edad | 1,038 | 1-1,07 | 0,041 |
| Sexo | 0,66 | 0,31-1,43 | 0,29 |
| Tiempo de evolución<5 años | 4,63 | 1,6-13,3 | 0,005 |
| HbA1c inicial (%) | 5,51 | 3,4-9 | <0,0001 |
| Glucosa plasmática inicial (mg/dl) | 1,005 | 0,99-1,01 | 0,33 |
| Tratamiento inicial con ADO | 1,37 | 0,3-5,9 | 0,67 |
| Tratamiento inicial con I (con o sin ADO) | 0,7 | 0,1-3,8 | 0,68 |
| Cambio de tratamiento hipoglucemiante | 2,77 | 1,1-6,9 | 0,03 |
ADO: antidiabéticos orales; HbA1c: hemoglobina glucosilada; I: insulina.
Inicialmente, el 1,3% de los pacientes presentaron algún episodio de hipoglucemia grave en el año previo a su inclusión en el estudio, mientras que durante la realización de este, tras 26 semanas de seguimiento, fueron el 1,4% de los pacientes (p=0,7).
DiscusiónExisten evidencias de la importancia que tiene el control metabólico en la aparición y progresión de las complicaciones relacionadas con la DM11–13. Sin embargo, alcanzar y mantener los objetivos de control glucémico supone un reto en la práctica clínica habitual. Esta dificultad no solo se refleja en lo referente al control glucémico, sino también en el abordaje del resto de los factores de riesgo asociados. La hipoglucemia y la ganancia de peso son las dos barreras fundamentales para alcanzar un control glucémico óptimo en los pacientes con DM216–18. Existen un gran número de trabajos españoles que analizan el grado de control en los pacientes con DM. En un estudio realizado en 3.268 pacientes con DM2 seguidos en AP en centros de la Comunidad de Madrid19, el porcentaje de sujetos que inicialmente alcanzaba el objetivo de control glucémico (HbA1c<7%) era de 54,3%, el objetivo de control tensional (PAS<130mmHg y PAD<80mmHg) era de 35,3% y 51,4% y de control lipídico (cLDL<100mg/dL, cHDL>40mg/dl en hombres y 50mg/dl en mujeres y triglicéridos <150mg/dl) era de 32,7%, 57,3% y 66% respectivamente. En otro estudio realizado en consultas de AP de todo el territorio nacional20, en el que se analizaron datos de 5.382 pacientes, el 49,7% de los participantes presentaba una HbA1c<7%. Por último, en un estudio transversal realizado en Cataluña21, en el que se incluyeron 286.791 con DM2 seguidos en centros de AP, el 56,1% de los sujetos presentaba una HbA1c≤7%, el 31,7% alcanzaba el grado de objetivo de control tensional definido con PA≤130/80 y el 37,9% presentaba un cLDL<100mg/dl. Existen discrepancias entre los distintos estudios realizados en AP entre la asociación del género y la edad con el grado de control glucémico, pero parece claro que un tiempo de evolución más largo de la enfermedad y el tratamiento con insulina se asocian con una mayor probabilidad de control glucémico insatisfactorio20–23. También se han publicado trabajos en pacientes con DM seguidos en AE en los que la consecución de objetivos de control tampoco es adecuada, aunque probablemente se trate de pacientes más complejos. En un estudio realizado en 343 pacientes con DM (DM tipo 1 y DM2), únicamente el 26,5% de los pacientes seguidos durante 4 años en una consulta de endocrinología alcanzaba un objetivo de control glucémico adecuado24. En otro trabajo publicado se incluyeron 1.177 pacientes con DM2 y únicamente el 30,4% de los participantes presentaba una HbA1c<7% tras 3 años de seguimiento en AE, mientras que solo el 9,2% de los pacientes alcanzaba un objetivo combinado de HbA1c<7% y cLDL<100mg/dl25. En el estudio Mediodía26, en el que se incluyeron 1.159 pacientes con DM de más de 10 años de evolución, de los cuales el 48% tenía una DM tipo 1, el 25,5% presentaba una HbA1c<7% y únicamente el 4,3% de los pacientes con DM alcanzaba un objetivo combinado glucémico, lipídico y tensional. En nuestro trabajo se produce una mejoría del control glucémico, con una disminución estadísticamente significativa de la HbA1c a las 26 semanas de seguimiento, independientemente del motivo de derivación y de si el paciente había sido valorado de forma previa en AE. Así mismo, se produce un incremento del porcentaje de pacientes que alcanzan cifras de HbA1c<7% sin aumento del número de hipoglucemias moderadas o graves. Los parámetros que se relacionaron de forma independiente con un descenso de la HbA1c de al menos el 0,8% fueron un peor control metabólico inicial, una duración menor de la DM2, lo que probablemente esté relacionado con un menor deterioro en la secreción de insulina y el cambio de tratamiento hipoglucemiante, aunque no se ha tenido en cuenta si el cambio consistía en el aumento o cambio de ADO, inicio de tratamiento con insulina o cambio de la pauta de insulina. En este trabajo también la edad se asocia con una mayor probabilidad de mejoría del control metabólico. Este fenómeno se ha observado en otro estudio en el que los pacientes de mayor edad presentaban un mejor control glucémico, lo que pone en entredicho un menor grado de intervención en estos pacientes20. A pesar de la mejoría del control glucémico, en el 28,4% de los pacientes no se alcanzan cifras de HbA1<7% tras su valoración e intensificación del tratamiento hipoglucemiante. Esto indica que probablemente, aunque en determinados casos no se persiga un control glucémico tan estricto, debamos de cambiar en ocasiones nuestra estrategia terapéutica, con medidas dirigidas a promover por una parte la autonomía del paciente con DM2 y, por otra parte, a romper con la inercia terapéutica presente en el manejo de la DM. Por otro lado, en este estudio también se produce una mejoría del resto de parámetros (PAS, PAD, cLDL, triglicéridos e IMC), lo que indica que se realiza un manejo global de todos los FRCV. No se produce una mejoría de la cifra de cHDL, aunque sí del porcentaje de pacientes que alcanza cifras de cHDL en objetivo tras 26 semanas de seguimiento. También se produce un incremento del porcentaje de pacientes que alcanza el objetivo combinado glucémico, tensional y lipídico, aunque este porcentaje sigue siendo muy bajo.
El tratamiento hipoglucemiante que reciben los pacientes con DM2ha sido analizado en varios estudios. En un artículo publicado en el año 201427, en el que se incluyeron 286.791 pacientes diagnosticados de DM2 antes de julio de 2009 y seguidos en AP, el 24,4% era manejado exclusivamente con modificaciones en el estilo de vida. En cuanto al tratamiento farmacológico el 35,1%, 21% y 2,8% recibían tratamiento con uno, dos y tres ADO respectivamente, mientras que el 17,7% recibía tratamiento con insulina (sola o en combinación con ADO). Al igual que en nuestro trabajo, el tratamiento con insulina se utilizaba fundamentalmente en aquellos casos de mayor evolución de la DM2, o ante la presencia de enfermedad renal grave. También existen otros estudios en los que, al igual que en nuestro caso, un peor control glucémico se asocia con una mayor utilización de insulina de forma aislada o asociada a un mayor número de ADO23,28. Por último, en otro estudio publicado recientemente, en el que se incluyeron pacientes con DM2 seguidos en AP entre los años 2007-201329, el porcentaje de sujetos que recibía tratamiento farmacológico era de 71,9% en el año 2007 y aumentó hasta el 81,6% en el año 2013. El porcentaje de pacientes que recibía tratamiento con ADO (en monoterapia o en combinación) era del 54,4% en el año 2007 y aumentó hasta el 61,6% en el año 2013, al igual que el tratamiento con insulina (sola o con ADO) que aumentó desde el 17,5% hasta el 20% en el año 2007 y 2013 respectivamente. En este último estudio también se evaluaron los datos en función del tipo de ADO. Desde el año 2007 al año 2013 se produjo un aumento del porcentaje de pacientes que recibía tratamiento con metformina, glinidas, IDPP-4 y a-RGLP1. Sin embargo, descendió el porcentaje de pacientes que recibía tratamiento con SFU, ID y glitazonas. En nuestro trabajo se cambió el tratamiento en el 75,1% de los pacientes. Tras 26 semanas de seguimiento se aumentó el porcentaje de pacientes que recibía tratamiento combinado con ADO más insulina, así como el número de ADO de forma estadísticamente significativa. Aumentó el porcentaje de pacientes que recibía tratamiento con metformina, a-RGLP1 e I-SGLT2. También se produjo un aumento en la utilización de IDPP-4 y glinidas, aunque no de forma estadísticamente significativa y una disminución en la utilización de SFU e ID, mientras que el porcentaje de pacientes que recibía tratamiento con TZD permaneció estable. Existen múltiples trabajos que describen un aumento en la utilización de metformina en pacientes con DM2 y una disminución en el uso de SFU29–31. En nuestro caso se produjo también un aumento en la utilización de a-RGLP1 e I-SGLT2, lo que explica en parte la disminución del IMC tras 26 semanas se seguimiento en la consulta de AE, a pesar de la mejoría del control metabólico. No obstante, se debe tener en cuenta que son fármacos que precisan o han precisado visado de inspección, lo que dificulta su utilización en AP. Llama la atención el elevado porcentaje de pacientes que está en tratamiento con glinidas, superior al de otros trabajos publicados29.
Este estudio presenta una serie de limitaciones. Por un lado, los pacientes incluidos son aquellos que acuden a 2 de las 4 consultas de endocrinología del Hospital Universitario de Guadalajara, y por tanto no se pueden extrapolar los datos a todos los pacientes con DM2 derivados a AE en nuestra área sanitaria. Otra limitación que presenta este trabajo es el elevado porcentaje de pacientes que no presentan determinación de HbA1c en los 6 meses previos de su valoración inicial, incluso aunque el motivo de derivación sea la DM, así como el elevado porcentaje de pacientes que no acuden a la revisión. Estos datos apoyan la necesidad de mejorar el manejo de los pacientes con DM2, pero limita la interpretación de los datos relativos a la mejoría del control glucémico. Además, en este trabajo no se han recogido las intervenciones no farmacológicas, tales como seguimiento en consulta de la enfermera educadora o manejo nutricional. Por último, los objetivos de control glucémico que se han propuesto (HbA1c<7%) no son individualizados en función de las características de los pacientes y las comorbilidades asociadas. No obstante, sí que se pueden extraer una serie de conclusiones, como que los pacientes con DM2 asocian con gran frecuencia otros FRCV que a su vez requieren un abordaje integral, y que se produce una mejoría del control glucémico en esta cohorte de pacientes con DM2 tras su valoración en AE, aunque en muchas ocasiones los objetivos terapéuticos sean difíciles de alcanzar en la práctica clínica habitual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.