La diabetes gestacional (DG) está relacionada con el desarrollo de la diabetes mellitus (DM) tras el parto. Los predictores en esta asociación aún no están bien definidos. El objetivo de nuestro trabajo es estudiar los factores predictores de disglucosis en el posparto en una muestra de pacientes con DG.
Material y métodosUn total de 1.765 mujeres con DG fueron estudiadas. Variables analizadas: datos antropométricos y antecedentes maternos. Glucemia en sobrecarga de glucosa (SOG) con 100g (basal: 1, 2 y 3h) y HbA1c. Uso de insulina en la gestación. La SOG con 75g y HbA1c a los 3 meses tras el parto.
ResultadosPrevalencia DM posparto: 2,1%. Entre estas pacientes hubo mayor porcentaje de pacientes con antecedentes de DG (25,9 vs. 12,9%; p<0,05), obesidad pregestacional (20,8 vs. 14,9%; p<0,05) y uso de insulina durante el embarazo (79,2 vs. 20%; p<0,01). En la SOG con 100g, el número de puntos patológicos fue mayor (3,18±0,69 en DM vs. 2,3±0,28 normal, 2,6±0,47 GBA, 2,5±0,32 IHC; p<0,001). En la SOG con 100g, el nivel de glucemia por encima del cual es más probable el diagnístico de DM posparto es 189mg/dl en la determinación a las 2h (S: 86,2%; E: 72%). Un nivel de HbA1c>5,9% durante la gestación tiene una especificidad del 95,9% para el diagnóstico de DM posparto en nuestra muestra.
ConclusiónEvidenciamos factores asociados al diagnóstico de DM posparto entre los que se encuentran determinaciones cuantitativas como la glucemia a las 2h de la SOG con 100g y la HbA1c durante la gestación en pacientes con DG.
Gestational diabetes (GD) is related to development of diabetes mellitus (DM) after delivery. The predictive factors in this association are not yet well defined. Objetive: to study the predictive factors of dysglucosis in the postpartum period in a sample of patients with GD.
Material and methodsA total of 1765 women with DG were studied. Variables analyzed: anthropometric data and maternal history. Glycemia in OGTT with 100g (basal: 1, 2 and 3h) and HbA1c. Use of insulin in pregnancy. The OGTT with 75g and HbA1c at 3 months after delivery.
ResultsPostpartum DM prevalence 2.1%. Among these patients, there was a higher percentage of patients with a history of GD (25.9 vs. 12.9%; P<.05), pre-pregnancy obesity (20.8 vs. 14.9%; P<.05) and insulin use during pregnancy (79.2 vs. 20%; P<.01). In the OGTT with 100g, the number of pathological points was higher (3.18±0.69 in DM vs. 2.3±0.28 normal, 2.6±0.47 IFG, 2.5±0.32 IGT; P<.001). In the OGTT 100g, the blood glucose level above which the diagnosis of postpartum DM is most likely is 189mg/dl in the 2h determination (S: 86.2%, E: 72%). A level of HbA1c>5.9% during pregnancy has a specificity of 95.9% for the diagnosis of postpartum DM in our sample.
ConclusionWe show factors associated with the diagnosis of postpartum DM, among which are quantitative determinations such as glycemia at 2h of the OGTT with 100g and HbA1c during pregnancy in patients with DG.
La diabetes gestacional (DG) se define como una situación de intolerancia hidrocarbonada de intensidad variable diagnosticada por primera vez durante la gestación independientemente del tratamiento empleado para su control y de su evolución posparto1.
La prevalencia en nuestro país se sitúa entre el 4,5 y el 11,6% del total de las gestaciones dependiendo de los estudios y los criterios bajo los cuales se diagnostique dicha enfermedad2.
La DG está relacionada con padecer síndrome metabólico, hipertensión arterial, dislipemia y obesidad en el futuro y más de la mitad de las pacientes desarrollan diabetes mellitus (DM) tipo 2 en los estudios de seguimiento3. Por eso las guías de práctica clínica actuales4 recomiendan realizar una reevaluación temprana tras el parto. Sin embargo, en la práctica habitual resulta un problema asegurar el cumplimiento por parte de la paciente una vez finalizada la gestación5.
Existe evidencia en cuanto a la reducción de la incidencia de DM al incorporar hábitos de vida saludable. A pesar de ello habitualmente menos de la mitad de las pacientes con DG se someten a una reevaluación posparto según lo reportado en algunos trabajos6.
La comunicación de factores involucrados en el desarrollo de la DM puede aumentar el número de pacientes que se adhieren a los programas de prevención.
Sin embargo, la falta de datos para la estimación del riesgo individual contribuye a que los profesionales de la salud involucrados en la asistencia de mujeres con DG no optimicen el asesoramiento dado a este respecto7.
Por tanto, llevamos a cabo un estudio cuyo objetivo principal es analizar los factores relacionados con la diabetes posparto en una muestra de pacientes con DG.
Material y métodosSe trata de un estudio observacional retrospectivo que se llevó a cabo utilizando la información recabada en el seno de una consulta monográfica de DG en el Hospital Universitario de Getafe, Madrid. Seleccionamos un total de 1.765 mujeres con embarazo único diagnosticadas de DG según los criterios del National Diabetes Data Group (NDDG) desde el año 1993 hasta el año 2013. El estudio se llevó acabo con la aprobación del comité ético del hospital.
Se evaluaron a las mujeres sin antecedentes de diabetes entre las semanas 24-28 de gestación mediante la prueba O'Sullivan, después de un ayuno de 12h. Si se detectó algún factor de riesgo conocido para desarrollar DG (edad >35 años, índice de masa corporal [IMC]≥30kg/m2, DG previa o antecedentes familiares de DM), la prueba de despistaje se realizó en el primer trimestre de gestación. Cuando los niveles de glucosa plasmática 1h después de la sobrecarga de glucosa (SOG) con 50g fueron >140mg/dl, se realizó una SOG con 100g y se midieron los niveles de glucosa plasmática en ayunas y a las 1, 2 y 3h después de la ingesta además de HbA1c (DCCT). Se diagnosticó DG según los criterios NDDG: 2 o más valores de glucosa plasmática por encima de los siguientes: 105mg/dl basal: 190mg/dl en 1h, 165mg/dl en 2h y 145mg/dl en 3h.
En caso de diagnóstico de DG, se indicaron medidas dietéticas (50% de hidratos de carbono, 20% proteínas y 30% grasas) con un aporte calórico de 35kcal/kg en pacientes con bajo peso, 30kcal/kg en pacientes con normopeso, 25kcal/kg en pacientes con sobrepeso y 15kcal/kg en pacientes con obesidad. Además, se dieron recomendaciones de actividad física moderada y regular (caminar a paso ligero al menos 1h al día). La terapia con insulina se inició si no cumplian objetivos de glucemia óptimos de forma reiterada (glucemia capilar en ayunas >95mg/dl o 1h posprandial >140mg/dl).
Tres meses tras el parto se realizó una SOG con 75g y HbA1c (DCCT) con el fin de reevaluar el estado de disglucosis posparto. Se consideró normal una glucemia basal <100mg/dl y a las 2h<140mg/dl, glucemia basal alterada (GBA) si la glucemia basal se encontraba entre 100 y 125mg/dl, intolerancia a hidratos de carbono (IHC) si la glucemia a las 2h estaba entre 140-199mg/dl y DM si la basal >126mg/dl y/o a las 2h>200mg/dl.
Los criterios de exclusión fueron gestación múltiple, parto <20 semanas y seguimiento incompleto hasta el parto.
Los datos analizados fueron los siguientes:
Datos clínicosEdad materna, procedencia materna, peso previo a la gestación (kg) e IMC (kg/m2) maternos considerando obesidad un IMC>30kg/m2, ganancia de peso durante la gestación, antecedentes de DM en familiares de 1.° grado y antecedentes de DG en la paciente.
Datos analíticosGlucemia plasmática en test diagnóstico de DG tras SOG con 100g (basal: 1, 2 y 3h). Número de puntos con glucemias patológicas de entre las 4 determinaciones (2, 3 o 4 puntos patológicos en la SOG). Respuesta glucémica al test de reevaluación a los 3 meses tras el parto mediante SOG con 75g. HbA1c al diagnóstico de DG y 3 meses tras el parto. Necesidad de uso de insulina durante el embarazo para perseguir un buen control glucémico.
Análisis estadísticoLas variables cualitativas fueron presentadas en distribución de frecuencias y las cuantitativas en medias con su desviación estándar (distribución normal).
El comportamiento de las variables cuantitativas se analizó para cada una de las variables independientes categorizadas mediante la prueba t de Student (en comparaciones de una variable con 2 categorías) o análisis de varianza (ANOVA).
Se utilizaron curvas de rendimiento diagnóstico (ROC) para los parámetros de SOG con 100g con el fin de detectar los puntos discriminativos de presencia de DM posparto dando información sobre su sensibilidad y especificidad.
Se ajustaron modelos de regresión lineal para evaluar los factores asociados al desarrollo de DM posparto.
El valor de p<0,05 se consideró estadísticamente significativo. El paquete estadístico utilizado para el análisis fue SPSS® para Windows® versión 15.0.
ResultadosUn total de 1.765 pacientes se incluyeron en el estudio con una edad media de 32,5±4,3 años (media+DE). El 14,2% (251) fueron extranjeras. El IMC pregestacional fue de 26,9±5,4kg/m2 y un 21,6% de las pacientes presentó obesidad pregestacional. El 60,6% de la muestra tuvo antecedentes de DM en familiares de 1.° grado y el 13,1% tuvo al menos un episodio previo de DG en embarazos anteriores.
El diagnóstico de DG y el inicio del tratamiento (fundamentado en recomendaciones de alimentación y actividad física de inicio) se realizó de media a la 29,2±5,9 semanas de gestación. Durante el embarazo un 20,1% de las pacientes precisó tratamiento con insulina para lograr mejorar su control glucémico (tabla 1).
Características maternas de la muestra: antecedentes personales, familiares, medidas antropométricas y porcentaje de pacientes tratadas con insulina
| Edad media (años) | 32,5±4,3 |
| Antecedentes de DM en la familia (%) (n=1.070) | 60,6 |
| Antecedentes de DG previa (%) (n=231) | 13,1 |
| Peso medio pregestacional (kg) | 68,4±14,7 |
| Talla media (m) | 1,59±0,06 |
| IMC pregestacional (kg/m2) | 26,9±5,4 |
| Obesidad (%) (n=381) | 21,6 |
| Semana diagnóstico DG | 29,2±5,9 |
| Insulina (%) (n=354) | 20,1 |
| Peso inicio 3.° trimestre (kg) | 75,6±14,1 |
| Ganancia ponderal total (kg) | 8,2±5,3 |
DG: diabetes gestacional; DM: diabetes mellitus; IMC: índice de masa corporal.
En cuanto a las características neonatales y del parto encontramos un 10,1% (171) de niños macrosómicos. Un 27,1% (474) de los partos fueron por cesárea y la edad media gestacional al parto fue de 38,8+2,1 semanas.
A los 3,5 meses (+0,4) de media tras el parto se realizó una SOG con 75g de glucosa con el fin de establecer si la paciente quedó con algún tipo de disglucosis posparto. En dicha reevaluación encontramos que el 77,8% tuvieron una SOG normal, el 9,5% compatible con GBA, el 10,8% con IHC y en un 2,1% se diagnosticó de DM tras la gestación. Hubo 524 (29,7%) que perdieron seguimiento en la revisión posparto. Por tanto, seguimos hasta la reevaluación tras el parto a un total de 1.241 pacientes (70,3%). Analizando las características basales de las pacientes con pérdida de seguimiento frente al resto de las pacientes no encontramos diferencias estadísticamente significativas.
En el análisis de factores predictores de DM posparto consideramos parámetros clínicos y parámetros analíticos fundamentalmente centrados en datos sobre el nivel de glucemia en la SOG con 100g y HbA1c durante la gestación (DCCT).
Datos clínicosEn el estudio de los parámetros clínicos encontramos diferencias atendiendo a los antecedentes de DG en gestaciones previas. Un 25% de las pacientes que finalmente tuvieron DM posparto tuvieron antecedentes de DG en embarazos previos frente al 12,9% de las pacientes que no tuvieron DM posparto (p<0,05).
Entre las pacientes de otras procedencias (no españolas) la probabilidad de DM posparto fue mayor que entre las pacientes españolas (6,8 vs. 1,3%; p<0,01).
También objetivamos diferencias en cuanto a la obesidad pregestacional de modo que entre las pacientes con obesidad el porcentaje de DM fue del 20,8 vs. 14,9% de las no obesas (p<0,05).
Encontramos diferencias estadísticamente significativas en cuanto al uso de insulina ya que, entre las pacientes que finalmente tuvieron DM posparto, un 79,2% precisaron tratamiento con insulina para lograr mejorar su control glucémico frente al 20% que precisaron insulina en el grupo de las que no tuvieron DM en la reevaluación (p<0,01).
No hubo diferencias significativas en el resultado de la reevaluación posparto teniendo en cuenta los antecedentes de DM en la familia, 59,2 vs. 61,3% de las pacientes con DM posparto (p>0,05).
Tampoco encontramos diferencias en lo referente a la ganancia ponderal materna durante la gestación dado que las pacientes sin DM posparto tuvieron una ganancia de peso de 8,1±4,3kg y las pacientes con DM posparto 8,3±5,9 (p>0,05).
Datos analíticosAnalizando los datos analíticos nos centramos en las determinaciones de glucemia de la SOG con 100g y los valores de HbA1c durante la gestación.
SOG con 100gLas determinaciones de glucemia media en el test diagnóstico de SOG con 100g fueron: Glucemia basal media: 91,6±16,0mg/dl; tras 1h: 210,2±27,7mg/dl; tras 2h: 187,4±27,7mg/dl y tras 3h: 138,4±37,0mg/dl.
En dicha SOG con 100g, del total de las pacientes, un 15,5% tuvieron patológica la determinación de glucemia basal, un 82,6% la determinación en la 1.ªh, un 91,6% en la 2.ªh y un 42,5% en la 3.ªh.
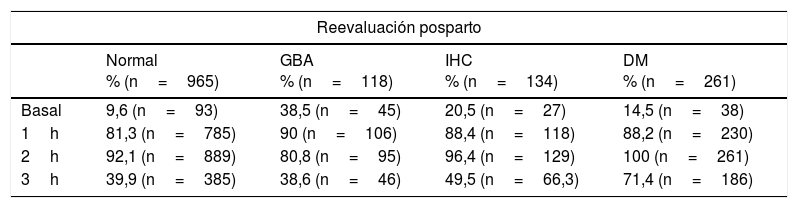
Atendiendo a la reevaluación posparto el porcentaje de pacientes con los distintos puntos de la SOG con 100g patológicos fue el siguiente (tabla 2):
Porcentaje de pacientes con glucemias patológicas en los distintos puntos de la SOG 100g atendiendo a los grupos según reevaluación posparto (normal, GBA, IHC y DM)
| Reevaluación posparto | ||||
|---|---|---|---|---|
| Normal % (n=965) | GBA % (n=118) | IHC % (n=134) | DM % (n=261) | |
| Basal | 9,6 (n=93) | 38,5 (n=45) | 20,5 (n=27) | 14,5 (n=38) |
| 1h | 81,3 (n=785) | 90 (n=106) | 88,4 (n=118) | 88,2 (n=230) |
| 2h | 92,1 (n=889) | 80,8 (n=95) | 96,4 (n=129) | 100 (n=261) |
| 3h | 39,9 (n=385) | 38,6 (n=46) | 49,5 (n=66,3) | 71,4 (n=186) |
DM: diabetes mellitus; GBA: glucemia basal alterada; IHC: intolerancia a hidratos de carbono; SOG: sobrecarga de glucosa.
Las glucemias que más frecuentemente se vieron alteradas en la SOG con 100g, independientemente de la reevaluación posparto, fueron las correspondientes a la determinación tras 1 y 2h de la ingesta de glucosa en todos los grupos (p<0,01). Existen diferencias estadísticamente significativas al comparar los puntos 1 y 2h con basal y 3h (p<0,01). No vemos diferencias al comparar 1 y 2h (p>0,05) ni al comparar basal con 3h (p>0,05) (tabla 2).
Analizando el porcentaje de pacientes que tuvieron alterados los distintos puntos en la SOG con 100g atendiendo a la reevaluación posparto vemos que entre las pacientes que finalmente tuvieron una GBA hubo un mayor porcentaje de pacientes con una determinación basal patológica (p<0,001) (tabla 2).
Para el resto de puntos no hay diferencias estadísticamente significativas.
Puesto que el diagnóstico de DG según criterios NDDG se realiza habiendo 2 o más puntos patológicos en la SOG con 100g, estudiamos el porcentaje de pacientes con 2, 3 o 4 puntos patológicos (basal: 1, 2 o 3h).
Vimos que un 76% de las pacientes tuvo 2 puntos patológicos, 25,6% 3 puntos y el 2,4% los 4 puntos patológicos.
En cuanto al número de puntos patológicos atendiendo a la situación en la reevaluación posparto detectamos que existen diferencias entre las pacientes que tuvieron finalmente DM posparto (3,18±0,69) frente al grupo de no DM posparto (2,5±0,45), p<0,001. El hecho de tener los 4 puntos patológicos de la SOG está relacionado con DM posparto, de modo que un 12% de estas pacientes tendrán DM posparto frente a un 1,1% de las pacientes que tienen 2 o 3 puntos patológicos (p<0,01).
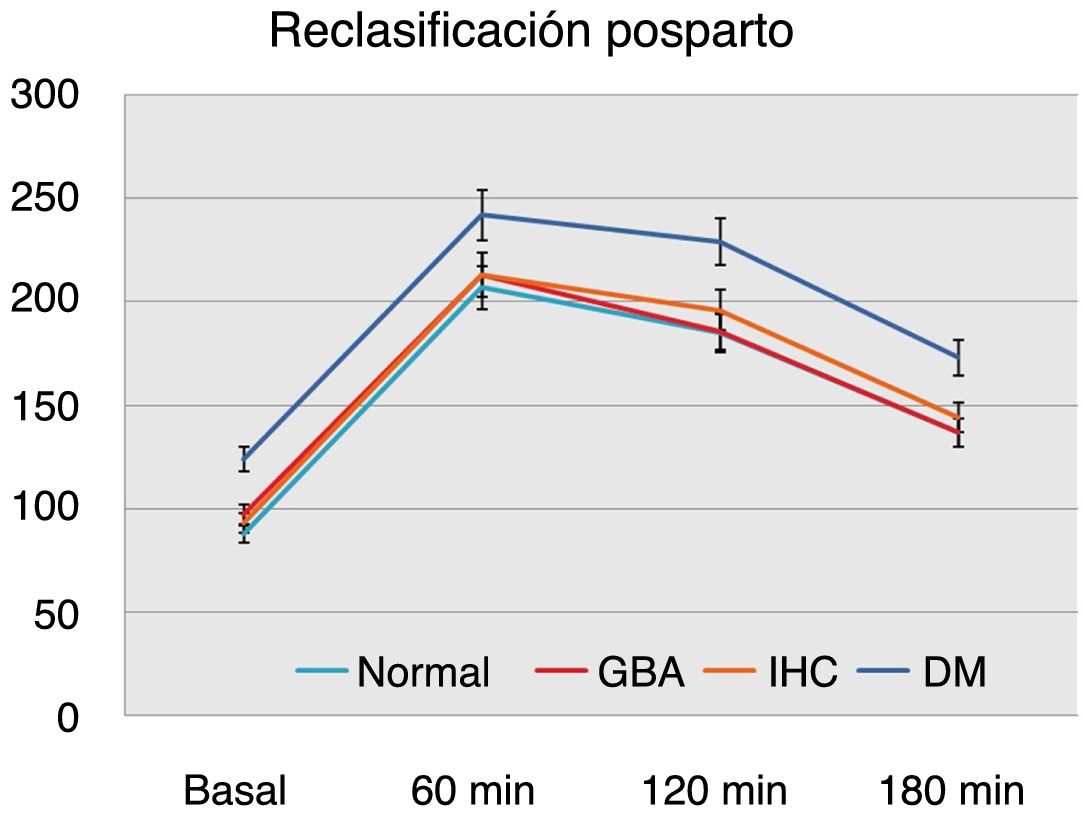
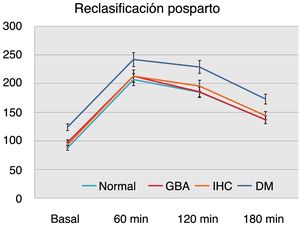
Estudiando los valores de las glucemias en la SOG con 100g atendiendo a la reevaluación posparto evidenciamos que en el grupo de pacientes con DM posparto los valores de glucemia basal y tras 1, 2 y 3h de la ingesta de glucosa son significativamente mayores frente al resto de los grupos (p<0,01) (fig. 1).
No hallamos diferencias estadísticamente significativas comparando los valores de la SOG con 100g entre de los grupos con reevaluación normal, GBA o IHC en el posparto (fig. 1).
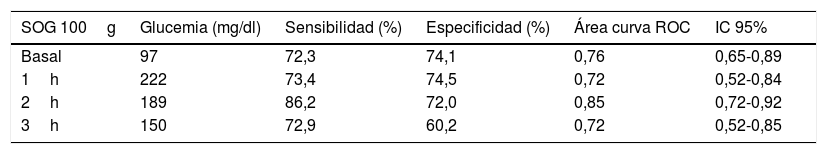
Teniendo en cuenta el resultado anterior analizamos los datos mediante curvas de rendimiento diagnóstico o curvas ROC para cada uno de los puntos de la SOG con 100g, y resultó que el punto más representativo con relación a la DM posparto es la determinación de glucemia a las 2h de la ingesta de glucosa (p<0,01; con un área bajo la curva: 0,85). Dentro de este, el nivel de glucemia más sensible y específico a partir del cual es más probable predecir DM posparto es 189mg/dl (sensibilidad: 86,2%; especificidad: 72%) (tabla 3).
Sensibilidad, especificidad y curva ROC para glucemias de cada punto de la SOG 100g en paciente con DM posparto
| SOG 100g | Glucemia (mg/dl) | Sensibilidad (%) | Especificidad (%) | Área curva ROC | IC 95% |
|---|---|---|---|---|---|
| Basal | 97 | 72,3 | 74,1 | 0,76 | 0,65-0,89 |
| 1h | 222 | 73,4 | 74,5 | 0,72 | 0,52-0,84 |
| 2h | 189 | 86,2 | 72,0 | 0,85 | 0,72-0,92 |
| 3h | 150 | 72,9 | 60,2 | 0,72 | 0,52-0,85 |
DM: diabetes mellitus; IC 95%: intervalo de confianza del 95%; SOG: sobrecarga de glucosa.
Con respecto a la HbA1c vimos que, en el momento del diagnóstico de la DG, la media fue del 5,3%±0,4 y en la reevaluación posparto del 5,2%±0,6.
Estudiando los valores de HbA1c durante el embarazo y tras el parto, en relación a la reevaluación posparto, vemos que existen diferencias significativas en los valores de HbA1c comparando las pacientes con DM posparto frente al resto de los grupos (tabla 4).
Con relación al resultado anterior, investigamos la existencia de un valor de HbA1c determinada durante la gestación relacionada con el desarrollo de DM posparto. Encontramos que una HbA1c del 5,9% o mayor tiene una alta especificidad en la predicción DM posparto (E: 95,9%; S: 69%; área bajo la curva ROC: 0,77; p<0,01).
En el análisis multivariado ajustado por edad, IMC materno, procedencia materna y glucemia basal se objetiva relación estadísticamente significativa entre la glucemia a las 2h de la SOG y el diagnóstico de DM posparto (p=0,02) y entre la HbA1c determinada al diagnóstico de la gestación y la DM posparto (p=0,03).
DiscusiónEl riesgo de DM en pacientes con antecedentes de DG está claramente elevado, de modo que más del 50% de las pacientes desarrollarán DM a lo largo de los años8,9.
La incidencia reportada en los estudios es muy variable, desde el 3% en la evaluación temprana posparto (3-6 meses)10 al 50-70% a los 15-25 años del parto3.
Por esta razón las guías clínicas recomiendan hacer una evaluación tras el parto en un intervalo aproximado de 4-12 semanas con una SOG con 75g4. Sin embargo, no es desdeñable el porcentaje de pacientes que pierden seguimiento en esta fase y finalmente no se realizan dicha prueba. Los estudios sobre DG en los que se analizan datos basados en la reevaluación posparto asumen como habitual una pérdida del seguimiento de más del 50%10,11. En nuestro estudio, tuvimos una consecución del seguimiento de más del 70% en la realización de la reevaluación posparto lo que le da valor añadido a los resultados encontrados.
Es de gran importancia la identificación precoz de las pacientes con mayor probabilidad de DM posparto. De este modo podríamos insistir, con datos objetivos, en la reevaluación del estado de disglucosis tras el parto y seríamos capaces de priorizar, en los casos en que fuera necesario, la realización de la prueba de forma tempana.
Llevando a cabo una revisión exhaustiva sobre factores de riesgo de DM en pacientes con DG encontramos que los factores más comúnmente analizados son datos clínicos como el sobrepeso u obesidad pregestacional12–14 el uso de insulina durante el embarazo3,15 o el antecedente de DG en embarazos previos16,17.
En un metanálisis realizado en 2016 por Rayanagoudar et al.18 se evidencia que las mujeres que precisaron usar insulina para mejorar el control de la DG tienen más riesgo de desarrollar DM futura con un RR de 3,66 comparadas con las que no requirieron insulina. En las pacientes con obesidad el RR fue de 3,18. Sobre estos factores pesa una gran evidencia de asociación con DM en pacientes con antecedentes de DG19–21, lo que es congruente con los datos reportados en nuestro trabajo.
En los estudios en los que se evalúan como predictores de DM posparto datos analíticos, la determinación más analizada es la glucemia basal que parece estar relacionada con el desarrollo de DM futura10,22–24.
Sin embargo, los trabajos en los que se analiza el resto de los puntos de la SOG con 100g son limitados. En el metaanálisis de Rayanagoudar et al.18 apuntan a que los niveles de glucemia en las determinaciones basal y a la 1, 2 y 3h de la SOG 100g pueden tener relación con la aparición de DM posparto (RR: 3,5, 3,05, 3,46 y 3,2, respectivamente) pero los estudios en los que se basa son muy escasos y el nivel de evidencia en consecuencia es muy bajo25.
En la población española se han llevado a cabo trabajos entre los que encontramos el realizado por Albareda et al.26. En él identifican como factores predictores de diabetes el IMC pregestacional, una glucemia >210mg/dl a las 2h y el hecho de haber tenido los 4 puntos patológicos en la SOG. Recientemente publicado destacamos el trabajo de Monroy et al.27 en el que identifican asociación entre la glucemia de la SOG en cada uno de sus puntos con el riesgo de disglucosis posparto (RR entre 1,0 y 1,4).
En nuestro trabajo nos centramos en el rendimiento que puede aportar la SOG con 100g. Encontramos que un gran porcentaje de las pacientes son diagnosticadas de DG por presentar únicamente 2 puntos de la curva alterados (el 76% de las pacientes vs. 25,6% con 3 puntos alterados y el 2,4% con 4 puntos alterados). Las determinaciones más frecuentemente alteradas son 1 y 2h tras la ingesta de glucosa y, por tanto, son estos 2 puntos los más relevantes a la hora del diagnóstico de DG.
En las pacientes con DM posparto, los niveles de glucemia en dicha SOG son mayores. De este modo nos planteamos averiguar qué punto es el más significativo y por encima de qué valor de glucemia es más probable el diagnóstico de DM en la reevaluación posparto. Evidenciamos que una glucemia >189mg/dl en la determinación a las 2h de la SOG con 100g está relacionada con mayor probabilidad de diagnóstico de DM posparto. En el análisis multivariado ajustado por factores relacionados con diabetes posparto se confirma su asociación de forma independiente.
En cuanto a HbA1c determinada durante la gestación, encontramos en la literatura relación con el diagnóstico de DM posparto (RR: 2,56) pero la evidencia es escasa18. En nuestro estudio averiguamos que las pacientes que finalmente fueron diagnosticadas de DM en el posparto tuvieron durante la gestación una HbA1c mayor que el resto de las pacientes. En el análisis realizado encontramos que una HbA1c mayor o igual al 5,9% al diagnóstico de la DG, tiene una elevada especificidad (95,9%) para la predicción de DM posparto.
Consideramos que el hallazgo de nuestros resultados es de gran importancia ya que nos permitirá identificar, con datos objetivos extraídos de la SOG con 100g y de la HbA1c durante la gestación, aquellas pacientes con mayor probabilidad de desarrollar DM tras el parto. De este modo seremos capaces de dar recomendaciones más vehementes a las pacientes de mayor riesgo. Por un lado, aumentando la adherencia a la realización de pruebas en la reevaluación posparto y por otro incrementando la adherencia a las recomendaciones dadas para disminuir en la medida de lo posible el riesgo de DM futura.
Por tanto, podemos concluir que, en nuestra muestra de pacientes con DG, encontramos determinados parámetros analíticos como la glucemia a las 2h en la SOG con 100g o la HbA1c realizados durante la gestación, están relacionados con el diagnóstico de DM posparto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.